Method Article
Isolamento di fibroblasti primari associati al cancro da un modello murino singeneico di cancro al seno per lo studio di nanoparticelle mirate
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo documento mira a fornire un protocollo per l'isolamento e la coltura di fibroblasti primari associati al cancro da un modello murino singeneico di carcinoma mammario triplo negativo e la loro applicazione per lo studio preclinico di nuove nanoparticelle progettate per colpire il microambiente tumorale.
Abstract
I fibroblasti associati al cancro (CAF) sono attori chiave nel contesto del microambiente tumorale. Nonostante siano ridotti in numero rispetto alle cellule tumorali, i CAL regolano la progressione del tumore e forniscono protezione dall'immunità antitumorale. Le strategie antitumorali emergenti mirano a rimodellare il microambiente tumorale attraverso l'ablazione di CAF pro-tumorigenici o la riprogrammazione delle funzioni dei CAF e del loro stato di attivazione. Un approccio promettente è lo sviluppo di agenti di consegna di dimensioni nanometriche in grado di colpire i CAF, consentendo così la consegna specifica di farmaci e molecole attive. In questo contesto, un modello cellulare di CAF può fornire uno strumento utile per lo screening in vitro e l'indagine preliminare di tali nanoformulazioni.
Questo studio descrive l'isolamento e la coltura dei CAF primari dal modello murino singeneico 4T1 del carcinoma mammario triplo negativo. Le perle magnetiche sono state utilizzate in un processo di separazione in 2 fasi per estrarre i CAF dai tumori dissociati. Il controllo dell'immunofenotipizzazione è stato eseguito utilizzando la citometria a flusso dopo ogni passaggio per verificare la resa del processo. I CAF isolati possono essere impiegati per studiare la capacità di targeting di diverse nanoformulazioni progettate per affrontare il microambiente tumorale. Le nanogaggi di H-ferritina etichettate fluorescentemente sono state utilizzate come nanoparticelle candidate per impostare il metodo. Le nanoparticelle, nude o coniugate con un ligando bersaglio, sono state analizzate per il loro legame ai CAF. I risultati suggeriscono che l'estrazione ex vivo dei CAF mammari può essere un sistema utile per testare e convalidare le nanoparticelle per il targeting specifico dei CAF tumorigenici.
Introduzione
Negli ultimi decenni, è diventato chiaro che uccidere le cellule tumorali di solito non è sufficiente per sradicare la malignità, poiché il microambiente tumorale può provocare una ricaduta del tumore e indurre resistenza terapeutica1,2. È quindi emerso un nuovo paradigma: prendere di mira lo stroma tumorale per privare il tumore di fattori di supporto e, quindi, aumentare l'efficacia dei chemioterapici3,4,5. In particolare, i fibroblasti associati al cancro (CAF) sono un interessante bersaglio stromale in molti tumori solidi6,7. I CAF sono un gruppo molto eterogeneo di cellule che interagiscono con le cellule tumorali e le cellule del sistema immunitario attraverso la secrezione di fattori di crescita, citochine e chemochine; costruire e rimodellare la matrice extracellulare; e abilitare la formazione di metastasi8,9,10,11,12. A seconda del tipo di tumore, i CAF mostrano funzioni pro-tumorigeniche, mentre altri sottotipi di CAF sembrano avere funzioni oncosoppressori13,14. Per chiarire meglio questa dicotomia, è importante una caratterizzazione approfondita dei CAF da tumori primari e metastatici.
In questo contesto, un campo di ricerca emergente si è concentrato sullo sviluppo di agenti di dimensioni nanometriche progettati per colpire e/o distruggere i CAF fornendo molecole attive e farmaci in grado di rimodellare il microambiente tumorale15,16,17,18. Diversi tipi di nanoparticelle sono stati progettati per ottenere l'ablazione CAF con farmaci citotossici, per indurre una terapia fotodinamica mirata al CAF o per riprogrammare i CAF ripristinandoli in uno stato quiescente o inducendo l'espressione del ligando indotta dall'apoptosi correlata al TNF, che induce l'apoptosi delle cellule tumorali vicine16,19. Inoltre, il potenziale di molte nanoparticelle di colpire attivamente marcatori biologici specifici dà origine alla speranza di selezionare sottoinsiemi CAF da indirizzare. Sebbene la sua assoluta specificità per la CAF sia ancora messa in discussione, la proteina di attivazione dei fibroblasti (FAP) è uno degli obiettivi più promettenti dello stroma pro-tumorigenico e viene sfruttata per guidare la somministrazione di nanofarmaci, aprendo così la strada allo sviluppo di nanoterapie mirate al CAF20,21,22.
Questo documento descrive l'isolamento dei CAF primari da un modello singeneico di carcinoma mammario murino e riporta il loro uso nello studio della capacità di targeting delle nanoparticelle progettate per riconoscere il marcatore CAF, FAP. Le nanocaghe di ferritina sono utilizzate come nanosistemi candidati per impostare il metodo, poiché la loro specificità di consegna può essere modellata dall'esposizione superficiale delle partitargeting 23,24. Inoltre, le ferritine hanno dimostrato con successo di essere eccellenti navette biocompatibili per applicazioni antitumorali, innescando un rapido accumulo del carico utile nella massa tumorale25,26,27. Ad oggi, studi preclinici di nanosistemi CAF-targeting hanno coinvolto test in vitro su linee cellulari di fibroblasti stimolate in coltura con fattore di crescita trasformante-beta per indurre l'attivazione cellulare e l'espressione di alcune caratteristiche immunofenotipiche dei CAF28,29. Questo metodo viene solitamente applicato a linee cellulari immortalizzate (come NIH3T3, LX-2) ed è abbastanza rapido e semplice, producendo cellule attivate in poche ore o giorni. Un limite è che sebbene la stimolazione in vitro induca l'espressione di alcuni geni attribuiti a miofibroblasti attivati, non può ricapitolare interamente tutte le caratteristiche biologiche dei CAF reali, in particolare la loro eterogeneità in vivo.
Un'altra strategia prevede l'estrazione di CAF primari da campioni di tumore umano o murino30,31. Ciò garantisce che l'attivazione della CAF avvenga in un contesto fisiologico e che l'eterogeneità delle sottopopolazioni CAF sia mantenuta. Secondo l'obiettivo di ricerca, i CAF possono essere derivati da fonti diverse, offrendo così la possibilità di studiare la condizione più affidabile. Il protocollo qui riportato sarebbe prezioso per gli scienziati che cercano di eseguire una valutazione preliminare della funzionalità di nuove nanoparticelle progettate per colpire i CAF da un modello di cancro al seno murino. I CAF isolati sarebbero utili per lo screening di quelle nanoparticelle che sono abbastanza promettenti da procedere per la valutazione in vivo in modelli animali di cancro. Ciò sarà rilevante durante le prime fasi della produzione di nanoparticelle, guidando i nanotecnologi verso il perfezionamento della progettazione di nanoparticelle considerando principalmente la strategia di immobilizzazione del ligando per ottenere proprietà di targeting ottimali.
Protocollo
1. Stabilire un modello singeneico 4T1 di cancro al seno
NOTA: Il presente protocollo descrive l'isolamento dei CAF primari da un tumore al seno 4T1 del topo. Lo studio sugli animali qui descritto è stato approvato dal Ministero della Salute italiano (aut. numero 110/2018-PR).
- Coltura e impianto di cellule tumorali
- Scongelare 1 ×10 6 cellule 4T1-luc in un pallone T75 con 10 mL di Roswell Park Memorial Institute (RPMI) 1640 medio integrato con il 10% di siero bovino fetale (FBS), l'1% di penicillina / streptomicina (P / S) e l'1% di L-glutammina. Aggiungere l'agente di rimozione del micoplasma (1:100) nel terreno di coltura.
NOTA: le cellule 4T1-luc esprimono stabilmente la luciferasi e possono essere visualizzate mediante bioluminescenza (BLI) dopo una corretta stimolazione con D-luciferina. Ciò consente il monitoraggio in vivo della vitalità e della proliferazione delle cellule tumorali al momento dell'impianto nei topi (Figura 1). - Mantenere le celle a 37 °C e al 5% di CO2 in un'atmosfera umidificata fino a circa l'80% di confluenza, cambiando il mezzo ogni 2 giorni.
NOTA: Continuare il trattamento con l'agente di rimozione del micoplasma per 1 settimana (~ 2/3 passaggi) prima dell'iniezione nei topi per garantire che le cellule iniettate siano prive di micoplasma. - Il giorno della procedura, staccare le cellule utilizzando 1 mL di soluzione di acido tripsina-etilendiamminatetraacetico (EDTA) (tripsina 1:250) per 5 minuti a 37 °C. Interrompere l'attività della tripsina aggiungendo il terreno di coltura, contare le cellule con tripano blu (1: 1) e calcolare il numero di cellule / ml.
- Pipettare il volume corrispondente a 1 × 106 celle e centrifugare per 5 min a 400 × g. Versare il surnatante e risusciere il pellet in 1 mL di supporto base RPMI 1640. Tenere le cellule sul ghiaccio fino a quando non sono pronte per l'iniezione.
NOTA: per ogni mouse sono necessarie 1 ×10 5 celle; tuttavia, calcolare sempre per un eccesso di 2 topi (corrispondenti a 2 × 105 cellule) per facilitare il carico della siringa. - Un giorno prima dell'operazione, radere la pelliccia di 8 topi BALB / c (femmina, di sette settimane) per esporre l'area delle ghiandole mammarie addominali sul lato destro. Utilizzare un rasoio elettrico e applicare un sottile strato di crema depilatoria per 4 min; quindi, lavare via la crema con acqua e un pezzo di carta.
- Indurre l'anestesia per inalazione continua di gas isoflurano al 2% per ~ 5 minuti ed eseguire un'iniezione sottocutanea nella regione delle ghiandole mammarie addominali con una siringa tubercolina da 27 G. Girare l'ago verso l'alto per entrare nella pelle per via sottocutanea; quindi, tenere la pelle verso l'alto e iniettare lentamente 100 μL di sospensione cellulare (1 × 105 cellule). Ruotare leggermente l'ago prima di ritrarre lentamente la siringa.
NOTA: Ricordarsi di portare la sospensione cellulare a temperatura ambiente 15 minuti prima dell'iniezione.
- Scongelare 1 ×10 6 cellule 4T1-luc in un pallone T75 con 10 mL di Roswell Park Memorial Institute (RPMI) 1640 medio integrato con il 10% di siero bovino fetale (FBS), l'1% di penicillina / streptomicina (P / S) e l'1% di L-glutammina. Aggiungere l'agente di rimozione del micoplasma (1:100) nel terreno di coltura.
- Crescita e dissezione del tumore
- A 5 giorni dopo l'iniezione cellulare, iniettare 150 mg/kg di D-luciferina per via intraperitoneale (100 μL) 5 minuti prima dell'imaging. Cattura immagini BLI utilizzando un sistema di imaging in vivo che imposta un'esposizione di 10 s, un binning medio e f/stop a 4. Definire l'area luminescente del tumore come regione di interesse (ROI) e quantificare il segnale totale nel ROI (fotone/sec/m2)utilizzando un software di imaging.
- Ripetere la procedura di imaging (1.2.1) ogni 5 giorni dall'iniezione per monitorare la crescita tumorale in termini di aumento della BLI.
- Per stabilire il volume del tumore, tenere premuto il mouse ed esporre la sua pancia. Utilizzare pinze per misurare la lunghezza del tumore (L) e la larghezza (W) una volta alla settimana. Calcola il volume del tumore (V) usando l'equazione 1.
[V = (L x P2)/2] (1) - A 20 giorni dopo l'iniezione cellulare, sacrificare gli animali per lussazione cervicale, dissociare i tumori dalla pelle con le forbici e raccoglierli in una soluzione di conservazione dei tessuti (vedi la Tabella dei materiali).
NOTA: I campioni tumorali possono essere utilizzati immediatamente per la dissociazione in singole cellule (paragrafo 2) o conservati a 4 °C per un massimo di 48 ore.
2. Dissociazione tumorale in singole cellule
NOTA: per i seguenti passaggi, utilizzare reagenti sterili e monouso in una cappa a flusso laminare. Lavora con 4 tumori alla volta.
- Posizionare il campione di tumore in una capsula di Petri e rimuovere con cura qualsiasi frammento di pelle, grasso e aree necrotiche con l'aiuto di pinzette e bisturi. Quindi, ridurre il tumore in piccoli pezzi di circa 1-2 mm e trasferirli in un tubo (Figura 2A).
NOTA: I tumori 4T1 diventano altamente necrotici durante la crescita, con una tendenza all'ulcerazione. È importante rimuovere con attenzione le aree necrotiche per evitare qualsiasi interferenza di detriti con i passaggi successivi. - Preparare una miscela di digestione per la dissociazione del tumore: mescolare 2,35 mL di mezzo RPMI 1640, 100 μL di enzima D, 50 μL di enzima R e 12,5 μL di enzima A. Immergere i frammenti tumorali nella soluzione e chiudere ermeticamente il tubo.
NOTA: I volumi indicati di digestione mix sono validi per tumori fino a 1 g e possono essere regolati per tumori più grandi in base al loro peso. I tumori 4T1 cresciuti per 20 giorni normalmente sono in un intervallo di 0,5-0,8 g. - Capovolgere il tubo, controllando che tutti i pezzi di tumore si trovino nella parte inferiore del tubo verso il cappuccio. Collegare il tubo a un dissociatore meccanico nell'alloggiamento appropriato ed eseguire un programma di dissociazione specifico progettato per tumori duri (vedere le istruzioni del produttore).
NOTA: potrebbero essere necessari tubi speciali per adattarsi al dissociatore. I tubi c recano un rotore all'interno del cappuccio per promuovere la dissociazione meccanica del tessuto. - Staccare il tubo, mantenerlo capovolto e incubare il campione a 37 °C per 40 minuti con un leggero scuotimento. Quindi, collegare il tubo al dissociatore nell'alloggiamento appropriato ed eseguire il seguente programma di dissociazione specifico progettato per i tumori duri due volte. Assicurarsi che non vi siano grandi pezzi di tessuto alla fine della procedura (Figura 2B).
NOTA: Per dissociare il tumore, altri cocktail enzimatici potrebbero essere utilizzati per degradare la matrice extracellulare. Tuttavia, in questo protocollo, è stato utilizzato un kit di dissociazione tumorale disponibile in commercio contenente una miscela enzimatica ottimizzata (enzimi D, R, A) e un dissociatore semi-automatico che dissocia meccanicamente il tessuto. Questa combinazione ha assicurato una corretta degradazione della matrice extracellulare insieme al mantenimento dell'integrità cellulare e degli epitopi della superficie cellulare. - Filtrare il campione attraverso un filtro a celle da 40 μm in un tubo da 50 ml, lavare il filtro con 10 mL di mezzo RPMI 1640 e centrifugare il tubo per 7 minuti a 300 × g. Se il pellet cellulare appare rosso, lisi eritrociti aggiungendo 1 mL di tampone di lisi ammonio-cloruro-potassio (ACK) per 5 minuti a temperatura ambiente, lavare con 10 ml di RPMI 1640, trasferire la sospensione cellulare in un tubo da 15 ml e centrifugare di nuovo.
- Spesesere il pellet in 1 mL di tampone PBE composto da soluzione salina tamponata con fosfato (PBS), albumina sierica bovina allo 0,5% (BSA) e 2 mM ed EDTA, e contare le cellule con tripano blu (1:1). In caso di grumi cellulari, filtrare la sospensione cellulare attraverso un filtro cellulare da 70 μm, precedentemente imbevuto di PBS.
NOTA: Soprattutto quando i tumori sono grandi, è importante controllare il conteggio delle cellule ed eventualmente dividere ogni campione tumorale in diversi tubi con non più di 107 cellule in ciascun tubo prima di procedere al passaggio 2.7. - Preparare il tampone legante per la rimozione delle cellule morte diluendo la soluzione di scorta tampone legante 20x (vedere la Tabella dei materiali)con acqua sterile a doppio distillato. Celle di lavaggio con 5 mL di tampone di legame da 1× (Figura 2C).
NOTA: Tenere il tampone a 4 °C. - Centrifugare per 7 minuti a 300 × g e risuscidere il pellet cellulare con 0,1 ml di microsfere di rimozione delle cellule morte (vedere la tabella dei materiali). Mescolare bene e incubare a temperatura ambiente per 15 min.
- Durante l'incubazione con perle, preparare un supporto magnetico sotto il cofano e appendere colonne di separazione ferromagnetica (una colonna per un massimo di 107 celle) su di esso con le punte puntate verso il basso. Equilibrare le colonne con 0,5 mL di buffer di legame freddo da 1×. Attendere fino a quando la soluzione non è passata sotto gravità.
NOTA: è importante non superare il numero di celle per colonna per evitare qualsiasi rischio di coagulazione del letto della colonna e ridurre la resa di recupero. Quando si lavora con più di 107 celle, utilizzare più colonne in base al numero totale di celle o utilizzare colonne più grandi. In tali casi, adeguare i volumi di reagenti descritti nei passaggi seguenti a quelli indicati dal produttore. - Al termine dell'incubazione, aggiungere 400 μL di tampone di legame freddo da 1× alla sospensione di perle/celle, caricare l'intero volume sulla colonna e raccogliere l'effluente (corrispondente alle celle non etichettate) in un tubo da 15 mL.
- Lavare la colonna quattro volte con 0,5 mL di tampone legante freddo da 1× e raccogliere l'effluente totale (corrispondente alla frazione cellulare viva) nello stesso tubo.
- Conta le celle con tripano blu (1:1). Posizionare 1 × 105 celle in due tubi per Fluorescence Activated Cell Sorting (FACS) e mantenerli a 4 °C fino alla convalida del processo (vedere fase 4.1): utilizzare il primo tubo per impostare i parametri di analisi e le regioni di positività (tubo di controllo) e l'altro per l'analisi dei biomarcatori (tubo campione). Utilizzare le celle rimanenti per l'estrazione dei CAF (vedere paragrafo 3).
NOTA: La rimozione delle cellule morte è importante per ridurre le reazioni non specifiche con le microsfere nel paragrafo 3. Tuttavia, per migliorare la resa, evitare la rimozione delle cellule morte se la proporzione di cellule morte è <20%.
3. Estrazione di CAF primari dal tumore al seno
NOTA: Per il paragrafo 3, utilizzare il kit di isolamento dei fibroblasti associati al tumore del topo contenente il cocktail di deplezione dei fibroblasti non associati al tumore e le microsfere dei fibroblasti associati al tumore adatte per l'etichettatura magnetica delle cellule (vedere la tabella dei materiali).
- Esaurimento dei fibroblasti non associati al cancro
- Inumidire un filtro cellulare da 70 μm con PBS e filtrare la sospensione cellulare per rimuovere eventuali grumi. Quindi, centrifugare le cellule per 10 minuti a 300 × g e aspirare il surnatante.
NOTA: Se un singolo tumore è stato diviso in due campioni per il passaggio 2.7, mettere in comune la sospensione cellulare a due a due prima di procedere con il passaggio 3.1.2. - Rispendare il pellet in 80 μL di tampone PBE freddo e aggiungere 20 μL di cocktail di esaurimento dei fibroblasti non associati al tumore. Mescolare bene e incubare a 4 °C per 15 minuti al buio.
- Durante l'incubazione con perle, preparare colonne di esaurimento ferromagnetico (1 per campione) su un supporto magnetico ed equilibrare le colonne con 2 ml di tampone PBE freddo. Attendere fino a quando la soluzione non è passata.
- Al termine dell'incubazione, aggiungere 400 μL di tampone PBE freddo alla sospensione di perle/celle, caricare l'intero volume sulla colonna e raccogliere l'effluente (corrispondente alle celle non etichettate) in un tubo da 15 ml.
- Lavare la colonna due volte con 2 ml di tampone PBE freddo e raccogliere l'effluente totale nello stesso tubo. Centrifugare per 10 minuti a 300 × g e riconsocie in 0,1 mL di tampone PBE freddo.
NOTA: L'esaurimento dei fibroblasti non associati al cancro riduce drasticamente la quantità totale di cellule recuperate. È generalmente necessario e raccomandato mettere insieme sospensioni cellulari da quattro diversi campioni per ottenere un pellet visibile e abbastanza celle per il passaggio 3.2. Ciò garantirà una resa ottimale. - Posizionare 20 μL della sospensione cellulare in un tubo FACS e mantenerla a 4 °C per la convalida del processo (vedere paragrafo 4). Utilizzare le celle rimanenti per la selezione CAF (vedere il passaggio 3.2).
- Inumidire un filtro cellulare da 70 μm con PBS e filtrare la sospensione cellulare per rimuovere eventuali grumi. Quindi, centrifugare le cellule per 10 minuti a 300 × g e aspirare il surnatante.
- Selezione positiva dei fibroblasti associati al cancro
- Aggiungere 20 μL di microsfere fibroblastiche associate al tumore a 80 μL di sospensione cellulare. Mescolare bene e incubare a 4 °C per 15 minuti al buio.
- Durante l'incubazione con perle, preparare colonne di separazione ferromagnetica (1 per campione) su un supporto magnetico ed equilibrare le colonne con 0,5 ml di tampone PBE freddo. Attendere fino a quando la soluzione non è passata.
- Alla fine dell'incubazione, aggiungere 400 μL di tampone PBE freddo alla sospensione di perle/celle, caricare l'intero volume sulla colonna e lasciare che le celle non etichettate fluiscano attraverso un tubo da 15 ml.
- Lavare la colonna tre volte con 0,5 mL di tampone PBE freddo e raccogliere l'effluente totale nello stesso tubo.
NOTA: il flusso contiene cellule CD90.2-negative non etichettate, che possono essere scartate come fibroblasti non associati al cancro. - Rimuovere la colonna dal magnete e posizionarla in un tubo da 1,5 ml. Aggiungere 1 mL di PBE freddo sulla colonna e spingere immediatamente lo stantuffo nella colonna per svuotare le celle.
- Centrifugare per 10 minuti a 400 × g e ricandidare in 0,1 mL di tampone PBE freddo. Posizionare 20 μL di sospensione cellulare in un tubo FACS e mantenerlo a 4 °C per la convalida del processo (vedere paragrafo 4).
NOTA: Dopo la centrifugazione, il pellet può essere difficilmente visibile, soprattutto quando i tumori originali sono piccoli. Utilizzare tubi centrifughi conici inferiori e fare attenzione a non perdere cellule quando si aspira al surnatante. - Diluire le cellule rimanenti in un volume appropriato di Dulbecco's Modified Eagle's Medium (DMEM) / Ham's F-12 integrato con il 15% fbs, 2 mM di L-glutammina, l'1% P / S e l'1% di aminoacidi non essenziali e seminare le cellule in una piastra di coltura tissutale.
- Controllare la densità cellulare al microscopio e posizionare la piastra in un'incubatrice a 37 °C e al 5% di CO2 per consentire alle cellule di aderire e crescere.
NOTA: Se le cellule sono troppo dense, dividere immediatamente la sospensione cellulare in due pozzetti della piastra di coltura tissutale prima di posizionare la piastra nell'incubatrice.
4. Convalida del processo
- Citometria a flusso
NOTA: il punto 4.1 non richiede condizioni sterili e può essere eseguito al di fuori della cappa laminare. Eseguire il paragrafo 4.1 in parallelo per i campioni raccolti nel passo 2.11 (tumore dissociato), nel passo 3.1.6 (dopo esaurimento dei fibroblasti non associati al cancro) e nel passo 3.2.6 (dopo arricchimento dei fibroblasti associati al cancro).- Centrifugare i tubi FACS preparati nei passaggi 2.11, 3.1.6 e 3.2.6 per 10 minuti a 300 × g. Scartare il surnatante.
NOTA: preparare almeno un tubo aggiuntivo, che contiene celle non macchiate che fungono da controllo per impostare i parametri per l'analisi. - Nelle provette campione, risuspare le cellule in 88 μL di PBE e aggiungere 2 μL di anticorpo anti-CD45 coniugato con isotiocianato di fluoresceina (FITC, diluizione 1:50, secondo le istruzioni del produttore) e 10 μL di anticorpo anti-CD90.2 coniugato con ficoeritrina (DILUIZIONE 1:10, secondo le istruzioni del produttore). Mescolare accuratamente e incubare per 10 minuti a 4 °C al buio. Nel tubo di controllo (non macchiato), le celle disuspendo in 100 μL di PBE. Incubare per 10 minuti a 4 °C al buio per replicare la procedura seguita per le cellule macchiate di anticorpi.
NOTA: La temperatura e il tempo di incubazione devono essere controllati attentamente, poiché una variazione di tali variabili potrebbe comportare una colorazione scarsa o non specifica, alterando così i risultati. - Dopo aver completato la fase di incubazione, eseguire un lavaggio aggiungendo 1 ml di PBE. Centrifuga per 10 min a 300 x g. Scartare il surnatante.
- Celle di sospensione (tutti i tubi) in 500 μL di PBS.
- Mescolare bene e procedere con l'analisi della citometria a flusso. Impostare i canali per misurare la fluorescenza degli anticorpi (ad esempio, FITC e PE).
- Dal tubo di controllo, selezionare tutte le celle vitali disegnando un primo gate (P1) sul grafico a dispersione forward versus side (FSC vs SSC). All'interno di P1, impostare un secondo gate (P2) comprendente solo celle singole.
- Utilizzando i canali di fluorescenza specifici degli anticorpi (cioè FITC e PE), impostare porte adeguate per discernere le cellule macchiate positivamente.
- Inizia l'analisi e registra almeno 10.000 eventi in P2. Leggi i segnali da entrambi i canali contemporaneamente.
NOTA: se il numero complessivo di celle è inferiore al previsto, potrebbe essere preferibile leggere l'intero tubo. - (FACOLTATIVO) Se viene programmata un'ulteriore colorazione con anticorpi/fluorofori aggiuntivi, impostare una matrice di compensazione appropriata prima di iniziare l'analisi.
- Centrifugare i tubi FACS preparati nei passaggi 2.11, 3.1.6 e 3.2.6 per 10 minuti a 300 × g. Scartare il surnatante.
- Monitoraggio della morfologia e delle caratteristiche cellulari
NOTA: Una volta seminate, le cellule devono essere maneggiate in condizioni sterili.- Il giorno dopo la semina, visualizza le cellule al microscopio ottico per controllare l'adesione e la morfologia cellulare. Aspirare il surnatante e sostituirlo con mezzo fresco.
NOTA: I CAF sono grandi cellule a forma di fuso, che possono essere facilmente distinte dalla struttura epiteliale delle cellule tumorali 4T1. - Mantenere le celle a 37 °C e al 5% di CO2 in atmosfera umidificata, cambiando il mezzo ogni 2 giorni.
- Quando le cellule raggiungono una confluenza di circa l'80% (circa 4-6 giorni dopo la semina), staccare le cellule utilizzando la soluzione TrypLE Select (vedere la tabella dei materiali)per 5 minuti a temperatura ambiente. Aggiungere il mezzo fresco (4:1), centrifugare la sospensione cellulare a 400 × g per 5 minuti e risusciere il pellet in mezzo fresco.
- Dividere le cellule 1:2 ed espandere la coltura fino ad ottenere il numero di cellule necessarie per l'esperimento.
- Ad ogni passaggio, controllare la morfologia e la crescita cellulare al microscopio ottico. Se la morfologia cellulare non è omogenea (ad esempio, cloni di piccole cellule di forma rotonda che appaiono in coltura), analizzare un campione di cellule mediante citometria a flusso come descritto nel paragrafo 4.1. Se omogeneo, procedere al passaggio 4.2.7.
NOTA: I cambiamenti nella morfologia cellulare possono indicare la contaminazione da fibroblasti non associati al cancro, che devono essere rimossi per garantire la purezza della coltura. - Analizzare i risultati della citometria a flusso e procedere secondo uno dei seguenti scenari: (i) se si verifica una contaminazione delle cellule CD90.2-/CD45-, raccogliere tutte le cellule e ripetere la selezione positiva seguendo il passaggio 3.2; (ii) se si verifica anche la contaminazione delle cellule CD45+, raccogliere tutte le cellule e ripetere l'esaurimento nel passaggio 3.1; iii) se non si verifica alcuna contaminazione (sono presenti solo cellule CD90.2+/CD45-), mantenere le cellule in coltura e procedere direttamente al 4.2.7.
NOTA: poiché ripetere il processo di esaurimento con le microsfere ridurrà il recupero cellulare, si raccomanda solo quando le cellule non devono essere utilizzate immediatamente. - Contare le cellule con tripano blu (1:1), posizionare 5 × 105 celle in due tubi FACS e centrifugare per 10 minuti a 300 × g. Scartare il surnatante e risuscimpere il pellet in 0,5 ml di tampone bloccante (PBS integrato con 2% di BSA, 2% di siero di capra) per 15 minuti a temperatura ambiente.
NOTA: un tubo funge da controllo costituito solo da cellule non macchiate, mentre le cellule nel secondo tubo saranno colorate per l'analisi della citometria a flusso. - Centrifugare per 10 minuti a 300 × g, scartare il surnatante e riaspensare in 99 μL di tampone bloccante. Aggiungere 1 μg di anticorpo anti-FAP alla provetta del campione e 1 mL di tampone bloccante al tubo di controllo. Mescolare accuratamente e incubare per 15 minuti a temperatura ambiente.
NOTA: FAP è un marcatore di superficie dello stroma tumorale reattivo e può essere utilizzato per identificare e caratterizzare i CAF. - Lavare tre volte con PBS, centrifugare e incubare con l'anticorpo secondario appropriato coniugato con un colorante fluorescente (1 μg) in tampone bloccante per 15 minuti a temperatura ambiente.
- Lavare tre volte con PBS e analizzare mediante citometria a flusso (seguire i passaggi da 4.1.5 a 4.1.7 impostando il canale appropriato per rilevare il fluoroforo utilizzato). Quindi, utilizzare le celle per gli esperimenti (passaggio 5.2).
- (FACOLTATIVO) Congelare un campione di cellule in 1 mL di FBS al 90% e disolfossido di dimetile (DMSO) al 10%; conservare a -80 °C per un ulteriore utilizzo.
- Il giorno dopo la semina, visualizza le cellule al microscopio ottico per controllare l'adesione e la morfologia cellulare. Aspirare il surnatante e sostituirlo con mezzo fresco.
5. CaF mirati da nanoparticelle di ferritina ingegnerizzate
NOTA: Una variante ricombinante della catena pesante della ferritina umana (HFn) è stata utilizzata come nanoparticella nuda o è stata coniugata con parti targeting. Qui, nanoparticelle HFn funzionalizzate con la porzione variabile di un anticorpo anti-FAP (Fab@FAP) sono state preparate dal NanoBioLab dell'Università di Milano-Bicocca a due rapporti molari HFn:Fab@FAP, 1:1 e 1:5, secondo un protocollo32precedentemente descritto.
- Etichettatura fluorescente di nanoparticelle HFn
NOTA: Sia le nanocaghe HFn nude che funzionalizzate sono etichettate fluorescentemente con FITC.- Sciogliere la polvere FITC in etanolo al 99% per ottenere una concentrazione di 2 mg/ml.
NOTA: Questa soluzione deve essere preparata al momento. - Incubare 50 μL della soluzione preparata (200 μg di FITC) per ogni 1 mg di proteina (cioè 100 μL di HFn a 10 mg/mL). Aggiungere 50 μL di bicarbonato di sodio 1 M (NaHCO3) e regolare il volume a 500 μL con 0,1 M NaHCO3.
NOTA: Scalare i volumi in base alle esigenze sperimentali. - Incubare la miscela di reazione a temperatura ambiente, al buio e con agitazione continua per 1 ora.
- Rimuovere l'eccesso di FITC dal coniugato mediante filtrazione su gel utilizzando una colonna di dissaldazione di centrifuga (7 kDa MWCO).
- Valutare la concentrazione della proteina marcata recuperata utilizzando uno spettrofotometro. Stimare le quantità di proteine e coloranti misurando l'assorbanza rispettivamente a 280 nm e a 488 nm.
- Sciogliere la polvere FITC in etanolo al 99% per ottenere una concentrazione di 2 mg/ml.
- Legame di nanoparticelle HFn a CAF
NOTA: utilizzare i CAL al più tardi nei passaggi da 4 a 5 nella lingua.- Posizionare 5 ×10 5 celle in ogni tubo FACS, centrifugare per 10 minuti a 300 × g e spese in 0,5 mL di PBS, 0,3% BSA integrato con 0,1 mg/mL dei diversi preparati di nanoparticelle (HFn nudo, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) precedentemente etichettati con FITC.
NOTA: eseguire ogni condizione in triplice copia. Preparare un tubo aggiuntivo come campione di controllo non etichettato a cui non vengono aggiunte nanoparticelle. - Incubare per 2 ore a 4 °C al buio, centrifugare e lavare tre volte in PBS.
- Sospendare le cellule con 0,5 ml di PBS, mescolare bene e analizzare mediante citometria a flusso. Impostare i canali per misurare la fluorescenza di FITC.
- Dopo aver gating su singole cellule vive, acquisire 20.000 eventi. Utilizzare il tubo di controllo non etichettato per impostare il gate di positività FITC e ottenere la percentuale di eventi FITC+ (corrispondenti al legame delle nanoparticelle).
- Posizionare 5 ×10 5 celle in ogni tubo FACS, centrifugare per 10 minuti a 300 × g e spese in 0,5 mL di PBS, 0,3% BSA integrato con 0,1 mg/mL dei diversi preparati di nanoparticelle (HFn nudo, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) precedentemente etichettati con FITC.
6. Analisi statistica e repliche sperimentali
- Animali
- Eseguire tre esperimenti indipendenti di crescita tumorale e isolamento DI CAF, utilizzando 8 animali per singolo esperimento, come descritto in 1.1.5. Per ottimizzare la resa di isolamento dei CAF, dividere i tessuti asportati in sottogruppi (n=4) ed elaborarli, seguendo i passaggi descritti nella sezione 2.
- Interazione HFn con le cellule
- Valutare l'interazione di HFn funzionalizzato e non funzionalizzato con cellule bersaglio e non bersaglio (CAF e 4T1, rispettivamente) in termini di percentuale di cellule macchiate positivamente da nanocages marcate fluorescenti. Riportare i risultati come deviazione media ± standard di tre esperimenti indipendenti.
- Analisi statistica
- Per calcolare la significatività statistica negli esperimenti di legame cellulare con HFn e HFn-FAP, utilizzare il normale test ANOVA unizionale.
Risultati
Configurazione del modello in vivo per un isolamento CAF ottimale
L'iniezione di10 5 cellule 4T1-luc nel cuscinetto di grasso mammario di topi femmina BALB/c porta alla crescita di una massa tumorale rilevabile a 5 giorni dopo l'impianto. Misurando il volume del tumore con pinze e la vitalità delle cellule tumorali con BLI, la crescita del tumore è stata monitorata per un mese dopo l'impianto. Per trovare una finestra di sacrificio adeguata per l'isolamento delle CAF, è stato cercato un compromesso ottimale tra dimensioni tumorali più elevate e BLI da un lato e un'ulcerazione e necrosi tumorale emergente dall'altro (Figura 1). Poiché un nucleo necrotico appare 20 giorni dopo l'impianto e si ingrandisce a 25 e 30 giorni (come documentato dalle immagini BLI nella Figura 1C),il giorno 20 è stato impostato come punto temporale per ottimizzare il recupero cellulare dopo il processo di isolamento. Anche dopo aver accuratamente rimosso tutte le aree necrotiche visibili durante le prime fasi di manipolazione del tumore ex vivo,un'alta percentuale di cellule morte è stata trovata al termine della dissociazione in singole cellule(Tabella 1). Poiché questa percentuale può essere rilevante, specialmente con l'aumento delle dimensioni del tumore, la rimozione delle cellule morte è sempre necessaria quando si lavora con il modello 4T1.
Ottimizzazione della procedura di isolamento, della coltura e della caratterizzazione dei CAF
Sono necessari altri due passaggi per isolare la popolazione di CAF (CD90.2+ CD45-) dal pannello delle cellule vitali raccolte: l'esaurimento dei fibroblasti non associati al tumore e l'arricchimento dei fibroblasti associati al tumore (Figura 2). Il cocktail di perle di deplezione rimuove in modo efficiente le cellule CD45+ (che rappresentano il 67,35% e lo 0,69% delle cellule totali pre e post-esaurimento, rispettivamente, Tabella 2), ed è sempre stato utilizzato per elaborare un singolo tumore in ogni colonna. Come mostrato nella Tabella 1,il numero di cellule eluite è sceso da una media di 3 × 106 a 1 × 105 dopo la fase di esaurimento. A causa di questa massiccia diminuzione del numero totale di cellule, è conveniente mettere in comune le cellule raccolte da almeno 2 a un massimo di 4 tumori in un singolo tubo prima di procedere con la fase di arricchimento. In questo modo, è stato ottenuto un numero adeguato di cellule per l'incubazione con perle di fibroblasti associate al tumore e sono passate attraverso una singola colonna di separazione per ottenere una media finale del 93% delle cellule CD90.2+ CD45( Tabella 2).
Una volta seminate su piastre di coltura tissutale, queste hanno recuperato cellule attaccate alla plastica e hanno rivelato una grande morfologia a forma di fuso tipica dei fibroblasti(Figura 3A,B)e diversa dalle cellule tumorali 4T1(Figura 3D). Non mettere in comune i tumori dopo l'esaurimento fa sì che la resa cellulare con le microsfere dei fibroblasti associate al tumore sia troppo bassa per stabilire una coltura. In altri casi, quando la durata e la temperatura delle incubazioni con microsfere non vengono mantenute con cura, possono verificarsi alcuni legami non specifici. In questi casi, le fasi di arricchimento sono state meno efficienti e percentuali più elevate di cellule CD90.2- CD45+ e CD90.2- CD45 - sono state recuperate insieme alle cellule CD90.2+ (5.97 ± 1.5 e 16.75 ± 1.1, rispettivamente) (Figura 4 e Tabella 3). Queste cellule contaminanti erano probabilmente responsabili della presenza in coltura di piccoli cloni con morfologia diversa(Figura 4B,punte di freccia nere) che crescevano più velocemente dei CAF e prevalevano sulla coltura CAF primaria(Figura 4C). Questi risultati non ottimali hanno confermato l'importanza di ricontrollare sempre sia l'espressione di CD90.2 che CD45, così come la morfologia cellulare alla fine del processo di arricchimento e durante la crescita cellulare in coltura.
Uso di cellule isolate per valutare il potenziale di targeting CAF di nanofarmaci ingegnerizzati
I CAL appena isolati possono essere utilizzati per diverse applicazioni che vanno dalla ricerca di base agli studi farmacologici. L'obiettivo di questo gruppo è quello di sviluppare nanocavaggi HFn che possano colpire specificamente i CAL. HFn è stato funzionalizzato con uno specifico frammento di anticorpo anti-FAP (HFn-FAP) a due diversi rapporti proteina/anticorpo (un inferiore 1:1 e un superiore 1:5), ed è stato testato il loro legame con i CAF. Poiché il FAP è stato utilizzato come biomarcatore di superficie dei CAF pro-tumorigenici, è stato di fondamentale importanza controllare l'espressione di FAP su CAF isolati (Figura 3C). L'espressione FAP è stata seguita in 5 passaggi in cultura per confermare che la cultura CAF primaria ha mantenuto le sue caratteristiche originali.
Si è scoperto che la funzionalizzazione FAP su HFn contribuisce a uno spostamento significativo verso il targeting CAF rispetto all'HFn nudo, e la minore quantità di anticorpi (1:1) è stata sufficiente per osservare questo effetto (Figura 5A). Tuttavia, questo non è stato osservato con le cellule tumorali 4T1 utilizzate per impostare il modello tumorale in vivo, in cui l'HFn nudo ha mostrato un legame più elevato rispetto all'HFn funzionalizzato (Figura 5B). Ciò è stato molto probabilmente dovuto all'assenza di sovraespressione di FAP nelle cellule 4T1 e all'interazione preferenziale di HFn con TfR1, che regola l'assorbimento di HFn nelle cellule, come ampiamente riportato da questo gruppo27,33. Questi risultati confermano l'utilità dell'utilizzo di colture primarie di CAF mammarie per lo screening preliminare della capacità di targeting delle nanoparticelle progettate per affrontare il microambiente tumorale.
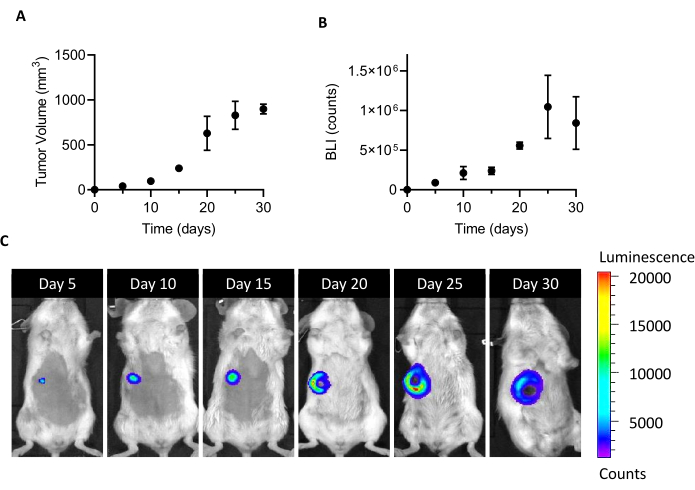
Figura 1: Istituzione del modello tumorale 4T1. Le cellule (105 cellule/ topo) sono state iniettate nel cuscinetto di grasso mammario. La crescita tumorale è stata seguita ai giorni 5, 10, 15, 20, 25 e 30 dopo l'impianto(A)misurando il volume del tumore con pinze e(B)mediante imaging a bioluminescenza. I volumi tumorali e blI sono espressi rispettivamente in mm3 e conteggi. I risultati sono riportati come media ± SEM (n = 6). (C)Le immagini rappresentative BLI ottenute 5, 10, 15, 20, 25 e 30 giorni dopo l'impianto cellulare confermano la crescita del tumore fino al giorno 25, quando sembra raggiungere un plateau. All'ultimo punto di analisi (30 giorni), il BLI non aumenta rispetto al giorno 25. A partire dal giorno 20, le aree di necrosi e ulcerazione iniziano a diventare visibili nella parte centrale del tumore. Scala dei colori: Min = 1.194, Max = 20.462. Abbreviazioni: BLI = imaging a bioluminescenza; SEM = errore standard della media. Fare clic qui per visualizzare una versione più grande di questa figura.
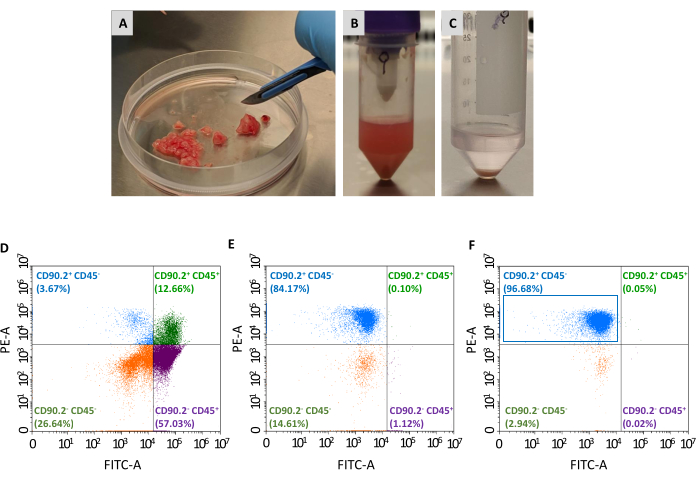
Figura 2: Preparazione di campioni tumorali e caratterizzazione citometrica a flusso di CAF isolati. I tumori sono stati asportati e ridotti in (A) piccoli pezzi di circa 1-2 mm con l'aiuto di un bisturi; (B)sospensione unicellulare dopo digestione tissutale e dissociazione meccanica di un tumore asportato; (C) pellet cellulare ottenuto dopo lisi dei globuli rossi; (D) analisi citometrica a flusso dell'espressione di CD45 e CD90.2 in cellule ottenute dopo rimozione di globuli rossi e cellule morte, (E) dopo esaurimento di fibroblasti non associati al cancro e (F) dopo arricchimento di fibroblasti associati al cancro, dove la maggior parte delle cellule sono CD90,2+ CD45- (rettangolo blu). Abbreviazioni: CAFs = fibroblasti associati al cancro; CD = cluster di differenziazione; PE-A = area di ficoeritrina; FITC-A = aree di isotiocianato di fluoresceina. Fare clic qui per visualizzare una versione più grande di questa figura.
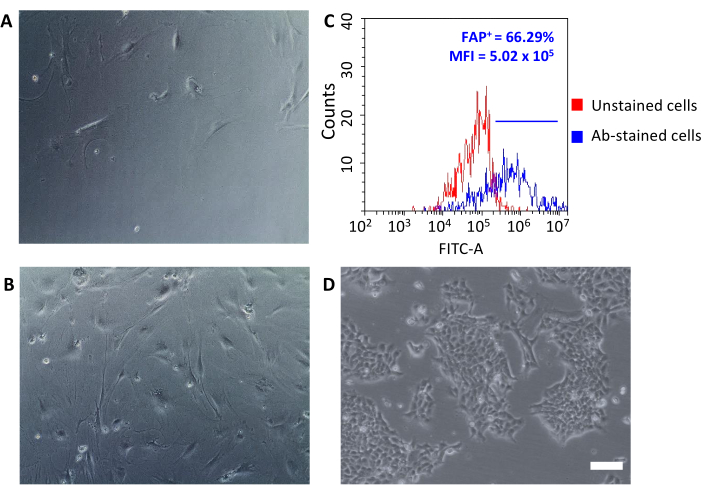
Figura 3: Analisi morfologica dell'espressione di CAFe FAP. (A, B) La morfologia dei CAF è stata verificata in tutti i passaggi di coltura mediante microscopia ottica (diversi livelli di confluenza al passaggio 2 e al passaggio 5) e confrontata con le cellule tumorali (D) 4T1; (C) L'espressione della proteina di attivazione dei fibroblasti (FAP) è stata valutata mediante citometria a flusso alla fine del processo di isolamento sullecellule CD90.2+ CD45 raccolte per confermare le loro caratteristiche molecolari. Una soglia di fluorescenza è stata impostata sulle cellule di controllo non macchiate (grafico rosso) per quantificare l'intensità media della fluorescenza e la percentuale di cellule positive (FAP+)tra le cellule macchiate di anticorpi (grafico blu). Abbreviazioni: CAFs = fibroblasti associati al cancro; FAP = proteina di attivazione dei fibroblasti; CD = cluster di differenziazione; IFM = intensità media di fluorescenza; Ab = anticorpo; FITC-A = area di isotiocianato di fluoresceina; FAP+ = cellule FAP-positive. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Esempio di un processo di isolamento CAF sub-ottimale. ( A )Lavalutazione della citometria a flusso dopo la fase finale di isolamento ha rivelato la presenza di cellule contaminanti CD90.2- CD45+ e CD90.2- CD45. (B) Queste cellule possono essere viste come cloni con una piccola morfologia rotonda al momento della semina (punte di freccia nere e inserto nell'angolo in basso a sinistra del pannello) che (C) ha prevalso sui CAF dopo il terzo passaggio in coltura. Barre della scala = 10 μm. Abbreviazioni: CAF = fibroblasto associato al cancro; CD = cluster di differenziazione; PE-A = area di ficoeritrina; FITC-A = aree di isotiocianato di fluoresceina. Fare clic qui per visualizzare una versione più grande di questa figura.
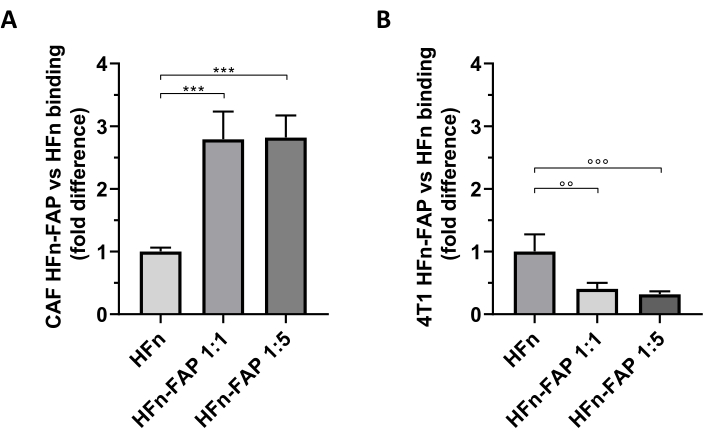
Figura 5: Legame di nanocavi HFn su CAF e 4T1. Le nanocaghe HFn sono state etichettate fluorescentemente con FITC, funzionalizzate con un frammento di anticorpo anti-FAP (HFn-FAP) a due diversi rapporti proteina-anticorpo (1:1 e 1:5) e incubate con (A) cellule bersaglio e (B) 4T1 a 4 °C per 2 ore. Il legame è stato valutato mediante citometria a flusso. ( A )Illegame HFn-FAP con i CAF è significativamente aumentato di tre volte a entrambe le concentrazioni di frammenti di anticorpi rispetto all'HFn nudo. (B) Al contrario, è stato osservato un legame significativamente più elevato di HFn nudo nelle cellule 4T1, dove il legame non è migliorato dal riconoscimento FAP. I risultati sono riportati come deviazione media ± standard di tre esperimenti indipendenti. p = 0,0003; °° p = 0,0021 ; °°° p = 0,0008. Abbreviazioni: CAFs = fibroblasti associati al cancro; FAP = proteina di attivazione dei fibroblasti; HFn = variante ricombinante della catena pesante di ferritina umana usata come nanoparticella nuda o coniugata; HFN-FAP = nanoparticelle HFn funzionalizzate con la porzione variabile di un anticorpo anti-FAP preparato a due rapporti molari HFn:Fab@FAP, 1:1 e 1:5. Fare clic qui per visualizzare una versione più grande di questa figura.
| Numero di cella (SD ± media) | Resa di estrazione Totale (per passaggio) | |
| Tumore asportato (post rimozione dei globuli rossi) | 1,27 x 108 ± 9,81 x 107 | 100% |
| Tumore asportato (rimozione delle cellule morte post) | 3,01 x 106 ± 9,61 x 105 | 2.38% |
| Cocktail post esaurimento | 1,15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Post arricchimento | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tabella 1: Conta cellulare totale dopo ogni fase di isolamento dei fibroblasti associati al cancro.
| Distribuzione cellulare (%) | CD90.2+ CD45- | CD90,2+ CD45+ | CD90,2- CD45+ | CD90,2- CD45- |
| Tumore asportato (rimozione delle cellule morte post) | 1,81 ± 0,98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| Cocktail post esaurimento | 69.33 ± 16.75 | 0,14 ± 0,13 | 0,55 ± 0,63 | 39.89 ± 30.31 |
| Post arricchimento | 93.14 ± 3.3 | 0,09 ± 0,1 | 0,09 ± 0,08 | 6.69 ± 3.4 |
Tabella 2: Distribuzione cellulare in base all'espressione di CD90.2 e CD45 dopo ogni passaggio di isolamento dei fibroblasti associati al cancro.
| Distribuzione cellulare (%) | CD90.2+ CD45- | CD90,2+ CD45+ | CD90,2- CD45+ | CD90,2- CD45- |
| Post arricchimento (senza pooling) | 75.80 ± 2.9 | 1,49 ± 0,4 | 5,97 ± 1,5 | 16.75 ± 1.1 |
Tabella 3: Espressione CD90.2 e CD45 di cellule raccolte dopo un esperimento di isolamento dei fibroblasti associato al cancro sub-ottimale.
Discussione
I CAF stanno emergendo come attori chiave nel rimodellamento della matrice extracellulare, promuovendo la progressione delle metastasi e limitando l'accesso dei farmaci al sito tumorale34. Tuttavia, a causa della loro eterogeneità, i loro ruoli sono ancora controversi: alcuni CAF sono tumorigenici, mentre alcuni altri sottotipi sembrano avere un ruolo soppressivo del tumore. In questo contesto, il loro isolamento può essere di estremo interesse per far luce sul loro ruolo molto dibattuto nella progressione del cancro, che avrà importanti implicazioni cliniche12,31. Inoltre, l'estrazione CAF di successo da modelli tumorali murini umani e preclinici faciliterebbe anche lo sviluppo di nuovi farmaci CAF-targeting. Questo documento riporta un metodo per isolare e coltura in modo efficiente i CAF primari da un modello preclinico singeneico di cancro al seno. Sulla base dell'esperienza, tre fasi sperimentali influenzano principalmente il successo del protocollo.
Il primo è lavorare velocemente per evitare l'aggregazione di sospensioni cellulari associate al rischio di coagulazione nella colonna e al rallentamento dell'efflusso cellulare: infatti, quando le cellule che passavano attraverso la colonna venivano raggruppate insieme, aumentava la probabilità di un processo di isolamento sub-ottimale e le colture finali contenevano cloni cellulari "contaminanti". Il secondo è il pooling di cellule di diversi tumori dopo il passaggio di esaurimento per garantire un numero sufficiente di cellule da attraversare nella fase finale di arricchimento. L'ultimo problema critico è la placcatura delle cellule estratte ad alte densità cellulari, molto probabilmente partendo da un singolo pozzettino della piastra a 24 pozzetti per aumentare la crescita cellulare e l'espansione della colonia per un massimo di 4-5 passaggi. Se le cellule venivano seminate a basse densità, si espandevano sulla superficie libera e smettevano rapidamente di replicarsi.
Diversi studi hanno già descritto metodi di estrazione CAF di origine sia umana che murina, per studiare il loro ruolo nel promuovere lo sviluppo e l'invasività del cancro. Questo è stato fatto in molti tipi di tumori, tra cui il cancro al seno, il melanoma, il colangiocarcinoma e l'adenocarcinoma pancreatico35,36,37,38. Tuttavia, a causa della mancanza di marcatori CAF specifici e della loro eterogeneità, i risultati di questi processi sono ancora sub-ottimali.
Qui, le cellule isolate sono state utilizzate per convalidare la capacità di targeting CAF delle nanocaghe HFn funzionalizzate con parti di targeting anti-FAP. L'uso di colture primarie di CAF è stato un vantaggio significativo, consentendo la validazione della nanostrategia ex vivo con un esperimento di legame molto più semplice ed economico rispetto a farlo direttamente in vivo in questa fase preliminare di ottimizzazione dei nanofarmaci.
In questo senso, i test ex vivo sui CAF possono precedere gli esperimenti in vivo sugli animali consentendo lo screening e la selezione delle nanoparticelle più promettenti per il targeting ottimale della CAF. Il modello CAF qui presentato può anche essere utilizzato per studi preliminari di efficacia, quando si caricano nanoparticelle con farmaci attivi. Gli animali saranno utilizzati solo in seguito per valutare la biodistribuzione, la farmacocinetica e gli studi di efficacia.
Sono in fase di sviluppo diversi nanofarmaci CAF-targeting, come nanocages di ferritina per la terapia fotodinamica nel cancro al seno e particelle a base di peptidi per fornire doxorubicina nei modelli di cancro alla prostata39,40. Tuttavia, non molti studi si sono concentrati sull'isolamento dei CAF come piattaforme cellulari per l'ottimizzazione dei nanofarmaci.
Questo protocollo presenta alcune limitazioni. In primo luogo, è un protocollo che richiede tempo, che richiede la preparazione e l'acquisto di diversi reagenti e materiali. In secondo luogo, a causa della scarsità di CAF nel tumore al seno 4T1, la loro resa è bassa. Gli esperimenti sulle nanoparticelle dovrebbero essere pianificati ed eseguiti non appena viene raggiunto il numero di cellule richiesto, poiché i CAF primari subiscono la senescenza e non possono essere mantenuti in coltura per lungo tempo. In conclusione, questo metodo di isolamento, coltivazione e caratterizzazione dei CAF può essere un potente strumento per accelerare lo sviluppo di nuovi nanofarmaci mirati nella lotta contro il cancro.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dall'Associazione Italiana per la Ricerca sul Cancro (AIRC) nell'ambito del progetto IG 2017-ID. 20172 – P.I. Corsi Fabio. SM riconosce il centro di ricerca clinica pediatrica "Romeo ed Enrica Invernizzi" che supporta la sua posizione. AB ringrazia AIRC (progetto ID. 20172) e l'Università degli Studi di Milano per l'assegno di ricerca. Le borse di studio post-dottorato e dottorato LS e MS sono sostenute dall'Università degli Studi di Milano.
Materiali
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Riferimenti
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon