A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج من Steatosis التجريبية في المختبر: ثقافة الخلية الكبدية في الدهون الزائد مشروط المتوسطة
In This Article
Summary
ويهدف هذا البروتوكول إلى أن يكون أداة لدراسة steatosis والجزيئية والبيوكيميائية والتغيرات الخلوية التي تنتجها أكثر من التعرض للخلايا الكبدية إلى الدهون في المختبر.
Abstract
مرض الكبد الدهني المرتبط بالخلل الأيضي (MAFLD)، المعروف سابقا باسم مرض الكبد الدهني غير الكحولي (NAFLD)، هو مرض الكبد الأكثر انتشارا في جميع أنحاء العالم بسبب علاقته بالسمنة والسكري من النوع 2 وعسر الهضم. التهاب الكبد، تراكم قطرات الدهون في فترة الإصابة بسمة الكبد، هو سمة رئيسية من سمات المرض الذي يسبق الالتهاب الملاحظ في التهاب الكبد والتليف وأمراض الكبد في المرحلة النهائية. تراكم الدهون في خلايا الكبد قد تتداخل مع التمثيل الغذائي السليم للزينوبيولوجيات والجزيئات الذاتية، وكذلك للحث على العمليات الخلوية مما يؤدي إلى تقدم المرض. على الرغم من أن الدراسة التجريبية للداء الكبدي يمكن إجراؤها في الجسم الحي، إلا أن النهج المختبرية لدراسة الداء النتني هي أدوات تكميلية ذات مزايا مختلفة. ثقافة الكبد في الدهون الزائد مشروطة المتوسطة هو خيار استنساخ ممتازة لدراسة steatosis الكبدي السماح بتحديد العمليات الخلوية المتعلقة تراكم الدهون، مثل الضغوط التأكسدية والريبلتية، autophagia، والانتشار، وموت الخلايا، الخ، فضلا عن غيرها من الاختبارات بما في ذلك فعالية المخدرات، والاختبار السمية، من بين العديد من التطبيقات المحتملة الأخرى. هنا ، كان يهدف إلى وصف منهجية زراعة خلايا الكبد في المتوسطة الدهنية ذات الحالة الزائدة. تم استزراع خلايا HepG2 في RMPI 1640 متوسطة مكيفة مع بالميتات الصوديوم وأوليت الصوديوم. الأهم من ذلك، فإن نسبة هذه الدهون اثنين أمر بالغ الأهمية لصالح تراكم قطرات الدهون، مع الحفاظ على انتشار الخلايا ومعدل وفيات معتدل، كما يحدث في الكبد أثناء المرض. تظهر المنهجية ، من إعداد مخزون محلول الدهون ، والخليط ، بالإضافة إلى الوسط ، وثقافة خلايا الكبد. مع هذا النهج، فمن الممكن لتحديد قطرات الدهون في خلايا الكبد التي يمكن ملاحظتها بسهولة عن طريق النفط الأحمر O تلطيخ، فضلا عن منحنيات معدلات الانتشار / الوفيات.
Introduction
الكبد الدهني المرتبطة الخلل الأيضي هو منتشرة للغاية في جميع أنحاء العالم1,2; وتشير التقديرات إلى أن ما يصل إلى 25٪ من السكان يتأثرون3. هذا المرض المعروف سابقا باسم مرض الكبد الدهني غير الكحولية (NAFLD), وقد تم تحديث التسميات إلى الخلل الأيضي المرتبطة مرض الكبد الدهني (MAFLD) لتعكس بدقة الإمراض المتعلقة السمنة, مقاومة الأنسولين, مرض السكري من النوع 2, وعسر الهضم, فضلا عن التدليس المحتمل للمرض3,4.
بغض النظر عن الاسم ، يتضمن المرض طيفا واسعا من التغيرات النسيجية التي تتميز بتراكم الدهون المرتفع بشكل غير طبيعي في الكبد (>5٪ من الدهون في خلايا الكبد5)وقد يتطور من خلال تراكم الدهون الموجود عادة في الداء الدهني البسيط لالتهاب الكبد ، والذي بدوره قد يؤدي إلى تطور التليف وتليف الكبد ، سرطان الكبد، وفشل الكبد5،6،7،8. بسبب انتشاره المتزايد ، من المتوقع أن يصبح MAFLD أول مؤشر على زرع الكبد والسبب الرئيسي للورم الكبدي9.
على الرغم من أنه قد اعتبر شكل حميدة أو خفيفة من أمراض الكبد الدهنية, التهاب الكبد هو في الواقع مفتاح الأيض في MAFLD10. تتأثر مسارات التمثيل الغذائي المختلفة بتراكم الدهون في الكبد ، بما في ذلك على سبيل المثال لا الحصر تخليق الدهون ، والتصدير ، والتمثيل الغذائي10. مقاومة الأنسولين، والإجهاد التأكسدي، والإجهاد الشبكي، والخلل الخلوي ترتبط ارتباطا بقوة إلى السمية الدهنية الكبدية11،12. من ناحية أخرى، الخلايا الكبدية الدهنية هي هدف لأنواع الأكسجين التفاعلية، مما يجعل الأيض كما بيروكسيدات الدهون، كربونيل البروتين، والمواد الإضافية من الأحماض النووية13. على المستوى الخلوي، قد تتعرض خلايا الكبد الدهنية لتلف الميتوكوندريا14، الشيخوخة الخلوية15، موت الخلايا المبرمج16، الإصابة بالحمى12، و autophagia17، من بين أحداث أخرى.
خلايا الكبد هي المسؤولة للغاية عن التمثيل الغذائي، وإزالة السموم، وتوليف مجموعة واسعة من الجزيئات. قد يتعرض العديد من هذه الوظائف للخطر بسبب تراكم الدهون الملاحظ في الداء النتني. لذلك ، من الأهمية بمكان أن يكون لديك أدوات قابلة للاستنساخ تسمح بتقييم دقيق للداء النتن. وبهذا المعنى، فإن النماذج المختبرية قابلة للتطبيق بسهولة وقابلة للاستنساخ بدرجة كبيرة. وقد استخدمت Steatosis في المختبر مع أهداف مختلفة16،18،19. وتستخدم على نطاق واسع خلايا HepG2 كخط الخلية الكبدية. لديها مزايا مثل كونها سهلة الثقافة وتتميز بشكل جيد. ربما، العيب الوحيد لخلايا HepG2 هو حقيقة أنه خط خلايا مسرطنة، لذلك يجب النظر في هذا عند تحليل النتائج. هنا، يظهر تطبيق خليط من الأحماض الدهنية المستخدمة على نطاق واسع في زراعة الخلايا: حمض البالميتيك (PA) وحمض الأوليك (OA). كل من السلطة الفلسطينية وOA تقدم نتائج مختلفة في الثقافة20. السلطة الفلسطينية (C 16:0) هو الأحماض الدهنية المشبعة الأكثر شيوعا التي تم الحصول عليها من النظام الغذائي16. وتعتبر السلطة الفلسطينية باعتبارها علامة بيولوجية من دي نوفو lipogenesis، خطوة حاسمة في تطوير NAFLD21. السلطة الفلسطينية تبين أن تكون شديدة السمية22; لذلك ، قد لا يوصى بالحث على الداء النتني في المختبر. الزراعة العضوية (C 18:1) هو حمض دهني أحادي غير مشبع. على النقيض من السلطة الفلسطينية، وقد اقترح الزراعة العضوية لامتلاك خصائص مضادة للالتهابات ومضادة للأكسدة، والقدرة على مواجهة السلطة الفلسطينية12. كل من السلطة الفلسطينية وOA هي الأحماض الدهنية الرئيسية الموجودة في الدهون الثلاثية، بغض النظر عن حالة الصحة أو المرض16. يقدم الجدول 1 أمثلة على ثقافة خلايا الكبد مع السلطة الفلسطينية، الزراعة العضوية، وخليطها، فضلا عن النتائج المبلغ عنها12،23،24،25،26،27. كما تم استخدام الأحماض الدهنية الأخرى في زراعة الخلايا الكبدية، بما في ذلك حمض الستيريك (C 18:0)28،29،30، حمض اللينوليك (C 18:1)28،30،31 ومواكبته (CLA)28،32، حمض البالميتوليك (C 16:1)29. ومع ذلك ، يتم الإبلاغ عن استخدامها على الأقل في الأدب ، ربما لأن وفرة الكبد أقل من السلطة الفلسطينية وOA16.
بالتزامن, كل من الأحماض الدهنية تشبه steatosis في المختبر, توفير الخلايا المنتشرة, مع زيادة موت الخلايا وانخفاض الجدوى مقارنة مع ظروف السيطرة. ومن الجدير بالذكر أن الأملاح ذات الصلة من هذه الأحماض الدهنية متوفرة ويمكن استخدامها كذلك. واحدة من المشاكل الرئيسية عند تقييم الزائد الدهون في ثقافة خلايا الكبد تعطى في التفريق بين النماذج السمية ونموذج يمثل أفضل steatosis. يمكن حساب العديد من النماذج في الحالة الأولى. في الواقع ، يمكن اعتبار استخدام السلطة الفلسطينية وحدها من بينها ، وارتفاع معدل الوفيات هو النتيجة الأكثروضوحا 12،16،23،24،25،26،27. ويمكن أيضا استخدام جرعات عالية حتى في حالة الزراعة العضوية يمكن اعتبارها نموذجا toxicologic. البروتوكول المبين هنا هو في أعلى وفقا لتطوير steatosis لأنه يظهر انخفاض معدل الوفيات مقارنة مع تلك التي لوحظت في نماذج أخرى ويسمح لاتباعها خلال عدة أيام مع تراكم الدهون التدريجي كما يحدث في NAFLD. تعتبر إمكانية تقييم الداء النتني المعتدل والشاسي من خلال الحالات التجريبية ميزة أخرى.
| الأحماض الدهنية | شروط | نتائج | مرجع | ||
| ابي | التركيز: 200 ميكرومتر | تراكم الدهون | يان وآخرون، 201925. | ||
| التعرض للوقت: 24 ساعة | تلف خلايا الكبد | ||||
| ارتفاع ترانساميناس | |||||
| ابي | التركيز: 50 و100 و200 ميكرومتر | تراكم الدهون | شينغ وآخرون، 201924. | ||
| التعرض للوقت: 24 ساعة | |||||
| ابي | التركيز: 250 ميكرومتر، 500 ميكرومتر، 750 ميكرومتر و1000 ميكرومتر | تراكم الدهون | وانغ وآخرون، 202026. | ||
| التعرض للوقت: 24 ساعة | التخفيض التدريجي لاستدامة الخلية | ||||
| مزيج من الزراعة العضوية / السلطة الفلسطينية | التركيز: 1m | تراكم الدهون | شياو وآخرون، 202027. | ||
| التعرض للوقت: 24 ساعة | لا يبلغ عن سمية الدهون | ||||
| المعدل: 2OA:1PA | |||||
| مزيج من الزراعة العضوية / السلطة الفلسطينية | التحفيز الأول مع 200 ميكرومتر و 400 ميكرومتر من السلطة الفلسطينية ثم التحفيز الثاني مع 200 ميكرومتر من الزراعة العضوية | تراكم الدهون. | تسنغ وآخرون، 202012. | ||
| التركيز: 400 ميكرومتر في السلطة الفلسطينية: 200 ميكرومتر الزراعة العضوية | تم تقليل الأدلة على السمية الدهنية الناجمة عن السلطة الفلسطينية عن طريق تحفيز الزراعة العضوية. | ||||
| المعدل: 2PA:1OA | |||||
| التعرض للوقت: 24 ساعة | |||||
| مزيج من الزراعة العضوية / السلطة الفلسطينية | التركيز: 400 ميكرومتر في السلطة الفلسطينية: 200 ميكرومتر الزراعة العضوية | تراكم الدهون | تشن وآخرون، 201823. | ||
| المعدل: 2PA:1OA | |||||
| التعرض للوقت: 24 ساعة | |||||
| مزيج من الزراعة العضوية / السلطة الفلسطينية | التركيز :50 و 500 ميكرومتر | جيل من نوعين من steatosis: الداء النتن الخفيف و الداء النتني الحاد. | كامبوس وغوزمان 2021 | ||
| المعدل: 2PA:1OA | يحاكي المعرض المزمن من الزائد الدهون | ||||
| التعرض للوقت: 24 ساعة، 2 أيام، 3 أيام و 4 أيام. | |||||
الجدول 1 - الجداول ثقافة الكبد في ظروف مستخية. يعرض الجدول نوع الأحماض الدهنية المستخدمة، والظروف التي تم الحفاظ عليها، والنتائج الملحوظة في زراعة خلايا الكبد. السلطة الفلسطينية: حمض البالميتيك. OA: حمض الأوليك.
وأخيرا، ينطبق هذا النموذج ليس فقط على دراسة داء الستاتوسيس والكبد الدهني، ولكن أيضا على مسارات التمثيل الغذائي الكبدي والاصطناعية وإزالة السموم في سياق داء الستاتوسيس. أيضا، قد يقدم الداء المستحث في المختبر دليلا لتحديد العلامات المحتملة للمرض وكذلك الأهداف العلاجية.
Protocol
1. إعداد متوسطة قياسية ومشروطة
- لإعداد معيار RPMI 1640، تكملة RPMI 1640 وسط الثقافة مع 10٪ (v/v) من مصل البقر الجنيني (FBS، الحرارة معطلة سابقا) و 1٪ (v/v) من محلول البنسلين-ستريبتوميسين. تخزين المتوسطة عند 4 °C.Sterilize باستخدام مرشحات 0.22 ميكرومتر.
- لإعداد محلول مخزون البالميتات، قم بإعداد محلول 50 mM من البالميتات في RPMI 1640 القياسية التي تم استكمالها سابقا بنسبة 1٪ من ألبوم مصل البقر (خالية من الدهون). حجم 5-10 مل من هذا المخزون سيكون كافيا. تعقيم محلول المخزون باستخدام مرشحات 0.22 ميكرومتر. يخزن عند درجة حرارة 4 درجات مئوية محمي من الضوء لمدة تصل إلى شهر واحد.
- لإعداد محلول مخزون الأوليات، قم بإعداد محلول 50 mM من الأوليات في RPMI 1640 القياسية التي تم استكمالها سابقا بنسبة 1٪ من ألبوم مصل البقر (خالية من الدهون). حجم 10 مل سيكون كافيا. تعقيم محلول المخزون باستخدام مرشحات 0.22 ميكرومتر. يخزن عند -20 درجة مئوية محمي من الضوء لمدة تصل إلى شهر واحد.
- لإعداد المتوسطة steatogenic من المخزونات المعدة سابقا، وإعداد بالميتات 1 جزء: 2 جزء أوليات ستاتوجينيك المتوسطة على مستويين ممكنين: شتياتوسيس خفيفة وشديدة.
- داء الستاتوسيس الخفيف: تحضير 100 مل من بالميتات من جزء واحد: مزيج أوليات من جزئين (50 ميكرومتر) في RPMI 1640 القياسية. تعقيم باستخدام مرشحات 0.22 ميكرومتر. يخزن عند درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
- داء الستاتوسيس الشديد: تحضير 100 مل من بالميتات من جزء واحد: مزيج أوليات من جزئين (500 ميكرومتر) في RPMI 1640 القياسية. تعقيم باستخدام مرشحات 0.22 ميكرومتر. يخزن عند درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
- إعداد بديل لحلول المخزون.
- إعداد كل من الحلول الأسهم باستخدام الأحماض الدهنية المعنية باستخدام الدهون الألبومين الحرة كما هو مبين أعلاه.
- عندما تفتقر إلى الدهون مجانا الألبومين، واستخدام أملاح البالميتات والأوليتات.
- حل إما بالميتات أو الأوليات في 2 مل من الإيثانول المطلق ومن ثم مزيج في الحجم النهائي من معيار RPMI 1640 (5-10 مل). حل oleate مباشرة عن طريق تحريك في معيار RPMI 1640 الثقافة المتوسطة.
- السماح بتبخر الإيثانول عن طريق احتضان في حمام مائي عند 70 درجة مئوية. مزيج تماما.
- في كل حالة، قم بتعقيم كل من حلول المخزون باستخدام مرشحات 0.22 ميكرومتر. تخزين الأسهم بالميتات الحل في 4 °C و oleate حل الأسهم في - 20 °C. حماية كلا الحلين من الضوء. هذه الحلول مستقرة لمدة شهر واحد.
2. ما قبل الثقافة
- البذور 100،000 خلايا HepG2 لكل بئر في لوحة 24 جيدا. أضف 1 مل من RPMI 1640 القياسية.
- الحضانة المسبقة عند 37 درجة مئوية و5٪ثاني أكسيد الكربون لمدة 24 ساعة، مما يسمح بتعلق الخلية.
3. ثقافة السخرة
- بعد ما قبل الثقافة، تجاهل معيار RPMI 1640 المتوسطة وإضافة المتوسطة steatogenic وفقا لذلك.
- تجاهل supernatant وإضافة وسيطة steatogenic الطازجة كل 24 ساعة.
4. تقييم الجدوى والوفيات
- البذور 100،000 خلايا HepG2 لكل بئر في لوحة 24 جيدا. أضف 1 مل من RPMI 1640 القياسية.
- قبل الحضانة لمدة 24 ساعة في 37 درجة مئوية و 5٪ CO2.
- تغيير معيار RPMI 1640 المتوسطة للوسط steatogenic.
- حضانة لمدة 24 ساعة، 2 أيام، 3 أيام، و 4 أيام منعش المتوسطة steatogenic كل 24 ساعة.
- بعد الوقت المناسب، تجاهل supernatant.
- فصل الخلايا من البئر بإضافة 500 ميكرولتر من 0.05٪ تريبسين-EDTA. حضانة لمدة 5 دقائق في 37 درجة مئوية و 5٪ CO2.
- جمع الخلايا التي أعيد إنفاقها في microtube.
- الطرد المركزي في 300 × ز والتخلص من supernatant.
- إضافة 200 ميكرولتر من RPMI القياسية 1640 وإعادة إنفاق الخلايا.
- إضافة 15 ميكرولتر من 0.4٪ الحل الأزرق تريبان في microtube الطازجة. مزيج مع 15 ميكرولتر من تعليق الخلية السابقة.
- عد الخلايا الملطخة وغير الملطخة في مقياس الدم.
- حساب معدلات البقاء والوفيات وفقا لذلك.
القدرة على البقاء =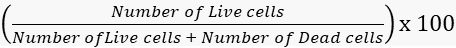
معدل الوفيات =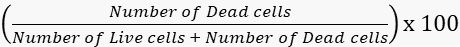
5. تلطيخ الدهون مع النفط الأحمر O
- وضع غطاء ثقافة الخلية في كل بئر في لوحة 24 جيدا.
- البذور 100،000 خلايا HepG2 لكل بئر. أضف 1 مل من RPMI 1640 القياسية.
- الحضانة المسبقة عند 37 درجة مئوية و5٪CO2 لمدة 24 ساعة.
- تغيير معيار RPMI 1640 المتوسطة للوسط steatogenic.
- حضانة لمدة 24 ساعة، 2 أيام، 3 أيام، و 4 أيام، منعش المتوسطة steatogenic كل 24 ساعة.
- بعد الوقت المناسب، تجاهل supernatant.
- غسل مع 1 مل من الفوسفات المالحة المخزنة (PBS). تجاهل الناتنات الفائق.
- إصلاح مع 1 مل من 4٪ بارافورمالديهايد في برنامج تلفزيوني.
- حضانة لمدة 1 ساعة في درجة حرارة الغرفة.
- تجاهل فائض البارافورمالديهايد.
- شطف الخلايا مع 1 مل من الماء المقطر.
- إضافة 1 مل من 70٪ ايزوبروبانول واحتضان لمدة 5 دقائق.
- تجاهل فائض الأيزوبروبانول. لا حاجة إلى غسل برنامج تلفزيوني في هذه المرحلة.
- أضف 1 مل من محلول O الأحمر الزيت واحتضن لمدة 30 دقيقة.
- تجاهل الفائض من محلول O الزيت الأحمر.
- شطف مع 1 مل من الماء المقطر.
- إضافة 500 ميكرولتر من محلول الهيماتوكسيلين. حضانة لمدة 3 دقائق.
- تجاهل الفائض من محلول الهيماتوكسيلين.
- شطف مع 1 مل من الماء المقطر.
- مراقبة تحت المجهر في تكبير 400x (الهدف 40x، العين 10x).
6. تقييم مورفومتري لمحتويات الدهون
- اختيار والتقاط الصور عشوائيا من 10 حقول بصرية من منطقة كاملة من البئر. كرر لكل بئر.
- تقييم النسبة المئوية للمنطقة الحمراء الملطخة باستخدام أداة عتبة اللون في برنامج ImageJ وفقا لفيريرا وراسباند33.
- قارن المنطقة الملطخة مع المساحة الكاملة للمجال البصري باستخدام أداة تحليل الجسيمات في برنامج ImageJ وفقا لفيريرا وراسباند33.
- حساب متوسط النسبة المئوية لكل بئر.
النتائج
خلايا الكبد المستزرعة في نمو العرض المتوسط الستاتيوجينيك في جميع أنحاء سطح البئر؛ ومع ذلك، تظهر خلايا الكبد الدهنية انخفاض معدل النمو مقارنة مع الخلايا المستزرعة في وسيطة التحكم. النسبة المقترحة وتركيز الزراعة العضوية والسلطة الفلسطينية، وضمان بقاء الخلية أثناء الثقافة. البذر 1 × 105
Discussion
ويهدف هذا البروتوكول إلى توفير استراتيجية لدراسة steatosis في المختبر. زراعة الخلايا هي أداة قوية لدراسة الجوانب الخلوية والجزيئية والكيميائية الحيوية والسمية للخلايا المعرضة لظروف مختلفة. مع هذا النهج ، يمكن تصور الستاتوسيس ليس فقط كمرحلة من المرض المعقد الذي هو MAFLD ، ولكن أيضا كتعرض م?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم تمويل هذا العمل من قبل المجلس الوطني للسينسيا إي تكنولوجيا (كوناسيت، CB-221137). أدريانا كامبوس طالبة دكتوراه في برنامج الدكتوراه في جامعة المكسيك، وكان يدعمها كوناسيتي (CVU: 1002502).
Materials
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
References
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved