Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un modelo de esteatosis experimental in vitro:cultivo de células de hepatocitos en medio condicionado por sobrecarga lipídica
En este artículo
Resumen
Este protocolo pretende ser una herramienta para estudiar la esteatosis y los cambios moleculares, bioquímicos, celulares producidos por la sobreexposición de los hepatocitos a los lípidos in vitro.
Resumen
La enfermedad del hígado graso asociada a la disfunción metabólica (MAFLD), anteriormente conocida como enfermedad del hígado graso no alcohólico (NAFLD), es la enfermedad hepática más prevalente en todo el mundo debido a su relación con la obesidad, la diabetes tipo 2 y la dislipidemia. La esteatosis hepática, la acumulación de gotas lipídicas en el parénquima hepático, es una característica clave de la enfermedad que precede a la inflamación observada en la esteatohepatitis, la fibrosis y la enfermedad hepática en etapa terminal. La acumulación de lípidos en los hepatocitos podría interferir con el metabolismo adecuado de los xenobióticos y las moléculas endógenas, así como inducir procesos celulares que conduzcan al avance de la enfermedad. Aunque el estudio experimental de la esteatosis se puede realizar in vivo, losenfoques in vitro para el estudio de la esteatosis son herramientas complementarias con diferentes ventajas. El cultivo de hepatocitos en medio condicionado por sobrecarga lipídica es una excelente opción reproducible para el estudio de la esteatosis hepática que permite la identificación de procesos celulares relacionados con la acumulación de lípidos, como tensiones oxidativas y reticulares, autofagia, proliferación, muerte celular, etcétera, así como otras pruebas que incluyen la eficacia de los fármacos y las pruebas toxicológicas, entre otras muchas posibles aplicaciones. Aquí, se tuvo como objetivo describir la metodología de cultivo de células de hepatocitos en medio condicionado por sobrecarga lipídica. Las células HepG2 se cultivaron en medio RMPI 1640 acondicionado con palmitato de sodio y oleato de sodio. Es importante destacar que la proporción de estos dos lípidos es crucial para favorecer la acumulación de gotas lipídicas, al tiempo que mantiene la proliferación celular y una tasa de mortalidad moderada, como ocurre en el hígado durante la enfermedad. Se muestra la metodología, a partir de la preparación de las existencias de solución lipídica, mezcla, adición al medio y cultivo de hepatocitos. Con este enfoque, es posible identificar gotas de lípidos en los hepatocitos que son fácilmente observables por tinción de O rojo aceite, así como curvas de tasas de proliferación / mortalidad.
Introducción
El hígado graso asociado con la disfunción metabólica es altamente prevalente en todo el mundo1,2; se estima que hasta el 25% de la población se ve afectada3. Esta enfermedad anteriormente conocida como enfermedad del hígado graso no alcohólico (EHGNA), ha actualizado su nomenclatura a disfunción metabólica asociada a la enfermedad del hígado graso (MAFLD) para reflejar con precisión la patogénesis relacionada con la obesidad, la resistencia a la insulina, la diabetes tipo 2 y la dislipidemia, así como los posibles manejos de la enfermedad3,4.
Independientemente del nombre, la enfermedad incluye un amplio espectro de cambios histopatológicos caracterizados por una acumulación anormalmente alta de lípidos en el hígado (>5% de grasa en los hepatocitos5) y podría progresar a través de la acumulación de lípidos típicamente encontrada en la esteatosis simple a esteatohepatitis, que a su vez podría conducir al desarrollo de fibrosis, cirrosis, carcinoma hepatocelular e insuficiencia hepática5,6,7,8. Debido a su creciente prevalencia, se espera que MAFLD se convierta en la primera indicación de trasplante hepático y la principal causa de carcinoma hepatocelular9.
Aunque se ha considerado como una forma benigna o leve de enfermedad del hígado graso, la esteatosis hepática es de hecho la clave metabólica en MAFLD10. Diferentes vías metabólicas se ven afectadas por la acumulación de lípidos en el hígado, incluyendo pero no limitado a la síntesis de lípidos, la exportación y el metabolismo10. La resistencia a la insulina, el estrés oxidativo, el estrés reticular y la disfunción celular están fuertemente asociados a la lipotoxicidad hepática11,12. Por otro lado, los hepatocitos grasos son el objetivo de las especies reactivas de oxígeno, haciendo metabolitos como peróxidos lipídicos, carbonilos proteicos y aductos de ácidos nucleicos13. A nivel celular, los hepatocitos grasos pueden sufrir daño mitocondrial14,senescencia celular15,apoptosis 16,piroptosis12y autofagia17,entre otros eventos.
Los hepatocitos son altamente responsables del metabolismo, la desintoxicación y la síntesis de una amplia gama de moléculas. Muchas de estas funciones podrían verse comprometidas por la acumulación de lípidos observada en la esteatosis. Por lo tanto, es de gran importancia contar con herramientas reproducibles que permitan una evaluación precisa de la esteatosis. En este sentido, los modelos in vitro son fácilmente aplicables y altamente reproducibles. La esteatosis in vitro se ha utilizado con diferentes objetivos16,18,19. Las células HepG2 son ampliamente utilizadas como línea celular de hepatocitos. Tiene ventajas como ser fácil de cultivar y bien caracterizado. Quizás, la única desventaja de las células HepG2 es el hecho de que es una línea celular cancerígena, por lo que esto debe tenerse en cuenta al analizar los resultados. Aquí, se muestra la aplicación de una mezcla de ácidos grasos muy utilizada en cultivo celular: ácido palmítico (PA) y ácido oleico (OA). Tanto la AP como la OA ofrecen resultados diferentes en la cultura20. PA (C 16:0) es el ácido graso saturado más común obtenido de la dieta16. La AF es considerada como un biomarcador de lipogénesis de novo,un paso crucial en el desarrollo de NAFLD21. La AP ha demostrado ser altamente tóxica22; por lo tanto, es posible que no se recomiende inducir esteatosis in vitro. OA (C 18:1) es un ácido graso monoinsaturado. A diferencia de la AP, se ha sugerido que la OA posee propiedades antiinflamatorias y antioxidantes, pudiendo contrarrestar la PA12. Tanto la AF como la OA son los principales ácidos grasos presentes en los triglicéridos, independientemente del estado de salud o enfermedad16. La Tabla 1 proporciona ejemplos del cultivo de hepatocitos con AF, OA y su mezcla, así como los resultados informados12,23,24,25,26,27. Otros ácidos grasos también se han utilizado en el cultivo de hepatocitos, incluyendo el ácido esteárico (C 18:0)28,29,30,ácido linoleico (C 18:1)28,30,31 y sus conjugados (CLA)28,32,ácido palmitoleico (C 16:1)29. Sin embargo, su uso se informa con menos frecuencia en la literatura, tal vez porque su abundancia hepática es menor que PA y OA16.
En conjunto, ambos ácidos grasos se asemejan a la esteatosis in vitro,proporcionando células proliferantes, con mayor muerte celular y menor viabilidad en comparación con las condiciones de control. Vale la pena mencionar que las respectivas sales de estos ácidos grasos están disponibles y también se pueden usar. Uno de los principales problemas a la hora de valorar la sobrecarga lipídica en cultivo de células hepatocitarias se da en la diferenciación entre los modelos toxicológicos y el modelo que mejor representa la esteatosis. Muchos modelos se pueden contabilizar en el primer caso. De hecho, el uso de AF solo podría considerarse entre ellos, y la alta mortalidad es el resultado más evidente12,16,23,24,25,26,27. El uso de dosis altas incluso en el caso de OA también puede considerarse como un modelo toxicológico. El protocolo aquí mostrado es mayor acorde con el desarrollo de esteatosis ya que muestra baja mortalidad en comparación con la observada en otros modelos y permite seguirlo durante varios días con acumulación progresiva de lípidos tal y como ocurre en NAFLD. La posibilidad de evaluar la esteatosis leve y grave a través de condiciones experimentales se considera otra ventaja.
| Ácidos grasos | Condiciones | Resultados | Referencia | ||
| PAPÁ | Concentración: 200 μM | Acumulación de lípidos | Yan et al, 201925. | ||
| Tiempo de exposición: 24 h | Daño a hepatocitos | ||||
| Elevación de transaminasas | |||||
| PAPÁ | Concentración: 50, 100 y 200 μM | Acumulación de lípidos | Xing et al, 201924. | ||
| Tiempo de exposición: 24 h | |||||
| PAPÁ | Concentración: 250 μM, 500 μM, 750 μM y 1.000 μM | Acumulación de lípidos | Wang et al, 202026. | ||
| Tiempo de exposición: 24 h | Reducción progresiva de la viabilidad celular | ||||
| Mezcla de OA/PA | Concentración: 1 mM | Acumulación de lípidos | Xiao et al, 202027. | ||
| Tiempo de exposición: 24 h | No reporta lipotoxicidad | ||||
| Precio: 2OA:1PA | |||||
| Mezcla de OA/PA | Primera estimulación con 200 μM y 400 μM de PA y luego segunda estimulación con 200 μM de OA | Acumulación de lípidos. | Zeng et al, 202012. | ||
| Concentración: 400 μM PA: 200 μM OA | La evidencia de lipotoxicidad inducida por AF se redujo mediante la estimulación de la OA. | ||||
| Precio: 2PA:1OA | |||||
| Tiempo de exposición: 24 h | |||||
| Mezcla de OA/PA | Concentración: 400 μM PA: 200 μM OA | Acumulación de lípidos | Chen et al, 201823. | ||
| Precio: 2PA:1OA | |||||
| Tiempo de exposición: 24 h | |||||
| Mezcla de OA/PA | Concentración: 50 y 500 μM | Generación de dos tipos de esteatosis: esteatosis leve y esteatosis severa. | Campos y Guzmán 2021 | ||
| Precio: 2PA:1OA | Simula la exposición crónica de la sobrecarga lipídica | ||||
| Tiempo de exposición: 24 h, 2 días, 3 días y 4 días. | |||||
Tabla 1. Cultivo de hepatocitos en condiciones esteatogénicas. La tabla presenta el tipo de ácido graso utilizado, las condiciones mantenidas y los resultados observados en el cultivo de hepatocitos. PA: Ácido palmítico. OA: Ácido oleico.
Finalmente, este modelo es aplicable no solo al estudio de la esteatosis y el hígado graso, sino también a las vías metabólicas hepáticas, sintéticas y de desintoxicación en el contexto de la esteatosis. Además, la esteatosis inducida in vitro podría proporcionar evidencia para la identificación de marcadores potenciales de la enfermedad, así como objetivos terapéuticos.
Protocolo
1. Preparación de medio estándar y acondicionado
- Para preparar el RPMI 1640 estándar, complemente el medio de cultivo RPMI 1640 con 10% (v/v) de suero fetal bovino (FBS, previamente inactivado por calor) y 1% (v/v) de solución de penicilina-estreptomicina. Conservar el medio a 4 °C.Esterilizar con filtros de 0,22 μm.
- Para preparar la solución de caldo de palmitato, prepare una solución de palmitato de 50 mM en el estándar RPMI 1640 previamente suplementada con 1% de albúmina sérica bovina (libre de lípidos). Un volumen de 5-10 ml de este stock será suficiente. Esterilizar la solución de material mediante el uso de filtros de 0,22 μm. Conservar a 4 °C protegido de la luz durante un tiempo límite de 1 mes.
- Para preparar la solución de caldo de oleato, prepare una solución de oleato de 50 mM en el estándar RPMI 1640 previamente suplementada con 1% de albúmina sérica bovina (libre de lípidos). Un volumen de 10 ml será suficiente. Esterilizar la solución de material mediante el uso de filtros de 0,22 μm. Conservar a -20 °C protegido de la luz durante un plazo de hasta 1 mes.
- Para preparar el medio esteatogénico a partir de las existencias preparadas previamente, prepare un palmitato de 1 parte: medio esteatogénico de oleato de 2 partes en dos niveles posibles: esteatosis leve y grave.
- Esteatosis leve: Preparar 100 ml de una mezcla de palmitato de 1 parte: oleato de 2 partes (50 μM) en RPMI 1640 estándar. Esterilizar mediante filtros de 0,22 μm. Conservar a 4 °C durante un tiempo de hasta 1 semana.
- Esteatosis severa: Prepare 100 ml de una mezcla de palmitato de 1 parte: oleato de 2 partes (500 μM) en RPMI 1640 estándar. Esterilizar mediante filtros de 0,22 μm. Conservar a 4 °C durante un tiempo de hasta 1 semana.
- Preparación alternativa para las soluciones de stock.
- Prepare ambas soluciones de caldo utilizando los ácidos grasos respectivos mediante el uso de albúmina lipídica libre como se indicó anteriormente.
- Cuando carezca de albúmina lipídica libre, use sales de palmitato y oleato.
- Disuelva el palmitato o el oleato en 2 ml de etanol absoluto y luego mezcle el volumen final del RPMI 1640 estándar (5-10 ml). Disolver el oleato directamente agitando en el medio de cultivo estándar RPMI 1640.
- Permitir la evaporación del etanol incubando en un baño de agua a 70 °C; Homogeneizar.
- En todos los casos, esterilice ambas soluciones de stock utilizando filtros de 0,22 μm. Almacene la solución de caldo de palmitato a 4 °C y la solución de caldo de oleato a - 20 °C. Proteja ambas soluciones de la luz. Estas soluciones son estables durante 1 mes.
2. Pre-cultura
- Seed 100.000 células HepG2 por pozo en una placa de 24 pozos. Agregue 1 ml de RPMI 1640 estándar.
- Preincubar a 37 °C y 5% de CO2 durante 24 h, permitiendo la unión celular.
3. Cultivo esteatogénico
- Después del precultivo, deseche el medio estándar RPMI 1640 y agregue el medio esteatogénico en consecuencia.
- Deseche el sobrenadante y agregue el medio esteatogénico fresco cada 24 h.
4. Evaluación de la viabilidad y la mortalidad
- Seed 100.000 células HepG2 por pozo en una placa de 24 pozos. Agregue 1 ml de RPMI 1640 estándar.
- Preincubar durante 24 h a 37 °C y 5% CO2.
- Cambie el medio estándar RPMI 1640 por el medio esteatogénico.
- Incubar durante 24 h, 2 días, 3 días y 4 días refrescando el medio esteatogénico cada 24 h.
- Después del tiempo apropiado, deseche el sobrenadante.
- Separe las células del pozo agregando 500 μL de Tripsina-EDTA al 0,05%. Incubar durante 5 min a 37 °C y 5% CO2.
- Recoge las células resuspendidas en un microtubo.
- Centrifugar a 300 x g y desechar el sobrenadante.
- Agregue 200 μL de RPMI 1640 estándar y resuspenda las células.
- Añadir 15 μL de solución de azul de tripano al 0,4% en un microtubo fresco. Mezclar con 15 μL de la suspensión celular anterior.
- Cuente las células teñidas y no teñidas en un hemocitómetro.
- Calcule las tasas de viabilidad y mortalidad en consecuencia.
Viabilidad =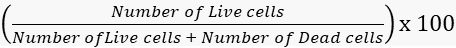
Mortalidad =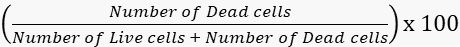
5. Tinción lipídica con Oil-Red O
- Coloque una cubierta de cultivo celular en cada pozo en una placa de 24 pozos.
- Seed 100.000 células HepG2 por pozo. Agregue 1 ml de RPMI 1640 estándar.
- Preincubar a 37 °C y 5% co2 durante 24 h.
- Cambie el medio estándar RPMI 1640 por el medio esteatogénico.
- Incubar durante 24 h, 2 días, 3 días y 4 días, refrescando el medio esteatogénico cada 24 h.
- Después del tiempo apropiado, deseche el sobrenadante.
- Lavar con 1 ml de solución salina tamponada con fosfato (PBS). Deseche el sobrenadante.
- Fijar con 1 mL de paraformaldehído al 4% en PBS.
- Incubar durante 1 h a temperatura ambiente.
- Desechar el exceso de paraformaldehído.
- Enjuague las células con 1 ml de agua destilada.
- Añadir 1 ml de isopropanol al 70% e incubar durante 5 min.
- Deseche el exceso de isopropanol. Un lavado de PBS no es necesario en este momento.
- Añadir 1 ml de solución de O rojo aceite e incubar durante 30 min.
- Deseche el exceso de la solución de O rojo aceite.
- Enjuague con 1 ml de agua destilada.
- Añadir 500 μL de solución de hematoxilina. Incubar durante 3 min.
- Deseche el exceso de solución de hematoxilina.
- Enjuague con 1 ml de agua destilada.
- Observar bajo el microscopio a un aumento de 400x (Objetivo 40x, Ocular 10x).
6. Evaluación morfométrica del contenido lipídico
- Seleccione y capture aleatoriamente fotografías de 10 campos ópticos del área completa del pozo. Repetir para cada pozo.
- Evalúe el porcentaje de área teñida de rojo utilizando la herramienta Umbral de color en el software ImageJ de acuerdo con Ferreira y Rasband33.
- Compare el área teñida con el área completa del campo óptico utilizando la herramienta Analizar partículas en el software ImageJ según Ferreira y Rasband33.
- Calcule el porcentaje promedio de cada pozo.
Resultados
Los hepatocitos cultivados en el medio esteatogénico muestran crecimiento en toda la superficie del pozo; sin embargo, los hepatocitos grasos muestran una tasa de crecimiento más baja en comparación con las células cultivadas en medio de control. La relación y concentración propuesta de OA y PA, garantizan la supervivencia celular durante el cultivo. La siembra de 1 x 105 células por pozo en placas de 24 pozos proporciona una confluencia óptima como se muestra en la Figura 1.
Discusión
Este protocolo pretende proporcionar una estrategia para estudiar la esteatosis in vitro. El cultivo celular es una herramienta poderosa para estudiar aspectos celulares, moleculares, bioquímicos y toxicológicos de las células expuestas a diferentes condiciones. Con este enfoque, la esteatosis se puede visualizar no solo como una etapa de la enfermedad compleja que es MAFLD, sino también como la sobreexposición de los hepatocitos a los lípidos y los posibles resultados resultantes de dicha exposición. Por...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Consejo Nacional de Ciencia y Tecnología (Conacyt, CB-221137). Adriana Campos es estudiante de doctorado en el Programa de Doctorado en Ciencias Biomédicas, Universidad Nacional Autónoma de México, y contó con el apoyo del Conacyt (CVU: 1002502).
Materiales
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
Referencias
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados