Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Deneysel Steatoz İn VitroModeli : Lipid Aşırı Yük Şartlandırılmış Ortamda Hepatosit Hücre Kültürü
Bu Makalede
Özet
Bu protokol, steatozu ve hepatositlerin lipitlere aşırı maruz kalmasıyla ortaya çıkardığı moleküler, biyokimyasal, hücresel değişiklikleri incelemek için bir araç olması amaçlanmıştır.
Özet
Metabolik disfonksiyon ilişkili yağlı karaciğer hastalığı (MAFLD), daha önce alkolsüz yağlı karaciğer hastalığı (NAFLD) olarak bilinir, obezite, diyabet tip 2 ve dislipidemi ile ilişkisi nedeniyle dünya çapında en yaygın karaciğer hastalığıdır. Karaciğer parankiminde lipit damlacıklarının birikmesi olan hepatik steatoz, steatohepatit, fibrozis ve son evre karaciğer hastalığında gözlenen iltihaplanmadan önce hastalığın önemli bir özelliğidir. Hepatositlerde lipit birikimi, ksenobiyotiklerin ve endojen moleküllerin uygun metabolizmasını ve hastalığın ilerlemesine yol açan hücresel süreçleri teşvik etmeyi engelleyebilir. Steatozun deneysel çalışması in vivoolarak yapılabilmesine rağmen, steatoz çalışmasına in vitro yaklaşımlar farklı avantajlara sahip tamamlayıcı araçlardır. Lipid aşırı yük şartlandırılmış ortamdaki hepatosit kültürü, oksidatif ve retiküler gerilmeler, otofaji, çoğalma, hücre ölümü vb. Burada lipid aşırı yük şartlandırılmış ortamda hepatosit hücre kültürünün metodolojisinin anlatılması amaçlanmıştır. HepG2 hücreleri RMPI 1640 ortamında sodyum palmitat ve sodyum oleat ile şartlandırılmış olarak kültürlendi. Daha da önemlisi, bu iki lipitin oranı lipid damlacık birikimini tercih etmek için çok önemlidir, ancak hastalık sırasında karaciğerde olduğu gibi hücre çoğalmasını ve orta derecede ölüm oranını korur. Lipid çözeltisi stoklarının hazırlanmasından, karışıma, ortama ek olarak ve hepatosit kültüründen metodoloji gösterilmiştir. Bu yaklaşımla, yağ-kırmızı O lekeleme ile kolayca gözlemlenebilen hepatositlerdeki lipit damlacıklarının yanı sıra çoğalma/mortalite oranları eğrilerini tanımlamak mümkündür.
Giriş
Metabolik disfonksiyon ile ilişkili yağlı karaciğer dünya çapında oldukça yaygındır1,2; nüfusun % 25'ine kadar etkilendiği tahmin edilmektedir3. Daha önce alkolsüz yağlı karaciğer hastalığı (NAFLD) olarak bilinen bu hastalık, obezite, insülin direnci, diyabet tip 2 ve dislipidemi ile ilgili patogenezin yanı sıra hastalığın olası yönetimlerini doğru bir şekilde yansıtacak şekilde nomenklatürünü metabolik disfonksiyon ilişkili yağlı karaciğer hastalığına (MAFLD) güncelledi3,4.
Adından bağımsız olarak, hastalık karaciğerde anormal derecede yüksek lipit birikimi ile karakterize geniş bir histopatolojik değişiklik spektrumu içerir (hepatositlerdeki yağın%>5'i 5)ve tipik olarak basit steatotozda bulunan lipit birikiminden steatohepatite ilerleyebilir, bu da fibrozis, siroz gelişimine yol açabilir, hepatosellüler karsinom ve karaciğer yetmezliği5,6,7,8. Artan prevalansı nedeniyle MAFLD'nin karaciğer naklinin ilk göstergesi ve hepatosellüler karsinomun önde gelen nedeni olması beklanmaktadır9.
Yağlı karaciğer hastalığının iyi huylu veya hafif bir formu olarak kabul edilmesine rağmen, hepatik steatoz aslında MAFLD10'dametabolik anahtardır. Farklı metabolik yollar, lipid sentezi, ihracat ve metabolizma dahil ancak bunlarla sınırlı olmamak üzere karaciğerdeki lipit birikimini etkiler10. İnsülin direnci, oksidatif stres, retiküler stres ve hücresel işlev bozukluğu hepatik lipotoksite ile güçlü bir şekilde ilişkilidir11,12. Öte yandan, yağlı hepatositler reaktif oksijen türlerinin hedefidir, metabolitleri lipid peroksitler, protein karboniller ve nükleik asitlerin adductları olarak oluşturur13. Hücresel düzeyde, yağlı hepatositler diğer olayların yanı sıra mitokondriyal hasar14, hücresel senescence15, apoptoz16, piroptoz12ve otofaji17'yemaruz kalabilir.
Hepatositler metabolizma, detoksifikasyon ve çok çeşitli moleküllerin sentezinden oldukça sorumludur. Bu fonksiyonların çoğu steatozda gözlenen lipit birikimi ile tehlikeye atılabilir. Bu nedenle, steatozun doğru bir şekilde değerlendirilmesini sağlayan tekrarlanabilir araçlara sahip olmak büyük önem taşımaktadır. Bu anlamda, in vitro modeller kolayca uygulanabilir ve oldukça tekrarlanabilir. Steatoz in vitro farklı hedeflerle kullanılmıştır16,18,19. HepG2 hücreleri hepatosit hücre hattı olarak yaygın olarak kullanılmaktadır. Kültüre kolay ve iyi karakterize olmak gibi avantajları vardır. Belki de, HepG2 hücrelerinin tek dezavantajı kanserojen bir hücre hattı olmasıdır, bu nedenle sonuçları analiz ederken bu dikkate alınmalıdır. Burada, hücre kültüründe yaygın olarak kullanılan yağ asitlerinin bir karışımının uygulanması: palmitik asit (PA) ve oleik asit (OA) gösterilmiştir. Hem PA hem de OA kültürde farklı sonuçlar sunar20. PA (C 16:0) diyetten elde edilen en yaygın doymuş yağ asididir16. PA, DE-novo lipogenezibiyobelirteç olarak kabul edilir NAFLD21'ingeliştirilmesinde önemli bir adım. PA'nın oldukça zehirli olduğu gösterilmiştir22; bu nedenle, steatoz in vitroindükle tavsiye edilmeyebilir. OA (C 18:1) tekli doymamış bir yağ asididir. PA'nın aksine, OA'nın anti-enflamatuar ve anti-oksidan özelliklere sahip olduğu ve PA12'yekarşı koyabildiği öne sürülüyor. Hem PA hem de OA, sağlık veya hastalık durumundan bağımsız olarak trigliseritlerde bulunan ana yağ asitleridir16. Tablo 1, PA, OA ve karışımları ile hepatat kültürüne ve 12 , 23 , 24,25,26,27bildirilen sonuçlara örnekler sağlar. Stearik asit (C 18:0) 28 , 29 , 30,linoleik asit (C18:1)28,30,31 ve konjugeleri (CLA)28,32,palmitoleik asit (C16:1)29dahil olmak üzere diğer yağ asitleri de hepatosit kültüründe kullanılmıştır. Bununla birlikte, kullanımları literatürde en az sıklıkla bildiriliyor, belki de hepatik bollukları PA ve OA16'dandaha düşük olduğu için .
Birlikte, her iki yağ asidi de steatoz in vitro, çoğalmış hücreler sağlar, hücre ölümü artar ve kontrol koşullarına kıyasla daha düşük canlılık sağlar. Bu yağ asitlerinin ilgili tuzlarının mevcut olduğunu ve kullanılabileceğini belirtmek gerekir. Hepatosit hücre kültüründe lipid aşırı yüklemesini değerlendirirken temel sorunlardan biri toksikolojik modeller ile steatozu en iyi temsil eden bir model arasındaki farklılaşmada verilmiştir. Birçok model ilk durumda hesaba katılabilir. Aslında, pa kullanımı tek başına bunlar arasında düşünülebilir ve yüksek mortalite en belirgin sonuçtur12,16,23,24,25,26,27. OA durumunda bile yüksek dozların kullanılması toksikolojik bir model olarak da düşünülebilir. Burada gösterilen protokol steatoz gelişimine daha yüksektir, çünkü diğer modellerde gözlenenlere kıyasla düşük mortalite gösterir ve NAFLD'de meydana geldiği gibi progresif lipit birikimi ile birkaç gün boyunca takip edilmesine izin verir. Hafif ve şiddetli steatozu deneysel koşullarla değerlendirme olasılığı da başka bir avantaj olarak kabul edilir.
| Yağ asitleri | Koşul -ları | Sonuç -ları | Referans | ||
| PA | Konsantrasyon: 200 μM | Lipid birikimi | Yan ve ark, 201925. | ||
| Zamana maruz kalma: 24 saat | Hepatosit hasarı | ||||
| Transaminaz yüksekliği | |||||
| PA | Konsantrasyon: 50, 100 ve 200 μM | Lipid birikimi | Xing ve ark, 201924. | ||
| Zamana maruz kalma: 24 saat | |||||
| PA | Konsantrasyon: 250 μM , 500 μM , 750 μM ve 1.000 μM | Lipid birikimi | Wang ve arkadaşları, 202026. | ||
| Zamana maruz kalma: 24 saat | Hücre canlılığının aşamalı olarak azaltılması | ||||
| OA/PA Karışımı | Konsantrasyon: 1 mM | Lipid birikimi | Xiao ve arkadaşları, 202027. | ||
| Zamana maruz kalma: 24 saat | Lipotoksikliği bildirmez | ||||
| Oran: 2OA:1PA | |||||
| OA/PA Karışımı | önce 200 μM ve 400 μM PA ile stimülasyon ve ardından 200 μM OA ile ikinci stimülasyon | Lipid birikimi. | Zeng ve ark, 202012. | ||
| Konsantrasyon:400 μM PA: 200 μM OA | PA'nın neden olduğu lipotoksiklik kanıtı OA'nın uyarılmasıyla azaldı. | ||||
| Oran: 2PA:1OA | |||||
| Zamana maruz kalma: 24 saat | |||||
| OA/PA Karışımı | Konsantrasyon: 400 μM PA: 200 μM OA | Lipid birikimi | Chen ve arkadaşları, 201823. | ||
| Oran: 2PA:1OA | |||||
| Zamana maruz kalma: 24 saat | |||||
| OA/PA Karışımı | Konsantrasyon :50 ve 500 μM | İki tip steatoz üretimi: hafif steatoz ve şiddetli steatoz. | Campos ve Guzmán 2021 | ||
| Oran: 2PA:1OA | Lipid aşırı yüklemesinin kronik sergisini simüle eder | ||||
| Zamana maruz kalma: 24 saat, 2 gün, 3 gün ve 4 gün. | |||||
Tablo 1. Steatojenik koşullarda hepatosit kültürü. Tablo, kullanılan yağ asidinin türünü, tutulan koşulları ve hepatosit kültüründe gözlenen sonuçları sunar. PA: Palmitik asit. OA: Oleik asit.
Son olarak, bu model sadece steatoz ve yağlı karaciğer çalışması için değil, aynı zamanda steatoz bağlamında hepatik metabolik, sentetik ve detoksifikasyon yolları için de geçerlidir. Ayrıca, in vitro indüklenen steatoz, hastalığın potansiyel belirteçlerinin ve terapötik hedeflerin tanımlanması için kanıt sağlayabilir.
Protokol
1. Standart ve şartlandırılmış orta hazırlık
- Standart RPMI 1640 hazırlamak için, RPMI 1640 kültür ortamını fetal sığır serumunun %10'u (V/v) ve Penisilin-Streptomisin çözeltisinin %1'i (v/v) ile tamamlar. Ortamı 4 °C'de saklayın.0,22 μm filtreler kullanarak sterilize edin.
- Palmitat stok çözeltisi hazırlamak için, daha önce sığır serum albüminin% 1'i (lipid içermeyen) ile desteklenmiş standart RPMI 1640'ta 50 mM'lik bir palmitat çözeltisi hazırlayın. Bu stokun 5-10 mL'lik bir hacmi yeterli olacaktır. 0,22 μm filtreler kullanarak stok çözeltisini sterilize edin. 4 °C'de 1 aya kadar ışıktan korunarak saklayın.
- Oleat stok çözeltisi hazırlamak için, daha önce sığır serum albüminin% 1'i (lipid içermeyen) ile desteklenmiş standart RPMI 1640'ta 50 mM'lik bir oleat çözeltisi hazırlayın. 10 mL'lik bir hacim yeterli olacaktır. 0,22 μm filtreler kullanarak stok çözeltisini sterilize edin. -20 °C'de 1 aya kadar ışıktan korunarak saklayın.
- Daha önce hazırlanmış stoklardan steatojenik ortam hazırlamak için, 1 parçalı bir palmitat hazırlayın: 2 bölümlü oleat steatojenik ortam iki olası seviyede: hafif ve şiddetli steatoz.
- Hafif Steatoz: Standart RPMI 1640'ta 100 mL 1 parçalı palmitat: 2 parçalı oleat (50 μM) karışımı hazırlayın. 0,22 μm filtreler kullanarak sterilize edin. 4 °C'de 1 haftaya kadar saklayın.
- Şiddetli Steatoz: Standart RPMI 1640'ta 100 mL 1 parçalı palmitat: 2 parçalı oleat (500 μM) karışımı hazırlayın. 0,22 μm filtreler kullanarak sterilize edin. 4 °C'de 1 haftaya kadar saklayın.
- Stok çözümleri için alternatif hazırlık.
- Yukarıda belirtildiği gibi serbest lipit albümin kullanarak ilgili yağ asitlerini kullanarak her iki stok çözeltisini de hazırlayın.
- Serbest lipit albümin eksikliği olduğunda, palmitat ve oleat tuzları kullanın.
- Palmitat veya oleat'ı 2 mL mutlak etanol içinde çözün ve ardından standart RPMI 1640'ın (5-10 mL) son hacminde karıştırın. Standart RPMI 1640 kültür ortamında karıştırarak oleat'ı doğrudan çözün.
- 70 °C'de bir su banyosunda kuluçkaya yatırarak etanol buharlaşmasına izin verin; iyice karıştırın.
- Her durumda, her iki stok sokunu 0,22 μm filtre kullanarak sterilize edin. Palmitate stok çözeltilerini 4 °C'de ve oleate stok çözeltisi - 20 °C'de saklayın. Her iki çözümü de ışıktan koruyun. Bu çözümler 1 ay boyunca kararlıdır.
2. Kültür öncesi
- Tohum 24 kuyulu bir tabakta kuyu başına 100.000 HepG2 hücresi. 1 mL standart RPMI 1640 ekleyin.
- 37 °C'de ön kuluçkaya yatır ve 24 saat boyunca%5 CO 2 ile hücre bağlanmasına izin verin.
3. Steatojenik kültür
- Kültür öncesi sonrası, standart RPMI 1640 ortamını atın ve steatojenik ortamı buna göre ekleyin.
- Süpernatant atın ve her 24 saat taze steatojenik ortam ekleyin.
4. Canlılık ve mortalite değerlendirmesi
- Tohum 24 kuyulu bir tabakta kuyu başına 100.000 HepG2 hücresi. 1 mL standart RPMI 1640 ekleyin.
- 37 °C'de 24 saat ve %5 CO2için önceden kuluçkaya yatır.
- Steatojenik ortam için standart RPMI 1640 ortamını değiştirin.
- Her 24 saat steatojenik ortamı yenileyerek 24 saat, 2 gün, 3 gün ve 4 gün kuluçkaya yaslanın.
- Uygun süreden sonra, üstnatant atın.
- %0,05 Trypsin-EDTA'nın 500 μL'sini ekleyerek hücreleri kuyudan ayırın. 37 °C ve %5 CO 2'de 5 dakika kuluçkayayaslanın.
- Yeniden dirilen hücreleri bir mikrotüpte toplayın.
- 300 x g'da santrifüj ve süpernatantı atın.
- 200 μL standart RPMI 1640 ekleyin ve hücreleri yeniden biriktirin.
- Taze bir mikrotüpte 15 μL% 0.4 Trypan mavisi çözelti ekleyin. Önceki hücre süspansiyonunun 15 μL'si ile karıştırın.
- Hemositometredeki lekeli ve lekesiz hücreleri sayın.
- Canlılık ve ölüm oranlarını buna göre hesaplayın.
Yaşayabilirlik =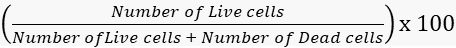
Mortalite =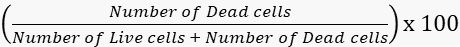
5. Yağ-Kırmızı O ile Lipid boyama
- Her kuyuya 24 kuyulu bir tabakta bir hücre kültürü kapağı koyun.
- Tohum kuyu başına 100.000 HepG2 hücresi. 1 mL standart RPMI 1640 ekleyin.
- 37 °C'de ön kuluçkaya yatır ve 24 saat boyunca%5 CO 2.
- Steatojenik ortam için standart RPMI 1640 ortamını değiştirin.
- Her 24 saat steatojenik ortamı yenileyerek 24 saat, 2 gün, 3 gün ve 4 gün kuluçkaya yatırın.
- Uygun süreden sonra, üstnatant atın.
- 1 mL fosfat tamponlu salin (PBS) ile yıkayın. Üstnatant atın.
- PBS'de %4 paraformaldehitin 1 mL'si ile sabitlenin.
- Oda sıcaklığında 1 saat kuluçkaya yaslanın.
- Paraformaldehit fazlalığını atın.
- Hücreleri 1 mL damıtılmış su ile durulayın.
- % 70 izopropanol 1 mL ekleyin ve 5 dakika kuluçkaya yatırın.
- İzopropanol fazlalığını atın. Bu noktada PBS yıkamaya gerek yoktur.
- 1 mL Yağ kırmızısı O çözeltisi ekleyin ve 30 dakika kuluçkaya yatırın.
- Yağ kırmızısı O çözeltisinin fazlalığını atın.
- 1 mL damıtılmış su ile durulayın.
- 500 μL hematoksilin çözeltisi ekleyin. 3 dakika kuluçkaya yaslanın.
- Hematoksilin çözeltisinin fazlalığını atın.
- 1 mL damıtılmış su ile durulayın.
- Mikroskop altında 400x büyütmede gözlemleyin (Amaç 40x, Oküler 10x).
6. Lipit içeriğinin morfometrik değerlendirilmesi
- Kuyunun tüm alanından 10 optik alanın fotoğraflarını rastgele seçin ve yakalayın. Her kuyu için tekrarlayın.
- Ferreira ve Rasband33'egöre ImageJ yazılımındaki Renk Eşiği aracını kullanarak kırmızı lekeli alanın yüzdesini değerlendirin.
- Ferreira ve Rasband33'egöre ImageJ yazılımındaki Parçacıkları Analiz Et aracını kullanarak lekeli alanı optik alanın tam alanıyla karşılaştırın.
- Her kuyunun ortalama yüzdesini hesaplayın.
Sonuçlar
Kuyunun her yerinde steatojenik orta ekran büyümesinde kültürlenmiş hepatositler; bununla birlikte, yağlı hepatositler kontrol ortamında kültürlenen hücrelere kıyasla daha düşük büyüme hızı gösterir. Önerilen oran ve OA ve PA konsantrasyonu, kültür sırasında hücre sağkalımını garanti altına alıp, oa ve PA'nın konsantrasyonu. 24 kuyu plakalarında kuyu başına1 x 10 5 hücre tohumlama, Şekil 1'degösterildiği gibi optimum izdiham sağlar.
Tartışmalar
Bu protokol steatoz in vitro çalışmak için bir strateji sağlamak için tasarlanmıştır. Hücre kültürü, farklı koşullara maruz kalan hücrelerin hücresel, moleküler, biyokimyasal ve toksikolojik yönlerini incelemek için güçlü bir araçtır. Bu yaklaşımla steatoz sadece MAFLD olan karmaşık hastalığın bir aşaması olarak değil, aynı zamanda lipitlere aşırı maruz kalma ve bu maruziyetten kaynaklanan olası sonuçlar olarak da görselleştirilebilir. Bu nedenle, uygulaması MAFLD'nin ...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Consejo Nacional de Ciencia y Tecnología (Conacyt, CB-221137) tarafından finanse edildi. Adriana Campos, Program de Doctorado en Ciencias Biomédicas, Universidad Nacional Autónoma de México'da doktora öğrencisidir ve Conacyt (CVU: 1002502) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
Referanslar
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır