このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
実験性脂肪化のモデル :脂質過負荷状態培地における肝細胞細胞培養
要約
このプロトコルは、肝細胞の脂質への過剰暴露によって産生される脂肪、生化学的、細胞変化をイン ビトロでステアトーシスおよび分子、生化学的、細胞変化を研究するためのツールとなるものである。
要約
代謝機能障害関連脂肪肝疾患(MAFLD)は、以前は非アルコール性脂肪性肝疾患(NAFLD)として知られており、肥満、糖尿病2型、および脂質異常症との関係により、世界中で最も流行している肝疾患です。肝脂肪症は、肝臓の小板減少の蓄積、脂肪肝炎、線維症、および末期肝疾患で観察される炎症に先行する疾患の重要な特徴である。肝細胞の脂質蓄積は、異種生物および内因性分子の適切な代謝を妨げるだけでなく、疾患の進行につながる細胞プロセスを誘導する可能性がある。ステアトーシスの実験的研究は 生体内で行うことができるが、精間症の研究に 対するインビトロ アプローチは、異なる利点を有する補完的なツールである。脂質過負荷状態培地中の肝細胞培養は、酸化および網状ストレス、オートファジア、増殖、細胞死、細胞死などの脂質蓄積に関連する細胞プロセスの同定を可能にする肝脂肪症の研究のための優れた再現可能な選択肢であり、薬物の有効性、および毒物学的検査を含む他の多くの可能な用途の中で可能な他のアプリケーションの中で。ここでは、脂質過負荷状態培地における肝細胞培養の方法論を説明することを目的とした。ヘプG2細胞はパルミチン酸ナトリウム及びオレイン酸ナトリウムを用いてRMPI 1640培地で培養した。重要なことに、これら2つの脂質の比率は、疾患の間に肝臓で起こるように、細胞増殖および適度な死亡率を維持しながら、脂質液滴蓄積を支持するために重要である。方法論としては、脂質溶液ストックの調製から、混合物、培地への添加、および肝細胞培養が示される。このアプローチにより、油赤O染色によって容易に観察できる肝細胞中の脂質滴、ならびに増殖/死亡率の曲線を同定することができる。
概要
代謝機能障害に関連する脂肪肝は世界的に非常に普及しています1,2;人口の最大25%が3に影響を受けると推定されています。この疾患は、以前は非アルコール性脂肪性肝疾患(NAFLD)として知られており、肥満、インスリン抵抗性、糖尿病2型、脂質異常症に関連する病因を正確に反映するように代謝機能不全に対するその命名法を更新した。3,4.
名前に関係なく、この疾患は肝臓における脂質の異常に高い蓄積(肝細胞5の脂肪の>5%)を特徴とする組織病理学的変化の広いスペクトルを含み、単純な脂肪症に典型的に見られる脂質蓄積を通じて進行する可能性があり、線維症、肝硬変の発症につながる可能性がある。 肝細胞癌、肝不全5、6、7、8.その増加の有病率のために, MAFLDは、肝移植の最初の徴候と肝細胞癌の主要な原因になると予想されます9.
それは、良性または軽度の形態の脂肪肝疾患として考えられてきましたが、肝性脂肪症は、実際にはMAFLD10の代謝キーです。異なる代謝経路は、肝臓における脂質蓄積の影響を受け、脂質合成、輸出、代謝10を含むがこれらに限定されない。インスリン抵抗性、酸化ストレス、網状ストレス、および細胞機能障害は、肝脂肪毒性11,12に強く関連している。一方、脂肪肝細胞は、活性酸素種の標的であり、代謝産物を過酸化脂質としてレンダリングし、タンパク質カルボニル、および核酸の付加物を13にする。細胞レベルでは、脂肪肝細胞はミトコンドリア損傷14、細胞老化15、アポトーシス16、ピロプトーシス12、およびオートファジア17を受ける可能性がある。
肝細胞は、幅広い分子の代謝、解毒、合成に大きな責任を負います。これらの機能の多くは、脂肪症で観察される脂質蓄積によって損なわれる可能性があります。.したがって、ステアトーシスの正確な評価を可能にする再現性のあるツールを持つことは非常に重要です。この意味で、in vitroモデルは容易に適用可能で、非常に再現可能である。体外のステアトーシスは、異なる目標16、18、19で使用されています。HepG2細胞は肝細胞細胞株として広く用いられている。それは、文化が容易で、よく特徴づけられるなどの利点を有する。おそらく、HepG2細胞の唯一の欠点は、発がん性細胞株であるという事実であるため、結果を分析する際に考慮する必要があります。ここで、細胞培養において広く用いられている脂肪酸の混合物の適用:パルミチン酸(PA)およびオレイン酸(OA)が示されている。PA と OA の両方が文化20で異なる結果を提供します。PA(C 16:0)は、ダイエット16から得られる最も一般的な飽和脂肪酸である。PAは、NAFLD21の開発における重要なステップである脱ノボリポジェネシスのバイオマーカーと考えられています。PAは毒性が高い22であることが示されている。したがって、体外でステアトーシスを誘発することは推奨されない場合があります。OA(C 18:1)は、一価不飽和脂肪酸である。PAとは対照的に、OAは、PA12に対抗することができる抗炎症および抗酸化特性を有することが示唆されている。PAとOAの両方が、健康または疾患16の状態に関係なく、トリグリセリドに存在する主脂肪酸である。表1は、PA、OA、およびそれらの混合物を含む肝細胞培養の例と、報告された結果が12、23、24、25、26、27である。他の脂肪酸は、ステアリン酸(C 18:0)28、29、30、リノール酸(C 18:1)28、30、31及びそのコンジュゲート(CLA)28、32、パルミトール酸(C16:1)29を含む肝細胞培養にも使用されている。しかし、その使用は、おそらく彼らの肝の豊富さがPAおよびOA16よりも低いため、文献で最も頻繁に報告される。
併用すると、両方の脂肪酸はインビトロで脂肪化に似ており、細胞の増殖を提供し、対照条件と比較して細胞死が増加し、生存率が低い。これらの脂肪酸のそれぞれの塩が利用可能であり、同様に使用することができることを言及する価値があります。肝細胞培養における脂質過多量を評価する際の主な問題の1つは、毒性モデルと脂肪沈殿を最もよく表すモデルとの分化において与えられる。多くのモデルは、最初のケースで説明することができます。実際には、PAの単独使用はそれらの中で考慮されるかもしれないし、高い死亡率は最も明白な結果である12、16、23、24、25、26、27。OAの場合でも高用量の使用は、毒物学的モデルとしても考えることができます。ここに示すプロトコルは、他のモデルで観察されたものと比較して低い死亡率を示し、NAFLDで発生する進行性脂質蓄積と数日間に従うことを可能にするので、ステアトーシスの発達に従って高い。実験条件を通じて軽度および重度のステアトーシスを評価する可能性は、別の利点と考えられる。
| 脂肪酸 | 条件 | 結果 | 参考 | ||
| お父さん | 濃度:200 μM | 脂質蓄積 | ヤンら、201925. | ||
| 時間露光:24時間 | 肝細胞の損傷 | ||||
| トランスアミンデス標高 | |||||
| お父さん | 濃度:50、100、200μM | 脂質蓄積 | Xingら, 201924. | ||
| 時間露光:24時間 | |||||
| お父さん | 濃度:250 μM、500 μM、750 μM、1,000 μM | 脂質蓄積 | 王ら, 202026. | ||
| 時間露光:24時間 | 細胞生存率の進行性の低下 | ||||
| OA/PAのミックス | 濃度:1mM | 脂質蓄積 | Xiaoらら、202027. | ||
| 時間露光:24時間 | リポ毒性を報告しない | ||||
| レート: 2OA:1PA | |||||
| OA/PAのミックス | PAの200 μMおよび400 μMの最初の刺激、そしてOAの200 μMの第2の刺激 | 脂質蓄積。 | Zengら, 202012. | ||
| 濃度:400 μM PA:200 μM OA | PAによって誘発されたリポ毒性の証拠は、OAの刺激によって減少した。 | ||||
| レート: 2PA:1OA | |||||
| 時間露光:24時間 | |||||
| OA/PAのミックス | 濃度:400 μM PA:200 μM OA | 脂質蓄積 | 陳ら, 201823. | ||
| レート: 2PA:1OA | |||||
| 時間露光:24時間 | |||||
| OA/PAのミックス | 濃度:50 μM | 2種類のステアトーシスの生成:軽度のステアトーシスと 重度のステアトーシス。 | カンポスとグスマン 2021 | ||
| レート: 2PA:1OA | 脂質過負荷の慢性博覧をシミュレート | ||||
| 時間暴露:24時間、2日、3日、4日。 | |||||
表 1.肝細胞培養は、ステア原性の状態で。 表は、使用される脂肪酸の種類、維持された条件、および肝細胞培養における観察された結果を示す。PA:パルミチ酸。OA:オレイン酸。
最後に、このモデルは、脂肪、脂肪肝の研究だけでなく、脂肪のコンテキストで肝代謝、合成、および解毒経路にも適用されます。また、 インビトロ 誘発性ステアトーシスは、疾患の潜在的なマーカーおよび治療標的を同定するための証拠を提供するかもしれない。
プロトコル
1. 標準および条件付き培地製剤
- 標準的なRPMI 1640を調製するために、牛胎児血清(FBS、以前に熱不活性化)の10%(v/v)とペニシリン・ストレプトマイシン溶液の1%(v/v)を含むRPMI 1640培地を補います。0.22 μmフィルターを使用して、4°Cで培地を滅菌してください。
- パルミチンストック溶液を調製するために、牛血清アルブミン(脂質フリー)の1%を以前に補充した標準RPMI 1640にパルミチンの50mM溶液を調製する。この在庫の5〜10 mLの量で十分です。0.22 μmフィルターを使用して、ストック溶液を滅菌します。光から保護された4°Cで1ヶ月まで保管してください。
- オレイン酸ストック溶液を調製するために、ウシ血清アルブミン(脂質フリー)の1%を以前補充した標準RPMI 1640にオレ酸塩の50 mM溶液を調製する。10 mLの容積で十分です。0.22 μmフィルターを使用して、ストック溶液を滅菌します。光から保護された-20°Cで1ヶ月まで保管してください。
- 以前に調製した株式からステアトゲン性培地を調製するには、1部パルミエートを準備します:2つの可能なレベルで2部部分の油性ステアトゲン培地:軽度および重度のステアトシス。
- 軽度のステアトーシス:1部パルミチン酸100 mLを調製:標準RPMI 1640で2部オーレ酸(50 μM)ミックス。0.22 μmフィルターを使用して滅菌します。4°Cで1週間保存します。
- 重度のステアトシス:1部パルミチン酸100 mLを準備:2部分のオレエート(500 μM)ミックスを標準RPMI 1640に入れます。0.22 μmフィルターを使用して滅菌します。4°Cで1週間保存します。
- ストックソリューションの代替準備。
- 上記のように遊離脂質アルブミンを用いて、それぞれの脂肪酸を用いて両方のストック溶液を調製する。
- フリーの脂質アルブミンが欠けている場合は、パルミチンとオレイン酸塩を使用してください。
- パルミチン酸またはオレイン酸を2 mLの絶対エタノールに溶解し、標準RPMI 1640(5〜10 mL)の最終体積で混合します。標準RPMI 1640培地で撹拌することにより直接オレエートを溶解する。
- 70 °Cの水浴でインキュベートすることによってエタノールの蒸発を可能にする;よく混ぜます。
- いずれの場合も、0.22 μmフィルターを使用して両方のストック溶液を殺菌します。パルミエートストックソリューションを4°Cに保存し、20°Cでオレエー酸ストックソリューションを保管してください。 両方のソリューションを光から保護します。これらのソリューションは、1ヶ月間安定しています。
2. プレカルチャー
- 24ウェルプレートに1ウェルあたり100,000 HepG2細胞をシードします。標準RPMI 1640を1 mL追加します。
- 37°Cで5%CO2を24時間前培養し、細胞の付着を可能にする。
3. ステアトゲン文化
- 前培養後、標準RPMI 1640培地を廃棄し、それに応じてスティーアトゲン培地を添加する。
- 上清を捨て、24時間ごとに新鮮なステア原性培地を加えます。
4. 生存率と死亡率評価
- 24ウェルプレートに1ウェルあたり100,000 HepG2細胞をシードします。標準RPMI 1640を1 mL追加します。
- 37°Cで24時間、CO2を5%で事前インキュベートする。
- ステアト原性培地用の標準RPMI 1640培地を変更する。
- 24時間、2日、3日、4日間、24時間ごとにステア原性培地をリフレッシュするインキュベート。
- 適切な時間が経過したら、上清を捨てます。
- 0.05%トリプシン-EDTAの500 μLを加えて、ウェルから細胞を取り外します。37°Cおよび5%CO2で5分間インキュベートする。
- マイクロチューブ内の再懸濁細胞を収集します。
- 300xgで遠心分離機を使用し、上清を捨てる。
- 200 μLの標準 RPMI 1640 を加え、細胞を再中断します。
- 新鮮なマイクロチューブに0.4%トリパンブルー溶液の15 μLを追加します。前の細胞懸濁液の15 μLと混合します。
- 血球計で染色された非染色細胞を数えます。
- それに応じて生存率と死亡率を計算します。
生存率=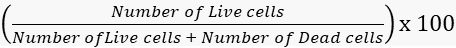
死亡率 =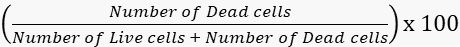
5. オイルレッドOでの脂質染色
- 24ウェルプレートのすべてのウェルに細胞培養カバースリップを入れます。
- 種子 100,000 HepG2 ウェルあたり細胞.標準RPMI 1640を1 mL追加します。
- 37°Cでプレインキュベートし、24時間のCO2 を5%で行います。
- ステアト原性培地用の標準RPMI 1640培地を変更する。
- 24時間、2日間、3日間、4日間インキュベートし、24時間ごとにステア原性培地をリフレッシュする。
- 適切な時間が経過したら、上清を捨てます。
- リン酸緩衝生理食塩分(PBS)1 mLで洗浄します。上清を捨てます。
- PBSで4%パラホルムアルデヒドの1 mLで固定します。
- 室温で1時間インキュベートする。
- 過剰のパラホルムアルデヒドを捨てる。
- 1 mLの蒸留水で細胞をすすいでください。
- 70%イソプロパノール1 mLを加え、5分間インキュベートします。
- イソプロパノールの過剰を捨てる。PBS洗浄は、この時点では必要ありません。
- オイルレッドO溶液を1mL加え、30分間インキュベートします。
- オイルレッドO溶液の超過分を捨てます。
- 蒸留水1mLですすります。
- 500 μLのヘマトキシリン溶液を加えます。3分間インキュベートします。
- 過剰のヘマトキシリン溶液を捨てる。
- 蒸留水1mLですすります。
- 顕微鏡下で400x(目標40x、眼球10倍)の倍率で観察します。
脂質内容物のモルフォメトリック評価
- ウェルの完全な領域から10個の光学フィールドの写真をランダムに選択してキャプチャします。すべての井戸のために繰り返します。
- フェレイラとラズバンド33に従って ImageJ ソフトウェアのカラーしきい値ツールを使用して、赤い染色面積の割合を評価します。
- フェレイラとラズバンド33に従って ImageJ ソフトウェアのパーティクルを分析ツールを使用して、光学フィールドの完全な領域と染色領域を比較します。
- すべてのウェルの平均パーセンテージを計算します。
結果
すべてのウェルの表面上の発育を表示するステア原性培地で培養された肝細胞;しかし、脂肪肝細胞は、対照培地で培養された細胞と比較して低い増殖速度を示す。OAとPAの提案された比率および濃度は、培養中の細胞生存を保証する。24 ウェルプレートにウェルあたり 1 x 105 個 のセルを播種すると 、図 1に示すように最適な合流点が提供されます。
ディスカッション
このプロトコルは、 体外でステアトーシスを研究するための戦略を提供することを目的としています。細胞培養は、細胞、分子、生化学的、および異なる条件にさらされた細胞の毒性学的側面を研究するための強力なツールです。このアプローチにより、脂肪症は、MAFLDである複雑な疾患の段階としてだけでなく、脂質への過剰暴露およびそのような暴露に起因する可能性のある結果?...
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、コンセホ・ナシオナル・デ・シエンシア・イ・テクノロジア(Conacyt、CB-221137)によって資金提供されました。アドリアナ・カンポスは、プログラム・デ・ドクマド・エン・シエンシアス・バイオメディカ、ナシオナル・エウトノマ・デ・メヒコ大学の博士課程の学生で、コナシト(CVU:1002502)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
参考文献
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved