Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle de stéatose expérimentale in vitro: culture de cellules hépatocytaires dans un milieu conditionné par surcharge lipidique
Dans cet article
Résumé
Ce protocole se veut un outil d’étude de la stéatose et des changements moléculaires, biochimiques, cellulaires produits par la surexposition des hépatocytes aux lipides in vitro.
Résumé
La stéatose hépatique associée au dysfonctionnement métabolique (MAFLD), précédemment connue sous le nom de stéatose hépatique non alcoolique (NAFLD), est la maladie du foie la plus répandue dans le monde en raison de sa relation avec l’obésité, le diabète de type 2 et la dyslipidémie. La stéatose hépatique, l’accumulation de gouttelettes lipidiques dans le parenchyme hépatique, est une caractéristique clé de la maladie précédant l’inflammation observée dans la stéatohépatite, la fibrose et la maladie hépatique terminale. L’accumulation de lipides dans les hépatocytes pourrait interférer avec le métabolisme approprié des xénobiotiques et des molécules endogènes, ainsi que pour induire des processus cellulaires conduisant à l’avancée de la maladie. Bien que l’étude expérimentale de la stéatose puisse être réalisée in vivo,les approches in vitro pour l’étude de la stéatose sont des outils complémentaires avec différents avantages. La culture d’hépatocytes dans un milieu conditionné par surcharge lipidique est une excellente option reproductible pour l’étude de la stéatose hépatique permettant l’identification des processus cellulaires liés à l’accumulation de lipides, tels que les stress oxydatifs et réticulaires, l’autophagie, la prolifération, la mort cellulaire, etc., ainsi que d’autres tests, y compris l’efficacité des médicaments et les tests toxicologiques, parmi de nombreuses autres applications possibles. Ici, il s’agissait de décrire la méthodologie de la culture de cellules hépatocytaires dans un milieu conditionné par une surcharge lipidique. Les cellules HepG2 ont été cultivées dans un milieu RMPI 1640 conditionné avec du palmitate de sodium et de l’oléate de sodium. Il est important de noter que le rapport de ces deux lipides est crucial pour favoriser l’accumulation de gouttelettes lipidiques, tout en maintenant la prolifération cellulaire et un taux de mortalité modéré, comme cela se produit dans le foie pendant la maladie. La méthodologie, à partir de la préparation des stocks de solution lipidique, du mélange, de l’addition au milieu et de la culture d’hépatocytes est montrée. Avec cette approche, il est possible d’identifier les gouttelettes lipidiques dans les hépatocytes qui sont facilement observables par coloration O rouge huile, ainsi que les courbes des taux de prolifération / mortalité.
Introduction
La stéatose hépatique associée à un dysfonctionnement métabolique est très répandue dans le mondeentier 1,2; on estime que jusqu’à 25% de la population est touchée3. Cette maladie précédemment connue sous le nom de stéatose hépatique non alcoolique (NAFLD), a mis à jour sa nomenclature pour la stéatose hépatique associée au dysfonctionnement métabolique (MAFLD) afin de refléter avec précision la pathogenèse liée à l’obésité, à la résistance à l’insuline, au diabète de type 2 et à la dyslipidémie, ainsi que les prises en charge possibles de la maladie3,4.
Quel que soit son nom, la maladie comprend un large spectre de changements histopathologiques caractérisés par une accumulation anormalement élevée de lipides dans le foie (>5% de graisse dans les hépatocytes5) et pourrait progresser à travers l’accumulation de lipides généralement trouvée dans la stéatose simple à la stéatohépatite, ce qui à son tour pourrait conduire au développement de fibrose, cirrhose, carcinome hépatocellulaire et insuffisance hépatique5,6,7,8. En raison de sa prévalence croissante, maFLD devrait devenir la première indication de transplantation hépatique et la principale cause de carcinome hépatocellulaire9.
Bien qu’elle ait été considérée comme une forme bénigne ou bénigne de stéatose hépatique, la stéatose hépatique est en fait la clé métabolique de MAFLD10. Différentes voies métaboliques sont affectées par l’accumulation de lipides dans le foie, y compris, mais sans s’y limiter, la synthèse, l’exportation et le métabolisme des lipides10. La résistance à l’insuline, le stress oxydatif, le stress réticulaire et le dysfonctionnement cellulaire sont fortement associés à la lipotoxicité hépatique11,12. D’autre part, les hépatocytes gras sont la cible d’espèces réactives de l’oxygène, rendant les métabolites sous forme de peroxydes lipidiques, de carbonyles protéiques et d’adductions d’acides nucléiques13. Au niveau cellulaire, les hépatocytes gras peuvent subir des dommages mitochondriaux14, la sénescence cellulaire15, l’apoptose16, la pyroptose12et l’autophagie17, entre autres événements.
Les hépatocytes sont hautement responsables du métabolisme, de la désintoxication et de la synthèse d’un large éventail de molécules. Beaucoup de ces fonctions pourraient être compromises par l’accumulation de lipides observée dans la stéatose. Par conséquent, il est d’une grande importance de disposer d’outils reproductibles qui permettent une évaluation précise de la stéatose. En ce sens, les modèles in vitro sont facilement applicables et hautement reproductibles. La stéatose in vitro a été utilisée avec différents objectifs16,18,19. Les cellules HepG2 sont largement utilisées comme lignée cellulaire hépatocytaire. Il a des avantages tels que facile à culture et bien caractérisé. Peut-être, le seul inconvénient des cellules HepG2 est le fait qu’il s’agit d’une lignée cellulaire cancérigène, donc cela doit être pris en compte lors de l’analyse des résultats. Ici, l’application d’un mélange d’acides gras largement utilisés en culture cellulaire: l’acide palmitique (PA) et l’acide oléique (OA) est montrée. L’AP et l’OA offrent des résultats différents dans la culture20. PA (C 16:0) est l’acide gras saturé le plus commun obtenu à partir de l’alimentation16. La PA est considérée comme un biomarqueur de la lipogenèse de novo,une étape cruciale dans le développement de la NAFLD21. Il est démontré que l’AP est très toxique22; par conséquent, il pourrait ne pas être recommandé d’induire la stéatose in vitro. L’arthrose (C 18:1) est un acide gras monoinsaturé. Contrairement à l’AP, il a été suggéré que l’arthrose possède des propriétés anti-inflammatoires et anti-oxydantes, étant capable de contrer la PA12. L’AP et l’ARTH sont les principaux acides gras présents dans les triglycérides, quel que soit l’état de santé ou la maladie16. Le tableau 1 fournit des exemples de la culture d’hépatocytes avec PA, OA et leur mélange, ainsi que les résultats rapportés12,23,24,25,26,27. D’autres acides gras ont également été utilisés en cultured’hépatocytes, notamment l’acide stéarique (C 18:0)28 , 29,30, l’acide linoléique (C 18:1) 28,30,31 et ses conjugués (CLA)28,32, l’acide palmitoléique (C 16: 1)29. Cependant, leur utilisation est moins fréquemment rapportée dans la littérature, peut-être parce que leur abondance hépatique est inférieure à celle de l’AP et de l’OA16.
En conjonction, les deux acides gras ressemblent à la stéatose in vitro, fournissant des cellules proliférantes, avec une mort cellulaire accrue et une viabilité inférieure par rapport aux conditions de contrôle. Il convient de mentionner que les sels respectifs de ces acides gras sont disponibles et peuvent également être utilisés. L’un des principaux problèmes lors de l’évaluation de la surcharge lipidique dans la culture de cellules hépatocytaires est donné dans la différenciation entre les modèles toxicologiques et un modèle qui représente le mieux la stéatose. De nombreux modèles peuvent être comptabilisés dans le premier cas. En fait, l’utilisation de l’AP seule pourrait être considérée parmi eux, et la mortalité élevée est le résultat le plus évident12,16,23,24,25,26,27. L’utilisation de doses élevées, même dans le cas de l’arthrose, peut également être considérée comme un modèle toxicologique. Le protocole présenté ici est plus conforme au développement de la stéatose car il montre une faible mortalité par rapport à celle observée dans d’autres modèles et permet de le suivre pendant plusieurs jours avec une accumulation progressive de lipides telle qu’elle se produit dans la NAFLD. La possibilité d’évaluer la stéatose légère et sévère par des conditions expérimentales est considérée comme un autre avantage.
| Acides gras | Conditions | Résultats | Référence | ||
| PAPA | Concentration : 200 μM | Accumulation de lipides | Yan et al, 201925. | ||
| Temps d’exposition: 24 h | Dommages aux hépatocytes | ||||
| Élévation des transaminases | |||||
| PAPA | Concentration : 50, 100 et 200 μM | Accumulation de lipides | Xing et al, 201924. | ||
| Temps d’exposition: 24 h | |||||
| PAPA | Concentration : 250 μM, 500 μM, 750 μM et 1 000 μM | Accumulation de lipides | Wang et al, 202026. | ||
| Temps d’exposition: 24 h | Réduction progressive de la viabilité cellulaire | ||||
| Mélange d’OA/PA | Concentration : 1 mM | Accumulation de lipides | Xiao et al, 202027. | ||
| Temps d’exposition: 24 h | Ne signale pas de lipotoxicité | ||||
| Tarif: 2OA:1PA | |||||
| Mélange d’OA/PA | Première stimulation avec 200 μM et 400 μM de PA, puis deuxième stimulation avec 200 μM d’ARTH | Accumulation de lipides. | Zeng et al, 202012. | ||
| Concentration:400 μM PA: 200 μM OA | Les signes de lipotoxicité induite par l’AP ont été réduits par la stimulation de l’arthrose. | ||||
| Tarif: 2PA:1OA | |||||
| Temps d’exposition: 24 h | |||||
| Mélange d’OA/PA | Concentration : 400 μM PA : 200 μM OA | Accumulation de lipides | Chen et al, 201823. | ||
| Tarif: 2PA:1OA | |||||
| Temps d’exposition: 24 h | |||||
| Mélange d’OA/PA | Concentration :50 et 500 μM | Génération de deux types de stéatose: stéatose légère et stéatose sévère. | Campos et Guzmán 2021 | ||
| Tarif: 2PA:1OA | Simule l’exposition chronique de la surcharge lipidique | ||||
| Temps d’exposition: 24 h, 2 jours, 3 jours et 4 jours. | |||||
Tableau 1. Culture d’hépatocytes dans des conditions stéatogènes. Le tableau présente le type d’acide gras utilisé, les conditions maintenues et les résultats observés dans la culture d’hépatocytes. PA : Acide palmitique. OA : Acide oléique.
Enfin, ce modèle est applicable non seulement à l’étude de la stéatose et de la stéatose hépatique, mais aussi aux voies métaboliques hépatiques, synthétiques et de désintoxication dans le contexte de la stéatose. En outre, la stéatose induite in vitro pourrait fournir des preuves pour l’identification de marqueurs potentiels de la maladie ainsi que de cibles thérapeutiques.
Protocole
1. Préparation de milieu standard et conditionné
- Pour préparer le RPMI 1640 standard, compléter le milieu de culture RPMI 1640 avec 10% (v/v) de sérum bovin fœtal (FBS, précédemment inactivé par la chaleur) et 1% (v/v) de solution de pénicilline-streptomycine. Conserver le milieu à 4 °C.Stériliser à l’aide de filtres de 0,22 μm.
- Pour préparer une solution mère de palmitate, préparer une solution de palmitate de 50 mM dans le RPMI 1640 standard préalablement complété par 1% d’albumine sérique bovine (sans lipides). Un volume de 5 à 10 mL de ce stock sera suffisant. Stériliser la solution mère à l’aide de filtres de 0,22 μm. Conserver à 4 °C à l’abri de la lumière jusqu’à 1 mois.
- Pour préparer une solution mère d’oléate, préparer une solution d’oléate de 50 mM dans le RPMI 1640 standard préalablement complété par 1% d’albumine sérique bovine (sans lipides). Un volume de 10 mL sera suffisant. Stériliser la solution mère à l’aide de filtres de 0,22 μm. Conserver à -20 °C à l’abri de la lumière jusqu’à 1 mois.
- Pour préparer le milieu stéatogène à partir des stocks préalablement préparés, préparez un milieu stéatogène en 1 partie palmitate: 2 parties d’oléate stéatogène à deux niveaux possibles: stéatose légère et sévère.
- Stéatose légère : Préparer 100 mL d’un mélange de palmitate en 1 partie : 2 parties d’oléate (50 μM) dans le RPMI 1640 standard. Stériliser à l’aide de filtres de 0,22 μm. Conserver à 4 °C jusqu’à 1 semaine.
- Stéatose sévère : Préparer 100 mL d’un mélange de palmitate en 1 partie : 2 parties d’oléate (500 μM) dans le RPMI 1640 standard. Stériliser à l’aide de filtres de 0,22 μm. Conserver à 4 °C jusqu’à 1 semaine.
- Préparation alternative pour les solutions de stock.
- Préparez les deux solutions d’élevage en utilisant les acides gras respectifs en utilisant de l’albumine lipidique libre comme indiqué ci-dessus.
- En cas de manque d’albumine lipidique libre, utilisez des sels de palmitate et d’oléate.
- Dissoudre le palmitate ou l’oléate dans 2 mL d’éthanol absolu, puis mélanger dans le volume final du RPMI standard 1640 (5-10 mL). Dissoudre l’oléate directement en remuant dans un milieu de culture RPMI 1640 standard.
- Permettre l’évaporation de l’éthanol par incubation au bain-marie à 70 °C; Mélanger.
- Dans tous les cas, stérilisez les deux solutions mères à l’aide de filtres de 0,22 μm. Conserver la solution sur place de palmitate à 4 °C et la solution d’oléate sur place à - 20 °C. Protégez les deux solutions de la lumière. Ces solutions sont stables pendant 1 mois.
2. Pré-culture
- Ensemencez 100 000 cellules HepG2 par puits dans une plaque de 24 puits. Ajoutez 1 mL de RPMI 1640 standard.
- Pré-incuber à 37 °C et 5% de CO 2 pendant24 h, permettant la fixation des cellules.
3. Culture stéatogène
- Après la pré-culture, jeter le milieu RPMI 1640 standard et ajouter le milieu stéatogène en conséquence.
- Jeter le surnageant et ajouter le milieu stéatogène frais toutes les 24 h.
4. Évaluation de la viabilité et de la mortalité
- Ensemencez 100 000 cellules HepG2 par puits dans une plaque de 24 puits. Ajoutez 1 mL de RPMI 1640 standard.
- Pré-incuber pendant 24 h à 37 °C et 5% de CO2.
- Changer le milieu RPMI 1640 standard pour le milieu stéatogène.
- Incuber pendant 24 h, 2 jours, 3 jours et 4 jours en rafraîchissant le milieu stétogène toutes les 24 h.
- Après le temps approprié, jetez le surnageant.
- Détacher les cellules du puits en ajoutant 500 μL de Trypsine-EDTA à 0,05 %. Incuber pendant 5 min à 37 °C et 5% de CO2.
- Recueillir les cellules ressuspendées dans un microtube.
- Centrifuger à 300 x g et jeter le surnageant.
- Ajouter 200 μL de RPMI 1640 standard et resuspend les cellules.
- Ajouter 15 μL de solution de bleu de trypan à 0,4 % dans un microtube frais. Mélanger avec 15 μL de la suspension cellulaire précédente.
- Comptez les cellules colorées et non colorées dans un hémocytomètre.
- Calculer les taux de viabilité et de mortalité en conséquence.
Viabilité =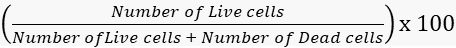
Mortalité =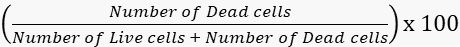
5. Coloration lipidique avec O rouge huile
- Mettez un couvercle de culture cellulaire dans chaque puits dans une plaque de 24 puits.
- Ensemencez 100 000 cellules HepG2 par puits. Ajoutez 1 mL de RPMI 1640 standard.
- Pré-incuber à 37 °C et 5% de CO2 pendant 24 h.
- Changer le milieu RPMI 1640 standard pour le milieu stéatogène.
- Incuber pendant 24 h, 2 jours, 3 jours et 4 jours, en rafraîchissant le milieu stéatogène toutes les 24 h.
- Après le temps approprié, jetez le surnageant.
- Laver avec 1 mL de solution saline tamponnée au phosphate (PBS). Jetez le surnageant.
- Fixer avec 1 mL de paraformaldéhyde à 4% dans le PBS.
- Incuber pendant 1 h à température ambiante.
- Jetez l’excès de paraformaldéhyde.
- Rincer les cellules avec 1 mL d’eau distillée.
- Ajouter 1 mL d’isopropanol à 70 % et incuber pendant 5 min.
- Jetez l’excès d’isopropanol. Un lavage PBS n’est pas nécessaire à ce stade.
- Ajouter 1 mL de solution d’O rouge huile et incuber pendant 30 min.
- Jetez l’excès de la solution O rouge huile.
- Rincer avec 1 mL d’eau distillée.
- Ajouter 500 μL de solution d’hématoxyline. Incuber pendant 3 min.
- Jeter l’excès de solution d’hématoxyline.
- Rincer avec 1 mL d’eau distillée.
- Observez au microscope à un grossissement de 400x (Objectif 40x, Oculaire 10x).
6. Évaluation morphométrique de la teneur en lipides
- Sélectionnez et capturez au hasard des photographies de 10 champs optiques à partir de la zone complète du puits. Répétez pour chaque puits.
- Évaluez le pourcentage de zone colorée rouge à l’aide de l’outil Seuil de couleur du logiciel ImageJ selon Ferreira et Rasband33.
- Comparez la zone colorée avec la zone complète du champ optique à l’aide de l’outil Analyser les particules du logiciel ImageJ selon Ferreira et Rasband33.
- Calculez le pourcentage moyen de chaque puits.
Résultats
Les hépatocytes cultivés dans le milieu stéatogène présentent une croissance sur toute la surface du puits; cependant, les hépatocytes gras présentent un taux de croissance inférieur à celui des cellules cultivées en milieu témoin. Le rapport et la concentration proposés d’arthrose et d’AP garantissent la survie cellulaire pendant la culture. L’ensemencement de 1 x10 5 cellules par puits dans des plaques de 24 puits permet une confluence optimale comme le montre la figure...
Discussion
Ce protocole vise à fournir une stratégie pour étudier la stéatose in vitro. La culture cellulaire est un outil puissant pour étudier les aspects cellulaires, moléculaires, biochimiques et toxicologiques des cellules exposées à différentes conditions. Avec cette approche, la stéatose peut être visualisée non seulement comme un stade de la maladie complexe qu’est la MAFLD, mais aussi comme la surexposition hépatocytaire aux lipides et les résultats possibles résultant d’une telle exposition. Pa...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par le Consejo Nacional de Ciencia y Tecnología (Conacyt, CB-221137). Adriana Campos est doctorante au Programa de Doctorado en Ciencias Biomédicas, Universidad Nacional Autónoma de México, et a été soutenue par Conacyt (CVU: 1002502).
matériels
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
Références
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon