É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de esteatose experimental in vitro: cultura celular hepatocitada em meio lipídidamente condicionado
Neste Artigo
Resumo
Este protocolo pretende ser uma ferramenta para estudar a esteatose e as alterações moleculares, bioquímicas, celulares produzidas pela exposição excessiva de hepatócitos a lipídios in vitro.
Resumo
A doença hepática gordurosa associada à disfunção metabólica (MAFLD), anteriormente conhecida como doença hepática gordurosa não alcoólica (NAFLD), é a doença hepática mais prevalente em todo o mundo devido à sua relação com obesidade, diabetes tipo 2 e dislipidemia. Esteatose hepática, o acúmulo de gotículas lipídicas no parnchyma hepático, é uma característica fundamental da doença que precede a inflamação observada na esteatohepatite, fibrose e doença hepática em estágio terminal. O acúmulo de lipídios em hepatócitos pode interferir com o metabolismo adequado de xenobióticos e moléculas endógenas, bem como induzir processos celulares que levem ao avanço da doença. Embora o estudo experimental da esteatose possa ser realizado in vivo,abordagens in vitro para o estudo da esteatose são ferramentas complementares com diferentes vantagens. A cultura hepatocito em meio lipídico-condicionado é uma excelente opção reprodutível para o estudo da esteatose hepática que permite a identificação de processos celulares relacionados ao acúmulo de lipídios, como estresses oxidativos e reticulares, autofagia, proliferação, morte celular, etc, bem como outros testes, incluindo eficácia de drogas, e testes toxicológicos, entre muitas outras aplicações possíveis. Aqui, teve como objetivo descrever a metodologia da cultura celular hepatocitada em meio lipídios condicionados por sobrecarga. As células hepG2 foram cultivadas em RMPI 1640 médio condicionado com palmitato de sódio e oleato de sódio. É importante ressaltar que a razão desses dois lipídios é crucial para favorecer o acúmulo de gotículas lipídicas, mantendo a proliferação celular e uma taxa de mortalidade moderada, como ocorre no fígado durante a doença. A metodologia, a partir da preparação dos estoques de solução lipídica, mistura, além do meio, e cultura hepatócida é mostrada. Com essa abordagem, é possível identificar gotículas lipídicas nos hepatócitos que são prontamente observáveis pela mancha O vermelha-óleo, bem como curvas de taxas de proliferação/mortalidade.
Introdução
Fígado gorduroso associado à disfunção metabólica é altamente prevalente em todo o mundo1,2; estima-se que até 25% da população seja afetada3. Esta doença anteriormente conhecida como doença hepática gordurosa não alcoólica (NAFLD), atualizou sua nomenclatura para disfunção metabólica associada à doença hepática gordurosa (MAFLD) para refletir com precisão a patogênese relacionada à obesidade, resistência à insulina, diabetes tipo 2 e dislipidemia, bem como os possíveis manejos da doença3,4.
Independentemente do nome, a doença inclui um amplo espectro de alterações histopatológicas caracterizadas pelo acúmulo anormalmente alto de lipídios no fígado (>5% de gordura nos hepatócitos5) e pode progredir através do acúmulo lipídudo tipicamente encontrado em esteatose simples à esteatohepatite, o que por sua vez pode levar ao desenvolvimento de fibrose, cirrose, carcinoma hepatocelular e insuficiência hepática5,6,7,8. Devido à sua crescente prevalência, espera-se que o MAFLD se torne a primeira indicação de transplante hepático e a principal causa do carcinoma hepatocelular9.
Embora tenha sido considerada como uma forma benigna ou leve de doença hepática gordurosa, a esteatose hepática é de fato a chave metabólica no MAFLD10. Diferentes vias metabólicas são afetadas pelo acúmulo de lipídios no fígado, incluindo, mas não se limitando à síntese lipídica, exportação e metabolismo10. Resistência à insulina, estresse oxidativo, estresse reticular e disfunção celular estão fortemente associados à lipotoxicidade hepática11,12. Por outro lado, hepatócitos gordurosos são alvo de espécies reativas de oxigênio, tornando metabólitos como peróxidos lipídicos, carbonilas proteicas e adutos de ácidos nucleicos13. No nível celular, hepatócitos gordurosos podem sofrer danos mitocondriais14, senescência celular15, apoptose16,pioptose12e autofagia17,entre outros eventos.
Hepatocitas são altamente responsáveis pelo metabolismo, desintoxicação e síntese de uma ampla gama de moléculas. Muitas dessas funções podem ser comprometidas pelo acúmulo lipídudo observado na esteatose. Portanto, é de grande importância ter ferramentas reprodutíveis que permitam uma avaliação precisa da esteatose. Nesse sentido, os modelos in vitro são prontamente aplicáveis e altamente reprodutíveis. Esteatose in vitro tem sido usada com diferentes gols16,18,19. As células HepG2 são amplamente utilizadas como linha celular hepatocitte. Tem vantagens como ser fácil de cultivar e bem caracterizado. Talvez, a única desvantagem das células HepG2 seja o fato de ser uma linha celular cancerígena, por isso isso deve ser considerado ao analisar os desfechos. Aqui, mostra-se a aplicação de uma mistura de ácidos graxos amplamente utilizados na cultura celular: ácido palmítico (PA) e ácido oleico (OA). Tanto o PA quanto o OA oferecem resultados diferentes na cultura20. Pa (C 16:0) é o ácido graxo saturado mais comum obtido da dieta16. A AF é considerada biomarcadora da lipogênese de-novo,um passo crucial no desenvolvimento do NAFLD21. Pa é mostrado como altamente tóxico22; portanto, pode não ser recomendado induzir esteatose in vitro. OA (C 18:1) é um ácido graxo monoinsaturado. Em contraste com a AF, foi sugerido que a OA possui propriedades anti-inflamatórias e antioxidantes, sendo capaz de neutralizar a PA12. Tanto a AF quanto a OA são os principais ácidos graxos presentes nos triglicérides, independentemente da condição de saúde ou doença16. A Tabela 1 fornece exemplos da cultura hepatocitte com PA, OA e sua mistura, bem como os resultados relatados12,23,24,25,26,27. Outros ácidos graxos também têm sido utilizados na cultura hepatocita, incluindo ácido esteárico (C 18:0)28,29,30, ácido linoleico (C 18:1)28,30,31 e seus conjugados (CLA)28,32, ácido palmitoleico (C 16:1)29. No entanto, seu uso é menos frequentemente relatado na literatura, talvez porque sua abundância hepática é menor que a PA e OA16.
Em conjunto, ambos os ácidos graxos se assemelham à esteatose in vitro,proporcionando células proliferadoras, com maior morte celular e menor viabilidade em comparação com as condições de controle. Vale ressaltar que os respectivos sais desses ácidos graxos estão disponíveis e também podem ser usados. Um dos principais problemas na avaliação da sobrecarga lipídica na cultura celular hepatocitte é dado na diferenciação entre modelos toxicológicos e um modelo que melhor representa a esteatose. Muitos modelos podem ser contabilizados no primeiro caso. De fato, o uso apenas de PA pode ser considerado entre eles, e a alta mortalidade é o desfecho mais evidente12,16,23,24,25,26,27. O uso de altas doses mesmo no caso de OA também pode ser considerado como um modelo toxicológico. O protocolo aqui mostrado está em maior conformidade com o desenvolvimento da esteatose, pois mostra baixa mortalidade em comparação com o observado em outros modelos e permite que seja seguido durante vários dias com acúmulo progressivo de lipídios como ocorre na NAFLD. A possibilidade de avaliar esteatose leve e grave por meio de condições experimentais é considerada outra vantagem.
| Ácidos graxos | Condições | Resultados | Referência | ||
| PAPAI | Concentração: 200 μM | Acúmulo de lipídios | Yan et al, 201925. | ||
| Exposição de tempo: 24 h | Dano à hepatocita | ||||
| Elevação de transminases | |||||
| PAPAI | Concentração: 50, 100 e 200 μM | Acúmulo de lipídios | Xing et al, 201924. | ||
| Exposição de tempo: 24 h | |||||
| PAPAI | Concentração: 250 μM , 500 μM, 750 μM e 1.000 μM | Acúmulo de lipídios | Wang et al, 202026. | ||
| Exposição de tempo: 24 h | Redução progressiva da viabilidade celular | ||||
| Mistura de OA/PA | Concentração: 1 mM | Acúmulo de lipídios | Xiao et al, 202027. | ||
| Exposição de tempo: 24 h | Não relata lipotoxicidade | ||||
| Taxa: 2OA:1PA | |||||
| Mistura de OA/PA | Primeiro estimulação com 200 μM e 400 μM de PA e depois segundo estímulo com 200 μM de OA | Acúmulo de lipídios. | Zeng et al, 202012. | ||
| Concentração:400 μM PA: 200 μM OA | A evidência de lipotoxicidade induzida pela AF foi reduzida por estimulação de OA. | ||||
| Taxa: 2PA:1OA | |||||
| Exposição de tempo: 24 h | |||||
| Mistura de OA/PA | Concentração: 400 μM PA: 200 μM OA | Acúmulo de lipídios | Chen et al, 201823. | ||
| Taxa: 2PA:1OA | |||||
| Exposição de tempo: 24 h | |||||
| Mistura de OA/PA | Concentração :50 e 500 μM | Geração de dois tipos de esteatose: esteatose leve e esteatose grave. | Campos e Guzmán 2021 | ||
| Taxa: 2PA:1OA | Simula exposição crônica de sobrecarga lipídica | ||||
| Exposição de tempo: 24h, 2 dias,3 dias e 4 dias. | |||||
Mesa 1. Cultura hepatocita em condições esteatogênicas. A tabela apresenta o tipo de ácido graxo utilizado, as condições mantidas e os desfechos observados na cultura hepatócica. Pa: Ácido palmítico. Ácido oleico.
Por fim, este modelo é aplicável não apenas ao estudo da esteatose e fígado gorduroso, mas também às vias hepáticas metabólicas, sintéticas e desintoxicação no contexto da esteatose. Além disso, a esteatose in vitro induzida pode fornecer evidências para a identificação de potenciais marcadores da doença, bem como alvos terapêuticos.
Protocolo
1. Preparação média padrão e condicionada
- Para preparar o RPMI padrão 1640, suplemente o meio de cultura RPMI 1640 com 10% (v/v) de soro bovino fetal (FBS, anteriormente inativado) e 1% (v/v) da solução penicilina-estreptomicina. Armazene o meio a 4 °C.Esterilizar usando filtros de 0,22 μm.
- Para preparar a solução de estoque palmitato, prepare uma solução de 50 mM de palmitato no RPMI padrão 1640 previamente suplementado com 1% de albumina de soro bovino (livre de lipídios). Um volume de 5-10 mL deste estoque será suficiente. Esterilize a solução de estoque utilizando filtros de 0,22 μm. Armazene a 4 °C protegido da luz por até 1 mês.
- Para preparar a solução de estoque oleate, prepare uma solução de 50 mM de oleate no RPMI padrão 1640 previamente suplementado com 1% de albumina de soro bovino (livre de lipídio). Um volume de 10 mL será suficiente. Esterilize a solução de estoque utilizando filtros de 0,22 μm. Armazene a -20 °C protegido contra luz por até 1 mês.
- Para preparar o meio esteatogênico dos estoques previamente preparados, prepare um palmitato de 1 parte: meio esteatogênico oleatogênico de 2 partes em dois níveis possíveis: esteatose leve e grave.
- Steatosis leve: Prepare 100 mL de uma palmitate de 1 parte: mistura de oleato de 2 partes (50 μM) no RPMI padrão 1640. Esterilize usando filtros de 0,22 μm. Guarde a 4 °C por até 1 semana.
- Steatosis grave: Prepare 100 mL de uma palmitate de 1 parte: mistura de oleato de 2 partes (500 μM) no RPMI padrão 1640. Esterilize usando filtros de 0,22 μm. Guarde a 4 °C por até 1 semana.
- Preparação alternativa para as soluções de estoque.
- Prepare ambas as soluções de estoque usando os respectivos ácidos graxos usando albumina lipídica gratuita, conforme indicado acima.
- Quando não ter albumina lipídica livre, use palmitato e sais de oleato.
- Dissolva palmitato ou oleate em 2 mL de etanol absoluto e, em seguida, misture no volume final do RPMI padrão 1640 (5-10 mL). Dissolva oleate diretamente mexendo no meio de cultura RPMI padrão 1640.
- Permitir a evaporação do etanol incubando em um banho de água a 70 °C; Homogeneizar.
- Em todos os casos, esterilize ambas as soluções de estoque usando filtros de 0,22 μm. Armazene a solução de estoque palmitate a 4 °C e a solução de estoque oleate a - 20 °C. Proteja ambas as soluções da luz. Essas soluções estão estáveis por 1 mês.
2. Pré-cultura
- Semente 100.000 células HepG2 por poço em uma placa de 24 poços. Adicione 1 mL de RPMI padrão 1640.
- Pré-incubação a 37 °C e 5% de CO2 por 24 h, permitindo a fixação celular.
3. Cultura esteatogênica
- Após a pré-cultura, descarte o meio RPMI padrão 1640 e adicione o meio esteatogênico em conformidade.
- Descarte o supernasal e adicione meio esteatogênico fresco a cada 24 horas.
4. Avaliação de viabilidade e mortalidade
- Semente 100.000 células HepG2 por poço em uma placa de 24 poços. Adicione 1 mL de RPMI padrão 1640.
- Pré-incubação por 24h a 37 °C e 5% de CO2.
- Alterar o meio RPMI padrão 1640 para o meio esteatogênico.
- Incubar por 24h, 2 dias, 3 dias e 4 dias refrescando o meio esteatogênico a cada 24h.
- Após o tempo apropriado, descarte o supernatante.
- Despemar células do poço adicionando 500 μL de 0,05% Trypsin-EDTA. Incubar por 5 min a 37 °C e 5% de CO2.
- Colete as células resuspended em um microtubo.
- Centrifugar a 300 x g e descartar o supernatante.
- Adicione 200 μL de RPMI padrão 1640 e resuspense as células.
- Adicione 15 μL de solução azul Trypan de 0,4% em um microtubo fresco. Misture com 15 μL da suspensão anterior da célula.
- Conte as células manchadas e não manchadas em um hemócito.
- Calcule as taxas de viabilidade e mortalidade em conformidade.
Viabilidade =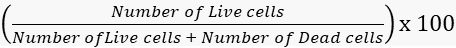
Mortalidade =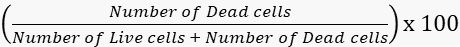
5. Mancha lipídica com O-Vermelho-Óleo
- Coloque uma cultura celular em cada poço em uma placa de 24 poços.
- Sementes 100.000 células HepG2 por poço. Adicione 1 mL de RPMI padrão 1640.
- Pré-incubação a 37 °C e 5% de CO2 por 24 h.
- Alterar o meio RPMI padrão 1640 para o meio esteatogênico.
- Incubar por 24h, 2 dias, 3 dias e 4 dias, refrescando o meio esteatogênico a cada 24h.
- Após o tempo apropriado, descarte o supernatante.
- Lave com 1 mL de salina tamponada de fosfato (PBS). Descarte o supernatante.
- Corrija com 1 mL de 4% de paraformaldeído em PBS.
- Incubar por 1h à temperatura ambiente.
- Descarte o excesso de paraformaldeído.
- Enxágüe as células com 1 mL de água destilada.
- Adicione 1 mL de isopropanol de 70% e incubar por 5 min.
- Descarte o excesso de isopropanol. Uma lavagem pbs não é necessária neste momento.
- Adicione 1 mL de solução O vermelho-óleo e incubar por 30 min.
- Descarte o excesso da solução O vermelho-óleo.
- Enxágüe com 1 mL de água destilada.
- Adicione 500 μL de solução de hematoxilina. Incubar por 3 min.
- Descarte o excesso de solução de hematoxilina.
- Enxágüe com 1 mL de água destilada.
- Observe sob o microscópio em uma ampliação de 400x (Objetivo 40x, Ocular 10x).
6. Avaliação morfométrica do conteúdo lipídudo
- Selecione e capture aleatoriamente fotografias de 10 campos ópticos da área completa do poço. Repita para cada poço.
- Avalie a porcentagem de área manchada de vermelho utilizando a ferramenta Limiar de Cor no software ImageJ de acordo com Ferreira e Rasband33.
- Compare a área manchada com a área completa do campo óptico utilizando a ferramenta Analisar Partículas no software ImageJ de acordo com Ferreira e Rasband33.
- Calcule a porcentagem média de cada poço.
Resultados
Hepatócitos cultivados no meio esteatogênico apresentam crescimento em toda a superfície do poço; no entanto, hepatócitos gordurosos apresentam menor taxa de crescimento em comparação com células cultivadas no meio de controle. A proporção proposta e concentração de OA e PA, garantem a sobrevivência celular durante a cultura. Semear 1 x 105 células por poço em placas de 24 poços fornece confluência ideal como mostrado na Figura 1.
A via...
Discussão
Este protocolo destina-se a fornecer uma estratégia para estudar esteatose in vitro. A cultura celular é uma ferramenta poderosa para estudar aspectos celulares, moleculares, bioquímicos e toxicológicos das células expostas a diferentes condições. Com essa abordagem, a esteatose pode ser visualizada não apenas como um estágio da doença complexa que é a MAFLD, mas também como a superexposição hepatocita aos lipídios e os possíveis desfechos resultantes dessa exposição. Portanto, sua aplicação ...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelo Consejo Nacional de Ciencia y Tecnología (Conacyt, CB-221137). Adriana Campos é doutoranda no Programa de Doutorado em Ciencias Biomédicas, Universidad Nacional Autónoma de México, e foi apoiada pela Conacyt (CVU: 1002502).
Materiais
| Name | Company | Catalog Number | Comments |
| Biosafety cabinet | ESCO Airstream | AC2-452+C2:C26 | Class II Type A2 Biological Safety Cabinet |
| Bottle top filter | Corning, US | 430513 | Non-pyrogenic, polystyrene, sterile. 1 filter/Bag. 0.22 μm, 500 mL. |
| Bovine serum albimun (BSA) | Gold Biotechnology, US | A-421-10 | BSA Fatty Acid Free for cell culture |
| Culture media RPMI 1640 | ThermoFisher-Gibco, US | 31800-022 | - |
| Fetal Bovine Serum (FBS) | ThermoFisher-Gibco, US | A4766801 | - |
| Hemocytometer | Marienfeld, DE | 640010 | - |
| HepG2 cell line | ATCC, US | HB-8065 | Hepatocellular carcinoma human cells. |
| Humidified incubator | Thermo Electronic Corporation,US | Model: 3110 | Temperature (37 °C ± 1 °C), humidity (90% ± 5%) , CO2 (5% ± 1%) |
| Inverted microscope Eclipse | NIKON, JPN | Model: TE2000-S | - |
| Isopropanol | Sigma-Aldrich, US | I9030-4L | - |
| Oil Red O Kit | Abcam, US | ab150678 | Kit for histological visualization of neutral fat. |
| Paraformaldehyde | Sigma-Aldrich, US | P6148-500G | - |
| Penicillin/streptomycin | ThermoFisher-Gibco, US | 15140-122 | Antibiotics 10,000 U/mL Penicillin, 10,000 μg/mL Streptomycin |
| pH meter | Beckman, US | Model: 360 PH/Temp/MV Meter | - |
| Phosphate buffered saline | ThermoFisher-Gibco, US | 10010-023 | - |
| Serological Pipettes | Sarstedt, AUS | 86.1253.001 | Non-pyrogenic, sterile, 5 mL |
| Serological Pipettes | Sarstedt, AUS | 86.1254.001 | Non-pyrogenic, sterile, 10 mL |
| Sodium bicarbonate | Sigma-Aldrich, US | S5761-1KG | Preparation of culture media |
| Sodium oleate | Santa Cruz Biotechnology, US | sc-215879A | - |
| Sodium palmitate | Santa Cruz Biotechnology, US | sc-215881 | - |
| Syring filter | Corning, US | 431219 | Non-pyrogenic, sterile, 28 mm, 0.2 μm. |
| Trypan Blue | Sigma-Aldrich, US | T6146-25G | - |
| Trypsin 0.05% /EDTA 0.53 mM | Corning, US | 25-052-Cl | - |
| 24 well cell culture cluster | Corning, US | 3524 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
| 96 well cell culture cluster | Corning, US | 3599 | Flat bottom with lid. Tissue culture treated. Nonpyrogenic, polystyrene, sterile. 1/Pack. |
Referências
- Younossi, Z. M. Non-alcoholic fatty liver disease - a global public health perspective. Journal of Hepatology. 70 (3), 531-544 (2019).
- Younossi, Z., et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 69 (6), 2672-2682 (2019).
- Eslam, M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology. 73 (1), 202-209 (2020).
- Eslam, M., Sanyal, A. J., George, J. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 158 (7), 1999-2014 (2020).
- Chalasani, N., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American association for the study of liver diseases. Hepatology. 67 (1), 328-357 (2018).
- Calzadilla Bertot, L., Adams, L. A. The natural course of non-alcoholic fatty liver disease. International Journal of Molecular Science. 17 (5), 774 (2016).
- Reccia, I., et al. Non-alcoholic fatty liver disease: A sign of systemic disease. Metabolism. 72, 94-108 (2017).
- Tomita, K., et al. Free cholesterol accumulation in hepatic stellate cells: Mechanism of liver fibrosis aggravation in nonalcoholic steatohepatitis in mice. Hepatology. 59 (1), 154-169 (2014).
- Byrne, C. D., Targher, G. Nafld: A multisystem disease. Journal of Hepatology. 62, 47-64 (2015).
- Ipsen, D. H., Lykkesfeldt, J., Tveden-Nyborg, P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cellular and Molecular Life Sciences. 75 (18), 3313-3327 (2018).
- Diehl, A. M., Day, C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis. New England Journal of Medicine. 377 (21), 2063-2072 (2017).
- Zeng, X., et al. Oleic acid ameliorates palmitic acid induced hepatocellular lipotoxicity by inhibition of ER stress and pyroptosis. Nutrition and Metabolism. 17, 11 (2020).
- Ore, A., Akinloye, O. A. Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease. Medicina (Kaunas). 55 (2), 26 (2019).
- Paradies, G., Paradies, V., Ruggiero, F. M., Petrosillo, G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 20 (39), 14205-14218 (2014).
- Aravinthan, A., et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease. Journal of Hepatology. 58 (3), 549-556 (2013).
- Gomez, M. J., et al. A human hepatocellular in vitro model to investigate steatosis. Chemico Biological Interactions. 165 (2), 106-116 (2007).
- Wu, W. K. K., Zhang, L., Chan, M. T. V. Autophagy, NAFLD and NAFLD-related HCC. Advances in Experimental Medicine and Biology. 1061, 127-138 (2018).
- Levy, G., Cohen, M., Nahmias, Y. In vitro cell culture models of hepatic steatosis. Methods in Molecular Biology. 1250, 377-390 (2015).
- Kanuri, G., Bergheim, I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International Journal of Molecular Science. 14 (6), 11963-11980 (2013).
- Ricchi, M., et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. Journal of Gastroenterology and Hepatology. 24 (5), 830-840 (2009).
- Lee, Y., et al. Serial biomarkers of de novo lipogenesis fatty acids and incident heart failure in older adults: The cardiovascular health study. Journal of the American Heart Association. 9 (4), 014119 (2020).
- Alnahdi, A., John, A., Raza, H. Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in Hepg2 cells by palmitic acid. Nutrients. 11 (9), 1979 (2019).
- Chen, X., et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sciences. 203, 291-304 (2018).
- Xing, J. H., et al. NLRP3 inflammasome mediate palmitate-induced endothelial dysfunction. Life Sciences. 239, 116882 (2019).
- Yan, H., et al. Insulin-like Growth Factor Binding Protein 7 accelerates hepatic steatosis and insulin resistance in non-alcoholic fatty liver disease. Clinical and Experimental Pharmacology and Physiology. 46 (12), 1101-1110 (2019).
- Wang, J., Hu, R., Yin, C., Xiao, Y. Tanshinone IIA reduces palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in Hepg2 liver cells. Fundamental and Clinical Pharmacology. 34 (2), 249-262 (2020).
- Xiao, Z., Chu, Y., Qin, W. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating ampk pathway in non-alcoholic fatty liver disease. Life Sciences. 256, 117997 (2020).
- Avila, G., et al. In vitro effects of conjugated linoleic acid (CLA) on inflammatory functions of bovine monocytes. Journal of Dairy Science. 103 (9), 8554-8563 (2020).
- Malhi, H., Bronk, S. F., Werneburg, N. W., Gores, G. J. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. The Journal of Biological Chemistry. 281 (17), 12093-12101 (2006).
- Oh, J. M., et al. Effects of palmitic acid on TNF-alpha-induced cytotoxicity in SK-Hep-1 cells. Toxicology In Vitro: An International Journal Published in Association with BIBRA. 26 (6), 783-790 (2012).
- Stellavato, A., et al. In vitro assessment of nutraceutical compounds and novel nutraceutical formulations in a liver-steatosis-based model. Lipids in Health and Disease. 17 (1), 24 (2018).
- Pachikian, B. D., et al. Implication of trans-11, trans-13 conjugated linoleic acid in the development of hepatic steatosis. PLoS One. 13 (2), 0192447 (2018).
- Ferreira, T., Rasband, W. Analyze. ImageJ User Guide. , 132-135 (2012).
- Geng, Y., Wu, Z., Buist-Homan, M., Blokzijl, H., Moshage, H. Hesperetin protects against palmitate-induced cellular toxicity via induction of GRP78 in hepatocytes. Toxicology and Applied Pharmacology. , 404 (2020).
- Geng, Y., et al. Protective effect of metformin against palmitate-induced hepatic cell death. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1866 (3), 165621 (2020).
- Sarnyai, F., et al. Effect of cis- and trans-monounsaturated fatty acids on palmitate toxicity and on palmitate-induced accumulation of ceramides and diglycerides. International Journal of Molecular Science. 21 (7), 2626 (2020).
- Chen, J. W., et al. Tetrahydrocurcumin ameliorates free fatty acid-induced hepatic steatosis and improves insulin resistance in HepG2 cells. Journal of Food and Drug Analysis. 26 (3), 1075-1085 (2018).
- Burhans, M. S., et al. Hepatic oleate regulates adipose tissue lipogenesis and fatty acid oxidation. Journal of Lipid Research. 56 (2), 304-318 (2015).
- Abenavoli, L., Milanovic, M., Milic, N., Luzza, F., Giuffre, A. M. Olive oil antioxidants and non-alcoholic fatty liver disease. Expert Reviews in Gastroenterology and Hepatology. 13 (8), 739-749 (2019).
- Nagarajan, S. R., et al. Lipid and glucose metabolism in hepatocyte cell lines and primary mouse hepatocytes: A comprehensive resource for in vitro studies of hepatic metabolism. American Journal of Physiology - Endocrinology and Metabolism. 316 (4), 578-589 (2019).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados