A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجميع نماذج محاكاة الخلايا المدعومة والموقوفة ثنائية الطبقات لدراسة التفاعلات الجزيئية
In This Article
Summary
يصف هذا البروتوكول تكوين خلايا تحاكي الحويصلات أحادية الدهون والدهون المتعددة، والبيلايات الدهنية المدعومة، والبيلايات الدهنية المعلقة. يمكن تكييف هذه النماذج في المختبر لدمج مجموعة متنوعة من أنواع الدهون ويمكن استخدامها للتحقيق في مختلف التفاعلات جزيء والجزيئات الكبيرة.
Abstract
أغشية الخلايا النموذجية هي أداة فحص مفيدة مع تطبيقات تتراوح بين اكتشاف الأدوية المبكرة ودراسات السمية. غشاء الخلية هو حاجز وقائي حاسم لجميع أنواع الخلايا ، وفصل المكونات الخلوية الداخلية عن البيئة خارج الخلية. وتتكون هذه الأغشية إلى حد كبير من طبقة ثنائية الدهون، والتي تحتوي على مجموعات الرأس المائية الخارجية ومجموعات الذيل الكاره للماء الداخلية، جنبا إلى جنب مع مختلف البروتينات والكوليسترول. يلعب تكوين وبنية الدهون نفسها دورا حاسما في تنظيم الوظيفة البيولوجية ، بما في ذلك التفاعلات بين الخلايا والبيئة الدقيقة الخلوية ، والتي قد تحتوي على المستحضرات الصيدلانية والسموم البيولوجية والمواد السامة البيئية. في هذه الدراسة، يتم وصف طرق لصياغة أحادي الدهون ومتعددة الدهون المدعومة والموقوفة الخلية تحاكي الطبقات ثنائية الدهون. في السابق ، تم تطوير طبقات ثنائية الدهون أحادية الدهون (PC) وكذلك ثنائيات الدهون المستوحاة من المشيمة متعددة الدهون المستوحاة من الدهون لاستخدامها في فهم التفاعلات الجزيئية. هنا، سيتم تقديم طرق لتحقيق كلا النوعين من نماذج ثنائية الطبقات. بالنسبة للخلايا التي تحاكي الطبقات الثنائية متعددة الدهون ، يتم تحديد تكوين الدهون المطلوب أولا عن طريق استخراج الدهون من الخلايا الأولية أو خطوط الخلايا تليها قياس الطيف الكتلي الكروماتوغرافي السائل (LC-MS). باستخدام هذا التكوين ، يتم تصنيع الحويصلات الدهنية باستخدام طريقة ترطيب وبث رقيقة وتتميز قطرها الهيدروديناميكي وإمكانات زيتا. ويمكن بعد ذلك تشكيل طبقات ثنائية الدهون المدعومة والموقوفة باستخدام ميكروبالانس الكريستال الكوارتز مع رصد التبدد (QCM-D) وعلى غشاء مسامي للاستخدام في مقايسة نفاذية الغشاء الاصطناعي الموازي (PAMPA) على التوالي. النتائج التمثيلية تسليط الضوء على استنساخ وبراعة في غشاء الخلية المختبرية نماذج ثنائي الطبقة الدهون. يمكن أن تساعد الأساليب المقدمة في التقييم السريع والسهل لآليات التفاعل ، مثل النفاذ ، الامتزاز ، وتضمين جزيئات والجزيئات الكلية المختلفة مع غشاء الخلية ، مما يساعد في فحص المرشحين للأدوية والتنبؤ بالسمية الخلوية المحتملة.
Introduction
غشاء الخلية، وتتألف أساسا من الفوسفوليبيدات والكوليسترول والبروتينات، هو عنصر حاسم في جميع الخلايا الحية1. مع تنظيم مدفوعة amphiphilicity الدهون، غشاء الخلية يعمل كحاجز وقائي وينظم كيفية تفاعل الخلية مع البيئة المحيطة بها2. تعتمد العديد من العمليات الخلوية على تكوين الدهون والبروتين للغشاء1،2. على سبيل المثال ، تعد تفاعلات غشاء الخلية مهمة لتسليم الدواء الفعال3. يمكن أن تؤثر المستحضرات الصيدلانية والبيولوجية والمواد النانوية والسموم البيولوجية والمواد السامة البيئية على سلامة غشاء الخلية ، مما يؤثر على الوظيفة الخلوية4. بناء الخلايا المختبرية تحاكي نماذج الأغشية على أساس تكوين الدهون من أغشية الخلايا لديه القدرة على توفير أدوات سهلة لتعزيز كبير في دراسة التأثير المحتمل لهذه المواد على الخلايا.
وتشمل طبقة ثنائية الدهون النموذجية الحويصلات الدهنية، والبيدات ثنائية الدهون المدعومة، والبيدات ثنائية الدهون المعلقة. ثنائيات الدهون المدعومة هي نموذج لغشاء الخلية الفوسفولبيد شائع الاستخدام في تطبيقات التكنولوجيا الحيوية حيث تمزق الحويصلات الدهنية على مادة ركيزة معتمدة5،6،7،8،9. تقنية واحدة شائعة تستخدم لرصد تشكيل ثنائي الطبقات هو الكوارتز الكريستال microbalance مع رصد تبديد (QCM-D)، الذي يدرس الامتزاز من الحويصلات بالمقارنة مع الخصائص السائلة السائبة في الموقع8،10،11،12،13،14 . سابقا, وقد استخدمت QCM-D لإثبات أنه في ظل ظروف التدفق, مرة واحدة في الحويصلات الحرجة تغطية فوسفاتيديلكولين (PC) يتحقق الحويصلات الدهنية على السطح, أنها تمزق تلقائيا إلى طبقات الدهون جامدة15. وقد حققت العمل السابق أيضا دعم تشكيل ثنائي الطبقة الدهون مع التراكيب الدهنية متفاوتة16, دمج البروتينات الدهنية17,18,19, واستخدام وسائد البوليمر 20 , تسفر عن ثنائيات الدهون المدعومة قادرة على محاكاة جوانب مختلفة منوظيفة غشاءالخلية.
وقد استخدمت ثنائيات الدهون لمحاكاة الحواجز البيولوجية المختلفة من مستويات شبه الخلوية إلى الجهاز بما في ذلك الميتوشوندريون، خلايا الدم الحمراء، وأغشية خلايا الكبد عن طريق تغيير الفوسفوليبيد والكوليسترول ومكونات الجليكوليبيد21. قد تتطلب هذه الحويصلات متعددة الدهون الأكثر تعقيدا طرقا إضافية لتحقيق تمزق الحويصلات ، اعتمادا على تكوين الدهون. على سبيل المثال، استخدمت الدراسات السابقة الببتيد α-helical (AH) المستمدة من البروتين غير الهيكلي لفيروس التهاب الكبد C 5A للحث على تشكيل طبقة ثنائية عن طريق زعزعة استقرار الحويصلات الدهنية الممتزة22،23. باستخدام هذا الببتيد AH، وقد شكلت سابقا ثنائيات الدهون المدعومة تحاكي خلايا المشيمة24. وقد أظهرت إمكانات كبيرة من bilayers الدهون المدعومة للتطبيقات الطبية الحيوية مع التحقيقات التي تمتد الجزيئية والجسيمات النانوية النقل25،26، التفاعلات البيئية السامة27، تجميع البروتين وظيفة17،18،19، ترتيب الببتيد وإدراج28،29، فحص المخدرات30، ومنصات microfluidic31.
وقد استخدمت ثنائيات الدهون المعلقة لدراسات الفحص الصيدلاني عن طريق فحص نفاذية الغشاء الاصطناعي الموازي (PAMPA) حيث يتم تعليق طبقة ثنائية الدهون عبر إدراج مسعورمسامية 32،33،34،35. وقد وضعت نماذج الدهون PAMPA لواجهات بيولوجية مختلفة بما في ذلك الدم الدماغ, buccal, الأمعاء, وواجهات عبر الجلد36. من خلال الجمع بين كل من ثنائي الطبقة الدهون المعتمدة وتقنيات PAMPA، يمكن دراسة الامتزاز، نفاذية، وتضمين المركبات داخل مكونات الدهون من الأنسجة المطلوبة أو نوع الخلية بدقة.
يصف هذا البروتوكول تصنيع وتطبيق نماذج ثنائية الطبقة الدهنية في غشاء الخلية المختبرية للتحقيق في العديد من التفاعلات الجزيئية. إعداد كل من أحادي الدهون ومتعددة الدهون أيد وعلقت ثنائيات الدهون مفصلة. لتشكيل طبقة ثنائية الدهون المدعومة ، يتم تطوير الحويصلات الدهنية لأول مرة باستخدام طرق الترطيب والقذف الرقيقة تليها التوصيف الفيزيائي الكيميائي. يتم مناقشة تشكيل ثنائي الدهون معتمد باستخدام مراقبة QCM-D وتصنيع الأغشية الدهنية المعلقة للاستخدام في PAMPA. وأخيرا، يتم فحص الحويصلات متعددة الدهون لتطوير أغشية محاكاة الخلايا الأكثر تعقيدا. باستخدام كلا النوعين من الأغشية الدهنية المصنعة ، يوضح هذا البروتوكول كيف يمكن استخدام هذه الأداة لدراسة التفاعلات الجزيئية. وعموما، فإن هذه التقنية يبني الخلية تحاكي ثنائيات الدهون مع استنساخ عالية وبراعة.
Protocol
1. تطوير حويصلات أحادية الدهون
- طريقة ترطيب رقيقة
- إعداد وتخزين حلول مخزون الدهون
ملاحظة: يجب تنفيذ جميع الخطوات التي تستخدم الكلوروفورم في غطاء الدخان الكيميائي. الكلوروفورم يجب أن يكون دائما pipetted باستخدام المذيبات آمنة ألياف الكربون ماصة نصائح. يجب دائما تخزين المحاليل التي تحتوي على الكلوروفورم في قوارير زجاجية.- إعداد محلول مخزون الدهون 10 ملغم / مل عن طريق إضافة الحجم المناسب من الكلوروفورم في القارورة التي تحتوي على مسحوق الدهون وتخلط جيدا. على سبيل المثال، أضف 20 مل من الكلوروفورم إلى 200 ملغ من L-α-فوسفاتيديلكولين (البيض والدجاج) (eggPC). ويمكن صنع محلول المخزون بتركيز مختلف إذا لزم الأمر.
ملاحظة: إذا تم تخزين الدهون مسحوق في أمبول، بعد إضافة نقل الكلوروفورم إلى قارورة زجاجية مع غطاء مبطن البوليتيترافلوروإيثيلين (PTFE). - ختم غطاء قارورة مع Parafilm وتخزينها في -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- إعداد محلول مخزون الدهون 10 ملغم / مل عن طريق إضافة الحجم المناسب من الكلوروفورم في القارورة التي تحتوي على مسحوق الدهون وتخلط جيدا. على سبيل المثال، أضف 20 مل من الكلوروفورم إلى 200 ملغ من L-α-فوسفاتيديلكولين (البيض والدجاج) (eggPC). ويمكن صنع محلول المخزون بتركيز مختلف إذا لزم الأمر.
- تشكيل فيلم الدهون الجافة
- أضف الحجم المناسب من محلول مخزون الدهون إلى قارورة زجاجية نظيفة مطلوبة لتركيز الحويكل النهائي من 2.5 ملغم / مل. على سبيل المثال، لتشكيل 1 مل من الحويصلات البيض PC في 2.5 ملغم / مل، ماصة 250 ميكرولتر من البيض PC الأسهم حل في القارورة.
ملاحظة: قد تعتمد وحدة التخزين المعدة على عملية البثق المستخدمة (راجع الخطوة 1.3). الحد الأقصى لحجم البثق المصغر الموصى به هو 1 مل بينما نطاق حجم البثق الكبير هو 5-50 مل. - إزالة الكلوروفورم من محلول مخزون الدهون باستخدام تيار من الغاز N2 (ultrapure 5.0 الصف).
- لضمان إزالة كاملة من الكلوروفورم، وربط الفيلم الدهون المجففة إلى فراغ وترك لمدة 4 ساعة على الأقل.
ملاحظة: يمكن إيقاف العملية هنا. إذا لم يتم استخدام الفيلم الدهون مباشرة بعد فراغ التجفيف، وتخزينها في مجفف حتى استخدامها. لقد لاحظنا أن هذه الأفلام الدهنية تسفر عن حويصلات ذات جودة مماثلة بعد أسبوع واحد من التخزين في هذه الظروف. يجب مواصلة استكشاف جودة الحويكل بعد فترات تخزين أطول ، إذا لزم الأمر.
- أضف الحجم المناسب من محلول مخزون الدهون إلى قارورة زجاجية نظيفة مطلوبة لتركيز الحويكل النهائي من 2.5 ملغم / مل. على سبيل المثال، لتشكيل 1 مل من الحويصلات البيض PC في 2.5 ملغم / مل، ماصة 250 ميكرولتر من البيض PC الأسهم حل في القارورة.
- تنفيذ دورات التجميد والذوبان دوامة
- إعداد محلول عازل من كلوريد الصوديوم Tris (NaCl) يحتوي على 10 mM من قاعدة Tris و 100 mM من NaCl. إعادة ترطيب الفيلم الدهون المجففة مع الحجم المطلوب من مخزن Tris NaCl المؤقت لتسفر عن تركيز الحويكل النهائي من 2.5 ملغ / مل ودوامة لحوالي 15-30 ثانية.
- نقل تعليق الحويكل في وعاء مع الثلج الجاف حتى المجمدة، ما يقرب من 30 دقيقة. بعد تجميد العينة بالكامل، قم بإذابة التعليق في حمام مائي 30-40 درجة مئوية. دوامة تعليق الحويكل المذاب.
ملاحظة: السائل N2 يمكن استخدامها بدلا من الجليد الجاف. نقل تعليق الحويكل إلى النيتروجين السائل لمدة 30 ثانية، ومن ثم ذوبان على الفور في حمام مائي 80 درجة مئوية. - كرر الخطوة 1.1.3.2 مرة إضافية 4، لما مجموعه 5 دورات تجميد ذوبان دوامة.
- إعداد وتخزين حلول مخزون الدهون
- النتوء
ملاحظة: بعد الانتهاء من دورات التجمد-ذوبان-دوامة، يتم تشكيل vesicles متعددةlamellar. يساعد البثق في تقليل الحجم وتطوير الحويصلات unilamellar كبيرة.- عملية البثق المصغرة (1 مل)
- تنظيف جميع مكونات الطارد بدقة باستخدام منظفات خفيفة في الماء فائقة النبور وشطف ثلاث مرات على الأقل مع المياه فائقة البور ضمان إزالة جميع المنظفات. الجافة مع الغاز N2.
- تجميع دعامات الغشاء الداخلي و O-rings (القطر الداخلي 12.7 مم؛ القطر الخارجي 15.2 مم). ضع كل دعم غشاء بحيث يواجه O-ring.
- قبل الرطب دعم مرشح مع المياه فائقة البور. وضعه على سطح دعم الغشاء داخل O-حلقة. كرر لدعم الغشاء الداخلي الثاني.
- وضع واحد دعم الغشاء الداخلي في الغلاف الخارجي مقذوف. ضع غشاء بولي كربونات واحد 100 نانومتر على دعم الغشاء الداخلي ، مباشرة على دعم الفلتر.
ملاحظة: يتم تخزين أغشية البولي بشكل منفصل بين قطع من الورق الأزرق الملون. قم بإزالة الورق الفاصل قبل إدخاله في دعم الغشاء. - ضع دعم الغشاء الداخلي الثاني في الغلاف الخارجي الخارجي للطارد مع جانب دعم O-ring والفلتر المواجه لغشاء البولي كربونات. إرفاق تحمل PTFE في الجوز التجنيب والمسمار مغلقة مع غلاف الخارجي مقذوف. قص البثق في كتلة التدفئة.
- تحميل تعليق الحويكل الدهني في واحدة من المحاقن ووضع المحاقن في كتلة الحرارة البثق، وإدراج الإبرة تماما في نهاية واحدة من البثق. أدخل الحقنة الثانية الفارغة في الجانب الآخر واقفل في كلتا الحقنتين باستخدام مقاطع الذراع على كتلة الحرارة.
ملاحظة: إذا لزم الأمر، ضع كتلة الحرارة البثق على لوحة ساخنة وتعيين درجة الحرارة إلى قيمة أعلى من درجة حرارة الانتقال من الدهون. أدخل ميزان الحرارة في الحامل المدمج في كتلة الحرارة لقراءات دقيقة لدرجة الحرارة وانتظر حتى يتم الوصول إلى درجة الحرارة المطلوبة (~ 15 دقيقة). الحويصلات الدهنية البيض PC لا تتطلب الحرارة أثناء البثق. - ادفع تعليق الحويصلة ببطء إلى الحقنة الفارغة ، ثم عد إلى الحقنة الأصلية. رصد لتغيرات الضغط في جميع أنحاء البثق التي تشير إلى تسرب. كرر 20 مرة أخرى لما مجموعه 21 يمر عبر غشاء البولي. نقل الحويصلات الدهنية إلى قارورة زجاجية نظيفة للتخزين.
ملاحظة: يمكن تحسين عدد البثقات اعتمادا على تكوين الدهون. - إذا تم استخدام الحرارة، والسماح لتعليق الحويصلات مقذوف للوصول إلى درجة حرارة الغرفة. تخزين الحويصلات الدهنية مقذوف في 4 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: تعتمد مدة تخزين الحويكل الموصى بها بشكل كبير على تكوين الدهون ، ويجب مراقبة الخصائص الفيزيائية الكيميائية الحويصية (مثل القطر الهيدروديناميكي ، إمكانات زيتا) بمرور الوقت. على سبيل المثال، تم تخزين الحويصلات البيض PC لمدة أسبوعين على الأقل مع أي تغيير في حجم الحويصلة أو قدرة تشكيل طبقة ثنائية.
- عملية قذف كبيرة (5-50 مل)
ملاحظة: اتبع الخطوات 1.2.2.1-1.2.2.5 إذا كانت الحرارة مطلوبة للدهون المختارة. انتقل إلى الخطوة 1.2.2.5 إذا لم تكن هناك حاجة للحرارة. الخطوات 1.2.2.1-1.2.2.4 غير مطلوبة لأجهزة الكمبيوتر البيض.- ملء قارورة 1 لتر مع التناضح العكسي (RO) المياه.
ملاحظة: لا تستخدم المياه فائقة السعة للتعميم عبر نظام 50 مل لأنها يمكن أن تسبب أيونات معدنية للرشح من أسطوانة البثق. - ضع قارورة 1 L في حمام مائي على طبق ساخن وحدد الطبق الساخن لدرجة حرارة أعلى من درجة حرارة انتقال الدهون.
- إرفاق اسطوانة عينة إلى قارورة مع أنابيب مرنة عبر مدخل على اسطوانة العينة. إرفاق أنابيب على منفذ الاسطوانة إلى أعلى قارورة 1 L. أنابيب آمنة في كل من المدخل والمنفذ، حسب الحاجة. وهذا سيخلق تدفق أحادي الاتجاه من المياه من خلال اسطوانة العينة.
- تشغيل المضخة لبدء دوران المياه. إذا كانت هناك حاجة للحرارة، والسماح لحوالي 30-45 دقيقة لعينة اسطوانة للوصول إلى درجة الحرارة المطلوبة.
- قم بتوصيل غطاء أسطوانة العينة بخزان النيتروجين عبر الموصل المرن المتصل بوحدة صمام تخفيف الضغط.
- تنظيف جميع أجزاء من مقذوف 50 مل مع 70٪ (v/v) الإيثانول.
- تجميع البثق عن طريق وضع دعم الشاشة ثقب كبير، والقرص المغرض، وأقراص استنزاف، وغشاء البولي في الفضاء في دعم أقل البثق. توصيل البثق العلوي والسفلي يدعم باستخدام مسامير الأربعة وتشديد.
- إرفاق وحدة البثق إلى اسطوانة عينة عن طريق الشد إلى أسفل وتشديد مع وجع لتأمين.
ملاحظة: إذا تم استخدام الحرارة، ضع ميزان الحرارة في الأسطوانة وانتظر حتى تصل درجة الحرارة المطلوبة إلى الماء قبل المتابعة. وهذا يضمن الحفاظ على درجة حرارة العينة طوال عملية البثق بأكملها. - ملء اسطوانة عينة مع المياه فائقة البور. قذف الماء من خلال وحدة البثق قبل إضافة العينة إلى اسطوانة العينة. ويتم ذلك قبل الرطب الأغشية، على غرار البثق مصغرة.
ملاحظة: تأكد من أن الغطاء مشدود بالكامل وأن صمام تخفيف الضغط مغلق تماما قبل تشغيل النيتروجين. مطلوب الحد الأدنى من الضغط لهذه الخطوة (~ 5-10 psi). - إضافة تعليق الحويكل الدهون في اسطوانة عينة والمسمار أعلى مغلقة. زيادة الضغط ببطء حتى تبدأ العينة بالتنقيط من وحدة البثق بمعدل 2-3 قطرات / ثانية تقريبا في قارورة زجاجية نظيفة.
ملاحظة: لا تزيد الضغط بسرعة في هذه الخطوة، حيث أن الضغط الشديد قد يؤثر سلبا على الأغشية ويؤدي إلى قذف غير ناجح. - مرة واحدة وقد تم قذف جميع العينة، إيقاف العرض N2 والإفراج عن الضغط في اسطوانة عينة عن طريق فتح صمام تخفيف الضغط ببطء. صب الحويصلات الدهنية مرة أخرى في اسطوانة عينة وتكرار الخطوة 1.2.2.11، 9 مرات أخرى لما مجموعه 10 البثق.
ملاحظة: قد ينخفض الضغط المطلوب للقذف مع زيادة عدد البثقات ، حيث تصبح العينة أكثر تجانسا وأقرب في الحجم إلى حجم مسام غشاء البولي. - تخزين تعليق الحويكل الدهني مقذوف في 4 درجة مئوية حتى مزيد من الاستخدام.
- ملء قارورة 1 لتر مع التناضح العكسي (RO) المياه.
- عملية البثق المصغرة (1 مل)
2. توصيف الحويصلات الدهنية
- قياس القطر الهيدروديناميكي باستخدام تشتت الضوء الديناميكي (DLS)
- دوامة الحويصلات الدهنية وماصة 50 ميكرولتر من تعليق الحويصلة الدهنية في cuvette منخفضة الحجم المتاح. تغطية لمنع التلوث بالغبار والحطام.
- تحميل تعليق الحويكل في الصك DLS، وإدخال تفاصيل العينة، وإجراء القياس باستخدام البرامج المرتبطة بها.
- زيتا المحتملة
- إعداد خلية زيتا الشعرية مطوية عن طريق الغسيل مع المياه فائقة البور، 70٪ الإيثانول، والمياه فائقة الشراء باستخدام المحاقن التي تتصل مدخلات الخلية. دفع السائل بلطف من خلال الخلية 3-4 مرات وتفريغ الخلية تماما قبل التحول إلى الحل التالي.
- دوامة الحويصلات الدهنية وإعداد 1:10 (v/v) تخفيف الحويصلات الدهنية في الماء فائقة النبور.
- تحميل تعليق الحويكل الدهون المخفف. إزالة فقاعات الهواء عن طريق دفع تعليق ذهابا وإيابا بين المحاقن. إرفاق سدادات إلى كل مدخل.
ملاحظة: من الضروري إزالة كافة الفقاعات، حيث سيؤثر ذلك على القياس. - ضع خلية زيتا في غرفة العينة، مع التأكد من أن الأقطاب الكهربائية على اتصال. أغلق الجزء العلوي من غرفة العينة. في البرنامج المرتبط، أدخل تفاصيل العينة وجمع القياس.
3. تشكيل أحادي الدهون أيد ثنائي الدهون باستخدام QCM-D
- تحضيرات الحلول
- إعداد محلول كبريتات دودسيل الصوديوم (SDS) بنسبة 2٪ (ث/v) في المياه فائقة النبور. تخلط على لوحة ضجة حتى يذوب تماما. Aliquot حلول العمل من ما لا يقل عن 10 مل من المياه فائقة الشراء، 2٪ SDS، وترس NaCl.
- إعداد تخفيف الحويصلات الدهنية في مخزن Tris NaCl المؤقت. تركيز الحويصلات يعتمد على التطبيق. بالنسبة لأجهزة الكمبيوتر الشخصية البيض, وقد ثبت تركيزات في نطاق 0.01-0.5 ملغم / مل أن يؤدي إلى تشكيل ثنائي الطبقة الدهون المعتمدة الناجحة.
- تنظيف أجهزة استشعار الكريستال الكوارتز المغلفة بالسيليكا
ملاحظة: تنظيف بلورات QCM-D يعتمد على المواد السطحية للمستشعر المستخدم. لتشكيل ثنائيات الدهون المدعومة ، يتم استخدام بلورات الكوارتز المغلفة بالسيليكا في هذا البروتوكول ومفصلة أدناه على أنها مقتبسة من إجراء التشغيل القياسي للشركة المصنعة.- أدخل مستشعر كريستال الكوارتز المغلف بالسيليكا في وحدة التدفق لضمان محاذاة "t" على البلورة مع "t" على الوحدة. المسمار وحدة تدفق مغلقة.
ملاحظة: إذا كان QCM-D المستخدمة يسمح لوحدات تدفق متعددة ليتم توصيل وتشغيلها في وقت واحد، كرر الإجراءات التالية للوحدات النمطية الإضافية حسب الحاجة. - أدخل وحدة التدفق في قاعدة الجهاز مع الأقطاب الكهربائية من وحدة التدفق التي تتصل بنظام المحلل. قفل الوحدة في مكانها.
- قم بتوصيل مدخل ومنفذ الأنابيب إلى وحدة تدفق ومضخة. ضع الأنابيب في الحراس القابضة واغلق غطاء نظام المحلل. ضع حاوية نفايات في منفذ المضخة لجمع الحلول المستهلكة.
- لإجراء التنظيف، قم بتشغيل المضخة أولا. تعيين سرعة التدفق إلى 400 ميكرولتر / دقيقة. أدخل أنابيب المدخل في المياه فائقة السعة وانسياب 5-10 مل من خلال الوحدة.
- قم بتبديل أنابيب المدخل إلى 2٪ SDS وانسياب 5-10 مل من خلال الوحدة. قم بتبديل أنابيب المدخل مرة أخرى إلى مياه فائقة السعة وتدفق 10-20 مل من خلال الوحدة. إزالة مدخل أنابيب من الحل وتدفق الهواء من خلال الأنابيب حتى يتم إخراج جميع السائل.
ملاحظة: يتم استخدام بروتوكول التنظيف أعلاه يوميا قبل وبعد كل قياس. يمكن إجراء تنظيف شامل حسب الحاجة. باختصار، لإجراء تنظيف شامل، تفكيك وحدات التدفق. جميع المكونات باستثناء الجانب القطب من وحدة تدفق ينبغي أن تكون مغمورة في 2٪ (ث / v) SDS وحمام سونيكاتيد، تليها الشطف شامل مع المياه فائقة التجفيف مع تيار من الغاز N2. يجب ألا يكون مكون وحدة التدفق التي تحتوي على دبابيس القطب على اتصال مع السائل. - قم بإزالة المستشعر من وحدة التدفق وشطف المستشعر بالماء فائق النبع. جفف المستشعر بتيار غاز N2. قم بتجفيف وحدة التدفق بتيار غاز N2. تأكد من أن القطب الكهربائي يظل دائما خاليا من أي سائل.
- في غطاء الدخان الكيميائي، أدخل مستشعر كريستال الكوارتز المغلف بالسيليكا في أداة تنظيف فوق بنفسجية (UV)/الأوزون. قم بتشغيل الجهاز والسماح بالعلاج لمدة دقيقتين على الأقل. إزالة أجهزة الاستشعار بعناية والعودة إلى وحدة تدفق.
- أدخل مستشعر كريستال الكوارتز المغلف بالسيليكا في وحدة التدفق لضمان محاذاة "t" على البلورة مع "t" على الوحدة. المسمار وحدة تدفق مغلقة.
- تشكيل خط أساس Tris NaCl
- تشغيل أداة محلل للاتصال البرامج المرتبطة بها وتعيين درجة الحرارة إلى القيمة المطلوبة ل bilayer الدهون المعتمدة. السماح لدرجة الحرارة لتحقيق الاستقرار في الإدخال المطلوب.
ملاحظة: إذا كانت درجة الحرارة المحددة أعلى من درجة حرارة الغرفة، يجب تسخين جميع الحلول إلى نفس درجة الحرارة باستخدام كتلة حرارية. - تكوين القياس والعثور على جميع ترددات الرنين الاستشعار وتبدد لنغمات 3 و 5 و 7 و 9 و 11 و 13 قبل بدء القياس.
ملاحظة: يمكن تجاهل 1st الألوان الزائدة كما هذا التوافقي حساسة بشكل مفرط وتنتج بيانات صاخبة. - قم بتشغيل المضخة وحدد معدل التدفق إلى 175 ميكرولتر/دقيقة أو معدل التدفق التجريبي المطلوب.
- مسح مدخل الأنابيب مع الإيثانول قبل إدراجها في تريس NaCl. بدء القياس والبدء في تدفق تريس NaCl.
ملاحظة: يتم تجميع البيانات ومراقبتها في الوقت الحقيقي. وسيلاحظ التغير من الهواء إلى السائل في وحدة التدفق في برنامج جمع البيانات عن طريق التغير السريع في التبدد(ΔD)الزيادة وتغيير التردد(ΔF)انخفاض. - السماح ل Tris NaCl بالتدفق عبر الوحدة لمدة 5-10 دقائق ، مما يضمن بقاء قيم الأساس ΔF و ΔD في السائل مستقرة.
- تشغيل أداة محلل للاتصال البرامج المرتبطة بها وتعيين درجة الحرارة إلى القيمة المطلوبة ل bilayer الدهون المعتمدة. السماح لدرجة الحرارة لتحقيق الاستقرار في الإدخال المطلوب.
- تشكيل ثنائي الدهون أحادي الدهون المدعومة
- وقف المضخة وإزالة مدخل أنابيب من الحل NaCl تريس وإدراج بعناية في حل الحويص الدهون. تدفق الظهر لمدة 5 ق لإزالة أي فقاعات الهواء من مدخل الأنابيب، ومن ثم مواصلة تدفق إلى الأمام. أعد تشغيل القياس في البرنامج إلى صفر خط الأساس.
ملاحظة: يجب الحرص على تجنب فقاعات الهواء في الأنابيب، والتي يمكن أن تتدفق من خلال وحدة وتعطيل تشكيل ثنائي الطبقة وتسجيل البيانات. - تدفق الحويصلات الدهنية حتى يتم ملاحظة تشكيل طبقة ثنائية في الوقت الحقيقي في برنامج الحصول على البيانات (على الأقل 8 دقائق ل vesicles البيض PC).
- كرر الخطوة 3.4.1 لتغيير أنابيب مدخل من الحويصلات الدهنية مرة أخرى إلى مخزن Tris NaCl المؤقت.
ملاحظة: إذا كان التطبيق المطلوب هو لدراسة التفاعلات الجزيئية، تابع مباشرة إلى الخطوة 6.1 دون إيقاف تدفق الحل أو الحصول على البيانات. إذا كان تشكيل ثنائي الطبقة هو نقطة النهاية، انتقل إلى الخطوة 3.4.4. - في البرنامج، أوقف القياس واحفظ الملف. أوقف المضخة
- تنظيف وحدة تدفق ومستشعر الكريستال الكوارتز المغلفة بالسيليكا باتباع الخطوات البروتوكول 3.2.4 و 3.2.5.
- وقف المضخة وإزالة مدخل أنابيب من الحل NaCl تريس وإدراج بعناية في حل الحويص الدهون. تدفق الظهر لمدة 5 ق لإزالة أي فقاعات الهواء من مدخل الأنابيب، ومن ثم مواصلة تدفق إلى الأمام. أعد تشغيل القياس في البرنامج إلى صفر خط الأساس.
4. تشكيل ثنائي الدهون المعلقة
ملاحظة: بروتوكول لتشكيل ثنائي الدهون المعلقة مقتبس من الغشاء الاصطناعي المتوازي نفاذية (PAMPA) بروتوكول المقدمة من الشركة المصنعة لوحة تصفية37.
- Solubilize الدهون المطلوبة في دوديكان في 20 ملغم / مل (على سبيل المثال، 1،2-ديوليويل-سن-غليسيرو-3-فوسفوتشولين (DOPC)).
- إضافة 5 ميكرولتر من محلول الدهون إلى مقصورة المانحة، وهو ثنائي فلوريد البولي فينيلدين مسامية (PVDF) لوحة مرشح متعددة الشاشات 96 جيدا (0.45 ميكرومتر حجم المسام).
- غمر لوحة التصفية فورا في حجرة المقبول، وهي لوحة استقبال نقل تحتوي على 300 ميكرولتر من 1× ملحي عازل فوسفات (PBS). أضف 200 ميكرولتر من 1× برنامج تلفزيوني إلى مقصورة المانحين.
ملاحظة: يمكن تضمين عناصر التحكم في الفلاتر ذات الدهون فقط والمرشحات غير المعالجة المعرضة ل 1× PBS. - تابع مباشرة إلى القسم 6.2 للتحقيق في التفاعلات الجزيئية مع طبقة الدهون المعلقة. فمن المستحسن لاستكمال الدراسة في غضون 16 ساعة من تشكيل ثنائي الطبقات المعلقة.
5. تطوير خلايا متعددة الدهون تحاكي الحويصلات والحيويات ثنائية الطبقات
- استخراج الدهون من خلايا الثدييات
ملاحظة: استخراج الدهون يتبع نهج Bligh داير38.- الثقافة خط الخلية المطلوب حسب الاقتضاء. بعد تحقيق التقاء 70-80٪ (قارورة T75)، فصل الخلايا باستخدام حمض تريبسين-إيثيلينديامينتريتاستيك عند 37 درجة مئوية لمدة 5 دقائق.
- خلايا الطرد المركزي في 200 × غرام لمدة 5 دقائق. إزالة supernatant وإعادة إنفاق بيليه الخلية في 1 مل من المياه فائقة البور.
- أضف 3.75 مل من خليط 1:2 (v/v) من الكلوروفورم: الميثانول إلى تعليق الخلية ودوامة لمدة 15 دقيقة. ثم، إضافة 1.25 مل من الكلوروفورم ودوامة لمدة 1 دقيقة. وأخيرا، أضف 1.25 مل من الماء ودوامة لمدة دقيقة واحدة.
- خليط خلايا الطرد المركزي في 1000 × غرام لمدة 10 دقائق. جمع الطبقة السفلية من السائل، الذي يحتوي على الدهون في المرحلة العضوية. الجافة تحت تيار من الغاز N2.
- قياس محتوى الدهون باستخدام قياس الطيف الكتلي الكروماتوغرافي السائل (LC-MS) باستخدام مرحلة عكسية C18، 3.5 ميكرومتر × عمود 50 ملم.
- للمرحلة المتنقلة, إعداد حلين, الأول مع 60:40 (v/v) أستونيتريل:ماء والثاني مع 90:10 (v/v) isopropanol:acetonitrile. وينبغي إضافة الأمونيوم formate لكلا الحلين في تركيز النهائي من 10 MM. أكثر من 60 دقيقة، وزيادة التدرج المرحلة المتنقلة من 35٪ (v/v) من الحل الثاني إلى 95٪ (v/v).
- الكشف عن النفايات السائلة في وضع التأين السلبي، مع التصلب المتعدد المسح الكامل على التوالي والتصلب المتعدد جنبا إلى جنب / MS. تحديد الأنواع الفوسفوليبيدات الفردية من نسب كتلة إلى تهمة (م / ض). تحليل الأطياف الشاملة من تجزئة الانفصال الناجم عن الاصطدام، وذلك باستخدام أدوات تحليل الطيف الكتلي LIPID MAPS. الحصول على الكروماتوجرامات الأيونية المستخرجة لدمج المنطقة تحت المنحنى ، وتحديد وفرة كل نوع من أنواع الدهون.
- تنفيذ الخطوات 5.1.5-5.1.7 لمعيار الدهون التي تحتوي على فئات الدهون الرئيسية لتحديد الحساسات النسبية للكشف عن كل فئة فوسفوليبيد مختلفة.
- تطوير الحويصلات متعددة الدهون
- اتبع الخطوات في 1.1.1 لإعداد حلول مخزون الدهون للدهون التي تمثل كل مكون ثنائي الطبقة المطلوب، كما هو محدد في الخطوة 5.1.
- استنادا إلى التراكيب الدهنية التي تم الحصول عليها من الخطوة 5.1، إضافة الحجم المناسب من مخزون الدهون / الكلوروفورم في قارورة زجاجية نظيفة اللازمة لتركيز الحويكل النهائي من 2.5 ملغم / مل. إزالة محلول تجفيف الكلوروفورم السائبة تحت تيار من الغاز N2.
- اتبع الخطوات 1.1.2 و1.1.3 و1.2 لتشكيل الحويصلات متعددة الدهون. اتبع الخطوة 2 لتوصيف الحويكل.
- تشكيل ثنائي الدهون متعددة الدهون المدعومة باستخدام QCM-D
ملاحظة: بعض الحويصلات متعددة الدهون يمكن أن يؤدي إلى تمزق الحويصلات الدهنية العفوية وتشكيل ثنائي الطبقات مماثلة ل vesicles PC أحادي الدهون المقدمة في الخطوة 3. ومع ذلك، قد تحتاج الحويصلات متعددة الدهون الأكثر تعقيدا إلى مدخلات خارجية للمساعدة في تمزق الحويصلات. هنا ، يتم استخدام الببتيد AH لزعزعة استقرار المنشور الخارجي لل الحويكل مما يؤدي إلى تشكيل طبقة ثنائية. ويمكن النظر في طرق أخرى لتحقيق زعزعة الاستقرار وتمزق الحوييل إذا رغبت في ذلك.- اتبع الخطوة 3 لتشكيل ثنائي الدهون متعدد الدهون المدعومة باستخدام الحويصلات متعددة الدهون التي تشكلت في الخطوة 5.2.
- إذا لم يتم ملاحظة تمزق عفوي لل الحويصلات إلى طبقة ثنائية ، فحاول زعزعة الاستقرار باستخدام ببتيد AH. إعداد الببتيد AH (تسلسل الببتيد: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−حل Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2)عند 13 ميكرومتر في تريس ناكل بنسبة 1٪ (v/v) ثنائي ميثيل سلفوإكسيد، DMSO.
- اتبع الخطوات 3.4.1-3.4.3. بعد الخطوة 3.4.3، تغيير مدخل أنابيب في حل الببتيد AH. أدخل الحل في وحدة التدفق حتى يتم ملاحظة ΔF و ΔD من إضافة الحل الجديد. وقف المضخة والسماح للببتيد AH لاحتضان مع الحويصلات لمدة 10 دقيقة.
- تبديل مدخل الأنابيب إلى تريس NaCl وبدء تدفق لإزالة الببتيد AH من الحويصلات تمزق مما يؤدي إلى تشكيل ناجح من طبقة ثنائية الدهون.
ملاحظة: إذا كان التطبيق المطلوب هو لدراسة التفاعلات الجزيئية، استمر في الاتجاه إلى الخطوة 6.1 دون إيقاف تدفق الحل أو الحصول على البيانات. - في البرنامج، أوقف القياس واحفظ الملف. أوقف المضخة
- تنظيف وحدة تدفق ومستشعر الكريستال الكوارتز المغلفة بالسيليكا باتباع الخطوات البروتوكول 3.2.4-3.2.6.
- طبقات ثنائية متعددة الدهون معلقة
- Solubilize خليط من الدهون المطلوبة في دوديكان في 20 ملغ / مل.
- تشكل محلول مزيج الدهون 5 ميكرولتر باستخدام الخلية المطلوبة محاكاة التكوين.
- اتبع الخطوتين 4.2 و4.3.
ملاحظة: تابع مباشرة إلى الخطوة 6.2 للتحقيق في التفاعلات الجزيئية مع طبقة ثنائية الدهون المعلقة.
6. دراسات التفاعل جزيء مع أحادي الدهون ومتعددة الدهون bilayers
- دراسة التفاعلات الجزيئية مع طبقة ثنائية الدهون المدعومة باستخدام QCM-D
- إعداد حل للجزيء المطلوب للتحقيق في الامتزاز مع ثنائي الدهون المدعومة. على سبيل المثال، إعداد حل من 200 ميكرومتر دي (2-إيثيلهيكسيل) الفثالات (DEHP) في تريس NaCl مع 1٪ (v/v) DMSO.
- إذا تم إعداد محلول الجزيء في Tris NaCl ، فيمكن تدفقه مباشرة بعد الخطوة 3.4.3 ل bilayer أحادي الدهون أو 5.3.4 ل bilayer متعدد الدهون. إذا كان يجب إعداد الجزيء في مذيب مختلف ، بدلا من ذلك إدراج أنابيب مدخل في المذيب المطلوب وحده لمدة 5 دقائق على الأقل (على سبيل المثال ، تريس NaCl مع 1 ٪ (v / v) DMSO لDHP).
ملاحظة: يمكن رصد التغيرات اللزوجة بسبب المذيب والنظر فيها عن طريق تدفق قبل وبعد إدخال جزيء من الفائدة. - قم بتبديل أنابيب المدخل إلى المحلول الذي يحتوي على جزيء الاهتمام وتدفق لمدة 5 دقائق على الأقل. ويمكن أيضا وقف تدفق والسائل الذي يحتوي على جزيء المطلوب يسمح لاحتضان مع طبقة ثنائية إذا رغبت في ذلك.
- تغيير مدخل أنابيب العودة إلى المذيب جزيء وحدها إذا كان هناك شيء آخر غير تريس NaCl. تدفق لمدة 5 دقائق على الأقل. ثم، قم بتبديل أنابيب المدخل إلى Tris NaCl وتدفق لمدة 5 دقائق على الأقل.
- في البرنامج، أوقف القياس واحفظ الملف. أوقف المضخة
- تنظيف وحدة تدفق ومستشعر الكريستال الكوارتز المغلفة بالسيليكا باتباع الخطوات البروتوكول 3.2.4-3.2.6.
- دراسة التفاعلات الجزيئية مع ثنائيات الدهون المعلقة باستخدام PAMPA
- إعداد حل للجزيء المطلوب. على سبيل المثال، قم بإعداد 200 ميكرومتر DEHP في 1× برنامج تلفزيوني مع 1٪ (v/v) DMSO.
- إعداد لوحة جديدة لاستقبال النقل مع 300 ميكرولتر من برنامج تلفزيوني جديد 1x لكل بئر.
- مباشرة بعد الخطوة 3.3 لثنائي أحادي الدهون المعلقة أو 4.4.3 لثنائية متعددة الدهون المعلقة، وإزالة برنامج تلفزيوني 1× من مقصورة المانحة من لوحة تصفية متعددة الشاشات واستبدالها مع 200 ميكروغرام من حل الاختبار. غمر فورا في لوحة استقبال النقل المعدة في الخطوة 6.2.2.
- احتضان مع هزاز لطيف لفترة من الوقت المطلوب (على سبيل المثال، 2 ساعة) في 25 درجة مئوية.
- بعد الحضانة، اجمع 150 ميكرولتر من المحلول من مقصورات المتبرع والمقبول. قياس تركيز الجزيء في كلتا العينتين باستخدام طريقة مناسبة على أساس خصائص هذا الجزيء.
- على سبيل المثال، استخدم مطياف ميكروبليت مع الطول الموجي المناسب للامتصاص، مثل 280 نانومتر ل DEHP، وقارنه بمنحنى قياسي للجزيء المثير للاهتمام.
- حساب نفاذية واضحة(P التطبيق)من جزيء الفائدة باستخدام المعادلات التالية:
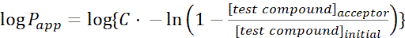 (1)
(1)
أين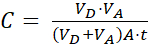 (2)
(2)
ملاحظة: [مركب الاختبار]المقبول هو تركيز جزيء الفائدة (مثل DEHP) في الوقت المناسب ، t ، في مقصورة القبول ؛ و [مركب الاختبار]الأولي هو التركيز الأولي للجزيء. A هي منطقة الغشاء، t هو الوقت، VD هو حجم مقصورة المانحة، وVA هو حجم مقصورة القبول.
النتائج
هذا البروتوكول تفاصيل أساليب لتشكيل معتمدة وعلقت ثنائيات الدهون(الشكل 1). الخطوة الأولى لتشكيل ثنائي الدهون المدعومة هو تطوير الحويصلات الدهنية. يسمح الطارد المصغر بإعداد كميات صغيرة من الحويصلات الدهنية (1 مل أو أقل) ، في حين يسمح البثق الكبير بإعداد 5-50 مل من الحويصلات الد...
Discussion
يسمح هذا البروتوكول بتشكيل الحويصلات الدهنية ، والبيلايات الدهنية المدعومة ، والبيلايات الدهنية المعلقة. هنا، يتم تقديم خطوات هامة لتشكيل كل من هذه الهياكل. عند تشكيل الحويصلات الدهنية ، من المهم أن تبرز فوق درجة حرارة الانتقال من الدهون39. عندما تحت درجة حرارة الانتقال ، تكو...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما تضارب في المصالح أو مصالح مالية متنافسة.
Acknowledgements
تستند هذه المادة إلى العمل الذي تدعمه المؤسسة الوطنية للعلوم بموجب المنحة رقم 1942418 الممنوحة ل A.S. وزمالة أبحاث الدراسات العليا التي تمنحها المؤسسة الوطنية للعلوم إلى C.M.B.H. بموجب المنحة رقم 1644760. أي آراء أو نتائج أو استنتاجات أو توصيات يتم التعبير عنها في هذه المواد هي آراء المؤلفين ولا تعكس بالضرورة وجهات نظر المؤسسة الوطنية للعلوم. يشكر المؤلفون الدكتور نويل فيرا غونزاليس على اكتساب بيانات توصيف الحويكل الدهني. يشكر المؤلفون البروفيسور روبرت هيرت (جامعة براون) على استخدام زيتايزر. يشكر المؤلفون مرفق قياس الطيف الكتلي في جامعة براون، وعلى وجه الخصوص، الدكتور تون لي شين للمساعدة في تحديد تركيبة الدهون كميا.
Materials
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
References
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved