Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сборка поддерживаемых и взвешенных липидных бислойных моделей, имитирующих клетки, для изучения молекулярных взаимодействий
В этой статье
Резюме
Этот протокол описывает образование клеток, имитирующих однолипидные и мультилипидные везикулы, поддерживаемые липидные бислои и взвешенные липидные бислои. Эти модели in vitro могут быть адаптированы для включения различных типов липидов и могут быть использованы для исследования различных взаимодействий молекул и макромолекул.
Аннотация
Модельные клеточные мембраны являются полезным инструментом скрининга с приложениями, варьирующимися от раннего открытия лекарств до исследований токсичности. Клеточная мембрана является важнейшим защитным барьером для всех типов клеток, отделяя внутренние клеточные компоненты от внеклеточной среды. Эти мембраны состоят в основном из липидного бислоя, который содержит внешние гидрофильные головные группы и внутренние гидрофобные хвостовые группы, а также различные белки и холестерин. Состав и структура самих липидов играют решающую роль в регулировании биологической функции, включая взаимодействия между клетками и клеточной микросредой, которая может содержать фармацевтические препараты, биологические токсины и токсиканты окружающей среды. В этом исследовании описаны методы формулирования однолипидных и мультилипидных поддерживаемых и взвешенных клеток, имитирующих липидные бислои. Ранее были разработаны однолипидные фосфатидилхолиновые (PC) липидные бислои, а также многолипидные плацентарные трофобласт-вдохновленные липидными бислоями для использования в понимании молекулярных взаимодействий. Здесь будут представлены методы достижения обоих типов двухслойных моделей. Для клеток, имитирующих мультилипидные бислои, желаемую липидную композицию сначала определяют путем экстракции липидов из первичных клеток или клеточных линий с последующей жидкостной хроматографией-масс-спектрометрией (LC-MS). С использованием этой композиции липидные везикулы изготавливают методом тонкопленочной гидратации и экструзии и характеризуют их гидродинамический диаметр и дзета-потенциал. Поддерживаемые и взвешенные липидные бислои затем могут быть сформированы с использованием микровесов кристаллов кварца с мониторингом диссипации (QCM-D) и на пористой мембране для использования в параллельном анализе проницаемости искусственной мембраны (PAMPA), соответственно. Репрезентативные результаты подчеркивают воспроизводимость и универсальность липидных двухслойных моделей in vitro клеточной мембраны. Представленные методы могут помочь в быстрой, поверхностной оценке механизмов взаимодействия, таких как проникновение, адсорбция и встраивание различных молекул и макромолекул с клеточной мембраной, помогая в скрининге кандидатов на лекарства и прогнозировании потенциальной клеточной токсичности.
Введение
Клеточная мембрана, состоящая в основном из фосфолипидов, холестерина и белков, является важнейшим компонентом всех живых клеток1. Благодаря организации, обусловленной амфифильностью липидов, клеточная мембрана функционирует как защитный барьер и регулирует, как клетка взаимодействует с окружающей средой2. Несколько клеточных процессов зависят от липидного и белкового составамембраны 1,2. Например, клеточные мембранные взаимодействия важны для эффективной доставки лекарств3. Фармацевтические препараты, биологические препараты, наноматериалы, биологические токсины и токсиканты окружающей среды могут влиять на целостность клеточной мембраны, тем самым влияя на клеточную функцию4. Построение моделей мембран in vitro, имитирующих клетки, на основе липидного состава клеточных мембран может обеспечить легкие инструменты для значительного улучшения изучения потенциального воздействия этих материалов на клетки.
Модельные липидные бислои включают липидные везикулы, поддерживаемые липидные бислои и взвешенные липидные бислои. Поддерживаемые липидные бислои представляют собой модель фосфолипидной клеточной мембраны, обычно используемой в биотехнологических приложениях, где липидные везикулы разрываются на поддерживаемом материале субстрата5,6,7,8,9. Одним из распространенных методов, используемых для мониторинга двухслойного образования, является микровес кристаллов кварца с мониторингом диссипации (QCM-D), который исследует адсорбцию везикул в сравнении с объемными свойствами жидкости in situ8,10,11,12,13,14 . Ранее QCM-D использовался для демонстрации того, что в условиях потока, как только на поверхности достигается критическое покрытие пузырчатых липидных пузырьков фосфатидилхолина (ПК), они самопроизвольно разрываются на жесткие липидные бислои15. Предыдущая работа также исследовала образование поддерживаемых липидных бислоев с различными липидными композициями16,включением липидных белков17,18,19и использованием полимерных подушек20,что дает поддерживаемые липидные бислои, способные имитировать различные аспекты функции клеточной мембраны.
Липидные бислои использовались для имитации различных биологических барьеров от субклеточных до органных уровней, включая митохондрии, эритроциты и мембраны клеток печени, путем изменения фосфолипидов, холестерина и гликолипидных компонентов21. Эти более сложные многолипидные везикулы могут потребовать дополнительных методов для достижения разрыва везикул, в зависимости от липидного состава. Например, в предыдущих исследованиях использовался α-спиральный (АГ) пептид, полученный из неструктурного белка 5А вируса гепатита С, чтобы индуцировать образование бислоя путем дестабилизации адсорбированных липидных везикул22,23. Используя этот пептид AH, ранее были сформированы поддерживаемые липидные бислои, имитирующие плацентарные клетки24. Большой потенциал поддерживаемых липидных бислоев для биомедицинских применений был продемонстрирован с помощью исследований, охватывающих перенос молекул и наночастиц25,26,токсикантные взаимодействия окружающей среды27,сборку и функцию белка17,18,19,расположение и введение пептидов28,29,скрининг лекарств30и микрофлюидные платформы31.
Взвешенные липидные бислои были использованы для фармацевтических скрининговых исследований с помощью параллельного искусственного анализа проницаемости мембран (PAMPA), где липидный бислой подвешен через пористую гидрофобную вставку32,33,34,35. Липидные модели PAMPA были разработаны для различных биологических интерфейсов, включая кровяно-мозговой, буккальный, кишечный и трансдермальный интерфейсы36. Комбинируя как поддерживаемый липидный бислой, так и методы PAMPA, можно тщательно изучить адсорбцию, проницаемость и встраивание соединений в липидные компоненты желаемого типа ткани или клеток.
Этот протокол описывает изготовление и применение моделей липидных бислоев клеточной мембраны in vitro для исследования нескольких молекулярных взаимодействий. Подробно описано получение как однолипидных, так и мультилипидных поддерживаемых и взвешенных липидных бислоев. Чтобы сформировать поддерживаемый липидный бислой, липидные везикулы сначала разрабатываются с использованием тонкопленочных методов гидратации и экструзии с последующей физико-химической характеристикой. Обсуждается формирование поддерживаемого липидного бислоя с использованием мониторинга QCM-D и изготовление взвешенных липидных мембран для использования в PAMPA. Наконец, исследуются многолипидные везикулы для развития более сложных клеточных имитирующих мембран. Используя оба типа изготовленных липидных мембран, этот протокол демонстрирует, как этот инструмент может быть использован для изучения молекулярных взаимодействий. В целом, этот метод конструирует клетки, имитирующие липидные бислои с высокой воспроизводимостью и универсальностью.
протокол
1. Развитие однолипидных везикул
- Метод тонкопленочной гидратации
- Приготовление и хранение растворов липидного сырья
ПРИМЕЧАНИЕ: Все этапы с использованием хлороформа должны выполняться в химической вытяжке. Хлороформ всегда следует пипетировать с использованием безопасных для растворителей наконечников пипеток из углеродного волокна. Растворы, содержащие хлороформ, всегда следует хранить в стеклянных флаконах.- Приготовьте раствор липидов 10 мг/мл, добавив соответствующий объем хлороформа во флакон, содержащий липидный порошок, и хорошо перемешайте. Например, добавьте 20 мл хлороформа к 200 мг L-α-фосфатидилхолина (яйцо, курица) (eggPC). При необходимости исходный раствор может быть изготовлен в другой концентрации.
ПРИМЕЧАНИЕ: Если порошок липида хранили в ампуле, то после добавления хлороформа перенос в стеклянный флакон с крышкой из политетрафторэтилена (PTFE). - Запечатайте крышку флакона парапленкой и храните при температуре -20 °C до 6 месяцев.
- Приготовьте раствор липидов 10 мг/мл, добавив соответствующий объем хлороформа во флакон, содержащий липидный порошок, и хорошо перемешайте. Например, добавьте 20 мл хлороформа к 200 мг L-α-фосфатидилхолина (яйцо, курица) (eggPC). При необходимости исходный раствор может быть изготовлен в другой концентрации.
- Образование сухо-липидной пленки
- Добавьте соответствующий объем раствора липидов в чистый стеклянный флакон, необходимый для окончательной концентрации пузырьков 2,5 мг/мл. Например, для образования 1 мл везикул яичного ПК по 2,5 мг/мл пипетки 250 мкл раствора яичного ПК во флакон.
ПРИМЕЧАНИЕ: Подготовленный объем может зависеть от используемого процесса экструдера (см. этап 1.3). Максимальный рекомендуемый объем мини-экструдера составляет 1 мл, в то время как большой диапазон объема экструдера составляет 5-50 мл. - Удалите хлороформ из раствора липидного сырья с помощью потока газаN2 (сверхчистый сорт 5,0).
- Чтобы обеспечить полное удаление хлороформа, соедините высушенную липидную пленку с вакуумом и оставьте не менее чем на 4 ч.
ПРИМЕЧАНИЕ: Процесс может быть остановлен здесь. Если липидная пленка не будет использована сразу после вакуумной сушки, храните в осушителе до использования. Мы наблюдали, что эти липидные пленки дают аналогичные по качеству везикулы после 1 недели хранения в этих условиях; при необходимости следует дополнительно изучить качество пузырьков после увеличения продолжительности хранения.
- Добавьте соответствующий объем раствора липидов в чистый стеклянный флакон, необходимый для окончательной концентрации пузырьков 2,5 мг/мл. Например, для образования 1 мл везикул яичного ПК по 2,5 мг/мл пипетки 250 мкл раствора яичного ПК во флакон.
- Выполнение циклов замораживания-оттаивания-вихря
- Готовят буферный раствор Tris натрия хлорида (NaCl), содержащий 10 мМ основания Tris и 100 мМ NaCl. Регидратировать высушенную липидную пленку требуемым объемом буфера Tris NaCl с получением конечной концентрации пузырьков 2,5 мг/мл и вихря в течение приблизительно 15-30 с.
- Переложите везикулярную суспензию в емкость с сухим льдом до замерзания, примерно 30 мин. После того, как образец будет полностью заморожен, разморозьте суспензию на водяной бане при температуре 30-40 °C. Вихревая размороженная везикулярная суспензия.
ПРИМЕЧАНИЕ: Жидкость N2 может использоваться вместо сухого льда. Перенесите везикулярную суспензию в жидкий азот на 30 с, а затем сразу же разморозьте на водяной бане при температуре 80°C. - Повторите этап 1.1.3.2 еще 4 раза, в общей сложности 5 циклов замораживания-оттаивания-вихря.
- Приготовление и хранение растворов липидного сырья
- Экструзия
ПРИМЕЧАНИЕ: После завершения циклов замораживания-оттаивания-вихря образуются многоламеллярные везикулы. Экструзия способствует уменьшению размера и развитию больших одноламеллярных везикул.- Мини (1 мл) экструдерный процесс
- Тщательно очистите все компоненты экструдера, используя мягкое моющее средство в сверхчистой воде, и промойте не менее трех раз сверхчистой водой, гарантируя, что все моющее средство будет удалено. Сухая с помощью газа N2.
- Соберите две внутренние мембранные опоры и уплотнительные кольца (внутренний диаметр 12,7 мм; наружный диаметр 15,2 мм). Расположите каждую мембранную опору так, чтобы уплотнительное кольцо было обращено вверх.
- Предварительно смочите фильтр опорой сверхчистой водой. Поместите его на опорную поверхность мембраны внутри уплотнительного кольца. Повторите для второй внутренней мембранной опоры.
- Поместите одну внутреннюю мембранную опору во внешний корпус экструдера. Поместите одну 100-нм поликарбонатную мембрану на внутреннюю мембранную опору непосредственно над опорой фильтра.
ПРИМЕЧАНИЕ: Поликарбонатные мембраны хранятся отдельно между кусками бумаги синего цвета. Снимите разделительную бумагу перед вставкой на мембранную опору. - Поместите вторую внутреннюю мембранную опору во внешний корпус экструдера с уплотнительным кольцом и опорой фильтра лицом к поликарбонатной мембране. Прикрепите подшипник из PTFE к стопорной гайке и закройте шнек наружным корпусом экструдера. Закрепите экструдер в нагревательном блоке.
- Загрузите суспензию липидного пузырька в один из шприцев и поместите шприц в тепловой блок экструдера, полностью вставив иглу в один конец экструдера. Вставьте второй, пустой шприц в противоположную сторону и зафиксируйте оба шприца с помощью зажимов на тепловом блоке.
ПРИМЕЧАНИЕ: При необходимости поместите тепловой блок экструдера на конфорку и установите температуру выше температуры перехода липида. Вставьте термометр в держатель, встроенный в тепловой блок, для точных показаний температуры и подождите, пока не будет достигнута необходимая температура (~ 15 мин). Липидные везикулы Egg PC не требуют нагрева во время экструзии. - Медленно протолкните везикулярную суспензию в пустой шприц, а затем обратно в исходный шприц. Следите за изменениями давления на протяжении всей экструзии, которые указывают на утечку. Повторите еще 20 раз, в общей сложности 21 проход через поликарбонатную мембрану. Переложите липидные пузырьки в чистый стеклянный флакон для хранения.
ПРИМЕЧАНИЕ: Количество экструзий может быть оптимизировано в зависимости от липидного состава. - Если было использовано тепло, позвольте экструдированной везикулярной суспензии достичь комнатной температуры. Хранить экструдированные липидные везикулы при 4 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Рекомендуемая продолжительность хранения везикул сильно зависит от липидного состава, и физико-химические свойства пузырьков (например, гидродинамический диаметр, дзета-потенциал) должны контролироваться с течением времени. Например, яичные везикулы PC хранились в течение не менее двух недель без изменения размера везикул или способности к образованию двух слоев.
- Большой (5-50 мл) экструдерный процесс
ПРИМЕЧАНИЕ: Выполните шаги 1.2.2.1-1.2.2.5, если для выбранного липида требуется тепло. Перейдите к шагу 1.2.2.5, если тепло не требуется. Этапы 1.2.2.1-1.2.2.4 не требуются для ПК для яиц.- Наполните колбу объемом 1 л водой обратного осмоса (RO).
ПРИМЕЧАНИЕ: Не используйте сверхчистую воду для циркуляции через систему 50 мл, так как это может привести к выщелачиванию ионов металлов из цилиндра экструдера. - Поместите колбу объемом 1 л на водяную баню на конфорке и установите температуру конфорки выше температуры перехода липида.
- Прикрепите цилиндр для образцов к колбе с помощью гибкой трубки через входное отверстие на цилиндре для образцов. Прикрепите трубку на выходе цилиндра к верхней части колбы объемом 1 л. При необходимости закрепите трубку как на входе, так и на выходе. Это создаст однонаправленный поток воды через цилиндр образца.
- Включите насос, чтобы начать циркуляцию воды. Если требуется тепло, подождите примерно 30-45 минут, чтобы цилиндр образца достиг желаемой температуры.
- Подключите крышку цилиндра для отбора проб к резервуару для азота через гибкий разъем, прикрепленный к блоку предохранительного клапана.
- Очистите все части экструдера 50 мл с 70% (v/v) этанолом.
- Соберите экструдер, поместив большую опору отверстия, спеченный диск, дренажные диски и поликарбонатную мембрану в пространство нижней опоры экструдера. Соедините верхнюю и нижнюю опоры экструдера с помощью четырех винтов и затяните.
- Прикрепите блок экструдера к цилиндру для отбора проб путем привинчивания к дну и затяжки с помощью гаечного ключа для закрепления.
ПРИМЕЧАНИЕ: Если используется тепло, поместите термометр в цилиндр и подождите, пока вода не достигнет желаемой температуры, прежде чем продолжить. Это обеспечит поддержание температуры образца на протяжении всего процесса экструзии. - Наполните цилиндр для проб сверхчистой водой. Экструдируйте воду через блок экструдера перед добавлением образца в цилиндр для образцов. Это делается для предварительного намокания мембран, аналогично мини-экструдера.
ПРИМЕЧАНИЕ: Убедитесь, что крышка полностью завинчена, а предохранительный клапан полностью закрыт перед включением азота. Для этого шага требуется минимальное давление (~5-10 фунтов на кв. дюйм). - Добавьте суспензию липидного пузырька в цилиндр для образцов и прикрутите верхнюю закрытую часть. Медленно увеличивайте давление до тех пор, пока образец не начнет капать из экструдера со скоростью примерно 2-3 капли/с в чистый стеклянный флакон.
ПРИМЕЧАНИЕ: Не увеличивайте давление быстро на этом этапе, так как слишком большое давление может негативно повлиять на мембраны и привести к неудачной экструзии. - После того, как весь образец будет экструдирован, выключите подачу N2 и отпустите давление в цилиндре для образцов, медленно открывая предохранительный клапан. Перелейте липидные везикулы обратно в цилиндр для образцов и повторите этап 1.2.2.11 еще 9 раз, в общей сложности 10 экструзий.
ПРИМЕЧАНИЕ: Требуемое давление для экструзии может уменьшаться с увеличением числа экструзий, поскольку образец становится более однородным и приближающимся по размеру к размеру пор поликарбонатной мембраны. - Хранить экструдированную липидную везикулярную суспензию при 4 °C до дальнейшего использования.
- Наполните колбу объемом 1 л водой обратного осмоса (RO).
- Мини (1 мл) экструдерный процесс
2. Характеристика липидных пузырьков
- Измерение гидродинамического диаметра с использованием динамического рассеяния света (DLS)
- Вихревые липидные везикулы и пипетка 50 мкл липидной везикулярной суспензии в одноразовый малообъемный кювет. Чехол для предотвращения загрязнения пылью и мусором.
- Загрузите везикулярную суспензию в прибор DLS, введите детали образца и выполните измерение с помощью соответствующего программного обеспечения.
- Дзетский потенциал
- Подготовьте сложенную капиллярную дзета-клетку, промыв ее сверхчистой водой, 70% этанолом и сверхчистой водой с помощью шприцев, которые соединяются со входами ячейки. Осторожно протолкните жидкость через клетку 3-4 раза и полностью опорожните клетку перед переходом на следующий раствор.
- Вихрь липидных пузырьков и приготовьте 1:10 (v/v) разведение липидных пузырьков в сверхчистой воде.
- Загрузить разбавленную липидную везикулярную суспензию. Удалите пузырьки воздуха, толкая подвеску вперед и назад между шприцами. Прикрепите пробки к каждому входу.
ПРИМЕЧАНИЕ: Крайне важно удалить все пузырьки, так как это повлияет на измерение. - Поместите дзета-ячейку в камеру для отбора проб, убедившись, что электроды находятся в контакте. Закройте верхнюю часть камеры для отбора проб. В соответствующем программном обеспечении введите сведения о образце и соберите данные измерения.
3. Формирование липидного бислоя с поддержкой унилипидов с помощью QCM-D
- Приготовление раствора
- Приготовьте 2% (мас./об.) раствор додецилсульфата натрия (SDS) в сверхчистой воде. Перемешать на перемешиваемой пластине до полного растворения. Рабочие растворы Aliquot не менее 10 мл сверхчистой воды, 2% SDS и Tris NaCl.
- Приготовьте разведение липидных пузырьков в буфере Tris NaCl. Концентрация везикул зависит от применения. Было показано, что для яичного ПК концентрации в диапазоне 0,01-0,5 мг/мл приводят к успешному образованию липидных бислоев.
- Очистка кварцевых кристаллических датчиков с кремнеземным покрытием
ПРИМЕЧАНИЕ: Очистка кристаллов QCM-D зависит от материала поверхности используемого датчика. Для образования поддерживаемых липидных бислоев в этом протоколе используются кристаллы кварца с кремнеземным покрытием, которые подробно описаны ниже, как адаптировано из стандартной операционной процедуры производителя.- Вставьте кварцевый кристаллический датчик с кремнеземным покрытием в модуль потока, гарантируя, что «t» на кристалле совпадает с «t» на модуле. Прикрутите модуль потока закрытым.
ПРИМЕЧАНИЕ: Если используемый QCM-D позволяет подключать и запускать несколько модулей потока одновременно, повторите следующие процедуры для дополнительных модулей по мере необходимости. - Вставьте проточный модуль в основание прибора с электродами из проточного модуля, соединяющимися с системой анализатора. Зафиксируйте модуль на месте.
- Подключите впускную и выпускную трубки к проточному модулю и насосу. Поместите трубку в удерживающую кожухи и закройте крышку анализаторной системы. Поместите контейнер для отходов на выходе из насоса для сбора отработанных растворов.
- Чтобы выполнить очистку, сначала включите насос. Установите скорость потока на 400 мкл/мин. Вставьте впускную трубку в сверхчистую воду и протейте через модуль 5-10 мл.
- Переключите впускную трубку в 2% SDS и протейте через модуль 5-10 мл. Переключите впускную трубку обратно в сверхчистую воду и протейте через модуль 10-20 мл. Извлеките впускную трубку из раствора и пропустите воздух через трубку до тех пор, пока вся жидкость не будет выброшена.
ПРИМЕЧАНИЕ: Приведенный выше протокол очистки используется ежедневно до и после каждого измерения. Тщательная очистка может быть выполнена по мере необходимости. Вкратце, чтобы выполнить тщательную очистку, разберите проточные модули. Все компоненты, за исключением электродной стороны проточного модуля, должны быть погружены в 2% (мас./об.) SDS и ванна обработана ультразвуком с последующим тщательным промывкой сверхчистой водой и сушкой струей газаN2. Компонент проточного модуля, содержащий электродные штифты, никогда не должен контактировать с жидкостью. - Извлеките датчик из модуля потока и промойте датчик сверхчистой водой. Высушите датчик с помощью потока газа N2. Высушите проточный модуль потокомN2. Убедитесь, что электрод всегда остается свободным от любой жидкости.
- В вытяжку с химическим дымом вставьте кварцевый кристаллический датчик с кремнеземным покрытием в ультрафиолетовый (УФ)/озоноочистительный прибор. Включите инструмент и оставьте обработку не менее 2 минут. Осторожно извлеките датчики и вернитесь в модуль потока.
- Вставьте кварцевый кристаллический датчик с кремнеземным покрытием в модуль потока, гарантируя, что «t» на кристалле совпадает с «t» на модуле. Прикрутите модуль потока закрытым.
- Формирование базовой линии Tris NaCl
- Включите анализатор для подключения к соответствующему программному обеспечению и установите температуру на желаемое значение для поддерживаемого липидного бислоя. Позвольте температуре стабилизироваться до нужного входа.
ПРИМЕЧАНИЕ: Если установленная температура выше комнатной, все растворы следует нагревать до одинаковой температуры с помощью теплового блока. - Настройте измерение и найдите все резонансные частоты и диссипации датчиков для обертонов 3, 5, 7, 9, 11 и 13 перед началом измерения.
ПРИМЕЧАНИЕ:1-й обертон можно игнорировать, так как эта гармоника чрезмерно чувствительна и производит шумные данные. - Включите насос и установите скорость потока на 175 мкл/мин или желаемую экспериментальную скорость потока.
- Протрите впускную трубку этанолом перед введением в Tris NaCl. Начните измерение и начните течь Tris NaCl.
ПРИМЕЧАНИЕ: Данные собираются и контролируются в режиме реального времени. Переход от воздуха к жидкости в модуле потока будет наблюдаться в программном обеспечении для сбора данных путем быстрого увеличения изменения диссипации(ΔD)и уменьшения изменения частоты(ΔF). - Позвольте Tris NaCl протекать через модуль в течение 5-10 минут, гарантируя, что исходные значения ΔF и ΔD в жидкости остаются стабильными.
- Включите анализатор для подключения к соответствующему программному обеспечению и установите температуру на желаемое значение для поддерживаемого липидного бислоя. Позвольте температуре стабилизироваться до нужного входа.
- Образование однолипидного поддерживаемого липидного бислоя
- Остановите насос и извлеките впускную трубку из раствора Tris NaCl и осторожно вставьте в раствор липидного пузырька. Обратный поток в течение 5 с, чтобы удалить любые пузырьки воздуха из входной трубки, а затем продолжить прямой поток. Перезапустите измерение в программном обеспечении, чтобы свести к нулю базовый уровень.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы избежать пузырьков воздуха в трубке, которые могут протекать через модуль и нарушать формирование бислоя и запись данных. - Протекание липидных везикул до образования бислоя наблюдается в режиме реального времени в программном обеспечении для сбора данных (не менее 8 мин для везикул яйцеклетки ПК).
- Повторите шаг 3.4.1, чтобы изменить впускную трубку из липидных пузырьков обратно в буфер Tris NaCl.
ПРИМЕЧАНИЕ: Если желаемое приложение заключается в изучении молекулярных взаимодействий, перейдите непосредственно к шагу 6.1 без остановки потока раствора или сбора данных. Если конечной точкой является двухслойное формирование, перейдите к шагу 3.4.4. - В программном обеспечении остановите измерение и сохраните файл. Остановите насос.
- Очистите модуль потока и кварцевый кристаллический датчик с кремнеземным покрытием в соответствии с этапами протокола 3.2.4 и 3.2.5.
- Остановите насос и извлеките впускную трубку из раствора Tris NaCl и осторожно вставьте в раствор липидного пузырька. Обратный поток в течение 5 с, чтобы удалить любые пузырьки воздуха из входной трубки, а затем продолжить прямой поток. Перезапустите измерение в программном обеспечении, чтобы свести к нулю базовый уровень.
4. Образование взвешенного липидного бислоя
ПРИМЕЧАНИЕ: Протокол формирования взвешенного липидного бислоя адаптирован из параллельного искусственного анализа проницаемости мембран (PAMPA), предоставленного производителем фильтрующей пластины37.
- Солюбилизируйте желаемый липид в додекане при 20 мг/мл (например, 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC)).
- Добавьте 5 мкл липидного раствора в донорский отсек, который представляет собой пористый поливинилидендифторид (PVDF) 96-луночной многоэкранной фильтрующей пластины (размер пор 0,45 мкм).
- Немедленно погрузите фильтрующую пластину в отсек акцептора, который представляет собой транспортную приемную пластину, содержащую 300 мкл 1× фосфатного буферизованного физиологического раствора (PBS). Добавьте 200 мкл 1× PBS в донорский отсек.
ПРИМЕЧАНИЕ: Элементы управления фильтрами только с липидными и необработанными фильтрами, подвергающимися воздействию 1× PBS, могут быть включены. - Переходим непосредственно к разделу 6.2 для исследования молекулярных взаимодействий с взвешенным липидным бислоем. Рекомендуется завершить исследование в течение 16 ч после формирования взвешенного бислоя.
5. Развитие мультилипидных клеток, имитирующих везикулы и бислои
- Извлечение липидов из клеток млекопитающих
ПРИМЕЧАНИЕ: Экстракция липидов следует подходу Блай-Дайера38.- При необходимости культивируйте нужную клеточную линию. После достижения 70-80% слияния (колба Т75) отделяют клетки с помощью трипсина-этилендиаминетретауксусной кислоты при 37 °C в течение 5 мин.
- Центрифужные ячейки по 200 × г в течение 5 мин. Удалите супернатант и повторно суспендируйте гранулу клетки в 1 мл сверхчистой воды.
- Добавляйте 3,75 мл смеси хлороформ:метанол 1:2 (v/v) в клеточную суспензию и вихрь в течение 15 мин. Затем добавьте 1,25 мл хлороформа и вихрь в течение 1 мин. Наконец, добавьте 1,25 мл воды и вихря в течение 1 мин.
- Смесь центрифужных клеток при 1000 х г в течение 10 мин. Соберите нижний слой жидкости, которая содержит липиды в органической фазе. Высушите под струей газаN2.
- Количественная оценка содержания липидов с помощью жидкостной хроматографии-масс-спектрометрии (LC-MS) с использованием обратной фазы C18, 3,5 мкм × колонки 50 мм.
- Для подвижной фазы готовят два раствора, первый с 60:40 (v/v) ацетонитрилом:вода и второй с 90:10 (v/v) изопропанолом:ацетонитрилом. Формиат аммония следует добавлять в оба раствора в конечной концентрации 10 мМ. В течение 60 мин увеличивают градиент подвижной фазы с 35% (v/v) второго раствора до 95% (v/v).
- Обнаружение сточных вод в режиме отрицательной ионизации с последовательным полным сканированием MS и тандема MS / MS. Идентифицируйте отдельные виды фосфолипидов по их соотношению массы к заряду (m / z). Анализ масс-спектров от фрагментации диссоциации, вызванной столкновением, с помощью инструментов масс-спектрометрического анализа LIPID MAPS. Получают экстрагированные ионные хроматограммы для интеграции площади под кривой, определяя численность каждого вида липидов.
- Выполнить шаги 5.1.5-5.1.7 для липидного стандарта, содержащего основные классы липидов, для определения относительной чувствительности обнаружения для каждого отдельного класса фосфолипидов.
- Развитие мультилипидных везикул
- Выполните действия, описанные в разделе 1.1.1, для получения растворов липидного сырья для липидов, представляющих каждый желаемый двухслойный компонент, как указано на этапе 5.1.
- На основе липидных композиций, полученных на стадии 5.1, добавляют соответствующий объем липидного/хлороформного запаса в чистый стеклянный флакон, необходимый для конечной концентрации пузырьков 2,5 мг/мл. Удаляют сыпучий раствор хлороформа для сушки под струей газаN2.
- Выполните шаги 1.1.2, 1.1.3 и 1.2, чтобы сформировать многолипидные везикулы. Выполните шаг 2 для определения характеристик везикул.
- Формирование многолипидного поддерживаемого липидного бислоя с помощью QCM-D
ПРИМЕЧАНИЕ: Некоторые многолипидные везикулы могут привести к спонтанному разрыву липидного пузырька и образованию бислоя, аналогичного однолипидным везикулам ПК, представленным на этапе 3. Однако более сложные многолипидные везикулы могут потребовать внешнего ввода, чтобы помочь в разрыве пузырьков. Здесь пептид АГ используется для дестабилизации внешнего листка пузырька везикулы, что приводит к образованию бислоя. При желании могут быть рассмотрены и другие методы достижения дестабилизации и разрыва пузырьков.- Следуйте шагу 3, чтобы сформировать многолипидный липидный бислой, использующий многолипидные везикулы, сформированные на этапе 5.2.
- Если спонтанного разрыва везикул на бислой не наблюдается, попробуйте дестабилизацию пузырьков с помощью пептида АГ. Получают пептид AH (пептидная последовательность: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Cys−Thr−Val−Asp−Phe−Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2)раствор на 13 мкм в Tris NaCl с 1% (v/v) диметилсульфоксидом, ДМСО.
- Выполните шаги 3.4.1-3.4.3. После этапа 3.4.3 замените впускную трубку на пептидный раствор АГ. Вводите раствор в модуль потока до тех пор, пока ΔF и ΔD не будут наблюдаться из нового добавления раствора. Остановите насос и дайте пептиду АГ инкубироваться с везикулами в течение 10 мин.
- Переключите впускную трубку в Tris NaCl и запустите поток для удаления пептида AH из разорванных пузырьков, что приведет к успешному образованию липидного бислоя.
ПРИМЕЧАНИЕ: Если желаемое приложение заключается в изучении молекулярных взаимодействий, продолжайте направление к шагу 6.1 без остановки потока раствора или сбора данных. - В программном обеспечении остановите измерение и сохраните файл. Остановите насос.
- Очистите модуль потока и кварцевый кристаллический датчик с кремнеземным покрытием в соответствии с этапами протокола 3.2.4-3.2.6.
- Взвешенные многолипидные бислои
- Солюбилизируйте смесь желаемых липидов в додекане при 20 мг/мл.
- Составляем раствор липидной смеси объемом 5 мкл, используя желаемую клеточную композицию.
- Выполните шаги 4.2 и 4.3.
ПРИМЕЧАНИЕ: Переходим непосредственно к шагу 6.2 для исследования молекулярных взаимодействий с взвешенным липидным бислоем.
6. Исследования взаимодействия молекул с однолипидными и мультилипидными бислоями
- Изучение молекулярных взаимодействий с поддерживаемым липидным бислоем с использованием QCM-D
- Готовят раствор нужной молекулы для исследования адсорбции с поддерживаемым липидным бислоем. Например, готовят раствор 200 мкМ ди(2-этилгексил)фталата (DEHP) в Tris NaCl с 1% (v/v) DMSO.
- Если молекулярный раствор приготовлен в Tris NaCl, он может протекать непосредственно после этапа 3.4.3 для однолипидного бислоя или 5.3.4 для многолипидного бислоя. Если молекула должна быть приготовлена в другом растворителе, вместо этого вставьте впускную трубку в желаемый растворитель отдельно в течение, по меньшей мере, 5 мин (например, Tris NaCl с 1% (v/v) DMSO для DEHP).
ПРИМЕЧАНИЕ: Изменения вязкости, обусловленные растворителем, можно контролировать и учитывать путем протекания его до и после введения интересующей молекулы. - Переключите впускную трубку в раствор, содержащий интересующую молекулу, и течь в течение не менее 5 мин. Поток также может быть остановлен и жидкости, содержащей желаемую молекулу, позволено инкубироваться с бислоем, если это необходимо.
- Замените впускную трубку обратно на молекулярный растворитель, если что-то отличное от Tris NaCl. Расходите не менее 5 мин. Затем переключите впускную трубку в Tris NaCl и проточите не менее 5 минут.
- В программном обеспечении остановите измерение и сохраните файл. Остановите насос.
- Очистите модуль потока и кварцевый кристаллический датчик с кремнеземным покрытием в соответствии с этапами протокола 3.2.4-3.2.6.
- Изучение молекулярных взаимодействий с взвешенными липидными бислоями с помощью PAMPA
- Приготовьте раствор нужной молекулы. Например, подготовьте 200 мкМ DEHP в 1× PBS с 1% (v/v) DMSO.
- Подготовьте новую транспортную приемную пластину с 300 мкл свежего 1x PBS на скважину.
- Сразу после этапа 3.3 для однолипидного взвешенного бислоя или 4.4.3 для многолипидного взвешенного бислоя удалите 1× PBS из донорского отсека многоэкранной фильтрующей пластины и замените 200 мкл испытательного раствора. Немедленно погрузить в транспортную приемную коробку, подготовленную на этапе 6.2.2.
- Инкубировать с мягким раскачиванием в течение желаемого количества времени (например, 2 ч) при 25 °C.
- После инкубации собирают 150 мкл раствора из донорского и акцепторного отсеков. Измерьте концентрацию молекулы в обоих образцах с помощью соответствующего метода, основанного на свойствах этой молекулы.
- Например, используйте микропластинчатый спектрофотометр с соответствующей длиной волны поглощения, такой как 280 нм для DEHP, и сравните со стандартной кривой интересующей молекулы.
- Рассчитайте кажущуюся проницаемость(приложениеP) интересующей молекулы, используя следующие уравнения:
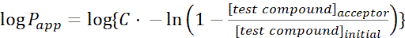 (1)
(1)
Где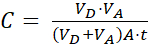 (2)
(2)
ПРИМЕЧАНИЕ: [испытательное соединение]акцептор представляет собой концентрацию интересующей молекулы (например, DEHP) в момент времени, t, в акцепторном отсеке; и [тестовое соединение]начальное — начальная концентрация молекулы. A - площадь мембраны, t - время, VD - объем донорского отсека, а VA - объем акцепторного отсека.
Результаты
Этот протокол детализирует методы формирования поддерживаемых и взвешенных липидных бислоев(рисунок 1). Первым шагом к формированию поддерживаемого липидного бислоя является развитие липидных пузырьков. Мини-экструдер позволяет готовить небольшие объемы липидных пу...
Обсуждение
Этот протокол позволяет образовывать липидные везикулы, поддерживаемые липидные бислои и взвешенные липидные бислои. Здесь представлены критические шаги для формирования каждой из этих структур. При образовании липидных пузырьков важно экструдировать выше температуры перехода лип?...
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов или конкурирующих финансовых интересов.
Благодарности
Этот материал основан на работе, поддержанной Национальным научным фондом в рамках гранта No 1942418 присужденного A.S., и стипендии Национального научного фонда для аспирантов, присужденной C.M.B.H., в соответствии с грантом No 1644760. Любые мнения, выводы, выводы или рекомендации, выраженные в этом материале, принадлежат авторам и не обязательно отражают взгляды Национального научного фонда. Авторы благодарят доктора Ноэля Веру-Гонсалеса за получение данных о характеристике липидных пузырьков. Авторы благодарят профессора Роберта Херта (Университет Брауна) за использование его Zetasizer. Авторы благодарят Центр масс-спектрометрии Университета Брауна, в частности, доктора Тун-Ли Шена за помощь в количественной оценке липидного состава.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Ссылки
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены