Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Assemblage de modèles de bicouches lipidiques supportées et suspendues imitant des cellules pour l’étude des interactions moléculaires
Dans cet article
Résumé
Ce protocole décrit la formation de cellules imitant les vésicules unilipidiques et multilipidiques, les bicouches lipidiques soutenues et les bicouches lipidiques en suspension. Ces modèles in vitro peuvent être adaptés pour incorporer une variété de types de lipides et peuvent être utilisés pour étudier diverses interactions entre molécules et macromolécules.
Résumé
Les membranes cellulaires modèles sont un outil de dépistage utile avec des applications allant de la découverte précoce de médicaments aux études de toxicité. La membrane cellulaire est une barrière protectrice cruciale pour tous les types de cellules, séparant les composants cellulaires internes de l’environnement extracellulaire. Ces membranes sont composées en grande partie d’une bicouche lipidique, qui contient des groupes de tête hydrophile externe et des groupes de queue hydrophobes internes, ainsi que diverses protéines et cholestérol. La composition et la structure des lipides eux-mêmes jouent un rôle crucial dans la régulation de la fonction biologique, y compris les interactions entre les cellules et le microenvironnement cellulaire, qui peut contenir des produits pharmaceutiques, des toxines biologiques et des toxiques environnementaux. Dans cette étude, des méthodes pour formuler des bicouches unilipidiques et multilipidiques soutenues et en suspension imitant les cellules lipidiques sont décrites. Auparavant, des bicouches lipidiques unilipidiques phosphatidylcholine (PC) ainsi que des bicouches lipidiques multilipidiques inspirées du trophoblaste placentaire ont été développées pour être utilisées dans la compréhension des interactions moléculaires. Ici, les méthodes pour réaliser les deux types de modèles bicouches seront présentées. Pour les cellules imitant les bicouches multilipidiques, la composition lipidique souhaitée est d’abord déterminée par extraction lipidique à partir de cellules primaires ou de lignées cellulaires, suivie d’une chromatographie liquide-spectrométrie de masse (LC-MS). En utilisant cette composition, les vésicules lipidiques sont fabriquées à l’aide d’une méthode d’hydratation et d’extrusion en couche mince et leur diamètre hydrodynamique et leur potentiel zêta sont caractérisés. Les bicouches lipidiques supportées et en suspension peuvent ensuite être formées à l’aide d’une microbalance à cristaux de quartz avec surveillance de la dissipation (QCM-D) et sur une membrane poreuse pour une utilisation dans un test de perméabilité à membrane artificielle parallèle (PAMPA), respectivement. Les résultats représentatifs mettent en évidence la reproductibilité et la polyvalence des modèles de bicouches lipidiques de membrane cellulaire in vitro. Les méthodes présentées peuvent aider à évaluer rapidement et facilement les mécanismes d’interaction, tels que la perméation, l’adsorption et l’incorporation, de diverses molécules et macromolécules avec une membrane cellulaire, aidant ainsi au dépistage des candidats médicaments et à la prédiction de la toxicité cellulaire potentielle.
Introduction
La membrane cellulaire, composée principalement de phospholipides, de cholestérol et de protéines, est un composant crucial de toutes les cellules vivantes1. Avec une organisation guidée par l’amphiphilie lipidique, la membrane cellulaire fonctionne comme une barrière protectrice et régule la façon dont la cellule interagit avec son environnementenvironnant 2. Plusieurs processus cellulaires dépendent de la composition lipidique et protéique de la membrane1,2. Par exemple, les interactions de la membrane cellulaire sont importantes pour une administration efficace des médicaments3. Les produits pharmaceutiques, les produits biologiques, les nanomatériaux, les toxines biologiques et les toxiques environnementaux peuvent avoir un impact sur l’intégrité d’une membrane cellulaire, affectant ainsi la fonction cellulaire4. La construction de modèles membranaires imitant les cellules in vitro basés sur la composition lipidique des membranes cellulaires a le potentiel de fournir des outils faciles pour améliorer considérablement l’étude de l’impact potentiel de ces matériaux sur les cellules.
Les bicouches lipidiques modèles comprennent les vésicules lipidiques, les bicouches lipidiques supportées et les bicouches lipidiques en suspension. Les bicouches lipidiques supportées sont un modèle de la membrane cellulaire phospholipide couramment utilisée dans les applications biotechnologiques où les vésicules lipidiques sont rompues sur un matériau de substratsupporté5,6,7,8,9. Une technique couramment utilisée pour surveiller la formation de bicouches est la microbalance de cristaux de quartz avec surveillance de la dissipation (QCM-D), qui examine l’adsorption des vésicules par rapport aux propriétés liquides en vrac in situ8,10,11,12,13,14 . Auparavant, QCM-D a été utilisé pour démontrer que dans des conditions d’écoulement, une fois qu’une couverture vésiculaire critique des vésicules lipidiques phosphatidylcholine (PC) est obtenue à la surface, elles se rompent spontanément en bicouches lipidiques rigides15. Des travaux antérieurs ont également étudié la formation de bicouches lipidiques soutenues avec des compositions lipidiques variables16,l’incorporation de protéines lipidiques17,18,19et l’utilisation de coussins polymères20,produisant des bicouches lipidiques supportées capables d’imiter divers aspects de la fonction de la membrane cellulaire.
Les bicouches lipidiques ont été utilisées pour imiter diverses barrières biologiques allant des niveaux subcellulaires aux niveaux d’organes, y compris la mitochondrie, les globules rouges et les membranes des cellules hépatiques en modifiant les composants phospholipides, cholestérol et glycolipides21. Ces vésicules multilipidiques plus complexes peuvent nécessiter des méthodes supplémentaires pour obtenir une rupture de vésicule, en fonction de la composition lipidique. Par exemple, des études antérieures ont utilisé un peptide α-hélicoïdal (AH) dérivé de la protéine non structurelle 5A du virus de l’hépatite C pour induire la formation de bicouches en déstabilisant les vésicules lipidiques adsorbées22,23. En utilisant ce peptide AH, des bicouches lipidiques supportées imitant les cellules placentaires ont déjà été formées24. Le grand potentiel des bicouches lipidiques supportées pour des applications biomédicales a été démontré avec des études couvrant le transport moléculaire et de nanoparticules25,26, les interactions toxiquesenvironnementales 27, l’assemblage et la fonction des protéines17,18,19, l’arrangement et l’insertion peptidiques28,29, le dépistage demédicaments 30, et les plates-formes microfluidiques31.
Les bicouches lipidiques en suspension ont été utilisées pour des études de criblage pharmaceutique via un test parallèle de perméabilité de la membrane artificielle (PAMPA) où une bicouche lipidique est suspendue à travers un insert hydrophobe poreux32,33,34,35. Des modèles lipidiques PAMPA ont été développés pour différentes interfaces biologiques, y compris les interfaces sang-cerveau, buccale, intestinale et transdermique36. En combinant à la fois les techniques de bicouche lipidique et de PAMPA, l’adsorption, la perméabilité et l’incorporation de composés dans les composants lipidiques d’un type de tissu ou de cellule souhaité peuvent être étudiés en profondeur.
Ce protocole décrit la fabrication et l’application de modèles de bicouches lipidiques de membrane cellulaire in vitro pour étudier plusieurs interactions moléculaires. La préparation des bicouches unilipidiques et multilipidiques soutenues et en suspension est détaillée. Pour former une bicouche lipidique supportée, les vésicules lipidiques sont d’abord développées en utilisant des méthodes d’hydratation et d’extrusion en couche mince suivies d’une caractérisation physico-chimique. La formation d’une bicouche lipidique supportée à l’aide de la surveillance QCM-D et la fabrication de membranes lipidiques en suspension pour une utilisation dans PAMPA est discutée. Enfin, les vésicules multilipidiques pour le développement de membranes imitant des cellules plus complexes sont examinées. En utilisant les deux types de membranes lipidiques fabriquées, ce protocole démontre comment cet outil peut être utilisé pour étudier les interactions moléculaires. Dans l’ensemble, cette technique construit des bicouches lipidiques imitant les cellules avec une reproductibilité et une polyvalence élevées.
Protocole
1. Développer des vésicules unilipidiques
- Méthode d’hydratation en couche mince
- Préparation et stockage de solutions mères lipidiques
REMARQUE: Toutes les étapes d’utilisation du chloroforme doivent être effectuées dans une hotte chimique. Le chloroforme doit toujours être pipeté à l’aide d’embouts de pipette en fibre de carbone sans danger pour les solvants. Les solutions contenant du chloroforme doivent toujours être stockées dans des flacons en verre.- Préparer une solution mère lipidique de 10 mg/mL en ajoutant le volume approprié de chloroforme dans le flacon contenant la poudre lipidique et bien mélanger. Par exemple, ajouter 20 mL de chloroforme à 200 mg de L-α-phosphatidylcholine (œuf, poulet) (eggPC). La solution mère peut être fabriquée à une concentration différente si nécessaire.
REMARQUE: Si le lipide en poudre a été stocké dans une ampoule, après avoir ajouté du chloroforme, transférez-le dans un flacon en verre avec un bouchon doublé de polytétrafluoroéthylène (PTFE). - Scellez le bouchon du flacon avec Parafilm et conservez-le à -20 °C jusqu’à 6 mois.
- Préparer une solution mère lipidique de 10 mg/mL en ajoutant le volume approprié de chloroforme dans le flacon contenant la poudre lipidique et bien mélanger. Par exemple, ajouter 20 mL de chloroforme à 200 mg de L-α-phosphatidylcholine (œuf, poulet) (eggPC). La solution mère peut être fabriquée à une concentration différente si nécessaire.
- Formation d’un film lipidique sec
- Ajouter le volume approprié de solution mère lipidique dans un flacon de verre propre nécessaire pour une concentration finale de vésicules de 2,5 mg/mL. Par exemple, pour former 1 mL de vésicules PC d’œuf à 2,5 mg/mL, pipeter 250 μL de solution mère d’oeuf PC dans le flacon.
REMARQUE: Le volume préparé peut dépendre du procédé d’extrusion utilisé (voir l’étape 1.3). Le volume maximal recommandé de la mini-extrudeuse est de 1 mL tandis que la plage de volume de la grande extrudeuse est de 5 à 50 mL. - Retirer le chloroforme de la solution mère lipidique à l’aide d’un flux de gazN2 (grade ultrapur 5.0).
- Pour assurer l’élimination complète du chloroforme, raccordez le film lipidique séché sous vide et laissez agir pendant au moins 4 h.
REMARQUE: Le processus peut être arrêté ici. Si le film lipidique ne sera pas utilisé immédiatement après le séchage sous vide, conserver dans un dessiccateur jusqu’à ce qu’il soit utilisé. Nous avons observé que ces films lipidiques produisent des vésicules de qualité similaire après 1 semaine de stockage dans ces conditions; la qualité des vésicules après des durées de stockage plus longues, si nécessaire, devrait être étudiée plus avant.
- Ajouter le volume approprié de solution mère lipidique dans un flacon de verre propre nécessaire pour une concentration finale de vésicules de 2,5 mg/mL. Par exemple, pour former 1 mL de vésicules PC d’œuf à 2,5 mg/mL, pipeter 250 μL de solution mère d’oeuf PC dans le flacon.
- Effectuer des cycles gel-dégel-vortex
- Préparer une solution tampon de chlorure de sodium Tris (NaCl) contenant 10 mM de base Tris et 100 mM de NaCl. Réhydrater le film lipidique séché avec le volume requis de tampon Tris NaCl pour obtenir une concentration finale de vésicules de 2,5 mg/mL et un vortex pendant environ 15 à 30 s.
- Transférer la suspension de vésicule dans un récipient avec de la glace carbonique jusqu’à ce qu’elle soit congelée, environ 30 min. Une fois l’échantillon complètement congelé, décongeler la suspension dans un bain-marie à 30-40 °C. Vortex la suspension de vésicule décongelée.
REMARQUE: Le liquide N2 peut être utilisé à la place de la glace carbonique. Transférer la suspension de vésicule dans de l’azote liquide pendant 30 s, puis décongeler immédiatement dans un bain-marie à 80 °C. - Répétez l’étape 1.1.3.2 4 fois de plus, pour un total de 5 cycles de gel-dégel-vortex.
- Préparation et stockage de solutions mères lipidiques
- Extrusion
REMARQUE: Une fois les cycles de gel-dégel-dégel-vortex terminés, des vésicules multilamellaires se forment. L’extrusion aide à réduire la taille et à développer de grandes vésicules unilamellaires.- Procédé de mini-extrudeuse (1 mL)
- Nettoyez soigneusement tous les composants de l’extrudeuse à l’aide d’un détergent doux dans de l’eau ultrapure et rincez au moins trois fois à l’eau ultrapure en vous assurant que tout le détergent est retiré. Sécher avec du gaz N2.
- Assemblez les deux supports de membrane internes et les joints toriques (diamètre intérieur de 12,7 mm; diamètre extérieur de 15,2 mm). Positionnez chaque support de membrane de manière à ce que le joint torique soit tourné vers le haut.
- Pré-mouiller un support de filtre avec de l’eau ultrapure. Placez-le sur la surface de support de la membrane à l’intérieur du joint torique. Répétez l’opération pour le deuxième support de membrane interne.
- Positionnez un support de membrane interne dans le boîtier extérieur de l’extrudeuse. Placez une membrane en polycarbonate de 100 nm sur le support interne de la membrane, directement sur le support du filtre.
REMARQUE: Les membranes en polycarbonate sont stockées séparément entre des morceaux de papier de couleur bleue. Retirez le papier de séparation avant de l’insérer sur le support de la membrane. - Placez le deuxième support de membrane interne dans le boîtier extérieur de l’extrudeuse avec le joint torique et le côté support du filtre face à la membrane en polycarbonate. Fixez le roulement en PTFE dans l’écrou de retenue et vissez fermé avec le boîtier extérieur de l’extrudeuse. Clipsez l’extrudeuse dans le bloc chauffant.
- Chargez la suspension de vésicule lipidique dans l’une des seringues et positionnez la seringue dans le bloc thermique de l’extrudeuse, en insérant complètement l’aiguille dans une extrémité de l’extrudeuse. Insérez la deuxième seringue vide dans le côté opposé et verrouillez les deux seringues à l’aide des clips de bras sur le bloc chauffant.
REMARQUE: Si nécessaire, placez le bloc thermique de l’extrudeuse sur une plaque chauffante et réglez la température à une valeur supérieure à la température de transition du lipide. Insérez un thermomètre dans le support intégré dans le bloc chauffant pour des lectures de température précises et attendez que la température requise soit atteinte (~ 15 min). Les vésicules lipidiques d’oeuf PC ne nécessitent pas de chaleur pendant l’extrusion. - Poussez lentement la suspension de vésicule dans la seringue vide, puis dans la seringue d’origine. Surveillez les changements de pression tout au long de l’extrusion qui indiquent une fuite. Répétez 20 fois de plus pour un total de 21 passages à travers la membrane en polycarbonate. Transférer les vésicules lipidiques dans un flacon en verre propre pour le stockage.
REMARQUE: Le nombre d’extrusions peut être optimisé en fonction de la composition lipidique. - Si de la chaleur a été utilisée, laissez la suspension de vésicule extrudée atteindre la température ambiante. Conserver les vésicules lipidiques extrudées à 4 °C jusqu’à nouvel usage.
REMARQUE: La durée de stockage recommandée des vésicules dépend fortement de la composition lipidique, et les propriétés physicochimiques des vésicules (par exemple, diamètre hydrodynamique, potentiel zêta) doivent être surveillées au fil du temps. Par exemple, les vésicules d’œuf PC ont été stockées pendant au moins deux semaines sans changement dans la taille des vésicules ou la capacité de formation de bicouches.
- Procédé d’extrusion de grande taille (5-50 mL)
REMARQUE: Suivez les étapes 1.2.2.1-1.2.2.5 si de la chaleur est requise pour le lipide choisi. Passez à l’étape 1.2.2.5 si la chaleur n’est pas nécessaire. Les étapes 1.2.2.1 à 1.2.2.4 ne sont pas requises pour egg PC.- Remplir une fiole de 1 L avec de l’eau d’osmose inverse (OI).
REMARQUE: N’utilisez pas d’eau ultrapure pour circuler dans le système de 50 mL, car cela pourrait entraîner la lixiviation des ions métalliques du cylindre de l’extrudeuse. - Placez la fiole de 1 L au bain-marie sur une plaque chauffante et réglez la plaque chauffante à une température supérieure à la température de transition du lipide.
- Fixez le cylindre d’échantillon au ballon avec un tube flexible via l’entrée du cylindre d’échantillon. Fixez le tube à la sortie du cylindre au sommet de la fiole de 1 L. Fixez les tubes à l’entrée et à la sortie, au besoin. Cela créera un écoulement unidirectionnel de l’eau à travers le cylindre d’échantillon.
- Allumez la pompe pour démarrer la circulation de l’eau. Si de la chaleur est nécessaire, prévoyez environ 30 à 45 minutes pour que le cylindre d’échantillon atteigne la température souhaitée.
- Connectez le bouchon du cylindre d’échantillon à un réservoir d’azote via le connecteur flexible fixé à l’unité de soupape de surpression.
- Nettoyez toutes les parties de l’extrudeuse de 50 mL avec de l’éthanol à 70 % (v/v).
- Assemblez l’extrudeuse en plaçant le support d’écran à grand trou, le disque fritté, les disques de vidange et la membrane en polycarbonate dans l’espace du support inférieur de l’extrudeuse. Connectez les supports supérieur et inférieur de l’extrudeuse à l’aide des quatre vis et serrez.
- Fixez l’unité d’extrusion au cylindre d’échantillon en vissant au fond et en serrant avec une clé pour la fixer.
REMARQUE: Si de la chaleur est utilisée, placez un thermomètre dans le cylindre et attendez que l’eau ait atteint la température souhaitée avant de continuer. Cela garantira que la température de l’échantillon est maintenue tout au long du processus d’extrusion. - Remplissez le cylindre d’échantillon avec de l’eau ultrapure. Extrudez l’eau à travers l’unité d’extrusion avant d’ajouter l’échantillon dans le cylindre d’échantillon. Ceci est fait pour pré-mouiller les membranes, semblable à la mini extrudeuse.
REMARQUE: Assurez-vous que le bouchon est complètement vissé et que la soupape de surpression est complètement fermée avant d’allumer l’azote. Une pression minimale est requise pour cette étape (~5-10 psi). - Ajouter la suspension de vésicule lipidique dans le cylindre d’échantillon et visser le dessus fermé. Augmentez lentement la pression jusqu’à ce que l’échantillon commence à s’égoutter de l’unité d’extrusion à une vitesse d’environ 2-3 gouttes / s dans un flacon en verre propre.
REMARQUE: N’augmentez pas la pression rapidement à cette étape, car trop de pression peut avoir un impact négatif sur les membranes et entraîner une extrusion infructueuse. - Une fois que tout l’échantillon a été extrudé, coupez l’alimentation N2 et relâchez la pression dans le cylindre d’échantillon en ouvrant lentement la soupape de surpression. Versez les vésicules lipidiques dans le cylindre d’échantillon et répétez l’étape 1.2.2.11, 9 fois de plus pour un total de 10 extrusions.
REMARQUE: La pression requise pour l’extrusion peut diminuer avec l’augmentation du nombre d’extrusions, à mesure que l’échantillon devient plus homogène et plus proche de la taille des pores de la membrane en polycarbonate. - Conserver la suspension de vésicule lipidique extrudée à 4 °C jusqu’à nouvel emploi.
- Remplir une fiole de 1 L avec de l’eau d’osmose inverse (OI).
- Procédé de mini-extrudeuse (1 mL)
2. Caractérisation des vésicules lipidiques
- Mesure hydrodynamique du diamètre à l’aide de la diffusion dynamique de la lumière (DLS)
- Vortex lipid vésicules et pipette 50 μL de la suspension de vésicule lipidique dans une cuvette jetable à faible volume. Couvrir pour éviter la contamination par la poussière et les débris.
- Chargez la suspension de vésicule dans l’instrument DLS, entrez les détails de l’échantillon et effectuez la mesure à l’aide du logiciel associé.
- Potentiel zêta
- Préparez une cellule zêta capillaire pliée en la lavant avec de l’eau ultrapure, de l’éthanol à 70% et de l’eau ultrapure à l’aide de seringues qui se connectent aux entrées de la cellule. Poussez doucement le liquide à travers la cellule 3-4 fois et videz complètement la cellule avant de passer à la solution suivante.
- Vortex les vésicules lipidiques et préparer une dilution 1:10 (v/v) des vésicules lipidiques dans de l’eau ultrapure.
- Chargez la suspension de vésicule lipidique diluée. Enlevez les bulles d’air en poussant la suspension d’avant en arrière entre les seringues. Fixez les bouchons à chaque entrée.
REMARQUE: Il est crucial d’éliminer toutes les bulles, car cela aura un impact sur la mesure. - Placez la cellule zêta dans la chambre d’échantillonnage, en vous assurant que les électrodes sont en contact. Fermez le dessus de la chambre d’échantillonnage. Dans le logiciel associé, entrez les détails de l’échantillon et collectez la mesure.
3. Formation d’une bicouche lipidique unilipidique à l’aide de QCM-D
- Préparations de solutions
- Préparer une solution de dodécylsulfate de sodium (FDS) à 2 % (p/v) dans de l’eau ultrapure. Mélanger sur une plaque de remue-ménage jusqu’à dissolution complète. Solutions de travail Aliquote d’au moins 10 mL d’eau ultrapure, 2% de FDS et Tris NaCl.
- Préparer une dilution des vésicules lipidiques dans le tampon Tris NaCl. La concentration des vésicules dépend de l’application. Pour les œufs PC, il a été démontré que des concentrations comprises entre 0,01 et 0,5 mg/mL entraînaient une formation réussie de bicouche lipidique soutenue.
- Nettoyage des capteurs de cristal de quartz revêtus de silice
REMARQUE: Le nettoyage des cristaux QCM-D dépend du matériau de surface du capteur utilisé. Pour former des bicouches lipidiques supportées, des cristaux de quartz revêtus de silice sont utilisés dans ce protocole et détaillés ci-dessous, conformément à la procédure d’exploitation standard du fabricant.- Insérez le capteur de cristal de quartz revêtu de silice dans le module d’écoulement en vous assurant que le « t » sur le cristal s’aligne avec le « t » sur le module. Vissez le module d’écoulement fermé.
REMARQUE: Si le QCM-D utilisé permet de connecter et d’exécuter simultanément plusieurs modules de flux, répétez les procédures suivantes pour les modules supplémentaires si nécessaire. - Insérez le module de débit dans la base de l’instrument avec les électrodes du module de débit se connectant au système d’analyse. Verrouillez le module en place.
- Connectez le tuyau d’entrée et de sortie au module de débit et à la pompe. Placez le tube dans les protecteurs de maintien et fermez le couvercle du système d’analyse. Placez un conteneur à déchets à la sortie de la pompe pour collecter les solutions usées.
- Pour effectuer le nettoyage, allumez d’abord la pompe. Réglez la vitesse d’écoulement sur 400 μL/min. Insérez le tuyau d’entrée dans de l’eau ultrapure et faites couler 5 à 10 mL à travers le module.
- Basculez le tuyau d’entrée en FDS à 2 % et faites circuler 5 à 10 mL à travers le module. Remettez le tube d’entrée dans de l’eau ultrapure et faites couler 10 à 20 mL à travers le module. Retirez le tuyau d’entrée de la solution et faites circuler l’air à travers le tube jusqu’à ce que tout le liquide soit éjecté.
REMARQUE: Le protocole de nettoyage ci-dessus est utilisé quotidiennement avant et après chaque mesure. Un nettoyage en profondeur peut être effectué au besoin. En bref, pour effectuer un nettoyage en profondeur, démontez les modules de débit. Tous les composants, à l’exception du côté électrode du module d’écoulement, doivent être immergés dans une FDS à 2 % (p/v) et soniqués dans le bain, suivis d’un rinçage complet à l’eau ultrapure et d’un séchage avec un flux de gazN2. Le composant du module d’écoulement contenant les broches d’électrode ne doit jamais être en contact avec un liquide. - Retirez le capteur du module de débit et rincez-le à l’eau ultrapure. Séchez le capteur avec un flux de gaz N2. Séchez le module d’écoulement avec un flux de gaz N2. Assurez-vous que l’électrode reste toujours exempte de tout liquide.
- Dans une hotte à fumée chimique, insérez le capteur de cristal de quartz recouvert de silice dans un instrument de nettoyage ultra-violet (UV) / ozone. Allumez l’instrument et laissez le traitement pendant au moins 2 min. Retirez soigneusement les capteurs et retournez dans le module de débit.
- Insérez le capteur de cristal de quartz revêtu de silice dans le module d’écoulement en vous assurant que le « t » sur le cristal s’aligne avec le « t » sur le module. Vissez le module d’écoulement fermé.
- Formation d’une ligne de base Tris NaCl
- Allumez l’instrument de l’analyseur pour le connecter au logiciel associé et réglez la température à la valeur souhaitée pour la bicouche lipidique prise en charge. Laissez la température se stabiliser à l’entrée souhaitée.
REMARQUE: Si la température réglée est supérieure à la température ambiante, toutes les solutions doivent être chauffées à la même température à l’aide d’un bloc chauffant. - Configurez la mesure et recherchez toutes les fréquences de résonance et dissipations du capteur pour les harmoniques 3, 5, 7, 9, 11 et 13 avant de commencer la mesure.
REMARQUE: La 1ère harmonique peut être ignorée car cette harmonique est trop sensible et produit des données bruyantes. - Allumez la pompe et réglez le débit à 175 μL/min ou le débit expérimental souhaité.
- Essuyez le tube d’entrée avec de l’éthanol avant de l’insérer dans Tris NaCl. Commencez la mesure et commencez à faire couler Tris NaCl.
REMARQUE : Les données sont collectées et surveillées en temps réel. Le passage de l’air au liquide dans le module d’écoulement sera observé dans le logiciel de collecte de données par une augmentation rapide du changement de dissipation(ΔD)et un changement de fréquence(ΔF). - Laissez Tris NaCl circuler à travers le module pendant 5 à 10 minutes, en veillant à ce que les valeurs de base ΔF et ΔD dans le liquide restent stables.
- Allumez l’instrument de l’analyseur pour le connecter au logiciel associé et réglez la température à la valeur souhaitée pour la bicouche lipidique prise en charge. Laissez la température se stabiliser à l’entrée souhaitée.
- Formation d’une bicouche lipidique supportée par unilipidique
- Arrêtez la pompe et retirez le tube d’entrée de la solution Tris NaCl et insérez-la soigneusement dans la solution de vésicule lipidique. Flux de retour pendant 5 s pour éliminer les bulles d’air du tuyau d’entrée, puis continuer l’écoulement vers l’avant. Redémarrez la mesure dans le logiciel pour mettre à zéro la ligne de base.
REMARQUE: Veillez à éviter les bulles d’air dans le tube, qui peuvent circuler à travers le module et perturber la formation de bicouches et l’enregistrement des données. - Circulez les vésicules lipidiques jusqu’à ce que la formation de bicouches soit observée en temps réel dans le logiciel d’acquisition de données (au moins 8 min pour les vésicules PC d’œuf).
- Répétez l’étape 3.4.1 pour remplacer le tube d’entrée des vésicules lipidiques par un tampon Tris NaCl.
REMARQUE: Si l’application souhaitée consiste à étudier les interactions moléculaires, passez directement à l’étape 6.1 sans arrêter le flux de solution ou l’acquisition de données. Si la formation de bicouche est le point d’extrémité, passez à l’étape 3.4.4. - Dans le logiciel, arrêtez la mesure et enregistrez le fichier. Arrêtez la pompe.
- Nettoyez le module d’écoulement et le capteur de cristal de quartz revêtu de silice en suivant les étapes de protocole 3.2.4 et 3.2.5.
- Arrêtez la pompe et retirez le tube d’entrée de la solution Tris NaCl et insérez-la soigneusement dans la solution de vésicule lipidique. Flux de retour pendant 5 s pour éliminer les bulles d’air du tuyau d’entrée, puis continuer l’écoulement vers l’avant. Redémarrez la mesure dans le logiciel pour mettre à zéro la ligne de base.
4. Formation d’une bicouche lipidique en suspension
REMARQUE: Le protocole de formation d’une bicouche lipidique en suspension est adapté du protocole pamPA (Parallel Artificial Membrane Permeability Assay) fourni par le fabricant de plaques filtrantes37.
- Solubiliser le lipide souhaité dans le dodécane à 20 mg/mL (p.ex. 1,2-dioléoyl-sn-glycéro-3-phosphocholine (DOPC)).
- Ajouter 5 μL de la solution lipidique au compartiment donneur, qui est une plaque filtrante multi-écran poreuse au difluorure de vinylidène (PVDF) à 96 puits (taille des pores de 0,45 μm).
- Immergez immédiatement la plaque filtrante dans le compartiment accepteur, qui est une plaque réceptrice de transport contenant 300 μL de solution saline tamponnée au phosphate (PBS) de 1×. Ajouter 200 μL de PBS 1× dans le compartiment donneur.
REMARQUE: Les contrôles des filtres avec des filtres lipidiques uniquement et non traités exposés à 1× PBS peuvent être inclus. - Passez directement à la section 6.2 pour étudier les interactions moléculaires avec la bicouche lipidique en suspension. Il est recommandé de terminer l’étude dans les 16 heures suivant la formation de la bicouche en suspension.
5. Développer des cellules multilipidiques imitant les vésicules et les bicouches
- Extraction lipidique à partir de cellules de mammifères
REMARQUE: L’extraction des lipides suit l’approche Bligh-Dyer38.- Cultivez la lignée cellulaire souhaitée, le cas échéant. Après avoir atteint une confluence de 70 à 80 % (fiole T75), détacher les cellules à l’aide d’acide trypsine-éthylènediaminetrétaacétique à 37 °C pendant 5 min.
- Cellules centrifuges à 200 × g pendant 5 min. Retirez le surnageant et remettez en suspension la pastille cellulaire dans 1 mL d’eau ultrapure.
- Ajouter 3,75 mL d’un mélange 1:2 (v/v) de chloroforme:méthanol à la suspension cellulaire et vortex pendant 15 min. Ensuite, ajoutez 1,25 mL de chloroforme et de vortex pendant 1 min. Enfin, ajoutez 1,25 mL d’eau et de vortex pendant 1 min.
- Mélange de cellules centrifuges à 1000 x g pendant 10 min. Recueillir la couche inférieure de liquide, qui contient des lipides dans la phase organique. Sécher sous un courant de gazN2.
- Quantifier la teneur en lipides à l’aide de la chromatographie liquide-spectrométrie de masse (LC-MS) à l’aide d’une phase inverse en C18, de 3,5 μm × colonne de 50 mm.
- Pour la phase mobile, préparez deux solutions, la première avec 60:40 (v/v) acétonitrile:eau et la seconde avec 90:10 (v/v) isopropanol:acétonitrile. Le formiate d’ammonium doit être ajouté aux deux solutions à une concentration finale de 10 mM. Pendant 60 min, augmenter le gradient de phase mobile de 35% (v/v) de la deuxième solution à 95% (v/v).
- Détecter l’effluent en mode d’ionisation négative, avec MS à balayage complet consécutif et MS/MS en tandem. Identifier les espèces de phospholipides individuelles à partir de leurs rapports masse/charge (m/z). Analysez les spectres de masse de la fragmentation de dissociation induite par collision à l’aide des outils d’analyse de spectrométrie de masse LIPID MAPS. Obtenez des chromatogrammes ioniques extraits pour intégrer l’aire sous la courbe, en déterminant l’abondance de chaque espèce lipidique.
- Effectuez les étapes 5.1.5 à 5.1.7 pour un étalon lipidique contenant les principales classes de lipides afin de déterminer les sensibilités relatives à la détection pour chaque classe de phospholipides différente.
- Développer des vésicules multilipidiques
- Suivez les étapes de la section 1.1.1 pour préparer des solutions lipidiques pour les lipides représentant chaque composant bicouche souhaité, comme indiqué à l’étape 5.1.
- Sur la base des compositions lipidiques obtenues à partir de l’étape 5.1, ajouter le volume approprié de matière lipidique/chloroforme dans un flacon en verre propre nécessaire pour une concentration finale de vésicules de 2,5 mg/mL. Retirer la solution de séchage du chloroforme en vrac sous un flux de gazN2.
- Suivez les étapes 1.1.2, 1.1.3 et 1.2 pour former des vésicules multilipidiques. Suivez l’étape 2 pour la caractérisation des vésicules.
- Formation d’une bicouche lipidique multilipidique à l’aide de QCM-D
REMARQUE: Certaines vésicules multilipidiques peuvent entraîner une rupture spontanée de la vésicule lipidique et la formation de bicouches similaires aux vésicules PC unilipidiques présentées à l’étape 3. Cependant, des vésicules multilipidiques plus complexes peuvent nécessiter un apport externe pour aider à la rupture des vésicules. Ici, le peptide AH est utilisé pour déstabiliser la feuillet externe de la vésicule, ce qui entraîne la formation de bicouches. D’autres méthodes pour obtenir la déstabilisation et la rupture des vésicules peuvent être envisagées si vous le souhaitez.- Suivez l’étape 3 pour former la bicouche lipidique multilipidique en utilisant les vésicules multilipidiques formées à l’étape 5.2.
- Si la rupture spontanée des vésicules en une bicouche n’est pas observée, tenter la déstabilisation des vésicules à l’aide du peptide AH. Préparer la solution du peptide AH (séquence peptidique : H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2) à 13 μM dans tris NaCl avec 1 % (v/v) de diméthylsulfoxyde, DMSO.
- Suivez les étapes 3.4.1 à 3.4.3. Après l’étape 3.4.3, remplacez le tube d’entrée par la solution peptidique AH. Introduire la solution dans le module d’écoulement jusqu’à ce que ΔF et ΔD soient observés à partir de l’ajout de la nouvelle solution. Arrêtez la pompe et laissez le peptide AH incuber avec les vésicules pendant 10 min.
- Basculez le tube d’entrée en Tris NaCl et commencez le flux pour éliminer le peptide AH des vésicules rompues, ce qui conduit à la formation réussie d’une bicouche lipidique.
REMARQUE: Si l’application souhaitée consiste à étudier les interactions moléculaires, passez à l’étape 6.1 sans arrêter le flux de solution ou l’acquisition de données. - Dans le logiciel, arrêtez la mesure et enregistrez le fichier. Arrêtez la pompe.
- Nettoyez le module d’écoulement et le capteur de cristal de quartz revêtu de silice en suivant les étapes de protocole 3.2.4-3.2.6.
- Bicouches multilipidiques suspendues
- Solubiliser le mélange des lipides souhaités dans le dodécane à 20 mg/mL.
- Préparez une solution de mélange lipidique de 5 μL en utilisant la composition imitant la cellule souhaitée.
- Suivez les étapes 4.2 et 4.3.
REMARQUE: Continuez directement à l’étape 6.2 pour étudier les interactions moléculaires avec la bicouche lipidique en suspension.
6. Études d’interaction moléculaire avec des bicouches uni-lipidiques et multilipidiques
- Étude des interactions moléculaires avec une bicouche lipidique supportée à l’aide de QCM-D
- Préparez une solution de la molécule souhaitée pour étudier l’adsorption avec une bicouche lipidique supportée. Par exemple, préparer une solution de 200 μM de phtalate de di(2-éthylhexyle) (DEHP) dans Tris NaCl avec 1 % (v/v) de DMSO.
- Si la solution moléculaire est préparée dans Tris NaCl, elle peut être coulée directement après l’étape 3.4.3 pour une bicouche unilipidique ou 5.3.4 pour une bicouche multilipidique. Si la molécule doit être préparée dans un solvant différent, insérez plutôt le tuyau d’entrée dans le solvant désiré seul pendant au moins 5 min (par exemple, Tris NaCl avec 1% (v / v) de DMSO pour le DEHP).
REMARQUE: Les changements de viscosité dus au solvant peuvent être surveillés et pris en compte en le faisant couler avant et après l’introduction de la molécule d’intérêt. - Basculez le tube d’entrée dans la solution contenant la molécule d’intérêt et débitez pendant au moins 5 min. L’écoulement peut également être arrêté et le liquide contenant la molécule souhaitée peut être autorisé à incuber avec la bicouche si vous le souhaitez.
- Remplacez le tuyau d’entrée par le solvant moléculaire seul si quelque chose d’autre que Tris NaCl. Débit pendant au moins 5 min. Ensuite, basculez le tuyau d’entrée dans Tris NaCl et débitez pendant au moins 5 min.
- Dans le logiciel, arrêtez la mesure et enregistrez le fichier. Arrêtez la pompe.
- Nettoyez le module d’écoulement et le capteur de cristal de quartz revêtu de silice en suivant les étapes de protocole 3.2.4-3.2.6.
- Étude des interactions moléculaires avec les bicouches lipidiques en suspension à l’aide de PAMPA
- Préparez une solution de la molécule souhaitée. Par exemple, préparez un DEHP de 200 μM dans 1× PBS avec 1 % (v/v) de DMSO.
- Préparez une nouvelle plaque réceptrice de transport avec 300 μL de 1x PBS frais par puits.
- Immédiatement après l’étape 3.3 pour une bicouche en suspension unilipidique ou 4.4.3 pour une bicouche suspendue multilipidique, retirer le PBS 1× du compartiment donneur de la plaque filtrante multi-écrans et remplacer par 200 μL de la solution d’essai. Immergez immédiatement dans la plaque du récepteur de transport préparée à l’étape 6.2.2.
- Incuber avec un balancement doux pendant une durée souhaitée (par exemple, 2 h) à 25 °C.
- Après l’incubation, prélever 150 μL de la solution dans les compartiments donneur et accepteur. Mesurer la concentration de la molécule dans les deux échantillons en utilisant une méthode appropriée basée sur les propriétés de cette molécule.
- Par exemple, utilisez un spectrophotomètre à microplaques avec la longueur d’onde d’absorbance appropriée, telle que 280 nm pour le DEHP, et comparez avec une courbe standard de la molécule d’intérêt.
- Calculer la perméabilité apparente(applicationP) de la molécule d’intérêt à l’aide des équations suivantes :
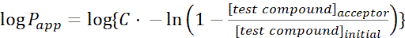 (1)
(1)
Où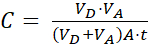 (2)
(2)
REMARQUE : [composéd’essai] l’accepteur est la concentration de la molécule d’intérêt (p. ex., DEHP) au moment t, dans le compartiment accepteur; et [composé d’essai]initial est la concentration initiale de la molécule. A est la zone de la membrane, t est le temps, VD est le volume du compartiment donneur et VA est le volume du compartiment accepteur.
Résultats
Ce protocole détaille les méthodes de formation des bicouches lipidiques supportées et suspendues (Figure 1). La première étape pour former une bicouche lipidique soutenue consiste à développer des vésicules lipidiques. La mini-extrudeuse permet de préparer de petits volumes de vésicules lipidiques (1 mL ou moins), tandis que la grande extrudeuse permet de préparer 5 à 50 mL de vésicules lipidiques en un seul lot. Les distributions granulométriques des vésicules unilipidiques ...
Discussion
Ce protocole permet la formation de vésicules lipidiques, de bicouches lipidiques soutenues et de bicouches lipidiques en suspension. Ici, des étapes critiques sont présentées pour former chacune de ces structures. Lors de la formation de vésicules lipidiques, il est important d’extruder au-dessus de la température de transition du lipide39. Lorsqu’il est en dessous de la température de transition, le lipide est physiquement présent dans sa phase de gel ordonnée39
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas de conflit d’intérêts ou d’intérêts financiers concurrents.
Remerciements
Ce matériel est basé sur des travaux soutenus par la National Science Foundation dans le cadre de la subvention n ° 1942418 attribuée à A.S., et une bourse de recherche supérieure de la National Science Foundation décernée à C.M.B.H., sous la subvention n ° 1644760. Toutes les opinions, constatations et conclusions ou recommandations exprimées dans ce document sont celles des auteurs et ne reflètent pas nécessairement les points de vue de la National Science Foundation. Les auteurs remercient le Dr Noel Vera-González pour l’acquisition de données sur la caractérisation des vésicules lipidiques. Les auteurs remercient le professeur Robert Hurt (Brown University) pour l’utilisation de son Zetasizer. Les auteurs remercient le Centre de spectrométrie de masse de l’Université Brown, en particulier le Dr Tun-Li Shen pour son aide à quantifier la composition lipidique.
matériels
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Références
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon