Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Moleküler Etkileşimlerin Çalışması için Desteklenen ve Askıya Alınan Lipid Bilayer Modellerinin Hücre Taklit Montajı
Bu Makalede
Özet
Bu protokolde tek lipid ve multi-lipid vesicles, desteklenen lipid bilayerler ve askıda lipid bilayerleri taklit eden hücre oluşumu açıklanmaktadır. Bu in vitro modeller çeşitli lipit tiplerini içerecek şekilde uyarlanabilir ve çeşitli molekül ve makromolekül etkileşimlerini araştırmak için kullanılabilir.
Özet
Model hücre zarları erken ilaç keşfinden toksisite çalışmalarına kadar birçok uygulama ile faydalı bir tarama aracıdır. Hücre zarı, tüm hücre tipleri için çok önemli bir koruyucu bariyerdir ve iç hücresel bileşenleri hücre dışı ortamdan ayırır. Bu membranlar büyük ölçüde çeşitli proteinler ve kolesterol ile birlikte dış hidrofilik kafa grupları ve iç hidrofobik kuyruk gruplarını içeren bir lipid bilayerden oluşur. Lipitlerin bileşimi ve yapısı, hücreler ve farmasötik, biyolojik toksinler ve çevresel toksik ediciler içerebilecek hücresel mikroçevrici arasındaki etkileşimler de dahil olmak üzere biyolojik işlevin düzenlenmesinde çok önemli bir rol oynar. Bu çalışmada lipid bilayerlerini taklit eden tek lipid ve multi-lipid destekli ve askıda hücre formüle etme yöntemleri açıklanmıştır. Daha önce, moleküler etkileşimleri anlamak için tek lipid fosfatidiylcholine (PC) lipid bilayerlerin yanı sıra multi-lipid plasental trophoblast esintili lipid bilayerler geliştirilmiştir. Burada her iki tip bilayer modeline ulaşma yöntemleri sunulacaktır. Hücre taklit eden multi-lipid bilayerler için, istenen lipid bileşimi ilk olarak birincil hücrelerden veya hücre çizgilerinden lipid ekstraksiyonu ve ardından sıvı kromatografi-kütle spektrometresi (LC-MS) ile belirlenir. Bu bileşim kullanılarak lipid vesikülleri ince film hidrasyon ve ekstrüzyon yöntemi kullanılarak imal edilir ve hidrodinamik çapı ve zeta potansiyeli karakterize edilir. Desteklenen ve askıya alınan lipid bilayerler daha sonra sırasıyla, dağılım izleme (QCM-D) ile kuvars kristal mikro denge kullanılarak ve paralel bir yapay membran geçirgenlik testinde (PAMPA) kullanılmak üzere gözenekli bir membran üzerinde oluşturulabilir. Temsili sonuçlar in vitro hücreli membran lipid bilayer modellerinin tekrarlanabilirliğini ve çok yönlülüğünü vurgulamaktadır. Sunulan yöntemler, çeşitli moleküllerin ve makromoleküllerin hücre zarı ile geçirgenliği, adsorpsiyonu ve gömmesi gibi etkileşim mekanizmalarının hızlı ve facile değerlendirilmesine yardımcı olabilir, ilaç adaylarının taranmasında ve potansiyel hücresel toksisitenin tahmin edilmesine yardımcı olabilir.
Giriş
Öncelikle fosfolipidler, kolesterol ve proteinlerden oluşan hücre zarı, tüm canlı hücrelerin önemli bir bileşenidir1. Lipid amfifililiği tarafından yönlendirilen organizasyon ile hücre zarı koruyucu bir bariyer görevi görerek hücrenin çevresindeki çevre ile nasıl etkileşime girdiğini düzenler2. Birkaç hücresel işlem, membranın lipid ve protein bileşimine bağlıdır1,2. Örneğin, hücre zarı etkileşimleri etkili ilaç dağıtımı için önemlidir3. farmasötikler, biyolojikler, nanomalzemeler, biyolojik toksinler ve çevresel toksikler bir hücre zarının bütünlüğünü etkileyebilir, böylece hücresel fonksiyonu etkileyebilir4. Hücre zarlarının lipid bileşimine dayanan in vitro hücre taklit membran modellerinin yapımı, bu malzemelerin hücreler üzerindeki potansiyel etkisinin incelenmesini büyük ölçüde geliştirmek için facile araçları sağlama potansiyeline sahiptir.
Model lipid bilayerler lipid vesicles, desteklenen lipid bilayers ve askı lipid bilayers içerir. Desteklenen lipid bilayerler, desteklenen bir substrat malzemesinde lipid veziküllerinin yırtıldığı biyoteknoloji uygulamalarında yaygın olarak kullanılan fosfolipid hücre zarının bir modelidir5,6,7,8,9. Bilayer oluşumunu izlemek için kullanılan yaygın bir teknik, veziküllerin adsorpsiyonunu yerinde8 , 10 , 11 ,12 ,13,14'ekıyasla inceleyen dağılım izleme (QCM-D) ile kuvars kristal mikro dengedir. . Daha önce, QCM-D, akış koşullarında, yüzeyde fosfatidikolin (PC) lipid veziklinlerinin kritik bir veziklin kapsamı elde edildikten sonra, kendiliğinden sert lipid bilayerlere15. Önceki çalışma ayrıca, değişen lipid bileşimleri 16 , lipid proteinlerinin dahili17,18,19ve polimer yastıklar kullanılarakdesteklenenlipid çift katmanlı oluşumu araştırmıştır20, hücre zarı fonksiyonunun çeşitli yönlerini taklit edebilen desteklenen lipid bilayerleri verir.
Lipid bilayerler fosfolipid, kolesterol ve glikolipid bileşenlerini değiştirerek mitokondrion, kırmızı kan hücresi ve karaciğer hücresi zarları dahil olmak üzere alt hücreselden organ seviyelerine kadar çeşitli biyolojik bariyerleri taklit etmek için kullanılmıştır21. Bu daha karmaşık multi-lipid veziklinler, lipit bileşimine bağlı olarak veziklin yırtılması için ek yöntemler gerektirebilir. Örneğin, önceki çalışmalar, adsorbe lipid veziklin22,23'üistikrarsızlaştırarak bilayer oluşumunu teşvik etmek için hepatit C virüsünün yapısal olmayan proteini 5A'dan elde edilen α-helikal (AH) peptit kullanmıştır. Bu AH peptidi kullanılarak, plasental hücreleri taklit eden desteklenen lipid bilayerler daha önceoluşturulmuştur 24. Biyomedikal uygulamalar için desteklenen lipid bilayerlerin büyük potansiyeli moleküler ve nanopartikül taşımacılığı25 , 26, çevresel toksikan etkileşimleri 27,protein montajı ve fonksiyonu17,18,19,peptit düzenlemesi ve yerleştirilmesi 28 ,29,ilaç tarama30ve mikroakışkan platformlar31'ikapsayan araştırmalarla gösterilmiştir.
Askıya alınmış lipid bilayers, bir lipid bilayer'in gözenekli bir hidrofobik kesici uç 32,33 ,34,35boyunca askıya alındığı paralel bir yapay membran geçirgenliği test (PAMPA) aracılığıyla farmasötik tarama çalışmaları için kullanılmıştır. PAMPA lipid modelleri kan-beyin, bukal, bağırsak ve transdermal arayüzler de dahil olmak üzere farklı biyolojik arayüzler için geliştirilmiştir36. Hem desteklenen lipid bilayer hem de PAMPA tekniklerinin birleştirilmesiyle, istenen bir doku veya hücre tipinin lipit bileşenleri içindeki bileşiklerin adsorpsiyonu, geçirgenliği ve gömülmesi iyice incelenebilir.
Bu protokol, çeşitli moleküler etkileşimleri araştırmak için in vitro hücre zarı lipid bilayer modellerinin imalatını ve uygulanmasını açıklar. Hem tek lipid hem de multi-lipid destekli ve askıda lipid bilayerlerinin hazırlanması ayrıntılı olarak sağlanmıştır. Desteklenen bir lipid bilayer oluşturmak için, lipid vezikülleri ilk olarak ince film hidrasyon ve ekstrüzyon yöntemleri ve ardından fizikokimyasal karakterizasyon kullanılarak geliştirilmiştir. PAMPA'da kullanılmak üzere askıya alınmış lipid membranlarının QCM-D izlemesi ve imalatı kullanılarak desteklenen bir lipid bilayer oluşumu tartışılmaktadır. Son olarak, membranları taklit eden daha karmaşık hücre gelişimi için multi-lipid vesicles incelenir. Her iki tip fabrikasyon lipid zarını kullanarak, bu protokol bu aracın moleküler etkileşimleri incelemek için nasıl kullanılabileceğini göstermektedir. Genel olarak, bu teknik yüksek tekrarlanabilirlik ve çok yönlülük ile hücre taklit lipid bilayers oluşturur.
Protokol
1. Tek lipid veziklinlerin geliştirilmesi
- İnce film hidrasyon yöntemi
- Lipid stok çözeltilerinin hazırlanması ve depolanmasının
NOT: Kloroform kullanan tüm adımların kimyasal duman kaputunda gerçekleştirilmesi gerekir. Kloroform her zaman solvent güvenli karbon fiber pipet uçları kullanılarak pipetlenmelidir. Kloroform içeren çözeltiler her zaman cam şişelerde saklanmalıdır.- Lipit tozunu içeren şişeye uygun kloroform hacmini ekleyerek 10 mg/mL lipit stok çözeltisi hazırlayın ve iyice karıştırın. Örneğin, 200 mg L-α-fosfatidiylcholine (yumurta, tavuk) (yumurtaPC) için 20 mL kloroform ekleyin. Stok çözeltisi gerekirse farklı bir konsantrasyonda yapılabilir.
NOT: Toz lipid bir ampulde saklanmışsa, politetrafloroetilen (PTFE) astarlı kapaklı bir cam şişeye kloroform transferi ekledikten sonra. - Şişe kapağını Parafilm ile kapatın ve -20 °C'de 6 aya kadar saklayın.
- Lipit tozunu içeren şişeye uygun kloroform hacmini ekleyerek 10 mg/mL lipit stok çözeltisi hazırlayın ve iyice karıştırın. Örneğin, 200 mg L-α-fosfatidiylcholine (yumurta, tavuk) (yumurtaPC) için 20 mL kloroform ekleyin. Stok çözeltisi gerekirse farklı bir konsantrasyonda yapılabilir.
- Kuru lipid filminin oluşumu
- 2,5 mg/mL'lik son veziklik konsantrasyonu için gerekli olan temiz bir cam şişeye uygun hacimde lipid stok çözeltisi ekleyin. Örneğin, 2,5 mg / mL'de 1 mL yumurta PC vezikliği oluşturmak için pipet 250 μL yumurta PC stok çözeltisi şişeye.
NOT: Hazırlanan hacim kullanılan ekstrüder işlemine bağlı olabilir (bkz. adım 1.3). Mini ekstrüder önerilen maksimum hacim 1 mL iken, büyük ekstrüder ses aralığı 5-50 mL'dir. - N 2 gazı akışı (ultra saf5.0 Sınıfı) kullanarak lipid stok çözeltisinden kloroform çıkarın.
- Kloroformun tamamen çıkarılmasını sağlamak için, kurutulmuş lipit filmini vakuma bağlayın ve en az 4 saat bekletin.
NOT: İşlem burada durdurulabilir. Lipid filmi vakumla kuruduktan hemen sonra kullanılmayacaksa, kullanılana kadar bir kurutucuda saklayın. Bu lipit filmlerinin bu koşullarda 1 haftalık depolamadan sonra benzer kalitede veziklinler verdiğini gözlemledik; gerekirse daha uzun depolama sürelerini takip eden veziklin kalitesi daha fazla araştırılmalıdır.
- 2,5 mg/mL'lik son veziklik konsantrasyonu için gerekli olan temiz bir cam şişeye uygun hacimde lipid stok çözeltisi ekleyin. Örneğin, 2,5 mg / mL'de 1 mL yumurta PC vezikliği oluşturmak için pipet 250 μL yumurta PC stok çözeltisi şişeye.
- Donma-çözülme-girdap döngüleri gerçekleştirme
- 10 mM Tris tabanı ve 100 mM NaCl içeren bir Tris sodyum klorür (NaCl) tampon çözeltisi hazırlayın. Kurutulmuş lipid filmini, yaklaşık 15-30 sn boyunca 2,5 mg/mL ve girdap içeren son bir vezikül konsantrasyonu sağlamak için gerekli Tris NaCl tampon hacmi ile yeniden sulandırın.
- Veziklin süspansiyonu, yaklaşık 30 dakika donana kadar kuru buzlu bir kaba aktarın. Numune tamamen dondurulduktan sonra, süspansiyonu 30-40 ° C su banyosunda çözün. Çözülmüş veziklin süspansiyonu girdap.
NOT: Kuru buz yerine sıvıN 2 kullanılabilir. Veziklin süspansiyonu 30 s sıvı nitrojene aktarın ve ardından 80 °C'lik bir su banyosunda hemen çözün. - Toplam 5 donma-çözülme girdabı döngüsü için 1.1.3.2 adımını ek olarak 4 kez yineleyin.
- Lipid stok çözeltilerinin hazırlanması ve depolanmasının
- Ekstrüzyon
NOT: Donma-çözülme-girdap döngüleri tamamlandıktan sonra multilameller vesikles oluşur. Ekstrüzyon, boyutun azaltılmasına ve büyük unilameller vesicles geliştirilmesine yardımcı olur.- Mini (1 mL) ekstrüder işlemi
- Ekstrüderin tüm bileşenlerini ultra saf suda hafif bir deterjan kullanarak iyice temizleyin ve tüm deterjanın çıkarılmasını sağlayan ultra saf suyla en az üç kez durulayın. N2 gazı ile kurutun.
- İki iç membran destekini ve O halkalarını (iç çapı 12,7 mm; dış çapı 15,2 mm) monte edin. Her membran desteğini O-ring yukarı bakacak şekilde konumlandırın.
- Ultra saf su ile bir filtre desteğini önceden ıslat. O-halkasının içindeki membran destek yüzeyinin üzerine yerleştirin. İkinci iç membran desteği için tekrarlayın.
- Ekstrüder dış kasasına bir iç membran desteği yerleştirin. İç membran desteğine doğrudan filtre desteğinin üzerine bir adet 100 nm polikarbonat membran yerleştirin.
NOT: Polikarbonat membranlar mavi renkli kağıt parçaları arasında ayrı ayrı saklanır. Membran desteğine takmadan önce ayırma kağıdını çıkarın. - İkinci iç membran desteğini, polikarbonat membrana bakan O-ring ve filtre destek tarafı ile ekstrüder dış kasaya yerleştirin. PTFE rulmanı tutucu somununa takın ve ekstrüder dış kasa ile vidayı kapatın. Ekstrüderi ısıtma bloğuna kırpın.
- Lipid vesicle süspansiyonunu şırıngalardan birine yükleyin ve şırıngayı ekstrüder ısı bloğuna yerleştirin ve iğneyi ekstrüderin bir ucuna tam olarak yerleştirin. İkinci, boş şırınnayı karşı tarafa yerleştirin ve ısı bloğundaki kol klipslerini kullanarak her iki şırınna da kilitleyin.
NOT: Gerekirse, ekstrüder ısı bloğunu sıcak bir tabağa yerleştirin ve sıcaklığı lipit geçiş sıcaklığının üzerinde bir değere ayarlayın. Doğru sıcaklık değerleri için ısı bloğuna yerleştirilmiş tutucuya bir termometre yerleştirin ve gerekli sıcaklığa ulaşana kadar bekleyin (~15 dk). Yumurta PC lipid veziklinler ekstrüzyon sırasında ısı gerektirmez. - Veziklin süspansiyonu yavaşça boş şırıngama itin ve ardından orijinal şırıngama geri dönün. Sızıntıyı gösteren ekstrüzyon boyunca basınç değişimlerini izleyin. Polikarbonat membrandan toplam 21 geçiş için 20 kez daha tekrarlayın. Lipid veziklinleri saklamak için temiz bir cam şişeye aktarın.
NOT: Ekstrüzyon sayısı lipid bileşimine bağlı olarak optimize edilebilir. - Isı kullanılmışsa, ekstrüde veziklin süspansiyonu oda sıcaklığına ulaşana izin verin. Ekstrüde lipid veziklinleri bir sonraki kullanıma kadar 4 °C'de saklayın.
NOT: Önerilen vezikül depolama süresi lipid bileşimine oldukça bağlıdır ve vezikül fizikokimyasal özellikleri (örneğin, hidrodinamik çap, zeta potansiyeli) zamanla izlenmelidir. Örneğin, yumurta PC vezikülleri en az iki hafta boyunca vezikül boyutunda veya ikiyemiş oluşum kapasitesinde bir değişiklik olmadan depolanmıştır.
- Büyük (5-50 mL) ekstrüder işlemi
NOT: Seçilen lipit için ısı gerekiyorsa 1.2.2.1-1.2.2.5 adımlarını izleyin. Isı gerekmemişse 1.2.2.5 adımına atlayın. Yumurta PC için 1.2.2.1-1.2.2.4 adımları gerekli değildir.- 1 L şişeyi ters ozmos (RO) suyu ile doldurun.
NOT: Ekstrüder silindirinden metal iyonlarının sızmasına neden olabileceği için 50 mL'lik sistemde dolaşmak için ultra saf su kullanmayın. - 1 L şişeyi sıcak bir tabağa bir su banyosuna yerleştirin ve sıcak plakayı lipit geçiş sıcaklığının üzerinde bir sıcaklığa ayarlayın.
- Örnek silindiri, numune silindirinin girişinden esnek boru ile şişeye takın. Silindirin çıkışına boruyu 1 L şişenin üstüne takın. Gerektiğinde hem giriş hem de çıkışta boruları sabitleyin. Bu, numune silindiri aracılığıyla suyun tek yönlü akışını oluşturacaktır.
- Su sirkülasyonunu başlatmak için pompayı açın. Isı gerekiyorsa, numune silindiri istenen sıcaklığa ulaşması için yaklaşık 30-45 dakika bekleyin.
- Numune silindirinin kapağını basınç tahliye valf ünitesine bağlı esnek konektör aracılığıyla bir azot tankına bağlayın.
- 50 mL ekstrüderin tüm parçalarını % 70 (v/v) etanol ile temizleyin.
- Büyük delikli ekran desteğini, sinterlenmiş diski, drenaj disklerini ve polikarbonat membranını ekstrüder alt desteğindeki boşluğa yerleştirerek ekstrüderi monte edin. Dört vidayı kullanarak ekstrüder üst ve alt desteklerini bağlayın ve sıkın.
- Ekstrüder ünitesini tabana vidalayarak ve sabitlemek için bir anahtarla sıkarak numune silindirine takın.
NOT: Isı kullanılıyorsa, silindire bir termometre yerleştirin ve devam etmeden önce su istenen sıcaklığa ulaşana kadar bekleyin. Bu, numune sıcaklığının tüm ekstrüzyon işlemi boyunca korunmasını sağlayacaktır. - Numune silindirini ultra saf suyla doldurun. Numuneyi numune silindirine eklemeden önce suyu ekstrüder ünitesinden geçirin. Bu, mini ekstrüdere benzer şekilde zarları önceden ıslatmak için yapılır.
NOT: Azot açmadan önce kapağın tamamen vidalı olduğundan ve basınç tahliye vanasının tamamen kapatıldığından emin olun. Bu adım için minimum basınç gereklidir (~5-10 psi). - Lipid vesicle süspansiyonu numune silindirine ekleyin ve üstünü kapalı vidaleyin. Numune ekstrüder ünitesinden temiz bir cam şişeye yaklaşık 2-3 damla/ s oranında damlamaya başlayana kadar basıncı yavaşça artırın.
NOT: Çok fazla basınç zarları olumsuz etkileyebileceği ve başarısız ekstrüzyona yol açabileceği için bu adımda basıncı hızlı bir şekilde artırmayın. - Tüm numune ekstrüde edildikten sonra, N2 beslemesini kapatın ve basınç tahliye vanasını yavaşça açarak numune silindirinin basıncını serbest bırakın. Lipid veziklikları numune silindirine geri dökün ve toplam 10 ekstrüzyon için 9 kez daha 1.2.2.11 adımını tekrarlayın.
NOT: Ekstrüzyon için gerekli basınç, artan ekstrüzyon sayısı ile azalabilir, çünkü numune polikarbonat membran gözenek boyutuna daha homojen ve daha yakın hale gelir. - Ekstrüde lipid veziklin süspansiyonu bir sonraki kullanıma kadar 4 °C'de saklayın.
- 1 L şişeyi ters ozmos (RO) suyu ile doldurun.
- Mini (1 mL) ekstrüder işlemi
2. Lipid veziklinlerin karakterizasyonsu
- Dinamik ışık saçılımı (DLS) kullanılarak hidrodinamik çap ölçümü
- Vortex lipid vesicles ve pipet 50 μL lipid vesicle süspansiyon tek kullanımlık düşük hacimli bir cuvette içine. Toz ve döküntü ile kirlenmeyi önlemek için örtün.
- Veziklin süspansiyonu DLS cihazına yükleyin, örnek ayrıntıları girin ve ilgili yazılımı kullanarak ölçümü gerçekleştirin.
- Zeta potansiyeli
- Hücrenin girişlerine bağlanan şırınnalar kullanarak ultra saf su, %70 etanol ve ultra saf su ile yıkayarak katlanmış kılcal zeta hücresi hazırlayın. Sıvıyı hücreden 3-4 kez hafifçe itin ve bir sonraki çözeltiye geçmeden önce hücreyi tamamen boşaltın.
- Lipid veziklinleri vorteks edin ve ultra saf suda lipid veziklinlerinin 1:10 (v/v) seyreltilmesini hazırlayın.
- Seyreltilmiş lipid vesicle süspansiyonu yükleyin. Süspansiyonu şırınnalar arasında ileri geri iterek hava kabarcıklarını çıkarın. Stoperleri her girişe takın.
NOT: Ölçümü etkileyeceği için tüm kabarcıkları çıkarmak çok önemlidir. - Zeta hücresini numune odasına yerleştirin ve elektrotların temas etmesini sağlayın. Örnek odanın üst üst kısmından kapatın. İlişkili yazılımda, örnek ayrıntıları girin ve ölçümü toplayın.
3. QCM-D kullanarak tek lipid destekli lipid bilayer oluşturma
- Çözüm hazırlıkları
- Ultra saf suda %2 (w/v) sodyum dodecyl sülfat (SDS) çözeltisi hazırlayın. Tamamen çözünene kadar bir karıştırma plakası üzerinde karıştırın. En az 10 mL ultra saf su, %2 SDS ve Tris NaCl aliquot çalışma çözümleri.
- Tris NaCl tamponunda lipid veziküllerinin seyreltilmesini hazırlayın. Veziklin konsantrasyonu uygulamaya bağlıdır. Yumurta PC için, 0.01-0.5 mg/mL aralığındaki konsantrasyonların başarılı destekli lipid bilayer oluşumu ile sonuçlendiği gösterilmiştir.
- Silika kaplı kuvars kristal sensörlerinin temizlenmesi
NOT: QCM-D kristallerinin temizlenmesi, kullanılan sensörün yüzey malzemesine bağlıdır. Desteklenen lipid bilayerleri oluşturmak için, bu protokolde silika kaplı kuvars kristalleri kullanılır ve üreticinin standart çalışma prosedüründen uyarlanmış olarak aşağıda ayrıntılı olarak açıklanmıştır.- Silika kaplı kuvars kristal sensörini akış modülüne yerleştirin ve kristal üzerindeki "t"nin modüldeki "t" ile hizalanmasını sağlayın. Akış modülini vidala.
NOT: Kullanılan QCM-D, birden fazla akış modülünün aynı anda bağlanmasına ve çalıştırılmasına izin veriyorsa, ek modüller için aşağıdaki prosedürleri gerektiği gibi tekrarlayın. - Akış modülini, analizör sistemine bağlanan akış modülünden gelen elektrotlarla cihazın tabanına yerleştirin. Modülü yerine kilitleyin.
- Giriş ve çıkış borularını akış modülüne ve pompaya bağlayın. Boruyu tutma korumalarına yerleştirin ve analizör sisteminin kapağını kapatın. Harcanan çözeltileri toplamak için pompanın çıkışına bir atık konteyneri yerleştirin.
- Temizliği yapmak için önce pompayı açın. Akış hızını 400 μL/dk olarak ayarlayın. Giriş borularını ultra saf suya yerleştirin ve modülden 5-10 mL akış.
- Giriş borularını % 2 SDS'ye geçirin ve modülden 5-10 mL akışa alın. Giriş borularını tekrar ultra saf suya geçirin ve modülden 10-20 mL akışa alın. Giriş borularını çözeltiden çıkarın ve tüm sıvı dışarı atılana kadar borudan hava akışı.
NOT: Yukarıdaki temizleme protokolü her ölçümden önce ve sonra günlük olarak kullanılır. Gerektiğinde kapsamlı bir temizlik yapılabilir. Kısaca, kapsamlı bir temizlik yapmak için akış modüllerini sökün. Akış modülünün elektrot tarafı dışındaki tüm bileşenler% 2 (w / v) SDS'ye batırılmalı ve banyo sonicated, ardından ultra saf su ile iyice durulanma ve N2 gaz akışı ile kurutulmalıdır. Elektrot pimlerini içeren akış modülünün bileşeni asla sıvı ile temas etmemelidir. - Sensörü akış modülünden çıkarın ve sensörü ultra saf suyla durulayın. Sensörü bir N2 gaz akışı ile kurutun. Akış modülini bir N2 gaz akışı ile kurutun. Elektrotunun her zaman herhangi bir sıvı içermemesini sağlayın.
- Kimyasal duman kaputunda, silika kaplı kuvars kristal sensörunu ultra mor (UV)/ozon temizleme cihazına yerleştirin. Cihazı açın ve en az 2 dakika boyunca tedaviye izin verin. Sensörleri dikkatlice çıkarın ve akış modülüne geri dönün.
- Silika kaplı kuvars kristal sensörini akış modülüne yerleştirin ve kristal üzerindeki "t"nin modüldeki "t" ile hizalanmasını sağlayın. Akış modülini vidala.
- Tris NaCl taban çizgisi oluşturma
- İlişkili yazılıma bağlanmak için analizör aletini açın ve sıcaklığı desteklenen lipid bilayer için istenen değere ayarlayın. Sıcaklığın istenen girişe sabitlenmesine izin verin.
NOT: Ayarlanan sıcaklık oda sıcaklığının üzerindeyse, tüm çözeltiler bir ısı bloğu kullanılarak aynı sıcaklığa ısıtılmalıdır. - Ölçümü yapılandırın ve ölçüme başlamadan önce 3, 5, 7, 9, 11 ve 13'ün aşırı tonları için tüm sensör rezonans frekanslarını ve dağılımlarını bulun.
NOT: Bu harmonik aşırı hassas olduğundan ve gürültülü veriler ürettiği için 1st aşırı ton göz ardı edilebilir. - Pompayı açın ve akış hızını 175 μL/dk veya istenen deneysel akış hızına ayarlayın.
- Tris NaCl'e takmadan önce giriş borularını etanol ile silin. Ölçümü başlatın ve Tris NaCl'yi akmaya başlayın.
NOT: Veriler gerçek zamanlı olarak toplanır ve izlenir. Akış modülünde havadan sıvıya değişim, veri toplama yazılımında hızlı bir dağılım değişimi (ΔD) artışı ve frekans değişimi (ΔF) azalması ile gözlemlenecektir. - Tris NaCl'in modülden 5-10 dakika akmasına izin vererek sıvıdaki temel ΔF ve ΔD değerlerinin sabit kalmasını sağlayın.
- İlişkili yazılıma bağlanmak için analizör aletini açın ve sıcaklığı desteklenen lipid bilayer için istenen değere ayarlayın. Sıcaklığın istenen girişe sabitlenmesine izin verin.
- Tek lipid destekli lipid bilayer oluşturma
- Pompayı durdurun ve giriş borularını Tris NaCl çözeltisinden çıkarın ve lipid vezikül çözeltisine dikkatlice yerleştirin. Giriş tüpünden herhangi bir hava kabarcığını çıkarmak için 5 sn boyunca geri akış ve ardından ileri akışa devam edin. Temel sıfırlamak için yazılımdaki ölçümü yeniden başlatın.
NOT: Modülden akabilen ve bilayer oluşumunu ve veri kaydını bozabilen borudaki hava kabarcıklarından kaçınmaya dikkat edin. - Veri toplama yazılımında (yumurta PC vezikülleri için en az 8 dk) gerçek zamanlı olarak bilayer oluşumu gözlenene kadar lipid vezikülleri akış.
- Lipid veziküllerden giriş borularını Tris NaCl arabelleğine geri değiştirmek için 3.4.1 adımını tekrarlayın.
NOT: İstenen uygulama moleküler etkileşimleri incelemekse, çözüm akışını veya veri alımını durdurmadan doğrudan 6.1 adımına devam edin. Çift noktadaki formasyon uç nokta ise, 3.4.4 adımına geçin. - Yazılımda, ölçümü durdurun ve dosyayı kaydedin. Pompayı durdurun.
- Protokol adımları 3.2.4 ve 3.2.5'i izleyerek akış modülünü ve silika kaplı kuvars kristal sensörünü temizleyin.
- Pompayı durdurun ve giriş borularını Tris NaCl çözeltisinden çıkarın ve lipid vezikül çözeltisine dikkatlice yerleştirin. Giriş tüpünden herhangi bir hava kabarcığını çıkarmak için 5 sn boyunca geri akış ve ardından ileri akışa devam edin. Temel sıfırlamak için yazılımdaki ölçümü yeniden başlatın.
4. Askıya alınmış bir lipid bilayer oluşturma
NOT: Askıya alınmış bir lipid bilayer oluşturma protokolü, filtre plakası üreticisi37tarafından sağlanan paralel yapay membran geçirgenlik test (PAMPA) protokolünden uyarlanmıştır.
- 20 mg/mL'de (örneğin, 1,2-dioleoyl-sn-glisero-3-fosfokolin (DOPC)) dodecane istenen lipid'i çözün.
- Gözenekli polivinylidene difluorid (PVDF) 96 kuyulu çok ekranlı filtre plakası (0,45 μm gözenek boyutu) olan donör bölmesine 5 μL lipid çözeltisi ekleyin.
- Filtre plakasını hemen 300 μL 1× fosfat tamponlu salin (PBS) içeren bir taşıma alıcı plakası olan alıcı bölmesine batırın. Donör bölmesine 200 μL 1× PBS ekleyin.
NOT: Yalnızca lipid içeren filtrelerin ve 1× PBS'ye maruz kalan tedavi edilmemiş filtrelerin kontrolleri dahil edilebilir. - Askıya alınan lipid bilayer ile moleküler etkileşimleri araştırmak için doğrudan bölüm 6.2'ye devam edin. Çalışmanın askıya alınan bilayer'i oluşturduktan sonra 16 saat içinde tamamlanması önerilir.
5. Veziklin ve bilayerleri taklit eden çoklu lipid hücresi geliştirme
- Memeli hücrelerinden lipid ekstraksiyonu
NOT: Lipid ekstraksiyonu Bligh-Dyer yaklaşımını takip eder38.- İstediğiniz hücre satırını uygun şekilde kültüre edin. % 70-80 izdiham (T75 şişesi) elde ettikten sonra, hücreleri 5 dakika boyunca 37 °C'de tripsin-etylenediaminetretaasetik asit kullanarak ayırır.
- 200 × g'da santrifüj hücreleri 5 dakika boyunca. Süpernatant çıkarın ve hücre peletini 1 mL ultra saf suya yeniden sunun.
- Hücre süspansiyonu ve girdabına 15 dakika boyunca 1:2 (v/v) kloroform:metanol karışımından 3,75 mL ekleyin. Ardından, 1 dakika boyunca 1,25 mL kloroform ve girdap ekleyin. Son olarak, 1 dakika boyunca 1,25 mL su ve girdap ekleyin.
- 10 dakika boyunca 1000 x g'da santrifüj hücre karışımı. Organik fazda lipitler içeren sıvının alt tabakasını toplayın. N2 gazı akışı altında kurutun.
- Sıvı kromatografi-kütle spektrometresi (LC-MS) kullanarak lipid içeriğini C18 ters faz, 3,5 μm × 50 mm sütun kullanarak ölçün.
- Mobil faz için, ilki 60:40 (v/v) asetonitril:su ve ikincisi 90:10 (v/v) izopropanol:asetonitril ile iki çözüm hazırlayın. Amonyum format her iki çözeltiye de 10 mM'lik son konsantrasyonda eklenmelidir. 60 dakikanın üzerinde, mobil faz gradyanını ikinci çözümün % 35'inden (v/v) %95'e (v/v) çıkarın.
- Atık suyu negatif iyonlaşma modunda, ardışık tam tarama MS ve tandem MS/MS ile tespit edin. LIPID MAPS kütle spektrometresi analiz araçlarını kullanarak çarpışma kaynaklı ayrışma parçalanmadan elde edilen kütle spektrumunu analiz edin. Her lipid türünün bolluğunu belirleyerek alanı eğrinin altına entegre etmek için ayıklanmış iyon kromatogramları elde edin.
- Her farklı fosfolipid sınıfı için göreli algılama hassaslarını belirlemek üzere ana lipit sınıflarını içeren bir lipit standardı için 5.1.5-5.1.7 adımlarını uygulayın.
- Çoklu lipid veziklin geliştirme
- 5.1 adımında tanımlanarak, istenen her bir bilayer bileşenini temsil eden lipitler için lipit stok çözümleri hazırlamak için 1.1.1'deki adımları izleyin.
- Adım 5.1'den elde edilen lipit bileşimlerine dayanarak, 2.5 mg/ mL'lik son bir veziklin konsantrasyonu için gerekli olan temiz bir cam şişeye uygun lipid / kloroform stoğu hacmini ekleyin. N2 gazı akışı altında dökme kloroform kurutma çözeltisini çıkarın.
- Çok lipidli veziklin oluşturmak için 1.1.2, 1.1.3 ve 1.2 adımlarını izleyin. Veziklin karakterizasyonu için 2.
- QCM-D kullanarak multi-lipid destekli lipid bilayer oluşturma
NOT: Bazı multi-lipid vesicles, adım 3'te sunulan uni-lipid PC vesicles'e benzer spontan lipid vesicle yırtılmasına ve bilayer oluşumuna neden olabilir. Bununla birlikte, daha karmaşık multi-lipid vesicles veziklin yırtılmasına yardımcı olmak için dış girdi gerektirebilir. Burada, AH peptit, ikiyer oluşumu ile sonuçlanan vezikliğin dış broşürünü istikrarsızlaştırmak için kullanılır. İstenirse istikrarsızlaşma ve vezikli rüptürü elde etmek için diğer yöntemler düşünülebilir.- Adım 5.2'de oluşan çoklu lipid veziklinleri kullanarak çok lipid destekli lipid bilayer oluşturmak için 3.
- Veziklin bir bilayer içine kendiliğinden yırtılma gözlenmezse, AH peptidi kullanarak vesicle dengesizleştirme girişiminde bulunun. AH peptidi hazırlayın (peptit dizisi: H-Ser−Gli−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−İle−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2) çözeltisi Tris NaCl'de 13 μM'de %1 (v/v) dimetilsüloksit, DMSO ile.
- 3.4.1-3.4.3 adımlarını izleyin. 3.4.3 adımından sonra, giriş borularını AH peptit çözeltisine değiştirin. Yeni çözelti ilavesinden ΔF ve ΔD gözlemlenene kadar çözeltiyi akış modülüne sokun. Pompayı durdurun ve AH peptidinin veziklilerle 10 dakika boyunca kuluçkaya yatmasına izin verin.
- Giriş borularını Tris NaCl'ye geçirin ve ah peptidi yırtılmış veziküllerden çıkarmak için akışı başlatın ve bu da lipid bilayerinin başarılı bir şekilde oluşmasına yol açtı.
NOT: İstenen uygulama moleküler etkileşimleri incelemekse, çözüm akışını veya veri alımını durdurmadan 6.1 adımına devam edin. - Yazılımda, ölçümü durdurun ve dosyayı kaydedin. Pompayı durdurun.
- Protokol adımları 3.2.4-3.2.6'yı izleyerek akış modülünü ve silika kaplı kuvars kristal sensörünü temizleyin.
- Askıya alınmış çok lipidli bilayerler
- 20 mg/mL'de dodecane istenen lipitlerin karışımını çözün.
- İstenen hücre mimasaj bileşimini kullanarak 5 μL lipid karışım çözeltisi yapın.
- 4.2 ve 4.3 adımlarını izleyin.
NOT: Askıya alınan lipid bilayer ile moleküler etkileşimleri araştırmak için doğrudan 6.2 adımına devam edin.
6. Tek lipid ve çoklu lipid bilayerleri ile molekül etkileşim çalışmaları
- QCM-D kullanarak desteklenen bir lipid bilayer ile moleküler etkileşimleri incelemek
- Desteklenen bir lipid bilayer ile adsorpsiyonu araştırmak için istenen molekülün bir çözeltisini hazırlayın. Örneğin, Tris NaCl'de %1 (v/v) DMSO ile 200 μM di(2-etilheksil) fitalat (DEHP) çözeltisi hazırlayın.
- Molekül çözeltisi Tris NaCl'de hazırlanırsa, tek lipidli bir bilayer için 3.4.3 veya çok lipidli bir bilayer için 5.3.4 adımını izleyerek doğrudan akabilir. Molekülün farklı bir çözücüde hazırlanması gerekiyorsa, bunun yerine giriş borularını istenen çözücüye en az 5 dakika boyunca tek başına yerleştirin (örneğin, DEHP için% 1 (v/ v) DMSO'ya sahip Tris NaCl).
NOT: Çözücüye bağlı viskozite değişiklikleri, ilgi molekülünün girişinden önce ve sonra akarak izlenebilir ve düşünülebilir. - Giriş borularını en az 5 dakika boyunca ilgi ve akış molekülünü içeren çözeltiye geçirin. Akış da durdurulabilir ve istenirse bilayer ile kuluçkaya yatmasına izin verilen istenen molekülü içeren sıvı.
- Tris NaCl'den başka bir şey varsa, giriş borularını tek başına molekül çözücüye geri döndür. En az 5 dakika akar. Ardından, giriş borularını Tris NaCl'ye geçirin ve en az 5 dakika akar.
- Yazılımda, ölçümü durdurun ve dosyayı kaydedin. Pompayı durdurun.
- Protokol adımları 3.2.4-3.2.6'yı izleyerek akış modülünü ve silika kaplı kuvars kristal sensörünü temizleyin.
- PAMPA kullanarak askıya alınmış lipid bilayerleri ile moleküler etkileşimleri incelemek
- İstenilen molekülün bir çözeltisini hazırlayın. Örneğin, %1 (v/v) DMSO ile 1× PBS'de 200 μM DEHP hazırlayın.
- Kuyu başına 300 μL taze 1x PBS ile yeni bir taşıma alıcı plakası hazırlayın.
- Tek lipid askıya alınmış bir bilayer için 3.3 veya çok lipid asılı bir bilayer için 4.4.3 adımını takiben, 1× PBS'yi çok ekranlı filtre plakasının donör bölmesinden çıkarın ve test çözümünün 200 μL ile değiştirin. 6.2.2 adımında hazırlanan taşıma alıcı plakasına hemen batırın.
- 25 °C'de istediğiniz süre boyunca (örneğin, 2 saat) hafif sallanarak kuluçkaya yatırın.
- Kuluçkadan sonra, donör ve alıcı bölmelerinden çözeltinin 150 μL'sini toplayın. Bu molekülün özelliklerine göre uygun bir yöntem kullanarak her iki örnekteki molekül konsantrasyonu ölçülün.
- Örneğin, DEHP için 280 nm gibi uygun absorbans dalga boylarına sahip bir mikro plaka spektrofotometre kullanın ve ilgi molekülünün standart bir eğrisiyle karşılaştırın.
- Aşağıdaki denklemleri kullanarak ilgi molekülünün görünür geçirgenliğini (Puygulaması)hesaplayın:
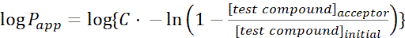 (1)
(1)
Nerede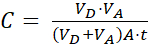 (2)
(2)
NOT: [test bileşiği]kabul eden, ilgi molekülünün (örneğin, DEHP) zaman zaman, t, kabul eden bölmede konsantrasyonudur; ve [test bileşiği]ilk molekülün ilk konsantrasyonudur. A membran alanı, t zaman, VD donör bölmesi hacmi ve VA kabul eden bölme hacmidir.
Sonuçlar
Bu protokolde desteklenen ve askıya alınmış lipid bilayerleri oluşturma yöntemleri ayrıntılı olarak açıklanmıştır (Şekil 1). Desteklenen bir lipid bilayer oluşturmanın ilk adımı lipid veziklin geliştirmektir. Mini ekstrüder, küçük hacimlerde lipid veziklin hazırlanmasına (1 mL veya daha az) izin verirken, büyük ekstrüder 5-50 mL lipid veziklin tek bir parti halinde hazırlanmasını sağlar. Mini veya büyük ekstrüder tarafından oluşturulan tek lipid veziklin...
Tartışmalar
Bu protokol lipid veziklinlerin, desteklenen lipid bilayerlerin ve askıya alınmış lipid bilayerlerinin oluşumuna izin verir. Burada, bu yapıların her birini oluşturmak için kritik adımlar sunulmaktadır. Lipid veziklin oluştururken, lipit geçiş sıcaklığının üzerinde ekstrüzyonyapmak önemlidir 39. Geçiş sıcaklığının altında olduğunda, lipit fiziksel olarak sipariş edilen jel faz39'dabulunur. Bu sıralı fazda hidrokarbon lipid kuyrukları tamam...
Açıklamalar
Yazarlar, çıkar çatışması veya rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Bu materyal, A.S.'ye verilen 1942418 No.'luk Hibe kapsamında Ulusal Bilim Vakfı tarafından desteklenen çalışmalara ve C.M.B.H.'ye verilen Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu'na, 1644760 No. Hibesi kapsamında dayanmaktadır. Bu materyalde ifade edilen herhangi bir görüş, bulgu ve sonuç veya öneri yazarların görüşleridir ve Ulusal Bilim Vakfı'nın görüşlerini yansıtmak zorunda değildir. Yazarlar, lipid vesicle karakterizasyon veri toplama için Dr. Noel Vera-González'e teşekkür ediyor. Yazarlar, Zetasizer'ını kullandığı için Profesör Robert Hurt'a (Brown Üniversitesi) teşekkür eder. Yazarlar, Brown Üniversitesi Kütle Spektrometresi Tesisi'ne, özellikle de Lipid bileşiminin ölçülmesine yardımcı olduğu için Dr. Tun-Li Shen'e teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Referanslar
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır