Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensamblaje de modelos de bicapa lipídica soportada y suspendida de imitación celular para el estudio de interacciones moleculares
En este artículo
Resumen
Este protocolo describe la formación de vesículas unilipídicas y multilipídicas que imitan a las células, bicapas lipídicas soportadas y bicapas lipídicas suspendidas. Estos modelos in vitro se pueden adaptar para incorporar una variedad de tipos de lípidos y se pueden utilizar para investigar diversas interacciones de moléculas y macromoléculas.
Resumen
Las membranas celulares modelo son una herramienta de detección útil con aplicaciones que van desde el descubrimiento temprano de fármacos hasta los estudios de toxicidad. La membrana celular es una barrera protectora crucial para todos los tipos de células, separando los componentes celulares internos del entorno extracelular. Estas membranas están compuestas en gran parte por una bicapa lipídica, que contiene grupos de cabeza hidrófilos externos y grupos de cola hidrófobos internos, junto con varias proteínas y colesterol. La composición y la estructura de los lípidos en sí mismos juegan un papel crucial en la regulación de la función biológica, incluidas las interacciones entre las células y el microambiente celular, que puede contener productos farmacéuticos, toxinas biológicas y tóxicos ambientales. En este estudio, se describen métodos para formular bicapas lipídicas y multilipídicas apoyadas y suspendidas que imitan a las células lipídicas. Anteriormente, se desarrollaron bicapas lipídicas de fosfatidilcolina (PC) unilídicas, así como bicapas lipídicas inspiradas en trofoblastos placentarios multilípidos para su uso en la comprensión de las interacciones moleculares. Aquí, se presentarán los métodos para lograr ambos tipos de modelos bicapa. Para las bicapas multilipídicas que imitan a las células, la composición lipídica deseada se determina primero mediante la extracción de lípidos de células primarias o líneas celulares, seguida de cromatografía líquida-espectrometría de masas (LC-MS). Utilizando esta composición, las vesículas lipídicas se fabrican utilizando un método de hidratación y extrusión de película delgada y se caracterizan su diámetro hidrodinámico y potencial zeta. Las bicapas lipídicas soportadas y suspendidas se pueden formar utilizando microbalanza de cristal de cuarzo con monitoreo de disipación (QCM-D) y en una membrana porosa para su uso en un ensayo de permeabilidad de membrana artificial paralela (PAMPA), respectivamente. Los resultados representativos destacan la reproducibilidad y versatilidad de los modelos de bicapa lipídica de membrana celular in vitro. Los métodos presentados pueden ayudar en la evaluación rápida y fácil de los mecanismos de interacción, como la permeación, la adsorción y la incrustación, de varias moléculas y macromoléculas con una membrana celular, ayudando en la detección de candidatos a fármacos y la predicción de la toxicidad celular potencial.
Introducción
La membrana celular, compuesta principalmente de fosfolípidos, colesterol y proteínas, es un componente crucial de todas las células vivas1. Con una organización impulsada por la anfifilia lipídica, la membrana celular funciona como una barrera protectora y regula cómo la célula interactúa con su entorno circundante2. Varios procesos celulares dependen de la composición lipídica y proteica de la membrana1,2. Por ejemplo, las interacciones de la membrana celular son importantes para la administración efectiva de fármacos3. Los productos farmacéuticos, biológicos, nanomateriales, toxinas biológicas y tóxicos ambientales pueden afectar la integridad de una membrana celular, afectando así la función celular4. La construcción de modelos de membrana que imitan células in vitro basados en la composición lipídica de las membranas celulares tiene el potencial de proporcionar herramientas fáciles para mejorar en gran medida el estudio del impacto potencial de estos materiales en las células.
Las bicapas lipídicas modelo incluyen vesículas lipídicas, bicapas lipídicas soportadas y bicapas lipídicas suspendidas. Las bicapas lipídicas soportadas son un modelo de la membrana celular fosfolípida comúnmente utilizada en aplicaciones biotecnológicas donde las vesículas lipídicas se rompen sobre un material de sustrato soportado5,6,7,8,9. Una técnica común utilizada para monitorear la formación de bicapa es la microbalanza de cristal de cuarzo con monitoreo de disipación (QCM-D), que examina la adsorción de vesículas en comparación con las propiedades líquidas a granel in situ8,10,11,12,13,14 . Anteriormente, QCM-D se ha utilizado para demostrar que en condiciones de flujo, una vez que se logra una cobertura crítica de vesículas lipídicas de fosfatidilcolina (PC) en la superficie, se rompen espontáneamente en bicapas lipídicas rígidas15. Trabajos anteriores también han investigado la formación de bicapas lipídicas apoyadas con composiciones lipídicas variables16,la incorporación de proteínas lipídicas17, 18,19y la utilización de cojines de polímeros20,produciendo bicapas lipídicas soportadas capaces de imitar varios aspectos de la función de la membrana celular.
Las bicapas lipídicas se han utilizado para imitar varias barreras biológicas desde los niveles subcelulares hasta los de órganos, incluidas la mitocondria, los glóbulos rojos y las membranas de las células hepáticas, alterando los componentes de fosfolípidos, colesterol y glicolípidos21. Estas vesículas multilipídicas más complejas pueden requerir métodos adicionales para lograr la ruptura de la vesícula, dependiendo de la composición lipídica. Por ejemplo, estudios previos han utilizado un péptido α-helicoidal (AH) derivado de la proteína no estructural 5A del virus de la hepatitis C para inducir la formación de bicapa desestabilizando las vesículas lipídicas adsorbidas22,23. Usando este péptido AH, previamente se han formado bicapas lipídicas soportadas que imitan las célulasplacentarias 24. El gran potencial de las bicapas lipídicas soportadas para aplicaciones biomédicas se ha demostrado con investigaciones que abarcan el transporte molecular y de nanopartículas25,26,interacciones tóxicas ambientales27,ensamblaje y función de proteínas17,18,19,disposición e inserción de péptidos28,29,detección de fármacos30y plataformas microfluídicas31.
Las bicapas lipídicas suspendidas se han utilizado para estudios de cribado farmacéutico a través de un ensayo paralelo de permeabilidad a la membrana artificial (PAMPA) donde se suspende una bicapa lipídica a través de un inserto hidrofóbico poroso32,33,34,35. Se han desarrollado modelos lipídicos de PAMPA para diferentes interfaces biológicas, incluidas las interfaces sangre-cerebro, bucal, intestinal y transdérmica36. Al combinar tanto la bicapa lipídica soportada como las técnicas PAMPA, se puede estudiar a fondo la adsorción, la permeabilidad y la incrustación de compuestos dentro de los componentes lipídicos de un tejido o tipo de célula deseado.
Este protocolo describe la fabricación y aplicación de modelos de bicapa lipídica de membrana celular in vitro para investigar varias interacciones moleculares. Se detalla la preparación de las bicapas lipídicas y suspendidas de lípidos unilipídicas y multilídicas. Para formar una bicapa lipídica soportada, las vesículas lipídicas se desarrollan primero utilizando métodos de hidratación y extrusión de película delgada seguidos de caracterización fisicoquímica. Se discute la formación de una bicapa lipídica soportada utilizando el monitoreo QCM-D y la fabricación de membranas lipídicas suspendidas para su uso en PAMPA. Finalmente, se examinan las vesículas multilipídicas para el desarrollo de membranas que imitan células más complejas. Utilizando ambos tipos de membranas lipídicas fabricadas, este protocolo demuestra cómo esta herramienta se puede utilizar para estudiar las interacciones moleculares. En general, esta técnica construye bicapas lipídicas que imitan a las células con alta reproducibilidad y versatilidad.
Protocolo
1. Desarrollo de vesículas unilipídicas
- Método de hidratación de película delgada
- Preparación y almacenamiento de soluciones de almacenamiento de lípidos
NOTA: Todos los pasos que usan cloroformo deben realizarse en una campana de humos químicos. El cloroformo siempre debe pipetearse con puntas de pipeta de fibra de carbono seguras para solventes. Las soluciones que contienen cloroformo siempre deben almacenarse en viales de vidrio.- Prepare una solución de caldo de lípidos de 10 mg/ml agregando el volumen apropiado de cloroformo en el vial que contiene el polvo lipídico y mezcle bien. Por ejemplo, agregue 20 ml de cloroformo a 200 mg de L-α-fosfatidilcolina (huevo, pollo) (eggPC). La solución madre se puede hacer a una concentración diferente si es necesario.
NOTA: Si el lípido en polvo se almacenó en una ampolla, después de agregar cloroformo, transfiera a un vial de vidrio con una tapa revestida de politetrafluoroetileno (PTFE). - Selle la tapa del vial con Parafilm y guárdela a -20 °C durante un máximo de 6 meses.
- Prepare una solución de caldo de lípidos de 10 mg/ml agregando el volumen apropiado de cloroformo en el vial que contiene el polvo lipídico y mezcle bien. Por ejemplo, agregue 20 ml de cloroformo a 200 mg de L-α-fosfatidilcolina (huevo, pollo) (eggPC). La solución madre se puede hacer a una concentración diferente si es necesario.
- Formación de una película de lípidos secos
- Añadir el volumen apropiado de solución de almacenamiento de lípidos en un vial de vidrio limpio necesario para una concentración final de vesícula de 2,5 mg/ml. Por ejemplo, para formar 1 ml de vesículas de PC de huevo a 2,5 mg/ml, pipetee 250 μL de solución madre de PC de huevo en el vial.
NOTA: El volumen preparado puede depender del proceso de extrusora que se esté utilizando (consulte el paso 1.3). El volumen máximo recomendado de la mini extrusora es de 1 ml, mientras que el rango de volumen de la extrusora grande es de 5-50 ml. - Retire el cloroformo de la solución de reserva de lípidos utilizando una corriente de gasN 2 (grado ultrapuro 5.0).
- Para garantizar la eliminación completa del cloroformo, conecte la película lipídica seca al vacío y déjela durante al menos 4 h.
NOTA: El proceso se puede detener aquí. Si la película lipídica no se va a utilizar inmediatamente después del secado al vacío, almacenar en un desecador hasta que se utilice. Hemos observado que estas películas lipídicas producen vesículas de calidad similar después de 1 semana de almacenamiento en estas condiciones; la calidad de la vesícula después de duraciones de almacenamiento más largas, si es necesario, debe explorarse más a fondo.
- Añadir el volumen apropiado de solución de almacenamiento de lípidos en un vial de vidrio limpio necesario para una concentración final de vesícula de 2,5 mg/ml. Por ejemplo, para formar 1 ml de vesículas de PC de huevo a 2,5 mg/ml, pipetee 250 μL de solución madre de PC de huevo en el vial.
- Realización de ciclos de congelación-descongelación-vórtice
- Prepare una solución tampón de cloruro de sodio Tris (NaCl) que contenga 10 mM de base Tris y 100 mM de NaCl. Rehidrate la película lipídica seca con el volumen requerido de tampón Tris NaCl para producir una concentración final de vesícula de 2.5 mg / ml y vórtice durante aproximadamente 15-30 s.
- Transfiera la suspensión de vesículas a un recipiente con hielo seco hasta que se congele, aproximadamente 30 min. Después de que la muestra esté completamente congelada, descongele la suspensión en un baño de agua de 30-40 °C. Vórtice la suspensión de vesícula descongelada.
NOTA: El líquido N2 se puede utilizar en lugar de hielo seco. Transfiera la suspensión de vesículas a nitrógeno líquido durante 30 s, y luego descongele inmediatamente en un baño de agua a 80 ° C. - Repita el paso 1.1.3.2 4 veces más, para un total de 5 ciclos de congelación-descongelación-vórtice.
- Preparación y almacenamiento de soluciones de almacenamiento de lípidos
- Extrusión
NOTA: Después de que se completan los ciclos de congelación-descongelación-vórtice, se forman vesículas multilamelares. La extrusión ayuda a reducir el tamaño y desarrollar grandes vesículas unilamelares.- Proceso de extrusora Mini (1 ml)
- Limpie a fondo todos los componentes de la extrusora con un detergente suave en agua ultrapura y enjuague al menos tres veces con agua ultrapura asegurándose de que se elimine todo el detergente. Secar con gasN 2.
- Ensamble los dos soportes de membrana interna y las juntas tóricas (diámetro interior de 12,7 mm; diámetro exterior de 15,2 mm). Coloque cada soporte de membrana de modo que la junta tórica esté hacia arriba.
- Pre-mojar un soporte de filtro con agua ultrapura. Colóquelo en la superficie de soporte de la membrana dentro de la junta tórica. Repita para el segundo soporte de membrana interna.
- Coloque un soporte de membrana interna en la carcasa exterior del extrusor. Coloque una membrana de policarbonato de 100 nm sobre el soporte de la membrana interna, directamente sobre el soporte del filtro.
NOTA: Las membranas de policarbonato se almacenan por separado entre trozos de papel de color azul. Retire el papel separador antes de insertarlo en el soporte de la membrana. - Coloque el segundo soporte de membrana interna en la carcasa exterior del extrusor con la junta tórica y el lado de soporte del filtro frente a la membrana de policarbonato. Coloque el cojinete de PTFE en la tuerca del retenedor y cierre el tornillo con la carcasa exterior del extrusor. Enganche la extrusora en el bloque de calentamiento.
- Cargue la suspensión de vesícula lipídica en una de las jeringas y coloque la jeringa en el bloque de calor del extrusor, insertando la aguja completamente en un extremo del extrusor. Inserte la segunda jeringa vacía en el lado opuesto y bloquee ambas jeringas con los clips para el brazo en el bloque de calor.
NOTA: Si es necesario, coloque el bloque de calor de la extrusora en una placa caliente y ajuste la temperatura a un valor por encima de la temperatura de transición del lípido. Inserte un termómetro en el soporte integrado en el bloque de calor para obtener lecturas de temperatura precisas y espere hasta que se alcance la temperatura requerida (~ 15 min). Las vesículas lipídicas de HUEVO PC no requieren calor durante la extrusión. - Empuje lentamente la suspensión de la vesícula en la jeringa vacía y luego vuelva a la jeringa original. Supervise los cambios de presión en toda la extrusión que indiquen una fuga. Repita 20 veces más para un total de 21 pasadas a través de la membrana de policarbonato. Transfiera las vesículas lipídicas a un vial de vidrio limpio para su almacenamiento.
NOTA: El número de extrusiones se puede optimizar en función de la composición lipídica. - Si se usó calor, permita que la suspensión de vesículas extruidas alcance la temperatura ambiente. Guarde las vesículas lipídicas extruidas a 4 °C hasta su uso posterior.
NOTA: La duración recomendada del almacenamiento de vesículas depende en gran medida de la composición lipídica, y las propiedades fisicoquímicas de las vesículas (por ejemplo, diámetro hidrodinámico, potencial zeta) deben controlarse a lo largo del tiempo. Por ejemplo, las vesículas de PC de huevo se han almacenado durante al menos dos semanas sin cambios en el tamaño de la vesícula o la capacidad de formación de bicapas.
- Proceso de extrusora grande (5-50 ml)
NOTA: Siga los pasos 1.2.2.1-1.2.2.5 si se requiere calor para el lípido elegido. Vaya al paso 1.2.2.5 si no se necesita calor. Los pasos 1.2.2.1-1.2.2.4 no son necesarios para el PC de huevo.- Llene un matraz de 1 L con agua de ósmosis inversa (RO).
NOTA: No use agua ultrapura para circular a través del sistema de 50 ml, ya que puede hacer que los iones metálicos se filtren del cilindro del extrusor. - Coloque el matraz de 1 L en un baño de agua en una placa caliente y ajuste la placa caliente a una temperatura superior a la temperatura de transición del lípido.
- Conecte el cilindro de muestra al matraz con tubos flexibles a través de la entrada del cilindro de muestra. Coloque el tubo en la salida del cilindro a la parte superior del matraz de 1 L. Asegure el tubo tanto en la entrada como en la salida, según sea necesario. Esto creará un flujo unidireccional del agua a través del cilindro de muestra.
- Encienda la bomba para iniciar la circulación del agua. Si se necesita calor, espere aproximadamente 30-45 minutos para que el cilindro de muestra alcance la temperatura deseada.
- Conecte la tapa del cilindro de muestra a un tanque de nitrógeno a través del conector flexible conectado a la unidad de válvula de alivio de presión.
- Limpie todas las partes de la extrusora de 50 ml con etanol al 70% (v/v).
- Ensamble la extrusora colocando el soporte de la pantalla de orificio grande, el disco sinterizado, los discos de drenaje y la membrana de policarbonato en el espacio en el soporte inferior del extrusor. Conecte los soportes superior e inferior de la extrusora con los cuatro tornillos y apriete.
- Conecte la unidad extrusora al cilindro de muestra atornillando a la parte inferior y apretando con una llave inglesa para asegurar.
NOTA: Si se usa calor, coloque un termómetro en el cilindro y espere hasta que el agua haya alcanzado la temperatura deseada antes de continuar. Esto asegurará que la temperatura de la muestra se mantenga durante todo el proceso de extrusión. - Llene el cilindro de muestra con agua ultrapura. Extruya el agua a través de la unidad extrusora antes de agregar la muestra al cilindro de muestra. Esto se hace para pre-mojar las membranas, similar a la mini extrusora.
NOTA: Asegúrese de que la tapa esté completamente atornillada y que la válvula de alivio de presión esté completamente cerrada antes de encender el nitrógeno. Se requiere una presión mínima para este paso (~ 5-10 psi). - Agregue la suspensión de vesícula lipídica en el cilindro de muestra y cierre la parte superior. Aumente lentamente la presión hasta que la muestra comience a gotear desde la unidad extrusora a una velocidad de aproximadamente 2-3 gotas / s en un vial de vidrio limpio.
NOTA: No aumente la presión rápidamente en este paso, ya que demasiada presión puede afectar negativamente a las membranas y provocar una extrusión fallida. - Una vez que se haya extruido toda la muestra, apague el suministro deN 2 y libere la presión en el cilindro de muestra abriendo lentamente la válvula de alivio de presión. Vierta las vesículas lipídicas de nuevo en el cilindro de muestra y repita el paso 1.2.2.11, 9 veces más para un total de 10 extrusiones.
NOTA: La presión requerida para la extrusión puede disminuir con el aumento del número de extrusiones, a medida que la muestra se vuelve más homogénea y más cercana en tamaño al tamaño del poro de la membrana de policarbonato. - Guarde la suspensión de vesícula lipídica extruida a 4 °C hasta su uso posterior.
- Llene un matraz de 1 L con agua de ósmosis inversa (RO).
- Proceso de extrusora Mini (1 ml)
2. Caracterización de vesículas lipídicas
- Medición del diámetro hidrodinámico mediante dispersión dinámica de la luz (DLS)
- Vesículas lipídicas de vórtice y pipetear 50 μL de la suspensión de vesícula lipídica en una cubeta desechable de bajo volumen. Cubierta para evitar la contaminación con polvo y escombros.
- Cargue la suspensión de vesículas en el instrumento DLS, ingrese los detalles de la muestra y realice la medición utilizando el software asociado.
- Potencial Zeta
- Prepare una célula zeta capilar plegada lavando con agua ultrapura, etanol al 70% y agua ultrapura con jeringas que se conecten a las entradas de la célula. Empuje suavemente el líquido a través de la celda 3-4 veces y vacíe la celda por completo antes de cambiar a la siguiente solución.
- Vórtice las vesículas lipídicas y prepare una dilución 1:10 (v/v) de las vesículas lipídicas en agua ultrapura.
- Cargue la suspensión de vesícula lipídica diluida. Retire las burbujas de aire empujando la suspensión hacia adelante y hacia atrás entre las jeringas. Coloque los tapones en cada entrada.
NOTA: Es crucial eliminar todas las burbujas, ya que esto afectará la medición. - Coloque la celda zeta en la cámara de muestra, asegurándose de que los electrodos estén en contacto. Cierre la parte superior de la cámara de muestra. En el software asociado, ingrese los detalles de la muestra y recopile la medición.
3. Formación de una bicapa lipídica soportada unilipídica usando QCM-D
- Preparaciones de la solución
- Prepare una solución de dodecil sulfato de sodio (SDS) al 2% (p/v) en agua ultrapura. Mezclar en una placa de agitación hasta que se disuelva por completo. Soluciones de trabajo alícuotas de al menos 10 ml de agua ultrapura, 2% SDS y Tris NaCl.
- Prepare una dilución de vesículas lipídicas en tampón Tris NaCl. La concentración de vesículas depende de la aplicación. Para el PC de huevo, se ha demostrado que las concentraciones en el rango de 0.01-0.5 mg / ml dan como resultado una formación exitosa de bicapas lipídicas compatibles.
- Limpieza de sensores de cristal de cuarzo recubiertos de sílice
NOTA: La limpieza de los cristales QCM-D depende del material de la superficie del sensor que se esté utilizando. Para formar bicapas lipídicas soportadas, se utilizan cristales de cuarzo recubiertos de sílice en este protocolo y se detallan a continuación como adaptados del procedimiento operativo estándar del fabricante.- Inserte el sensor de cristal de cuarzo recubierto de sílice en el módulo de flujo asegurando que la "t" en el cristal se alinee con la "t" en el módulo. Atornille el módulo de flujo cerrado.
NOTA: Si el QCM-D utilizado permite que varios módulos de flujo se conecten y ejecuten simultáneamente, repita los siguientes procedimientos para los módulos adicionales según sea necesario. - Inserte el módulo de flujo en la base del instrumento con los electrodos del módulo de flujo que se conectan con el sistema analizador. Bloquee el módulo en su lugar.
- Conecte el tubo de entrada y salida al módulo de flujo y a la bomba. Coloque el tubo en los protectores de sujeción y cierre la tapa del sistema analizador. Coloque un contenedor de residuos en la salida de la bomba para recoger las soluciones gastadas.
- Para realizar la limpieza, primero encienda la bomba. Ajuste la velocidad de flujo a 400 μL/min. Inserte el tubo de entrada en agua ultrapura y fluya 5-10 ml a través del módulo.
- Cambie el tubo de entrada a 2% SDS y fluya 5-10 ml a través del módulo. Vuelva a cambiar el tubo de entrada a agua ultrapura y fluya 10-20 ml a través del módulo. Retire el tubo de entrada de la solución y haga fluir el aire a través del tubo hasta que se expulse todo el líquido.
NOTA: El protocolo de limpieza anterior se utiliza diariamente antes y después de cada medición. Se puede realizar una limpieza a fondo según sea necesario. Brevemente, para realizar una limpieza a fondo, desmonte los módulos de flujo. Todos los componentes, excepto el lado del electrodo del módulo de flujo, deben sumergirse en SDS al 2% (p/v) y sonar el baño, seguido de un enjuague completo con agua ultrapura y secado con una corriente de gas N2. El componente del módulo de flujo que contiene los pines de los electrodos nunca debe estar en contacto con el líquido. - Retire el sensor del módulo de flujo y enjuague el sensor con agua ultrapura. Seque el sensor con una corriente de gasN 2. Seque el módulo de flujo con una corriente de gasN 2. Asegúrese de que el electrodo permanezca siempre libre de cualquier líquido.
- En una campana de humos químicos, inserte el sensor de cristal de cuarzo recubierto de sílice en un instrumento de limpieza ultravioleta (UV) / ozono. Encienda el instrumento y permita el tratamiento durante al menos 2 minutos. Retire los sensores con cuidado y vuelva al módulo de flujo.
- Inserte el sensor de cristal de cuarzo recubierto de sílice en el módulo de flujo asegurando que la "t" en el cristal se alinee con la "t" en el módulo. Atornille el módulo de flujo cerrado.
- Formación de una línea de base de Tris NaCl
- Encienda el instrumento analizador para conectarse al software asociado y establecer la temperatura en el valor deseado para la bicapa lipídica admitida. Permita que la temperatura se estabilice a la entrada deseada.
NOTA: Si la temperatura establecida es superior a la temperatura ambiente, todas las soluciones deben calentarse a la misma temperatura utilizando un bloque de calor. - Configure la medición y busque todas las frecuencias de resonancia y disipaciones del sensor para los sobretonos 3, 5, 7, 9, 11 y 13 antes de iniciar la medición.
NOTA: El1er sobretono puede ser ignorado ya que este armónico es demasiado sensible y produce datos ruidosos. - Encienda la bomba y ajuste el caudal a 175 μL/min o el caudal experimental deseado.
- Limpie el tubo de entrada con etanol antes de insertarlo en Tris NaCl. Inicie la medición y comience a fluir Tris NaCl.
NOTA: Los datos se recopilan y monitorean en tiempo real. El cambio de aire a líquido en el módulo de flujo se observará en el software de recolección de datos mediante un cambio de disipación rápida(ΔD)aumento y cambio de frecuencia(ΔF)disminución. - Permita que Tris NaCl fluya a través del módulo durante 5-10 minutos, asegurando que los valores basales de ΔF y ΔD en líquido permanezcan estables.
- Encienda el instrumento analizador para conectarse al software asociado y establecer la temperatura en el valor deseado para la bicapa lipídica admitida. Permita que la temperatura se estabilice a la entrada deseada.
- Formación de una bicapa lipídica soportada por unilípidos
- Detenga la bomba y retire el tubo de entrada de la solución de Tris NaCl e insértelo cuidadosamente en la solución de vesícula lipídica. Flujo hacia atrás durante 5 s para eliminar cualquier burbuja de aire del tubo de entrada y luego continuar el flujo hacia adelante. Reinicie la medición en el software para poner a cero la línea base.
NOTA: Tenga cuidado de evitar burbujas de aire en el tubo, que pueden fluir a través del módulo e interrumpir la formación de bicapas y el registro de datos. - Flujo de vesículas lipídicas hasta la formación de bicapa que se observa en tiempo real en el software de adquisición de datos (al menos 8 min para vesículas de PC de huevo).
- Repita el paso 3.4.1 para cambiar el tubo de entrada de las vesículas lipídicas de nuevo en el tampón Tris NaCl.
NOTA: Si la aplicación deseada es estudiar las interacciones moleculares, continúe directamente con el paso 6.1 sin detener el flujo de la solución o la adquisición de datos. Si la formación de bicapas es el punto final, continúe con el paso 3.4.4. - En el software, detenga la medición y guarde el archivo. Detenga la bomba.
- Limpie el módulo de flujo y el sensor de cristal de cuarzo recubierto de sílice siguiendo los pasos del protocolo 3.2.4 y 3.2.5.
- Detenga la bomba y retire el tubo de entrada de la solución de Tris NaCl e insértelo cuidadosamente en la solución de vesícula lipídica. Flujo hacia atrás durante 5 s para eliminar cualquier burbuja de aire del tubo de entrada y luego continuar el flujo hacia adelante. Reinicie la medición en el software para poner a cero la línea base.
4. Formación de una bicapa lipídica suspendida
NOTA: El protocolo para formar una bicapa lipídica suspendida está adaptado del protocolo de ensayo de permeabilidad de membrana artificial paralela (PAMPA) proporcionado por el fabricante de placas filtrantes37.
- Solubilizar el lípido deseado en dodecano a 20 mg/ml (por ejemplo, 1,2-dioleoil-sn-glicero-3-fosfocolina (DOPC)).
- Agregue 5 μL de la solución lipídica al compartimento donante, que es una placa de filtro multipantalla de polivinilideno poroso (PVDF) de 96 pocillos (tamaño de poro de 0,45 μm).
- Sumerja inmediatamente la placa de filtro en el compartimento aceptor, que es una placa receptora de transporte que contiene 300 μL de solución salina tamponada con fosfato (PBS) de 1×. Añadir 200 μL de 1× PBS al compartimento donante.
NOTA: Se pueden incluir controles de filtros con solo lípidos y filtros no tratados expuestos a PBS 1×. - Continúe directamente con la sección 6.2 para investigar las interacciones moleculares con la bicapa lipídica suspendida. Se recomienda completar el estudio dentro de las 16 h posteriores a la formación de la bicapa suspendida.
5. Desarrollo de células multilipídicas que imitan vesículas y bicapas
- Extracción de lípidos de células de mamíferos
NOTA: La extracción de lípidos sigue el enfoque de Bligh-Dyer38.- Cultive la línea celular deseada según corresponda. Después de lograr una confluencia del 70-80% (matraz T75), separe las células utilizando ácido tripsina-etilendiaminatretaacético a 37 °C durante 5 min.
- Células centrífugas a 200 × g durante 5 min. Retire el sobrenadante y vuelva a suspender el pellet celular en 1 ml de agua ultrapura.
- Añadir 3,75 ml de una mezcla 1:2 (v/v) de cloroformo:metanol a la suspensión celular y al vórtice durante 15 min. Luego, agregue 1.25 ml de cloroformo y vórtice durante 1 min. Finalmente, agregue 1.25 ml de agua y vórtice durante 1 min.
- Mezcla de células centrífugas a 1000 x g durante 10 min. Recoger la capa inferior de líquido, que contiene lípidos en la fase orgánica. Secar bajo una corriente de gasN 2.
- Cuantificar el contenido de lípidos mediante cromatografía líquida-espectrometría de masas (LC-MS) utilizando una columna de fase inversa C18, 3,5 μm × 50 mm.
- Para la fase móvil, prepare dos soluciones, la primera con 60:40 (v/v) acetonitrilo:agua y la segunda con 90:10 (v/v) isopropanol:acetonitrilo. El formiato de amonio debe agregarse a ambas soluciones a una concentración final de 10 mM. Durante 60 min, aumente el gradiente de fase móvil del 35% (v/v) de la segunda solución al 95% (v/v).
- Detecte el efluente en modo de ionización negativa, con EM de escaneo completo consecutivo y MS / MS en tándem. Identifique las especies de fosfolípidos individuales a partir de sus relaciones masa-carga (m / z). Analizar los espectros de masas de la fragmentación de disociación inducida por colisión, utilizando herramientas de análisis de espectrometría de masas LIPID MAPS. Obtener cromatogramas iónicos extraídos para integrar el área bajo la curva, determinando la abundancia de cada especie lipídica.
- Realice los pasos 5.1.5-5.1.7 para un estándar de lípidos que contenga las principales clases de lípidos para determinar los sensibles relativos de detección para cada clase diferente de fosfolípidos.
- Desarrollo de vesículas multilipídicas
- Siga los pasos descritos en 1.1.1 para preparar soluciones de reserva de lípidos para lípidos que representen cada componente bicapa deseado, como se identifica en el paso 5.1.
- Sobre la base de las composiciones lipídicas obtenidas a partir del paso 5.1, agregue el volumen apropiado de material lipídico/cloroformo en un vial de vidrio limpio necesario para una concentración final de vesícula de 2,5 mg/ml. Retire la solución de secado de cloroformo a granel bajo una corriente de gasN 2.
- Siga los pasos 1.1.2, 1.1.3 y 1.2 para formar vesículas multilipídicas. Siga el paso 2 para la caracterización de vesículas.
- Formación de una bicapa lipídica soportada multilipídica utilizando QCM-D
NOTA: Algunas vesículas multilipídicas pueden provocar la ruptura espontánea de la vesícula lipídica y la formación de bicapas similares a las vesículas PC unilipídicas presentadas en el paso 3. Sin embargo, las vesículas multilipídicas más complejas pueden requerir aportes externos para ayudar en la ruptura de la vesícula. Aquí, el péptido AH se utiliza para desestabilizar la valva externa de la vesícula, lo que resulta en la formación de bicapas. Se pueden considerar otros métodos para lograr la desestabilización y la ruptura de vesículas si se desea.- Siga el paso 3 para formar la bicapa lipídica soportada multilipídica utilizando las vesículas multilipídicas formadas en el paso 5.2.
- Si no se observa la ruptura espontánea de las vesículas en una bicapa, intente la desestabilización de la vesícula utilizando el péptido AH. Preparar el péptido AH (secuencia peptídica: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2) solución a 13 μM en Tris NaCl con dimetilsulfóxido al 1% (v/v), DMSO.
- Siga los pasos 3.4.1-3.4.3. Después del paso 3.4.3, cambie el tubo de entrada en la solución de péptido AH. Introduzca la solución en el módulo de flujo hasta que se observen ΔF y ΔD a partir de la nueva adición de solución. Detenga la bomba y deje que el péptido AH se incube con las vesículas durante 10 minutos.
- Cambie el tubo de entrada a Tris NaCl y comience el flujo para eliminar el péptido AH de las vesículas rotas que conducen a la formación exitosa de una bicapa lipídica.
NOTA: Si la aplicación deseada es estudiar las interacciones moleculares, continúe la dirección hasta el paso 6.1 sin detener el flujo de la solución o la adquisición de datos. - En el software, detenga la medición y guarde el archivo. Detenga la bomba.
- Limpie el módulo de flujo y el sensor de cristal de cuarzo recubierto de sílice siguiendo los pasos del protocolo 3.2.4-3.2.6.
- Bicapas multilipídicas suspendidas
- Solubilizar la mezcla de lípidos deseados en dodecano a 20 mg/ml.
- Haga una solución de mezcla de lípidos de 5 μL utilizando la composición que imita la célula deseada.
- Siga los pasos 4.2 y 4.3.
NOTA: Continúe directamente con el paso 6.2 para investigar las interacciones moleculares con la bicapa lipídica suspendida.
6. Estudios de interacción molecular con bicapas unilipídicas y multilídicas
- Estudio de las interacciones moleculares con una bicapa lipídica soportada utilizando QCM-D
- Prepare una solución de la molécula deseada para investigar la adsorción con una bicapa lipídica soportada. Por ejemplo, prepare una solución de 200 μM de di(2-etilhexilo) ftalato (DEHP) en Tris NaCl con DMSO al 1% (v/v).
- Si la solución molecular se prepara en Tris NaCl, se puede fluir directamente siguiendo el paso 3.4.3 para una bicapa unilipídica o 5.3.4 para una bicapa multilípida. Si la molécula debe prepararse en un disolvente diferente, inserte el tubo de entrada solo en el disolvente deseado durante al menos 5 minutos (por ejemplo, Tris NaCl con DMSO al 1% (v / v) para DEHP).
NOTA: Los cambios de viscosidad debidos al disolvente se pueden monitorear y considerar fluyendo antes y después de la introducción de la molécula de interés. - Cambie el tubo de entrada a la solución que contiene la molécula de interés y flujo durante al menos 5 minutos. El flujo también puede detenerse y el líquido que contiene la molécula deseada puede incubarse con la bicapa si se desea.
- Cambie el tubo de entrada de nuevo a la molécula disolvente solo si algo que no sea Tris NaCl. Flujo durante al menos 5 min. Luego, cambie el tubo de entrada a Tris NaCl y fluya durante al menos 5 minutos.
- En el software, detenga la medición y guarde el archivo. Detenga la bomba.
- Limpie el módulo de flujo y el sensor de cristal de cuarzo recubierto de sílice siguiendo los pasos del protocolo 3.2.4-3.2.6.
- Estudio de las interacciones moleculares con bicapas lipídicas suspendidas utilizando PAMPA
- Prepare una solución de la molécula deseada. Por ejemplo, prepare un DEHP de 200 μM en 1× PBS con 1% (v/v) DMSO.
- Prepare una nueva placa receptora de transporte con 300 μL de PBS fresco 1x por pozo.
- Inmediatamente después del paso 3.3 para una bicapa suspendida unilipídica o 4.4.3 para una bicapa suspendida multilipídica, retire el PBS 1× del compartimiento donante de la placa filtrante multipantalla y reemplácelo con 200 μL de la solución de prueba. Sumergir inmediatamente en la placa del receptor de transporte preparada en el paso 6.2.2.
- Incubar con balanceo suave durante el tiempo deseado (por ejemplo, 2 h) a 25 °C.
- Después de la incubación, recolecte 150 μL de la solución de los compartimentos donante y aceptor. Medir la concentración de moléculas en ambas muestras utilizando un método apropiado basado en las propiedades de esta molécula.
- Por ejemplo, use un espectrofotómetro de microplacas con la longitud de onda de absorbancia adecuada, como 280 nm para DEHP, y compare con una curva estándar de la molécula de interés.
- Calcular la permeabilidad aparente (Papp)de la molécula de interés utilizando las siguientes ecuaciones:
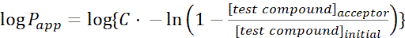 (1)
(1)
Donde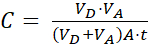 (2)
(2)
NOTA: Elaceptor [compuesto de prueba] es la concentración de la molécula de interés (por ejemplo, DEHP) en el momento, t, en el compartimiento del aceptor; y [compuesto de prueba]inicial es la concentración inicial de la molécula. A es el área de la membrana, t es el tiempo, VD es el volumen del compartimento donante y VA es el volumen del compartimento aceptor.
Resultados
Este protocolo detalla los métodos para formar bicapas lipídicas soportadas y suspendidas (Figura 1). El primer paso para formar una bicapa lipídica soportada es desarrollar vesículas lipídicas. La mini extrusora permite preparar pequeños volúmenes de vesículas lipídicas (1 ml o menos), mientras que la extrusora grande permite preparar 5-50 ml de vesículas lipídicas en un lote. Las distribuciones de tamaño de las vesículas unilipídicas formadas por la extrusora mini o grande se...
Discusión
Este protocolo permite la formación de vesículas lipídicas, bicapas lipídicas soportadas y bicapas lipídicas suspendidas. Aquí, se presentan pasos críticos para formar cada una de estas estructuras. Al formar vesículas lipídicas, es importante extruir por encima de la temperatura de transición del lípido39. Cuando está por debajo de la temperatura de transición, el lípido está físicamente presente en su fase de gel ordenada39. En esta fase ordenada, las cola...
Divulgaciones
Los autores declaran que no tienen conflicto de intereses ni intereses financieros en competencia.
Agradecimientos
Este material se basa en el trabajo apoyado por la Fundación Nacional de Ciencias bajo la Subvención No. 1942418 otorgada a A.S., y una Beca de Investigación de Posgrado de la Fundación Nacional de Ciencias otorgada a C.M.B.H., bajo la Subvención No. 1644760. Todas las opiniones, hallazgos y conclusiones o recomendaciones expresadas en este material son las de los autores y no reflejan necesariamente los puntos de vista de la National Science Foundation. Los autores agradecen al Dr. Noel Vera-González por la adquisición de datos de caracterización de vesículas lipídicas. Los autores agradecen al profesor Robert Hurt (Universidad de Brown) por el uso de su Zetasizer. Los autores agradecen a la Instalación de Espectrometría de Masas de la Universidad de Brown, en particular, al Dr. Tun-Li Shen por su ayuda para cuantificar la composición lipídica.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Referencias
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados