É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Montagem de Modelos de Bicamadas lipídicas apoiadas e suspensas para o estudo de interações moleculares
Neste Artigo
Resumo
Este protocolo descreve a formação de células imitando vesículas uni-lipídicas e multi-lipídicas, bicamadas lipídicas suportadas e bicamadas lipídicas suspensas. Estes modelos in vitro podem ser adaptados para incorporar uma variedade de tipos lipídes e podem ser usados para investigar várias interações de moléculas e macromoléculas.
Resumo
As membranas celulares modelo são uma ferramenta de triagem útil com aplicações que vão desde a descoberta precoce de drogas até estudos de toxicidade. A membrana celular é uma barreira protetora crucial para todos os tipos de células, separando os componentes celulares internos do ambiente extracelular. Essas membranas são compostas em grande parte por uma bicamada lipídica, que contém grupos de cabeças hidrofílicas externas e grupos de cauda hidrofóbica interna, juntamente com várias proteínas e colesterol. A composição e estrutura dos próprios lipídios desempenham um papel crucial na regulação da função biológica, incluindo interações entre as células e o microambiente celular, que podem conter fármacos, toxinas biológicas e tóxicos ambientais. Neste estudo, são descritos métodos para formular células uni-lipídicas e multi-lipídicas que imitam bicamadas lipídicas. Anteriormente, bicamadas lipídicas de fosfartilina uni-lipídica (PC), bem como bicamadas lipídicas multi-lipídicas inspiradas em trophoblast foram desenvolvidas para uso na compreensão de interações moleculares. Aqui, serão apresentados métodos para alcançar os dois tipos de modelos bicamadas. Para as bicamadas multi-lipídicas, a composição lipídica desejada é determinada pela primeira vez através da extração lipídica de células primárias ou linhas celulares seguidas por espectrometria de massa cromatografia líquida (LC-MS). Usando esta composição, as vesículas lipídicas são fabricadas usando um método de hidratação e extrusão de películas finas e seu diâmetro hidrodinâmico e potencial zeta são caracterizados. Bicamadas lipídicas suportadas e suspensas podem então ser formadas usando microequilíptico de cristal de quartzo com monitoramento de dissipação (QCM-D) e em uma membrana porosa para uso em um ensaio paralelo de permeabilidade da membrana artificial (PAMPA), respectivamente. Os resultados representativos destacam a reprodutibilidade e versatilidade dos modelos de bicamadas lipídicas de membrana celular in vitro. Os métodos apresentados podem auxiliar na avaliação rápida e fácil dos mecanismos de interação, como permeação, adsorção e incorporação, de várias moléculas e macromoléculas com uma membrana celular, auxiliando na triagem de candidatos a medicamentos e na previsão de potencial toxicidade celular.
Introdução
A membrana celular, composta principalmente de fosfolipídios, colesterol e proteínas, é um componente crucial de todas as células vivas1. Com organização impulsionada pela anfífilia lipídica, a membrana celular funciona como uma barreira protetora e regula como a célula interage com seu ambiente circundante2. Diversos processos celulares dependem da composição lipídica e proteica da membrana1,2. Por exemplo, as interações de membrana celular são importantes para uma entrega eficaz de medicamentos3. Medicamentos, biológicos, nanomateriais, toxinas biológicas e tóxicos ambientais podem impactar a integridade de uma membrana celular, afetando assim a função celular4. A construção de modelos de membrana de imitação de células in vitro baseadas na composição lipídica das membranas celulares tem o potencial de fornecer ferramentas fáceis para aprimorar muito o estudo do impacto potencial desses materiais nas células.
Bicamadas lipídicas modelo incluem vesículas lipídicas, bicamadas lipídicas suportadas e bicamadas lipídicas suspensas. Bicamadas lipídicas suportadas são um modelo da membrana celular fosfolipídica comumente usada em aplicações biotecnológicas onde vesículas lipídicas são rompidas em um material substrato suportado5,6,7,8,9. Uma técnica comum usada para monitorar a formação de bicamadas é o microequilípmo de cristal de quartzo com monitoramento de dissipação (QCM-D), que examina a adsorção de vesículas em comparação com as propriedades líquidas a granel no situ8,10,11,12,13,14 . Anteriormente, o QCM-D tem sido usado para demonstrar que, em condições de fluxo, uma vez que uma cobertura vesícula crítica de vesículas lipídicas fosfattidylcholina (PC) é alcançada na superfície, elas se rompem espontaneamente em bicamadas lipídicas rígidas15. Trabalhos anteriores também investigaram a formação de vitonas com diferentes composições lipídicas16, incorporação de proteínas lipídicas17,18,19, e utilizando almofadas de polímero20,produzindo bicamadas lipídicas suportadas capazes de imitar vários aspectos da função da membrana celular.
Bicamadas lipídicas têm sido usadas para imitar várias barreiras biológicas, do subcelular aos níveis de órgãos, incluindo mitocôndria, glóbulos vermelhos e membranas de células hepáticas alterando os componentes fosfolipídicos, colesterol e glicóptiides21. Essas vesículas multi-lipídicas mais complexas podem exigir métodos adicionais para alcançar a ruptura vesícula, dependendo da composição lipídica. Por exemplo, estudos anteriores utilizaram um peptídeo α-helicoidal (AH) derivado da proteína não estrutural 5A do vírus da hepatite C para induzir a formação de bicamadas desestabilizando as vesículas lipídicas adsorvidas22,23. Usando este peptídeo AH, bicamadas lipídicas apoiadas imitando células placentárias foram previamente formadas24. O grande potencial de bicamadas lipídicas suportadas para aplicações biomédicas tem sido demonstrado com investigações abrangendo o transporte molecular e nanopartícula25,26, interações toxicantes ambientais27,montagem e função de proteínas17,18,19,arranjo de peptídeos e inserção28,29,triagem de medicamentos30e plataformas microfluidas31.
Bicamadas lipídicas suspensas têm sido usadas para estudos de triagem farmacêutica através de um ensaio paralelo de permeabilidade de membrana artificial (PAMPA) onde uma bicamada lipídica é suspensa através de uma inserção hidrofóbica porosa32,33,34,35. Modelos lipídicos PAMPA foram desenvolvidos para diferentes interfaces biológicas, incluindo as interfaces hemato-cerebral, bucal, intestinal e transdérmica36. Combinando as técnicas de bicamadas lipídicas suportadas e técnicas PAMPA, a adsorção, a permeabilidade e a incorporação de compostos dentro de componentes lipíduos de um tecido ou tipo celular desejado podem ser exaustivamente estudados.
Este protocolo descreve a fabricação e aplicação de modelos de bicamadas lipídicas de membrana celular in vitro para investigar várias interações moleculares. A preparação de bicamadas lipídicas e multi-lipídicas e multi-lipídicas é detalhada. Para formar uma bicamada lipídica suportada, as vesículas lipídicas são desenvolvidas pela primeira vez usando métodos de hidratação e extrusão de filmes finos seguidos pela caracterização físico-química. Discute-se a formação de um bicamado lipídeco suportado usando monitoramento e fabricação de membranas lipídicas suspensas para uso no PAMPA. Finalmente, vesículas multi-lipídicas para o desenvolvimento de membranas de imitação celular mais complexas são examinadas. Usando ambos os tipos de membranas lipídicas fabricadas, este protocolo demonstra como esta ferramenta pode ser usada para estudar interações moleculares. No geral, essa técnica constrói células imitando bicamadas lipídicas com alta reprodutibilidade e versatilidade.
Protocolo
1. Desenvolvimento de vesículas uni-lipídicas
- Método de hidratação de filme fino
- Preparação e armazenamento de soluções de estoque lipídudo
NOTA: Todas as etapas que utilizam clorofórmio precisam ser realizadas em uma capa de fumaça química. O clorofórmio deve ser sempre pipetado usando pontas de pipeta de fibra de carbono com proteção. As soluções que contenham clorofórmio devem ser sempre armazenadas em frascos de vidro.- Prepare uma solução de caldo lipídico de 10 mg/mL adicionando o volume apropriado de clorofórmio no frasco contendo o pó lipídico e misture bem. Por exemplo, adicione 20 mL de clorofórmio a 200 mg de L-α-fosfattidylcholina (ovo, galinha) (eggPC). A solução de estoque pode ser feita em uma concentração diferente, se necessário.
NOTA: Se o lipídio em pó foi armazenado em uma ampola, após adicionar transferência de clorofórmio a um frasco de vidro com uma tampa forrada de politetrafluoroetileno (PTFE). - Sele a tampa do frasco com Parafilm e armazene a -20 °C por até 6 meses.
- Prepare uma solução de caldo lipídico de 10 mg/mL adicionando o volume apropriado de clorofórmio no frasco contendo o pó lipídico e misture bem. Por exemplo, adicione 20 mL de clorofórmio a 200 mg de L-α-fosfattidylcholina (ovo, galinha) (eggPC). A solução de estoque pode ser feita em uma concentração diferente, se necessário.
- Formação de um filme de lipídio seco
- Adicione o volume apropriado de solução de caldo lipídudo em um frasco de vidro limpo necessário para uma concentração final de vesícula de 2,5 mg/mL. Por exemplo, para formar 1 mL de vesículas de PC de ovo a 2,5 mg/mL, pipeta 250 μL de solução de estoque de PC de ovo no frasco.
NOTA: O volume preparado pode depender do processo de extrusor que está sendo utilizado (ver etapa 1.3). O volume máximo recomendado da mini extrusora é de 1 mL, enquanto a grande faixa de volume extrusora é de 5-50 mL. - Remova o clorofórmio da solução de estoque lipíduo usando um fluxo de gás N2 (ultrapure 5.0 Grau).
- Para garantir a remoção completa do clorofórmio, conecte o filme lipídedo seco ao vácuo e deixe por pelo menos 4h.
NOTA: O processo pode ser interrompido aqui. Se o filme lipídico não for usado imediatamente após a secagem do vácuo, guarde em um desiccador até ser usado. Observamos que esses filmes lipídes produzem vesículas de qualidade semelhantes após 1 semana de armazenamento nessas condições; a qualidade vesícula após durações de armazenamento mais longas, se necessário, deve ser mais explorada.
- Adicione o volume apropriado de solução de caldo lipídudo em um frasco de vidro limpo necessário para uma concentração final de vesícula de 2,5 mg/mL. Por exemplo, para formar 1 mL de vesículas de PC de ovo a 2,5 mg/mL, pipeta 250 μL de solução de estoque de PC de ovo no frasco.
- Realizando ciclos de congelamento-degelo-vórtice
- Prepare uma solução tampão de cloreto de sódio Tris (NaCl) contendo 10 mM de base Tris e 100 mM de NaCl. Reidratar o filme lipídigo seco com o volume necessário do tampão Tris NaCl para produzir uma concentração vesícula final de 2,5 mg/mL e vórtice para aproximadamente 15-30 s.
- Transfira a suspensão da vesícula para um recipiente com gelo seco até congelar, aproximadamente 30 min. Depois que a amostra estiver completamente congelada, descongele a suspensão em um banho de água de 30-40 °C. Vórtice a suspensão vesícula descongelada.
NOTA: O líquido N2 pode ser usado no lugar de gelo seco. Transfira a suspensão da vesícula em nitrogênio líquido por 30 s e, em seguida, descongele imediatamente em um banho de água de 80°C. - Repita o passo 1.1.3.2 mais 4 vezes, para um total de 5 ciclos de congelamento-degelo-vórtice.
- Preparação e armazenamento de soluções de estoque lipídudo
- Extrusão
NOTA: Após a conclusão dos ciclos de vórtice de congelamento-vórtice, as vesículas multilamellar são formadas. A extrusão auxilia na redução do tamanho e no desenvolvimento de grandes vesículas unilamellar.- Processo de extrusão mini (1 mL)
- Limpe minuciosamente todos os componentes da extrusora usando um detergente suave em água ultrauso e enxágue pelo menos três vezes com água ultrauso garantindo que todo o detergente seja removido. Seque com gás N2.
- Monte os dois suportes de membrana interna e anéis O (diâmetro interno de 12,7 mm; diâmetro externo de 15,2 mm). Posicione cada suporte de membrana para que o anel O esteja voltado para cima.
- Pré-molhar um suporte de filtro com água ultrapura. Coloque-o sobre a superfície de suporte da membrana dentro do anel O. Repita para o segundo suporte interno da membrana.
- Posicione um suporte interno de membrana na carcaça externa extrusora. Coloque uma membrana de policarbonato de 100 nm no suporte interno da membrana, diretamente sobre o suporte do filtro.
NOTA: As membranas de policarbonato são armazenadas separadamente entre pedaços de papel azul colorido. Remova o papel de separação antes de inserir no suporte da membrana. - Posicione o segundo suporte interno de membrana na carcaça externa extrusora com o anel O e o lado de suporte do filtro voltado para a membrana de policarbonato. Conecte o rolamento PTFE na porca do retentor e enrosque fechado com a carcaça externa extrusora. Corte a extrusora no bloco de aquecimento.
- Coloque a suspensão da vesícula lipídica em uma das seringas e posicione a seringa no bloco de calor extrusor, inserindo a agulha totalmente em uma extremidade da extrusora. Insira a segunda seringa vazia no lado oposto e bloqueie ambas as seringas usando os grampos de braço no bloco de calor.
NOTA: Se necessário, coloque o bloco de calor extrusor em uma placa quente e coloque a temperatura em um valor acima da temperatura de transição do lipídio. Insira um termômetro no suporte embutido no bloco de calor para leituras precisas de temperatura e espere até que a temperatura necessária seja atingida (~15 min). As vesículas lipídicas do PC do ovo não requerem calor durante a extrusão. - Empurre lentamente a suspensão vesícula para a seringa vazia e, em seguida, de volta para a seringa original. Monitore para alterações de pressão ao longo da extrusão que indique um vazamento. Repita mais 20 vezes para um total de 21 passagens através da membrana de policarbonato. Transfira as vesículas lipídicas para um frasco de vidro limpo para armazenamento.
NOTA: O número de extrusões pode ser otimizado dependendo da composição lipídica. - Se o calor for usado, permita que a suspensão da vesícula extrudada atinja a temperatura ambiente. Armazene as vesículas lipídicas extrudadas a 4 °C até que use mais.
NOTA: A duração recomendada do armazenamento de vesículas é altamente dependente da composição lipídica, e as propriedades físico-químicas vesículas (por exemplo, diâmetro hidrodinâmico, potencial zeta) devem ser monitoradas ao longo do tempo. Por exemplo, as vesículas do PC do ovo foram armazenadas por pelo menos duas semanas sem alteração no tamanho da vesícula ou na capacidade de formação de bicamadas.
- Processo de extrusão grande (5-50 mL)
NOTA: Siga as etapas 1.2.2.1-1.2.2.5 se for necessário calor para o lipídio escolhido. Pule para a etapa 1.2.2.5 se o calor não for necessário. As etapas 1.2.2.1-1.2.2.4 não são necessárias para pc de ovos.- Encha um frasco de 1 L com água de osmose reversa (RO).
NOTA: Não use água ultrauso para circular pelo sistema de 50 mL, pois pode causar íons metálicos ao lixiviação do cilindro extrusor. - Coloque o frasco de 1 L em um banho de água em uma placa quente e coloque a placa quente a uma temperatura acima da temperatura de transição do lipídio.
- Conecte o cilindro de amostra ao frasco com tubos flexíveis através da entrada no cilindro de amostra. Coloque a tubulação na saída do cilindro até a parte superior do frasco de 1 L. Entubação segura na entrada e na saída, conforme necessário. Isso criará um fluxo uni-direcional da água através do cilindro de amostra.
- Ligue a bomba para iniciar a circulação de água. Se for necessário calor, deixe por aproximadamente 30-45 minutos para que o cilindro de amostra atinja a temperatura desejada.
- Conecte a tampa do cilindro de amostra a um tanque de nitrogênio através do conector flexível ligado à unidade da válvula de alívio de pressão.
- Limpe todas as partes da extrusora de 50 mL com 70% (v/v) de etanol.
- Monte o extrusor colocando o suporte de tela de furo grande, disco sinter, discos de drenagem e membrana de policarbonato no espaço no suporte inferior extrusor. Conecte os suportes superiores e inferiores da extrusora usando os quatro parafusos e aperte.
- Coloque a unidade de extrusão no cilindro de amostra, aparafusando a parte inferior e apertando com uma chave inglesa para fixar.
NOTA: Se o calor for usado, coloque um termômetro no cilindro e espere até que a água tenha atingido a temperatura desejada antes de continuar. Isso garantirá que a temperatura da amostra seja mantida durante todo o processo de extrusão. - Encha o cilindro de amostra com água ultrapura. Extrude a água através da unidade de extrusora antes de adicionar a amostra no cilindro de amostra. Isso é feito para pré-molhar as membranas, semelhante à mini extrusora.
NOTA: Certifique-se de que a tampa está totalmente aparafusada e a válvula de alívio de pressão está completamente fechada antes de ligar o nitrogênio. É necessária pressão mínima para esta etapa (~5-10 psi). - Adicione a suspensão da vesícula lipídica no cilindro de amostra e enrosque a parte superior fechada. Aumente lentamente a pressão até que a amostra comece a gotejar da unidade de extrusor a uma taxa de aproximadamente 2-3 gotas/s em um frasco de vidro limpo.
NOTA: Não aumente a pressão rapidamente nesta etapa, pois muita pressão pode impactar negativamente as membranas e levar a uma extrusão mal sucedida. - Uma vez que toda a amostra tenha sido extrudada, desligue a fonte N2 e solte a pressão no cilindro de amostra abrindo lentamente a válvula de alívio de pressão. Despeje as vesículas lipídicas de volta no cilindro de amostra e repita o passo 1.2.2.11, 9 vezes mais para um total de 10 extrusões.
NOTA: A pressão necessária para a extrusão pode diminuir com o aumento do número de extrusões, à medida que a amostra se torna mais homogênea e mais próxima em tamanho do tamanho da membrana policarbonato. - Armazene a suspensão da vesícula lipídica extrudada a 4 °C até que seja usada mais.
- Encha um frasco de 1 L com água de osmose reversa (RO).
- Processo de extrusão mini (1 mL)
2. Caracterizando vesículas lipídicas
- Medição do diâmetro hidrodinâmico usando dispersão dinâmica de luz (DLS)
- Vesículas lipídicas de vórtice e pipeta 50 μL da suspensão de vesícula lipídica em um cuvette descartável de baixo volume. Cubra para evitar contaminação com poeira e detritos.
- Carregue a suspensão vesícula no instrumento DLS, insira os detalhes da amostra e realize a medição usando o software associado.
- Potencial zeta
- Prepare uma célula de zeta capilar dobrada lavando com água ultrauso, 70% de etanol e água ultrauso usando seringas que se conectam aos insumos da célula. Empurre suavemente o líquido através da célula 3-4 vezes e esvazie completamente a célula antes de mudar para a próxima solução.
- Vórtice as vesículas lipídicas e prepare uma diluição de 1:10 (v/v) de vesículas lipídicas em água ultrauso.
- Carregue a suspensão de vesícula lipídica diluída. Remova as bolhas de ar empurrando a suspensão para frente e para trás entre as seringas. Conecte as rolhas a cada entrada.
NOTA: É crucial remover todas as bolhas, pois isso afetará a medição. - Coloque a célula zeta na câmara de amostra, garantindo que os eletrodos estejam em contato. Feche a parte superior da câmara de amostra. No software associado, insira os detalhes da amostra e colete a medição.
3. Formando um bicamado lipídedo apoiado por uni-lipídes usando QCM-D
- Preparações de soluções
- Prepare uma solução de sulfato de dodecyl de sódio (SDS) de 2% (c/v) em água ultrapura. Misture em uma placa de mexida até dissolver completamente. Soluções de trabalho aliquot de pelo menos 10 mL de água ultrapura, 2% SDS e Tris NaCl.
- Prepare uma diluição de vesículas lipídicas no tampão Tris NaCl. A concentração de vesículas depende da aplicação. Para pc de ovos, concentrações na faixa de 0,01-0,5 mg/mL têm sido demonstradas para resultar em formação de bicamadas lipídicas bem-sucedidas.
- Limpeza de sensores de cristal revestidos de sílica
NOTA: A limpeza dos cristais QCM-D depende do material superficial do sensor que está sendo utilizado. Para formar bicamadas lipídicas suportadas, cristais de quartzo revestidos de sílica são usados neste protocolo e detalhados abaixo conforme adaptado do procedimento operacional padrão do fabricante.- Insira o sensor de cristal de quartzo revestido de sílica no módulo de fluxo, garantindo que o "t" no cristal se alinhe com o "t" no módulo. Enrosque o módulo de fluxo fechado.
NOTA: Se o QCM-D utilizado permitir que vários módulos de fluxo sejam conectados e executados simultaneamente, repita os seguintes procedimentos para os módulos adicionais conforme necessário. - Insira o módulo de fluxo na base do instrumento com os eletrodos do módulo de fluxo conectando-se com o sistema analisador. Coloque o módulo no lugar.
- Conecte a entrada e a tubulação de saída ao módulo de fluxo e à bomba. Coloque a tubulação nos protetores de retenção e feche a tampa do sistema de analisador. Coloque um recipiente de lixo na saída da bomba para coletar soluções gastas.
- Para realizar a limpeza, primeiro ligue a bomba. Defina a velocidade de fluxo para 400 μL/min. Insira a tubulação de entrada em água ultrauso e flua de 5 a 10 mL através do módulo.
- Mude a tubulação de entrada em 2% SDS e flua de 5 a 10 mL através do módulo. Troque a tubulação de entrada de volta em água ultrauso e flua de 10 a 20 mL através do módulo. Remova a tubulação de entrada da solução e flua ar através da tubulação até que todo o líquido seja ejetado.
NOTA: O protocolo de limpeza acima é usado diariamente antes e depois de cada medição. Uma limpeza minuciosa pode ser realizada conforme necessário. Brevemente, para realizar uma limpeza completa, desmonte os módulos de fluxo. Todos os componentes, exceto o lado do eletrodo do módulo de fluxo devem ser imersos em 2% (w/v) SDS e sonicated de banho, seguido de lavagem completa com água ultrapura e secagem com um fluxo de gás N2. O componente do módulo de fluxo contendo os pinos de eletrodo nunca deve estar em contato com o líquido. - Remova o sensor do módulo de fluxo e enxágue o sensor com água ultrapura. Seque o sensor com um fluxo de gás N2. Seque o módulo de fluxo com um fluxo de gás N2. Certifique-se de que o eletrodo permaneça sempre livre de qualquer líquido.
- Em uma capa de fumaça química, insira o sensor de cristal de quartzo revestido de sílica em um instrumento de limpeza ultravioleta (UV)/ozônio. Ligue o instrumento e deixe o tratamento por pelo menos 2 minutos. Remova os sensores cuidadosamente e retorne ao módulo de fluxo.
- Insira o sensor de cristal de quartzo revestido de sílica no módulo de fluxo, garantindo que o "t" no cristal se alinhe com o "t" no módulo. Enrosque o módulo de fluxo fechado.
- Formando uma linha de base Tris NaCl
- Ligue o instrumento analisador para conectar-se ao software associado e defina a temperatura ao valor desejado para o bicamadorídeo suportado. Deixe que a temperatura se estabilize até a entrada desejada.
NOTA: Se a temperatura definida estiver acima da temperatura ambiente, todas as soluções devem ser aquecidas à mesma temperatura usando um bloco de calor. - Configure a medição e encontre todas as frequências de ressonância do sensor e dissipações para sobretons 3, 5, 7, 9, 11 e 13 antes de iniciar a medição.
NOTA: O tom 1st pode ser desconsiderado, pois este harmônico é excessivamente sensível e produz dados barulhentos. - Ligue a bomba e defina a vazão para 175 μL/min ou a taxa de fluxo experimental desejada.
- Limpe a tubulação de entrada com etanol antes de inserir em Tris NaCl. Inicie a medição e comece a fluir Tris NaCl.
NOTA: Os dados são coletados e monitorados em tempo real. A mudança do ar para o líquido no módulo de fluxo será observada no software de coleta de dados por uma rápida mudança de dissipação (ΔD) aumento e mudança de frequência(ΔF) diminuição. - Permita que o Tris NaCl flua através do módulo por 5-10 min, garantindo que os valores de ΔF e ΔD de linha de base em líquido permaneçam estáveis.
- Ligue o instrumento analisador para conectar-se ao software associado e defina a temperatura ao valor desejado para o bicamadorídeo suportado. Deixe que a temperatura se estabilize até a entrada desejada.
- Formando uma bicamada lipídica apoiada por uní lipídio
- Pare a bomba e remova o tubo de entrada da solução Tris NaCl e insira cuidadosamente na solução de vesícula lipídica. Fluxo de volta para 5 s para remover quaisquer bolhas de ar da tubulação de entrada e, em seguida, continuar o fluxo para a frente. Reinicie a medição no software para zerar a linha de base.
NOTA: Tenha cuidado para evitar bolhas de ar na tubulação, que podem fluir através do módulo e interromper a formação de bicamadas e o registro de dados. - Flua vesículas lipídicas até que a formação de bicamadas seja observada em tempo real no software de aquisição de dados (pelo menos 8 min para vesículas de PC de ovos).
- Repita o passo 3.4.1 para alterar o tubo de entrada de vesículas lipídicas de volta para o tampão Tris NaCl.
NOTA: Se a aplicação desejada for estudar interações moleculares, continue diretamente à etapa 6.1 sem parar o fluxo de solução ou a aquisição de dados. Se a formação de bicamadas for o ponto final, proceda à etapa 3.4.4. - No software, pare a medição e salve o arquivo. Pare a bomba.
- Limpe o módulo de fluxo e o sensor de cristal de quartzo revestido de sílica seguindo as etapas do protocolo 3.2.4 e 3.2.5.
- Pare a bomba e remova o tubo de entrada da solução Tris NaCl e insira cuidadosamente na solução de vesícula lipídica. Fluxo de volta para 5 s para remover quaisquer bolhas de ar da tubulação de entrada e, em seguida, continuar o fluxo para a frente. Reinicie a medição no software para zerar a linha de base.
4. Formando uma bicamada lipídica suspensa
NOTA: O protocolo para a formação de uma bicamada lipídica suspensa é adaptado do protocolo de ensaio de permeabilidade da membrana artificial paralela (PAMPA) fornecido pelo fabricante da placa de filtro37.
- Solubilize lipídio desejado em dodecano a 20 mg/mL (por exemplo, 1,2-dioleoyl-sn -gliceo-3-fosfocholina (DOPC)).
- Adicione 5 μL da solução lipídica ao compartimento do doador, que é um difluoreto de polivinida porosa (PVDF) 96-well multitela placa de filtro (0,45 μm tamanho poros).
- Submergir imediatamente a placa do filtro no compartimento do receptor de transporte contendo 300 μL de 1× salina tamponada de fosfato (PBS). Adicione 200 μL de 1× PBS ao compartimento do doador.
NOTA: Podem ser incluídos controles de filtros com filtros lipídios e não tratados expostos a 1× PBS. - Continue diretamente até a seção 6.2 para investigar interações moleculares com o bicamadorão lipídedo suspenso. Recomenda-se concluir o estudo dentro de 16 horas após a formação da bicamada suspensa.
5. Desenvolvimento de células multi-lipídicas imitando vesículas e bicamadas
- Extração lipídica de células de mamíferos
NOTA: A extração lipídica segue a abordagem Bligh-Dyer38.- Cultume a linha celular desejada conforme apropriado. Depois de atingir 70-80% de confluência (frasco T75), desprendem células usando ácido trippsin-etilenodiaminetretacético a 37 °C por 5 min.
- Células centrífugas a 200 × g por 5 min. Remova o supernatante e resuspenque a pelota da célula em 1 mL de água ultrapura.
- Adicione 3,75 mL de uma mistura de 1:2 (v/v) de clorofórmio:metanol à suspensão celular e vórtice por 15 minutos. Em seguida, adicione 1,25 mL de clorofórmio e vórtice por 1 min. Por fim, adicione 1,25 mL de água e vórtice por 1 min.
- Mistura celular centrífuga a 1000 x g por 10 min. Colete a camada inferior do líquido, que contém lipídios na fase orgânica. Seque sob um fluxo de gás N2.
- Quantifique o teor lipídico usando espectrometria de massa cromatografia líquida (LC-MS) utilizando uma fase reversa C18, 3,5 μm × coluna de 50 mm.
- Para a fase móvel, prepare duas soluções, a primeira com acetonitrila de 60:40 (v/v): água e a segunda com isopropanol 90:10 (v/v) isopropanol:acetonitrila. A formatação de amônio deve ser adicionada a ambas as soluções em uma concentração final de 10 mM. Mais de 60 min, aumente o gradiente de fase móvel de 35% (v/v) da segunda solução para 95% (v/v).
- Detecte o efluente no modo de ionização negativa, com ms de varredura completa consecutiva e em ms/ms tandem. Identifique as espécies fosfolipídidas individuais a partir de suas relações massa-para-carga (m/z). Analise os espectros de massa da fragmentação da dissociação induzida por colisão, utilizando ferramentas de análise de espectrometria de massa LIPID MAPS. Obtenha cromatogramas de íons extraídos para integrar a área sob a curva, determinando a abundância de cada espécie lipídica.
- Realize as etapas 5.1.5-5.1.7 para um padrão lipídeco contendo as principais classes lipídicas para determinar os sensíveis relativos da detecção para cada classe fosfolipídica diferente.
- Desenvolvendo vesículas multi-lipídicas
- Siga os passos em 1.1.1 para preparar soluções de estoque lipíduo para lipídios representando cada componente bicamado desejado, conforme identificado na etapa 5.1.
- Com base nas composições lipídicas obtidas a partir da etapa 5.1, adicione o volume apropriado de caldo lipídedo/clorofórmio em um frasco de vidro limpo necessário para uma concentração final de vesícula de 2,5 mg/mL. Remova a solução de secagem de clorofórmio a granel sob um fluxo de gás N2.
- Siga os passos 1.1.2, 1.1.3 e 1.2 para formar vesículas multi-lipídicas. Siga o passo 2 para caracterização vesícula.
- Formando um bicamado lipídeto suportado por vários lipídios usando QCM-D
NOTA: Algumas vesículas multi-lipídicas podem resultar em ruptura espontânea de vesícula lipídica e formação de bicamadas semelhantes às vesículas uni-lipídicas do PC apresentadas na etapa 3. No entanto, vesículas multi-lipídicas mais complexas podem exigir entrada externa para ajudar na ruptura da vesícula. Aqui, o peptídeo AH é usado para desestabilizar o folheto externo da vesícula resultando em formação de bicamadas. Outros métodos para alcançar a desestabilização e a ruptura vesícula podem ser considerados se desejarem.- Siga o passo 3 para formar a bicamada lipídica apoiada multi-lipídica utilizando as vesículas multi-lipídicas formadas na etapa 5.2.
- Se a ruptura espontânea das vesículas em uma bicamada não for observada, tente a desestabilização vesícula usando o peptídeo AH. Prepare o peptídeo AH (sequência de peptídeos: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Thr−T solução de 13 μM em Tris NaClcom dimetilsulfoxida de 1% (v/v), DMSO.
- Siga os passos 3.4.1-3.4.3. Após o passo 3.4.3, troque a tubulação de entrada na solução de peptídeo AH. Introduza a solução no módulo de fluxo até que ΔF e ΔD sejam observados a partir da nova adição de solução. Pare a bomba e deixe o peptídeo AH incubar com as vesículas por 10 minutos.
- Mude a tubulação de entrada em Tris NaCl e inicie o fluxo para remover o peptídeo AH das vesículas rompidas levando à formação bem sucedida de uma bicamada lipídica.
NOTA: Se a aplicação desejada for estudar interações moleculares, continue a direção para a etapa 6.1 sem parar o fluxo de solução ou a aquisição de dados. - No software, pare a medição e salve o arquivo. Pare a bomba.
- Limpe o módulo de fluxo e o sensor de cristal de quartzo revestido de sílica seguindo as etapas do protocolo 3.2.4-3.2.6.
- Bicamadas multi-lipídicas suspensas
- Solubilize a mistura de lipídios desejados em dodecano a 20 mg/mL.
- Coma uma solução de mistura lipídica de 5 μL usando a composição de imitação de célula desejada.
- Siga os passos 4.2 e 4.3.
NOTA: Continue diretamente ao passo 6.2 para investigar interações moleculares com o bicamadorão lipídedo suspenso.
6. Estudos de interação de moléculas com bicamadas uni-lipídicas e multi-lipídicas
- Estudando interações moleculares com um bicamado lipídedo suportado usando QCM-D
- Prepare uma solução da molécula desejada para investigar a adsorção com uma bicamada lipídica suportada. Por exemplo, prepare uma solução de 200 μM di (2-ethylhexyl) phthalato (DEHP) em Tris NaCl com 1% (v/v) DMSO.
- Se a solução de molécula for preparada em Tris NaCl, ela pode ser fluída diretamente após o passo 3.4.3 para uma bicamada uni-lipídica ou 5.3.4 para uma bicamada multi-lipídica. Se a molécula deve ser preparada em um solvente diferente, em vez disso, insira a tubulação de entrada no solvente desejado sozinho por pelo menos 5 min (por exemplo, Tris NaCl com 1% (v/v) DMSO para DEHP).
NOTA: Alterações de viscosidade devido ao solvente podem ser monitoradas e consideradas fluindo-a antes e depois da introdução da molécula de interesse. - Mude a tubulação de entrada para a solução contendo a molécula de interesse e fluxo por pelo menos 5 minutos. O fluxo também pode ser interrompido e o líquido contendo a molécula desejada pode incubar com a bicamadas, se desejar.
- Mude a tubulação de entrada de volta para o solvente de molécula sozinho se algo diferente de Tris NaCl. Flua por pelo menos 5 minutos. Em seguida, troque a tubulação de entrada em Tris NaCl e flua por pelo menos 5 minutos.
- No software, pare a medição e salve o arquivo. Pare a bomba.
- Limpe o módulo de fluxo e o sensor de cristal de quartzo revestido de sílica seguindo as etapas do protocolo 3.2.4-3.2.6.
- Estudando interações moleculares com bicamadas lipídicas suspensas usando PAMPA
- Prepare uma solução da molécula desejada. Por exemplo, prepare um DEHP de 200 μM em 1× PBS com 1% (v/v) DMSO.
- Prepare uma nova placa receptora de transporte com 300 μL de PBS fresco 1x por poço.
- Imediatamente após a etapa 3.3 para uma bicamada suspensa uni-lipídica ou 4.4.3 para uma bicamada suspensa multi-lipídica, remova o PBS de 1× do compartimento do doador da placa de filtro multitela e substitua por 200 μL da solução de teste. Submerse imediatamente na placa receptora de transporte preparada na etapa 6.2.2.
- Incubar com balanço suave por um tempo desejado (por exemplo, 2 h) a 25 °C.
- Após a incubação, recolham 150 μL da solução dos compartimentos do doador e do aceitador. Meça a concentração da molécula em ambas as amostras usando um método apropriado baseado nas propriedades desta molécula.
- Por exemplo, use um espectrofotômetro de microplaca com o comprimento de onda de absorção apropriado, como 280 nm para DEHP, e compare com uma curva padrão da molécula de interesse.
- Calcule a permeabilidade aparente(appP) da molécula de interesse usando as seguintes equações:
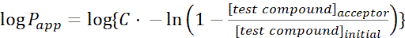 (1)
(1)
Onde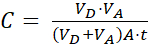 (2)
(2)
NOTA: [composto de teste]é a concentração da molécula de interesse (por exemplo, DEHP) no momento, t, no compartimento do aceitador; e [composto de teste]inicial é a concentração inicial da molécula. A é a área de membrana, t é o tempo, VD é o volume do compartimento do doador, e VA é o volume do compartimento do aceitador.
Resultados
Este protocolo detalha os métodos de formação de bicamadas lipídicas suportadas e suspensas(Figura 1). O primeiro passo para formar um bicamado lipídigo apoiado é desenvolver vesículas lipídicas. A mini extrusora permite que pequenos volumes de vesículas lipídicas sejam preparados (1 mL ou menos), enquanto a grande extrusora permite que 5-50 mL de vesículas lipídicas sejam preparados em um lote. Distribuições de tamanho de vesículas uni-lipídicas formadas pelo mini ou grande ...
Discussão
Este protocolo permite a formação de vesículas lipídicas, bicamadas lipídicas suportadas e bicamadas lipídicas suspensas. Aqui, são apresentados passos críticos para formar cada uma dessas estruturas. Ao formar vesículas lipídicas, é importante extrusão acima da temperatura de transição do lipídio39. Quando abaixo da temperatura de transição, o lipídio está fisicamente presente em sua fase de gelordenado 39. Nesta fase ordenada, as caudas lipídicas de hi...
Divulgações
Os autores declaram que não têm conflito de interesses ou interesses financeiros concorrentes.
Agradecimentos
Este material é baseado em trabalho apoiado pela Fundação Nacional de Ciência sob o Grant No. 1942418 concedido à A.S., e uma Bolsa de Pesquisa de Pós-Graduação da Fundação Nacional de Ciência concedida à C.M.B.H., sob o grant no. 1644760. Quaisquer opiniões, achados e conclusões ou recomendações expressas neste material são dos autores e não refletem necessariamente as opiniões da Fundação Nacional de Ciência. Os autores agradecem ao Dr. Noel Vera-González pela aquisição de dados de caracterização de vesículas lipídicas. Os autores agradecem ao professor Robert Hurt (Brown University) pelo uso de seu Zetasizer. Os autores agradecem ao Brown University Mass Spectrometria Facility, em particular, Dr. Tun-Li Shen pela assistência com a composição lipídica quantificada.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Referências
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados