A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسات التفاعلات Chaperone-Cochaperone باستخدام المتجانسة حبة القائم على المقايسة
In This Article
Summary
يقدم هذا البروتوكول تقنية للتحقيق في التفاعلات بين البروتين والبروتين باستخدام حبات المانحين المرتبطة بالجلوتاثيون مع مرافقين مشاركين من TPR-motif من GST وخرزات مقبولة إلى جانب ببتيد مشتق من Hsp90. لقد استخدمنا هذه التقنية لفحص الجزيئات الصغيرة لتعطيل تفاعلات Hsp90-FKBP51 أو Hsp90-FKBP52 وحددنا مثبطات تفاعل Hsp90-FKBP51 القوية والانتقائية.
Abstract
استهداف بروتين الصدمة الحرارية 90 (Hsp90) - التفاعلات cochaperone يوفر إمكانية لتنظيم العمليات على وجه التحديد Hsp90 تعتمد داخل الخلايا. وPENtapeptide MEEVD المحفوظة في C-terminus من Hsp90 هو المسؤول عن التفاعل مع تكرار رباعية التريتريكبتيد (TPR) عزر المرافقين المشاركين. بروتين FK506 ملزمة (FKBP) 51 و FKBP52 هما مماثلة TPR عزر المرافقين المشاركين المشاركين في الأمراض التي تعتمد على هرمون الستيرويد مع وظائف مختلفة. لذلك ، فإن تحديد الجزيئات التي تمنع التفاعلات بين Hsp90 و FKBP51 أو FKBP52 يوفر إمكانات علاجية واعدة للعديد من الأمراض البشرية. هنا، ونحن نصف بروتوكول لتضخيم القرب الإنارة المقايسة متجانسة للتحقيق التفاعلات بين Hsp90 وشريكها المرافقين FKBP51 و FKBP52. أولا، قمنا بتنقية البروتينات المحتوية على TPR FKBP51 و FKBP52 في شكل الجلوتاثيون S-transferase (GST) الموسومة. باستخدام حبات المانحين المرتبطة الجلوتاثيون مع البروتينات TPR-عزر GST تنصهر والخرز مقبول إلى جانب 10 مير C-محطة الببتيد من Hsp90, لقد بحثت التفاعلات البروتين البروتين في بيئة متجانسة. لقد استخدمنا هذا المقايسة لفحص الجزيئات الصغيرة لتعطيل تفاعلات Hsp90-FKBP51 أو Hsp90-FKBP52 وحددنا مثبطات تفاعل Hsp90-FKBP51 القوية والانتقائية.
Introduction
المرافقين الجزيئية تسهم في التوازن البروتين، بما في ذلك طي البروتين، والنقل، والتدهور. وهي تنظم العديد من العمليات الخلوية وترتبط بالعديد من الأمراض مثل السرطان والأمراض العصبية1. بروتين الصدمة الحرارية 90 (Hsp90) هي واحدة من أهم المرافقين الذين تعتمد وظيفتهم على التغيرات تشكيلية مدفوعة تحليل هيدروليسيس ATP وملزمة مع البروتينات العميل بوساطة المرافقين المشاركين2. على الرغم من الإمكانات الواضحة ل Hsp90 كهدف علاجي ، فإن ضبط وظيفته يمثل تحديا كبيرا. هناك العديد من مثبطات Hsp90 التي تستهدف منطقة ربط ATP N-terminal ، والتي تم تقييمها في التجارب السريرية ، ولكن لم تتم الموافقة على أي منها للتسويق3. نظرا لعدم وجود جيب ملزم ليغاند محددة جيدا4، واستهداف منطقة C-محطة Hsp90 كان نجاحا محدودا4. في الآونة الأخيرة ، تم التحقيق في تعطيل تفاعلات Hsp90-cochaperone بواسطة جزيئات صغيرة كاستراتيجية بديلة5. استهداف التفاعلات Hsp90-cochaperone لن تثير استجابة الإجهاد الخلية العامة ويوفر إمكانية لتنظيم العمليات داخل الخلايا على وجه التحديد. وPENtapeptide MEEVD المحفوظة في C-terminus من Hsp90 هو المسؤول عن التفاعل مع تكرار رباعية الترغيببتيد (TPR) عزر المرافقين المشاركين6. من 736 TPR البروتينات التي تحتوي على عزر المشروح في قاعدة بيانات البروتين البشري، ~ 20 البروتينات المختلفة تتفاعل مع Hsp90 عبر هذا الببتيد7. الجزيئات المتنافسة على MEEVD الببتيد ملزمة من شأنه أن يعطل التفاعلات بين Hsp90 والمرافقين المشاركين التي تحتوي على مجال TPR. يحتوي موقع ربط الببتيد على بنية ثالثة مماثلة ولكن التماثل العام بين نطاقات عزر TPR المختلفة منخفض نسبيا7، مما يوفر فرصة لتحديد الجزيئات القادرة على منع التفاعلات بين Hsp90 والمرافقين المشاركين في TPR-motif. من بين هذه TPR عزر المرافقين المشاركين, FK506 ملزمة البروتين (FKBP) 51 و FKBP52 هي المنظمين لمستقبلات هرمون الستيرويد (SHR) الإشارات والمشاركة في العديد من الأمراض التي تعتمد على هرمون الستيرويد بما في ذلك السرطان, الأمراض المرتبطة بالإجهاد, أمراض التمثيل الغذائي, ومرض الزهايمر8. على الرغم من أن FKBP51 و FKBP52 يشتركان > تشابه تسلسلي بنسبة 80٪، إلا أن وظائفهما تختلف: FKBP52 هو منظم إيجابي لنشاط SHR، في حين أن FKBP51 هو منظم سلبي في معظم الحالات8. لذلك ، فإن تحديد الجزيئات ، على وجه التحديد منع التفاعلات بين Hsp90 و FKBP51 أو FKBP52 ، يوفر إمكانات علاجية واعدة للأمراض ذات الصلة.
تمتطوير Luminescent Proximity Homogenous A ssay(AlphaScreen) لأول مرة في عام 1994 من قبل أولمان EF وآخرون. الآن يتم استخدامه على نطاق واسع للكشف عن أنواع مختلفة من التفاعلات البيولوجية، مثل الببتيد10،البروتين11،الحمض النووي12،RNA13،والسكر14. في هذه التقنية، هناك نوعان من الخرز (قطرها 200 نانومتر)، واحد هو حبة المانحة والآخر هو حبة المقبول. يتم شل الجزيئات الحيوية على هذه الخرز؛ تفاعلاتها البيولوجية تجلب الخرز المانحة والمقبل في القرب. في 680 نانومتر، ينير حساس للضوء في حبة المتبرع ويحول الأكسجين إلى أكسجين مفرد. لأن الأكسجين المفرد له عمر قصير ، فإنه يمكن أن ينتشر فقط حتى 200 نانومتر. إذا كان حبة المقبول على مقربة، مشتق ثيوكسيني يتفاعل مع الأكسجين المفرد توليد chemiluminescence في 370 نانومتر. هذه الطاقة ينشط كذلك الفلوروفوريس في حبة المقبول نفسه لتنبعث منها ضوء في 520-620 نانومتر15. إذا تعطلت التفاعلات البيولوجية ، لا يمكن أن تصل حبة المقبول وخرزة المتبرع إلى القرب ، مما يؤدي إلى تسوس الأكسجين المفرد والإشارة المنخفضة المنتجة.
هنا نحن نصف بروتوكول باستخدام هذه التقنية لفحص جزيئات صغيرة تمنع التفاعلات بين Hsp90 و TPR المرافقين المشاركين، وخاصة FKBP51 و FKBP52. يتم إرفاق الببتيدات 10 الأحماض الأمينية طويلة المقابلة لHsp90 المدقع C-terminus إلى حبات acceptor. يتفاعل المرافقون المشاركون في TPR الموسومون ب GST المنقى مع حبات المتبرعين المرتبطة بالجلوتاثيون. عندما التفاعل بين الببتيدات Hsp90 المشتقة وتي بي آر عزر المرافقين المشارك يجمع الخرز معا، يتم إنتاج إشارة مكبرة(الشكل 1A). إذا كانت الجزيئات الصغيرة التي تم فحصها يمكن أن تمنع التفاعلات بين Hsp90 و TPR-motif المرافقين المشاركين، سيتم تقليل هذه الإشارة مكبرة(الشكل 1B). ويمكن حساب IC50 من خلال القياس الكمي. يمكن توسيع نطاق هذا البروتوكول ليشمل أي مرافق - تفاعلات مرافق مشارك في TPR-motif ذات أهمية كبيرة في تطوير جزيئات جديدة ، مما يمنع على وجه التحديد التفاعل بين Hsp90 و FKBP51 أو FKBP52.

الشكل 1:المبدأ الأساسي لهذا المقايسة. (أ) تنقية GST-FKBP51 يتفاعل مع حبات المانحين المرتبطة الجلوتاثيون. يتم إرفاق الببتيدات 10 الأحماض الأمينية طويلة المقابلة لC-terminus المتطرفة من Hsp90 إلى حبات acceptor. التفاعل بين الببتيدات المشتقة من Hsp90 ومجال TPR من FKBP51 يجعل المتبرع والخرز المقبول في القرب. في 680 نانومتر، ينير حساس للضوء في حبة المتبرع ويحول الأكسجين إلى أكسجين مفرد. مشتق الثيوكسيني على حبة المقبول يتفاعل مع الأكسجين المفرد ويولد chemiluminescence في 370 نانومتر. هذه الطاقة ينشط كذلك الفلوروفوريس في حبة المقبول نفسه لتنبعث منها الضوء في 520-620 نانومتر. (ب)عندما تمنع الجزيئات الصغيرة التفاعلات بين Hsp90 و FKBP51 ، لا يمكن للخرز المانح والمقبل الوصول إلى القرب. ثم الأكسجين المفرد مع تسوس العمر القصير ، ولا يتم إنتاج إشارة يمكن اكتشافها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
ملاحظة: يتم عرض نظرة عامة حول هذا البروتوكول في الشكل 2.
1. التعبير وتنقية GST-FKBP51 وGST-FKBP52 (الشكل 2A)
-
البلازميدات
ملاحظة: الحصول على استنساخ cDNA لFKBP51 الإنسان (معرف استنساخ: 5723416) وFKBP52 الإنسان (استنساخ معرف: 7474554) من اتحاد IMAGE.- تضخيم الحمض النووي FKBP51 الإنسان من قبل PCR مع التمهيديات (إلى الأمام؛ 5'GGATCCATGACTACTGAGGT-3'، عكس؛ 5'-CTCGAGCTATGCCTCTCTCTCCAC-3') التي تحتوي على بامهي وXhoI يتدلى واستنساخ في ناقلات pGEX6-1 في مواقع تقييد BamHI / XhoI.
- تضخيم الحمض النووي FKBP52 الإنسان من قبل PCR مع التمهيديات (إلى الأمام؛ 5'-GAATTCATGAGCCGAGAGGG-3'، عكس؛ 5'CTCGAGCTATGCCTCTCTCCAC-3') التي تحتوي على EcoRI وXhoI يتدلى واستنساخ في ناقلات pGEX6-2 في مواقع تقييد EcoRI / XhoI.
ملاحظة: إعداد رد فعل PCR وتظهر الشروط في الجدول 1 والجدول 2. - تحقق من التسلسل المدرج وتحويل البلازميدات إلى الإشريكية القولونية المختصة كيميائيا وفقا لبروتوكول التصنيع.
-
التعبير عن البروتين وتنقية
- إضافة 25 غرام من مرق لوريا (LB) قاعدة في 1 لتر من الماء المقطر لجعل الحل LB. الأوتوكلاف في 121 درجة مئوية لمدة 15 دقيقة. بعد التبريد، أضف 50 ميكروغرام/مل أمبيسلين.
- خذ مستعمرة من البكتيريا التي تعبر عن GST-FKBP51 أو GST-FKBP52 واخلطها مع 500 ميكرولتر من محلول LB في أنبوب 1.5 مل. دوار.
- إضافة خليط من "1.2.2" إلى 1 لتر من حل LB في قارورة Erlenmeyer مغطاة رقائق الألومنيوم. احتضان قارورة Erlenmeyer في شاكر بين عشية وضحاها في 37 °C.
- حث تعبير البروتين بإضافة 1 mM isopropyl-β-D-thiogalactoside (IPTG) إلى قارورة إرلينماير ومواصلة الحضانة لمدة 2 ساعة أخرى.
- للحصول على الكريات الخلية، والطرد المركزي في 5000 × ز لمدة 15 دقيقة. أزل الناتنات الفائق.
ملاحظة: يمكن تخزين الكريات الخلية في -20 درجة مئوية. - Resuspend الكريات الخلية في 40 مل من برنامج تلفزيوني و sonicate 3 × 20 ق على الجليد. إضافة 1 mM PMSF, 1 mM EDTA, و كوكتيل مثبطات بروتيز (1 قرص) لمنع انحلال البروتين.
- الطرد المركزي تعليق لمدة 30 دقيقة 50،000 × ز لإزالة حطام الخلية وتطبيق supernatant على 5 مل GST فخ العمود.
- بعد غسل العمود مع 30 مل برنامج تلفزيوني، elute GST-FKBP51 وGST-FKBP52 مع 5 مل من الجلوتاثيون 10 mM في برنامج تلفزيوني.
- تركيز البروتينات على وحدة الطرد المركزي 15 مل 10.000 MWCO. لإزالة الجلوتاثيون الحر، يمر المركزات من خلال عمود PD-10 متساوية مع برنامج تلفزيوني 0.5x والتركيز مرة أخرى على جهاز الطرد المركزي مرشح.
- جمع الكسور المحتوية على البروتين. تحقق من البروتينات في SDS-PAGE وضبط تركيزات البروتين إلى 1 ملغم / مل.
ملاحظة: العائد البروتين النموذجي هو 2-5 ملغم / لتر الثقافة. يمكن تخزين البروتين عند -20 درجة مئوية.
2. اقتران Hsp90 C-محطة الببتيد إلى حبات المقبول (الشكل 2B)
-
Hsp90 إعداد الببتيد
- توليف عشرة حمض أميني الببتيد NH2-EDASRMEEVD-COOH المقابلة للأحماض الأمينية 714-724 من الإنسان Hsp90 بيتا isoform (UniProt معرف: P08238) من قبل خدمة توليف الببتيد.
- تمييع الببتيد Hsp90 في برنامج تلفزيوني إلى 1 ملغ / مل التركيز.
-
إعداد حبات المقبول
- تمييع حبات المقبول غير المترافقة في PBS إلى تركيز 1 ملغم / مل ونقلها إلى أنبوب 1.5 مل.
- قم بإجراء الغسيل عن طريق الطرد المركزي على 16,000 × ز لمدة 15 دقيقة. إزالة بعناية فائقة.
-
الاقتران
- تعيين النسبة بين الخرز والببتيد كما 10:1. في أنبوب 1.5 مل يحتوي على 1 ملغ من بيليه حبة المقبول (أعدت على النحو المبين أعلاه)، إضافة 1 مل من برنامج تلفزيوني (درجة الحموضة 7.4)، 0.1 ملغ من الببتيد المخفف، 1.25 ميكرولتر من توين-20، 10 ميكرولتر من محلول 400 مللي متر من الصوديوم سيانوبوروهيدريد (NaBH3CN) في الماء.
تنبيه: NaBH3CN سامة. استخدام غطاء الدخان والقفازات. وينبغي إعداد NaBH3CN الحل حديثا. - احتضان لمدة 24 ساعة في 37 درجة مئوية مع نهاية الإفراط في نهاية التحريض (10-20 دورة في الدقيقة) على شاكر دوارة.
- تعيين النسبة بين الخرز والببتيد كما 10:1. في أنبوب 1.5 مل يحتوي على 1 ملغ من بيليه حبة المقبول (أعدت على النحو المبين أعلاه)، إضافة 1 مل من برنامج تلفزيوني (درجة الحموضة 7.4)، 0.1 ملغ من الببتيد المخفف، 1.25 ميكرولتر من توين-20، 10 ميكرولتر من محلول 400 مللي متر من الصوديوم سيانوبوروهيدريد (NaBH3CN) في الماء.
-
رد فعل إخماد وغسل الخرز
- إضافة 20 ميكرولتر من محلول 1 M Tris-HCl (pH 8.0) إلى رد الفعل لمنع المواقع غير المتفاعلة. حضانة لمدة 1 ساعة في 37 درجة مئوية.
- جهاز طرد مركزي بسرعة 16,000 × غرام (أو السرعة القصوى) لمدة 15 دقيقة عند 4 درجات مئوية. إزالة supernatant وإعادة إنفاق بيليه حبة في 1 مل من الحل تريس-HCl (100 mM, pH 8.0).
- كرر خطوة الغسيل ثلاث مرات.
- بعد الطرد المركزي الأخير، إعادة إنفاق الخرز في 1 ملغم/ مل في المخزن المؤقت (1 مل من 0.5 × برنامج تلفزيوني مع 0.01٪ من أزيد الصوديوم كمادة حافظة). تخزين حل حبة المقبول المترافق في ضوء 4 درجة مئوية محمية.
تنبيه: أزيد الصوديوم سام. استخدام غطاء الدخان والقفازات.
3. الفحص التحقيق في التفاعل بين GST-FKBP51 أو GST-FKBP52 وHsp90 C-محطة الببتيد، وتثبيط مع المركبات الصغيرة الكتلة الجزيئية (الشكل 2C)
-
البروتينات الموسومة ب GST التي تتفاعل مع حبات المتبرعين بالجلوتاثيون
- إعداد ردود الفعل في لوحات 384 بئر.
- إعداد الحل الذي يحتوي على 10 ميكروغرام / مل من حبات المانحة الجلوتاثيون في برنامج تلفزيوني 0.5x، درجة الحموضة 7.4.
ملاحظة: بعد التخزين لفترات طويلة، والخرز يستقر وتحتاج إلى دوامة. - إضافة GST-FKBP51 أو GST-FKBP52 إلى تركيز نهائي من 10 ميكروغرام/مل.
- احتضان في الظلام في 25 درجة مئوية لمدة 10 دقيقة.
ملاحظة: في هذه الخطوة، سوف تتفاعل البروتينات الموسومة ب GST مع الجلوتاثيون المرفق بالخرز. لكل بئر، سيتم استخدام 22.5 ميكرولتر من هذا الخليط. ويجب تحديد تركيز الشركاء الملزمين تجريبيا. Titrate GST-FKBP51 و GST-FKBP52 واختيار التركيز الذي يعطي أفضل إشارة.
-
إضافة مركبة
- جعل التخفيفات التسلسلية من مركبات الاختبار في DMSO.
ملاحظة: عادة ما تكون التركيزات المستخدمة 10 و30 و100 و300 و1000 و3000 ميكرومتر. - إضافة 0.25 ميكرولتر من DMSO (التحكم السلبي) أو Hsp90 C-محطة الببتيد (التحكم الإيجابي، 30 ميكرومتر) أو مركبات في DMSO إلى زاوية كل بئر من لوحة. استخدام ثلاثية لكل تركيز مركب.
- إضافة 22.5 ميكرولتر من الحل الذي يحتوي على حبات المانحة الجلوتاثيون مع البروتينات GST الموسومة إلى كل بئر.
- يهز لوحة بلطف مع اليد ولكن بدقة. احتضان في الظلام في 25 درجة مئوية لمدة 15 دقيقة.
ملاحظة: خلال هذا الوقت، سوف تتفاعل المركبات مع مجال TPR في موقع ربط الببتيد C-terminal Hsp90.
- جعل التخفيفات التسلسلية من مركبات الاختبار في DMSO.
-
إضافة حبات مقبولة
- تمييع الخرز المقبول مع الببتيد Hsp90 C-terminal المرفقة إلى 100 ميكروغرام / مل في برنامج تلفزيوني 0.5x.
- إضافة 2.25 ميكرولتر من حبات المقبول المخفف إلى كل بئر.
- تخلط بلطف ولكن بدقة. احتضان في الظلام في 25 درجة مئوية لمدة 15 دقيقة.
ملاحظة: في هذه الخطوة، يتم إحضارها من قبل المانحين والخرز المقبول في القرب من التفاعلات البروتين الببتيد. الحجم النهائي لخليط التفاعل هو 25 ميكرولتر. لذلك، تتراوح التركيزات النهائية للمركبات من 0.1 إلى 30 ميكرومتر.
-
قراءة اللوحة
ملاحظة: قراءة لوحة باستخدام قارئ لوحة تعيين في الوضع ذي الصلة.- تشغيل الأداة وفتح البرنامج
- اختر البروتوكول ذي الصلة.
- انقر فوق تحرير خريطة اللوحة وحدد البئر المستخدم في اللوحة للقياس.
- انقر فوق التالي للمتابعة وتشغيل البروتوكول المحدد.
- بعد القياس، انقر فوق إظهار النتائج لعرض النتائج.
- تصدير البيانات.
4. تحليل البيانات
-
Z' عامل و إشارة إلى خلفية (S / B) نسبة
- حساب عامل Z ونسبة S/B للمقاايسة باستخدام المعادلة التالية:
Z'=1-(3σpos+3σneg)/ستينيμpos-μ negستيني عشر
S/B=μneg/μpos
حيث σ μ تمثل الانحرافات المعيارية والوسائل الإيجابية (Hsp90 C-محطة الببتيد، 30 ميكرومتر) والسلبية (DMSO) الضوابط، على التوالي. عامل Z > 0.5 سيضمن أن المقايسة قوية بما يكفي للفحص. لمراقبة حساسية المقايسة، تم حساب نسبة S/B أيضا.
- حساب عامل Z ونسبة S/B للمقاايسة باستخدام المعادلة التالية:
-
منحنى الاستجابة الجرعة وIC 50
ملاحظة: استخدم تحليل الانحدار غير الخطي لاحتواء بيانات مثبطات مؤشر أسعار المنتجين Hsp90-cochaperones حسب البرامج.- إنشاء جدول بيانات XY في الحوار الترحيب وحدد X أرقامو Y Enter 3 (إذا ثلاثية) نسخ القيم في أعمدة جنبا إلى جنب.
- تطبيع بيانات إشارة العينات إلى مجموعة التحكم السلبية. استيراد قيم التركيز إلى العمود X وقيم الإشارة إلى العمود ص.
- انقر على تحليل واختيار تحويل التركيز (X) ضمن تحويل | تطبيع. اختر تحويل إلى لوغاريتمات.
ملاحظة: هذا سيتم تحويل التركيز إلى مقياس سجل. إذا كان تركيز البداية صفرا، قم بتعيينه إلى رقم صغير جدا يكون صفرا فعليا (على سبيل المثال، 0.1 nM) بحيث لا يفقد تلك القيم نظرا لعدم تعريف لوغارتم الصفر. - انقر فوق تحليل واختيار الانحدار غير الخطي (منحنى تناسب) تحت التحليلات XY، افتح الجرعة - الاستجابة - تثبيط واختيار سجل (المانع) مقابل الاستجابة -- المنحدر المتغير.
- انقر فوق موافق لعرض النتائج (التي تحتوي على قيمةIC 50) والرسوم البيانية.
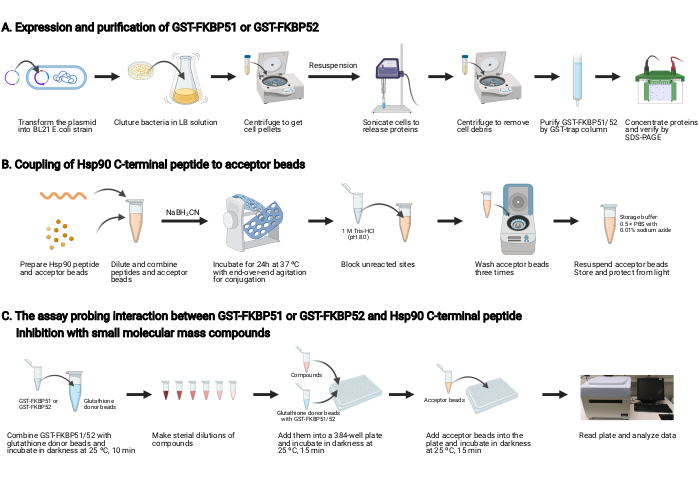
الشكل 2: تخطيطي لهذا البروتوكول. (أ) التعبير وتنقية من GST-FKBP51 وGST-FKBP52. (ب) اقتران Hsp90 C-محطة الببتيد إلى الخرز مقبول. (ج)الفحص الذي يتحرى التفاعل بين GST-FKBP51 أو GST-FKBP52 وHsp90 C-terminal الببتيد. تثبيط مع مركبات الكتلة الجزيئية الصغيرة. تم إنشاؤها باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
في المقايسة لدينا، عامل Z ونسبة S/ B هي 0.82 و 13.35، على التوالي(الشكل 3A)،مما يدل على أن لدينا المقايسة قوية وموثوق بها لفحص عالية الإنتاجية. ثم استخدمناه لفحص المركبات الجزيئية الصغيرة. الشكل 3B يقدم تثبيط تعتمد على الجرعة من التفاعلات المرافقين-cochaperone مع جزيء صغ?...
Discussion
هنا نصف بروتوكول باستخدام المقايسة لفحص الجزيئات الصغيرة التي تمنع التفاعلات بين Hsp90 و TPR-motif المرافقين المشاركين ، وخاصة FKBP51 و FKBP52. درجة Z العالية (>0.8) توضح متانة وموثوقية تنسيق عالي الإنتاجية. يمكن الحصول على النتائج في غضون ساعة واحدة، وهناك حاجة إلى كميات صغيرة من الخرز والبروتين والمرك?...
Disclosures
ولا يبلغ المؤلفون عن أي تضارب في المصالح.
Acknowledgements
تم دعم هذه الدراسة من خلال منح من مجلس البحوث السويدي (2018-02843) ومؤسسة الدماغ (Fo 2019-0140) ومؤسسة أمراض الشيخوخة في معهد كارولينسكا ومؤسسة غونفور وجوزيف أنيرز ومؤسسة ماغنوس بيرغفالس ومؤسسة غون وبيرتيل ستونيس ومؤسسة توري نيلسون للأبحاث الطبية ومؤسسة مارغريتا إيه أوغلاس ومؤسسة الخدم القدامى.
Materials
| Name | Company | Catalog Number | Comments |
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
References
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer's disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved