Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchungen von Chaperon-Cochaperon-Interaktionen mit homogenem Bead-based Assay
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Technik zur Untersuchung von Protein-Protein-Interaktionen unter Verwendung von Glutathion-verknüpften Spenderperlen mit GST-verschmolzenen TPR-Motiv-Co-Chaperonen und Akzeptorperlen in Verbindung mit einem Hsp90-abgeleiteten Peptid vor. Wir haben diese Technik verwendet, um kleine Moleküle zu screenen, um Hsp90-FKBP51- oder Hsp90-FKBP52-Interaktionen zu stören, und potente und selektive Hsp90-FKBP51-Interaktionshemmer identifiziert.
Zusammenfassung
Das Targeting der Wechselwirkungen mit dem Hitzeschockprotein 90 (Hsp90)-Cochaperon bietet die Möglichkeit, Hsp90-abhängige intrazelluläre Prozesse gezielt zu regulieren. Das konservierte MEEVD-Pentapeptid am C-Terminus von Hsp90 ist für die Wechselwirkung mit dem Tetratricopeptid-Wiederholungsmotiv (TPR) von Co-Chaperonen verantwortlich. FK506-bindendes Protein (FKBP) 51 und FKBP52 sind zwei ähnliche TPR-Motiv-Co-Chaperone, die an steroidhormonabhängigen Erkrankungen mit unterschiedlichen Funktionen beteiligt sind. Daher bietet die Identifizierung von Molekülen, die spezifisch Wechselwirkungen zwischen Hsp90 und FKBP51 oder FKBP52 blockieren, ein vielversprechendes therapeutisches Potenzial für mehrere menschliche Krankheiten. Hier beschreiben wir das Protokoll für einen amplifizierten lumineszierenden homogenen Näherungsassay zur Untersuchung von Wechselwirkungen zwischen Hsp90 und seinen Partner-Co-Chaperonen FKBP51 und FKBP52. Zunächst haben wir die TPR-motivhaltigen Proteine FKBP51 und FKBP52 in Glutathion-S-Transferase (GST)-getaggter Form gereinigt. Unter Verwendung der Glutathion-verknüpften Spenderperlen mit GST-verschmolzenen TPR-Motivproteinen und den Akzeptorperlen in Verbindung mit einem 10-mer C-terminalen Peptid von Hsp90 haben wir Protein-Protein-Interaktionen in einer homogenen Umgebung untersucht. Wir haben diesen Assay verwendet, um kleine Moleküle zu screenen, um Hsp90-FKBP51- oder Hsp90-FKBP52-Interaktionen zu stören, und potente und selektive Hsp90-FKBP51-Interaktionshemmer identifiziert.
Einleitung
Molekulare Chaperone tragen zur Protein-Homöostase bei, einschließlich Proteinfaltung, Transport und Abbau. Sie regulieren mehrere zelluläre Prozesse und sind mit zahlreichen Krankheiten wie Krebs und neurodegenerativen Erkrankungen verbunden1. Das Hitzeschockprotein 90 (Hsp90) ist eines der wichtigsten Chaperone, dessen Funktion von Konformationsänderungen abhängt, die durch ATP-Hydrolyse und Bindung an Client-Proteine, die durch seine Co-Chaperone vermitteltwerden, angetriebenwerden 2 . Trotz eines offensichtlichen Potenzials von Hsp90 als therapeutisches Ziel stellt die Feinabstimmung seiner Funktion eine große Herausforderung dar. Es gibt mehrere Hsp90-Inhibitoren, die auf die N-terminale ATP-Bindungsregion abzielen, die in klinischen Studien untersucht wurden, aber keiner von ihnen wurde für die Vermarktung zugelassen3. Aufgrund des Fehlens einer gut definierten Ligandenbindungstasche4hatte das Targeting der C-terminalen Region von Hsp90 nur begrenzten Erfolg4. Kürzlich wurde die Störung von Hsp90-Cochaperon-Wechselwirkungen durch kleine Moleküle als alternative Strategie untersucht5. Die Ausrichtung auf die Hsp90-Cochaperon-Interaktionen würde keine allgemeine Zellstressreaktion hervorrufen und bietet die Möglichkeit, verschiedene intrazelluläre Prozesse spezifisch zu regulieren. Das konservierte MEEVD-Pentapeptid am C-Terminus von Hsp90 ist für die Wechselwirkung mit dem Tetratricopeptid-Wiederholungsmotiv (TPR) der Co-Chaperone verantwortlich6. Von den 736 TPR-motivhaltigen Proteinen, die in der humanen Proteindatenbank annotiert sind, interagieren ~20 verschiedene Proteine über dieses Peptid mit Hsp907. Moleküle, die um die MEEVD-Peptidbindung konkurrieren, würden die Wechselwirkungen zwischen Hsp90 und Co-Chaperonen, die eine TPR-Domäne enthalten, stören. Die Peptidbindungsstelle hat eine ähnliche tertiäre Struktur, aber die Gesamthomologie zwischen verschiedenen TPR-Motivdomänen ist relativ niedrig7, was die Möglichkeit bietet, Moleküle zu identifizieren, die spezifisch in der Lage sind, Wechselwirkungen zwischen Hsp90 und bestimmten TPR-Motiv-Co-Chaperonen zu blockieren. Unter diesen TPR-Motiv-Co-Chaperonen sind FK506-bindendes Protein (FKBP) 51 und FKBP52 Regulatoren der Steroidhormonrezeptor-Signalisierung (SHR) und an mehreren Steroidhormon-abhängigen Krankheiten beteiligt, darunter Krebs, stressbedingte Krankheiten, Stoffwechselerkrankungen und Alzheimer-Krankheit8. Obwohl FKBP51 und FKBP52 > Sequenzähnlichkeit von 80% teilen, unterscheiden sich ihre Funktionen: FKBP52 ist ein positiver Regulator der SHR-Aktivität, während FKBP51 in den meisten Fällen ein negativer Regulator ist8. Daher bietet die Identifizierung von Molekülen, die spezifisch Wechselwirkungen zwischen Hsp90 und FKBP51 oder FKBP52 blockieren, ein vielversprechendes therapeutisches Potenzial für verwandte Krankheiten.
Einmplified Luminescent Proximity Homogenous Assay (AlphaScreen) wurde erstmals 1994 von Ullman EF et al.9entwickelt. Jetzt wird es häufig verwendet, um verschiedene Arten von biologischen Interaktionen wie Peptid10, Protein11, DNA12, RNA13und Zucker14zu erkennen . Bei dieser Technik gibt es zwei Arten von Perlen (Durchmesser 200 nm), eine ist die Spenderperle und die andere ist die Akzeptorperle. Die Biomoleküle werden auf diesen Perlen immobilisiert; ihre biologischen Wechselwirkungen bringen Spender- und Akzeptorperlen in die Nähe. Bei 680 nm beleuchtet ein Photosensibilisator in der Spenderperle und wandelt Sauerstoff in Singulett-Sauerstoff um. Da der Singsingstoff eine kurze Lebensdauer hat, kann er nur bis zu 200 nm diffundieren. Befindet sich die Akzeptorperle in der Nähe, reagiert ihr Thioxenderivat mit dem Singulett Sauerstoff, der bei 370 nm Chemilumineszenz erzeugt. Diese Energie aktiviert weiterhin Fluorophore in derselben Akzeptorperle, um Licht bei 520-620 nm15zu emittieren. Wenn die biologischen Wechselwirkungen gestört sind, können die Akzeptorperle und die Spenderperle keine Nähe erreichen, was zum Sauerstoffzerfall des Singuletts und zu einem schwach produzierten Signal führt.
Hier beschreiben wir ein Protokoll, das diese Technik zum Screening kleiner Moleküle verwendet, die Wechselwirkungen zwischen Hsp90- und TPR-Co-Chaperonen hemmen, insbesondere FKBP51 und FKBP52. Die 10 Aminosäuren langen Peptide, die Hsp90 extremem C-Terminus entsprechen, sind an Akzeptorperlen gebunden. Gereinigte GST-markierte TPR-Co-Chaperone interagieren mit Glutathion-verknüpften Spenderperlen. Wenn die Wechselwirkung zwischen Hsp90-abgeleiteten Peptiden und TPR-Motiv-Co-Chaperonen die Perlen zusammenbringt, wird ein verstärktes Signal erzeugt (Abbildung 1A). Wenn die gescreenten kleinen Moleküle die Wechselwirkungen zwischen Hsp90- und TPR-Motiv-Co-Chaperonen hemmen können, wird dieses verstärkte Signal verringert (Abbildung 1B). Ihr IC50 kann durch quantitative Messung berechnet werden. Dieses Protokoll kann auf alle Chaperon-TPR-Motiv-Co-Chaperon-Interaktionen von Interesse erweitert werden und ist von großer Bedeutung für die Entwicklung neuartiger Moleküle, die insbesondere die Wechselwirkung zwischen Hsp90 und FKBP51 oder FKBP52 blockieren.

Abbildung 1: Das Grundprinzip dieses Assays. (A) Gereinigte GST-FKBP51 interagiert mit Glutathion-verknüpften Spenderperlen. Die 10 Aminosäuren langen Peptide, die dem extremen C-Terminus von Hsp90 entsprechen, sind an Akzeptorperlen gebunden. Die Interaktion zwischen Hsp90-abgeleiteten Peptiden und der TPR-Domäne von FKBP51 bringt die Spender- und Akzeptorperlen in die Nähe. Bei 680 nm beleuchtet ein Photosensibilisator in der Spenderperle und wandelt Sauerstoff in Singulett-Sauerstoff um. Das Thioxenderivat auf der Akzeptorperle reagiert mit dem Singulett Sauerstoff und erzeugt eine Chemilumineszenz bei 370 nm. Diese Energie aktiviert weiterhin Fluorophore in derselben Akzeptorperle, um Licht bei 520-620 nm zu emittieren. (B) Wenn kleine Moleküle die Wechselwirkungen zwischen Hsp90 und FKBP51 hemmen, können die Spender- und Akzeptorperlen keine Nähe erreichen. Dann zerfällt der Singulett-Sauerstoff mit kurzer Lebensdauer und es wird kein nachweisbares Signal erzeugt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
HINWEIS: Eine Übersicht über dieses Protokoll ist in Abbildung 2 dargestellt.
1. Expression und Reinigung von GST-FKBP51 und GST-FKBP52 (Abbildung 2A)
-
Plasmide
HINWEIS: Beziehen Sie cDNA-Klone für menschlicheS FKBP51 (Klon-ID: 5723416) und für menschliches FKBP52 (Klon-ID: 7474554) vom IMAGE-Konsortium.- Amplifizieren Sie die humane FKBP51-DNA durch PCR mit Primern (vorwärts; 5'GGATCCATGACTACTGATGAAGGT-3', umgekehrt; 5'-CTCGAGCTATGCTTCTGTCTCCAC-3'), die BamHI- und XhoI-Überhänge enthalten, und klonen Sie sie an BamHI / XhoI-Restriktionsstellen in pGEX6-1-Vektor.
- Amplifizieren Sie die humane FKBP52-DNA durch PCR mit Primern (vorwärts; 5'-GAATTCATGACAGCCGAGGAGATG-3', umgekehrt; 5'-CTCGAGCTATGCTTCTGTCTCCAC-3') mit EcoRI- und XhoI-Überhängen und klonen Sie sie an EcoRI / XhoI-Restriktionsstellen in pGEX6-2-Vektor.
HINWEIS: Aufbau der PCR-Reaktion und Bedingungen sind in Tabelle 1 und Tabelle 2 dargestellt. - Überprüfen Sie die eingefügte Sequenz und wandeln Sie die Plasmide gemäß dem Herstellungsprotokoll in die chemisch kompetenten E. coli um.
-
Proteinexpression und -reinigung
- Fügen Sie 25 g Luria Brühe (LB) Basis in 1 L destilliertes Wasser hinzu, um die LB-Lösung herzustellen. Autoklavieren Sie es bei 121 °C für 15 min. Nach dem Abkühlen 50 μg/ml Ampicillin hinzufügen.
- Nehmen Sie eine Bakterienkolonie, die GST-FKBP51 oder GST-FKBP52 exprimieren, und mischen Sie sie mit 500 μL LB-Lösung in einem 1,5-ml-Röhrchen. Wirbel.
- Die Mischung aus "1.2.2" in 1 L LB-Lösung in den mit einer Aluminiumfolie bedeckten Erlenmeyerkolben geben. Den Erlenmeyerkolben über Nacht bei 37 °C im Shaker inkubieren.
- Induzieren Sie die Proteinexpression durch Zugabe von 1 mM Isopropyl-β-D-Thiogalactosid (IPTG) zum Erlenmeyerkolben und setzen Sie die Inkubation für weitere 2 h fort.
- Um Zellpellets zu erhalten, zentrifugieren Sie bei 5.000 x g für 15 min. Entfernen Sie den Überstand.
HINWEIS: Die Zellpellets können bei -20 °C gelagert werden. - Die Zellpellets in 40 ml PBS wieder auffüllen und 3 x 20 s auf Eis beschallen. Fügen Sie 1 mM PMSF, 1 mM EDTA und Protease-Inhibitor-Cocktail (1 Tablette) hinzu, um die Proteolyse zu verhindern.
- Zentrifugieren Sie die Suspension für 30 min 50.000 x g, um Zellablagerungen zu entfernen und tragen Sie den Überstand auf die 5 mL GST-Trap-Säule auf.
- Nachdem Sie die Säule mit 30 mL PBS gewaschen haben, eluieren Sie GST-FKBP51 und GST-FKBP52 mit 5 mL 10 mM Glutathion in PBS.
- Konzentrieren Sie Proteine auf 15 mL 10.000 MWCO Zentrifugationseinheit. Um freies Glutathion zu entfernen, geben Sie die Konzentrate durch die PD-10-Säule, die mit 0,5x PBS ausgeglichen ist, und konzentrieren Sie sich erneut auf die Filterzentrifuge.
- Sammeln Sie proteinhaltige Fraktionen. Überprüfen Sie die Proteine in SDS-PAGE und passen Sie die Proteinkonzentrationen auf 1 mg/ml an.
HINWEIS: Die typische Proteinausbeute beträgt 2-5 mg / L Kultur. Das Protein kann bei -20 °C gespeichert werden.
2. Kopplung des Hsp90 C-terminalen Peptids an die Akzeptorperlen (Abbildung 2B)
-
Hsp90 Peptidpräparat
- Synthese von zehnAminosäurepeptid NH2-EDASRMEEVD-COOH entsprechend den Aminosäuren 714-724 der humanen Hsp90 beta-Isoform (UniProt ID: P08238) durch einen Peptidsynthesedienst.
- Verdünnen Sie das Hsp90-Peptid in PBS auf 1 mg/ml Konzentration.
-
Vorbereitung von Akzeptorperlen
- Die unkonjugierten Akzeptorperlen in PBS auf 1 mg/ml Konzentration verdünnen und in ein 1,5 ml Röhrchen überführen.
- Waschen Sie durch Zentrifugation bei 16.000 x g für 15 min. Entfernen Sie vorsichtig den Überstand.
-
Konjugation
- Stellen Sie das Verhältnis zwischen Perlen und Peptid auf 10:1 ein. In das 1,5-ml-Röhrchen mit 1 mg Akzeptorperlenpellet (wie oben beschrieben hergestellt) 1 ml PBS (pH 7,4), 0,1 mg verdünntes Peptid, 1,25 μL Tween-20,10 μL einer 400 mM-Lösung von Natriumcyanoborohydrid (NaBH3 CN) in Wasser geben.
ACHTUNG: NaBH3CN ist giftig; Verwenden Sie eine Abzugshaube und Handschuhe. NaBH3CN Lösung sollte frisch zubereitet werden. - 24 h bei 37 °C mit End-over-End-Rührung (10-20 U/min) auf einem Rotationsschüttler inkubieren.
- Stellen Sie das Verhältnis zwischen Perlen und Peptid auf 10:1 ein. In das 1,5-ml-Röhrchen mit 1 mg Akzeptorperlenpellet (wie oben beschrieben hergestellt) 1 ml PBS (pH 7,4), 0,1 mg verdünntes Peptid, 1,25 μL Tween-20,10 μL einer 400 mM-Lösung von Natriumcyanoborohydrid (NaBH3 CN) in Wasser geben.
-
Reaktionsabschreckung und Perlenwäsche
- 20 μL 1 M Tris-HCl (pH 8,0) Lösung werden der Reaktion hinzugefügt, um nicht umgesetzte Stellen zu blockieren. 1 h bei 37 °C inkubieren.
- Zentrifuge bei 16.000 x g (oder Höchstgeschwindigkeit) für 15 min bei 4 °C. Entfernen Sie den Überstand und resuspendieren Sie das Perlenpellet in 1 ml Tris-HCl-Lösung (100 mM, pH 8,0).
- Wiederholen Sie den Waschschritt dreimal.
- Nach der letzten Zentrifugation die Perlen bei 1 mg/ml im Speicherpuffer (1 ml 0,5 × PBS mit 0,01% Natriumazid als Konservierungsmittel) wieder auffüllen. Lagern Sie die konjugierte Akzeptorperlenlösung bei 4 °C lichtgeschützt.
ACHTUNG: Natriumazid ist giftig; Verwenden Sie eine Abzugshaube und Handschuhe.
3. Der Assay, der die Wechselwirkung zwischen GST-FKBP51 oder GST-FKBP52 und Hsp90 C-terminales Peptid und Hemmung mit Verbindungen mit kleiner Molekülmasse untersucht (Abbildung 2C)
-
GST-markierte Proteine, die mit Glutathion-Spenderperlen interagieren
- Richten Sie die Reaktionen in 384-Well-Platten ein.
- Bereiten Sie die Lösung mit 10 μg/ml der Glutathionspenderperlen in 0,5x PBS, pH 7,4 vor.
HINWEIS: Nach längerer Lagerung setzen sich die Perlen ab und müssen vorgetexed werden. - GST-FKBP51 oder GST-FKBP52 wird zu einer Endkonzentration von 10 μg/ml hinzugefügt.
- Im Dunkeln bei 25 °C 10 min inkubieren.
HINWEIS: In diesem Schritt interagieren GST-markierte Proteine mit Glutathion, das an die Perlen gebunden ist. Für jede Vertiefung werden 22,5 μL dieser Mischung verwendet. Die Konzentration der Bindungspartner muss empirisch bestimmt werden. Titrieren Sie GST-FKBP51 und GST-FKBP52 und wählen Sie die Konzentration, die das beste Signal liefert.
-
Zusammengesetzte Zugabe
- Machen Sie serielle Verdünnungen von Testverbindungen in DMSO.
HINWEIS: Die verwendeten Konzentrationen betragen typischerweise 10, 30, 100, 300, 1.000 und 3.000 μM. - Fügen Sie 0,25 μL DMSO (Negativkontrolle) oder Hsp90 C-terminales Peptid (Positivkontrolle, 30 μM) oder Verbindungen in DMSO in die Ecke jeder Vertiefung der Platte hinzu. Verwenden Sie Triplikate für jede Verbindungskonzentration.
- Fügen Sie 22,5 μL der Lösung, die Glutathion-Spenderperlen mit GST-markierten Proteinen enthält, zu jeder Vertiefung hinzu.
- Schütteln Sie den Teller vorsichtig mit der Hand, aber gründlich. Im Dunkeln bei 25 °C 15 min inkubieren.
HINWEIS: Während dieser Zeit interagieren Verbindungen mit der TPR-Domäne an der Hsp90 C-terminalen Peptidbindungsstelle.
- Machen Sie serielle Verdünnungen von Testverbindungen in DMSO.
-
Akzeptorperlenzusatz
- Verdünnen Sie die Akzeptorperlen mit angehängtem Hsp90 C-terminalem Peptid auf 100 μg/ml in 0,5x PBS.
- Fügen Sie 2,25 μL verdünnte Akzeptorperlen zu jeder Vertiefung hinzu.
- Sanft aber gründlich mischen. Im Dunkeln bei 25 °C 15 min inkubieren.
HINWEIS: In diesem Schritt werden Spender- und Akzeptorperlen durch die Protein-Peptid-Interaktionen in die Nähe gebracht. Das Endvolumen des Reaktionsgemisches beträgt 25 μL. Daher liegen die Endkonzentrationen der Verbindungen zwischen 0,1 und 30 μM.
-
Plattenlesung
HINWEIS: Lesen Sie die Platte mit einem Plattenleser, der im entsprechenden Modus eingestellt ist.- Schalten Sie das Instrument ein und öffnen Sie die Software
- Wählen Sie das entsprechende Protokoll aus.
- Klicken Sie auf Plattenkarte bearbeiten und wählen Sie das in der Platte verwendete Bohrmittel für die Messung aus.
- Klicken Sie auf Weiter, um fortzufahren, und führen Sie das ausgewählte Protokoll aus.
- Klicken Sie nach der Messung auf Ergebnisse anzeigen, um die Ergebnisse anzuzeigen.
- Exportieren Sie die Daten.
4. Datenanalyse
-
Z-Faktor und Signal-Hintergrund-Verhältnis (S/B)
- Berechnen Sie den Z'-Faktor und das S/B-Verhältnis für den Assay mit der folgenden Gleichung:
Z'=1-(3σpos+3σneg)/│μpos-μneg│16
S/B=μneg/μpos
wobei σ und μ die Standardabweichungen und Mittelwerte der positiven (Hsp90 C-terminales Peptid, 30 μM) bzw. negativen (DMSO) Kontrollen darstellen. Ein Z'-Faktor > 0,5 stellt sicher, dass der Assay robust genug für das Screening ist. Zur Überwachung der Assay-Sensitivität wurde auch das S/B-Verhältnis berechnet.
- Berechnen Sie den Z'-Faktor und das S/B-Verhältnis für den Assay mit der folgenden Gleichung:
-
Dosis-Wirkungs-Kurve und IC 50
HINWEIS: Verwenden Sie die nichtlineare Regressionsanalyse, um die Daten von Hsp90-Cochaperon-PPI-Inhibitoren per Software anzupassen.- Erstellen Sie eine XY-Datentabelle im Begrüßungsdialogfeld, und wählen Sie X-Zahlenaus, und Y Geben Sie 3 ein (wenn tripliziert), replizieren Sie Werte in nebeneinander gelegenen Spalten.
- Normalisieren Sie die Signaldaten der Proben in die negative Kontrollgruppe. Importieren Sie Konzentrationswerte in die Spalte X und die Signalwerte in die Spalte Y.
- Klicken Sie auf Analysieren und wählen Sie unter | transformieren die Option Konzentration transformieren (X) Normalisieren. Wählen Sie Transform to Logarithms.
HINWEIS: Dadurch wird die Konzentration in eine Protokollskala transformiert. Wenn Ihre Anfangskonzentration Null ist, setzen Sie sie auf eine sehr kleine Zahl, die effektiv Null ist (z. B. 0,1 nM), um diese Werte nicht zu verlieren, da der Logarithmus von Null nicht definiert ist. - Klicken Sie auf Analysieren und wählen Sie Unter XY-Analysendie Option Nichtlineare Regression (Kurvenpassung), öffnen Sie die Dosis-Wirkungs-Hemmung und wählen Sie Log(Inhibitor) vs. Response -- Variable Steigung.
- Klicken Sie auf OK, um die Ergebnisse (mit ic50-Wert) und die Diagrammeanzuzeigen.
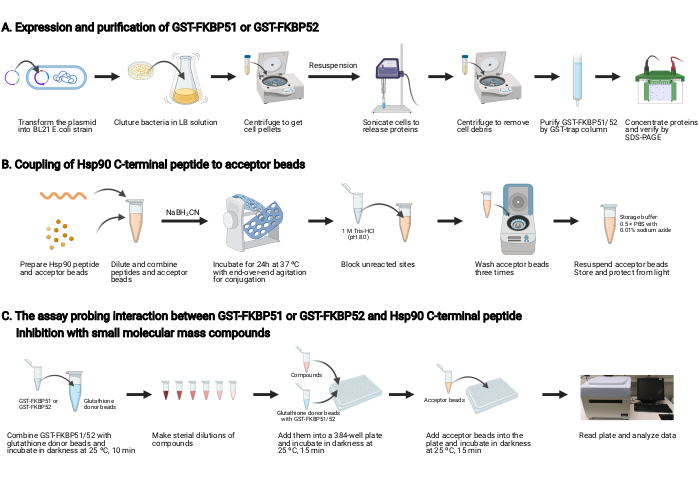
Abbildung 2: Schematische Darstellung dieses Protokolls. (A) Ausdruck und Reinigung von GST-FKBP51 und GST-FKBP52. (B) Kopplung des Hsp90 C-terminalen Peptids an die Akzeptorperlen. (C) Der Assay, der die Wechselwirkung zwischen GST-FKBP51 oder GST-FKBP52 und Hsp90 C-terminales Peptid untersucht. Hemmung mit Verbindungen mit geringer Molekülmasse. Erstellt mit BioRender.com Klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
In unserem Assay liegen der Z-Faktor und das S/B-Verhältnis bei 0,82 bzw. 13,35 (Abbildung 3A), was zeigt, dass unser Assay robust und zuverlässig für das Hochdurchsatz-Screening ist. Wir haben es dann verwendet, um Verbindungen mit kleiner molekularer Masse zu screenen. Abbildung 3B zeigt die dosisabhängige Hemmung von Chaperon-Cochaperon-Wechselwirkungen mit einem ausgewählten kleinen Molekül (D10). Die Dosis-Wirkungs-Kurven für D10 werden durch nichtli...
Diskussion
Hier beschreiben wir ein Protokoll mit dem Assay zum Screening kleiner Moleküle, die Wechselwirkungen zwischen Hsp90 und TPR-Motiv-Co-Chaperonen, insbesondere FKBP51 und FKBP52, hemmen. Sein hoher Z'-Wert (>0,8) zeigt die Robustheit und Zuverlässigkeit für ein Format mit hohem Durchsatz. Ergebnisse können innerhalb einer Stunde erzielt werden, und kleine Mengen an Perlen, Protein und Verbindungen sind erforderlich. Darüber hinaus könnte dieses Protokoll leicht auf alle Hsp90 / Hsp70 - TPR-Motiv-Co-Chaperon-Interakt...
Offenlegungen
Die Autoren berichten von keinen Interessenkonflikten.
Danksagungen
Diese Studie wurde durch Zuschüsse des Schwedischen Forschungsrats (2018-02843), der Brain Foundation (Fo 2019-0140), der Foundation for Geriatric Diseases am Karolinska Institutet, der Gunvor and Josef Anérs Foundation, der Magnus Bergvalls Foundation, der Gun and Bertil Stohnes Foundation, der Tore Nilssons Foundation for Medical Research, der Margaretha af Ugglas Foundation und der Foundation for Old Servants unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Referenzen
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer's disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten