JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
동질적인 구드 기반 분석체를 사용하여 샤페론 - 코카페론 상호 작용의 연구
요약
이 프로토콜은 GST 융합 TPR 모티프 공동 샤페론과 Hsp90 유래 펩타이드와 결합 된 수용자 구슬과 글루타티온 연결된 기증자 구슬을 사용하여 단백질 단백질 상호 작용을 조사하는 기술을 제시합니다. 우리는 Hsp90-FKBP51 또는 Hsp90-FKBP52 상호 작용을 중단하기 위하여 작은 분자를 스크린하기 위하여 이 기술을 사용하고 강력하고 선택적인 Hsp90-FKBP51 상호 작용 억제제를 확인했습니다.
초록
열 충격 단백질(Hsp90)-코차페론 상호작용을 대상으로 하면 Hsp90 의존성 세포내 공정을 구체적으로 조절할 수 있습니다. Hsp90의 C-terminus에서 보존된 MEEVD 펜타펩타이드는 공동 샤페론의 테트라트리코피타이드 반복(TPR) 모티프와의 상호 작용을 담당합니다. FK506 결합 단백질 (FKBP) 51 및 FKBP52는 다른 기능을 가진 스테로이드 호르몬 의존성 질병에 관여하는 두 개의 유사한 TPR-motif 공동 샤페론이다. 따라서, Hsp90과 FKBP51 또는 FKBP52 사이의 상호 작용을 구체적으로 차단하는 분자를 식별하는 것은 몇몇 인간 적인 질병을 위한 유망한 치료 잠재력을 제공합니다. 여기에서는 Hsp90과 파트너 공동 샤페론 FKBP51 및 FKBP52 간의 상호 작용을 조사하기 위해 증폭된 발광 근접 성 균질 분석에 대한 프로토콜을 설명합니다. 먼저, 글루타티온 S-transferase(GST) 태그형태로 TPR 모티프 함유 단백질 FKBP51 및 FKBP52를 정제했습니다. GST 융합 TPR 모티프 단백질과 Hsp90의 10-mer C-말단 펩타이드와 결합된 수용자 구슬을 곁들인 글루타티온 연계 기증자 구슬을 사용하여 동질적인 환경에서 단백질 단백질 상호 작용을 조사했습니다. 우리는 Hsp90-FKBP51 또는 Hsp90-FKBP52 상호 작용을 중단하기 위하여 작은 분자를 스크린하기 위하여 이 분석기를 사용하고 강력하고 선택적인 Hsp90-FKBP51 상호 작용 억제제를 확인했습니다.
서문
분자 샤페론은 단백질 접이식, 수송 및 저하를 포함한 단백질 항상성에 기여합니다. 그(것)들은 몇몇 세포 프로세스를 통제하고 암과 신경 퇴행성 질병1과같은 수많은 질병에 연결됩니다. 열 충격 단백질 90 (Hsp90)은 ATP 가수 분해에 의해 구동되는 형태 변화에 의존하고 공동 샤페론2에의해 매개 되는 클라이언트 단백질과 결합하는 가장 중요한 chaperones 중 하나입니다. 치료 대상으로 Hsp90의 명백한 잠재력에도 불구 하 고, 그것의 기능을 미세 조정 하는 것은 큰 도전을 나타냅니다. 임상 시험에서 평가된 N단 ATP 결합 영역을 대상으로 하는 여러 Hsp90 억제제가 있지만, 그 중 어느 것도 마케팅3에대해 승인되지 않았습니다. 잘 정의 된 리간드 바인딩 포켓4의부족으로 인해 Hsp90의 C-말단 영역을 대상으로한 성공 4. 최근, 작은 분자에 의한 Hsp90-cochaperone 상호 작용의 중단은 대체 전략5로조사되고 있다. Hsp90-cochaperone 상호 작용을 표적으로 하는 것은 일반적인 세포 응력 반응을 이끌어 내는 것이 아니라 각종 세포내 프로세스를 구체적으로 통제할 수 있는 가능성을 제공합니다. Hsp90의 C-terminus에서 보존된 MEEVD 펜타펩타이드는 공동 샤페론6의테트라트리코피타이드 반복(TPR) 모티프와의 상호 작용을 담당한다. 인간 단백질 데이터베이스에 주석이 달린 736TPR 모티프 함유 단백질 중 ~20개의 상이한 단백질은 이 펩티드7을통해 Hsp90과 상호 작용한다. MEEVD 펩티드 결합을 위해 경쟁하는 분자는 TPR 도메인을 포함하는 Hsp90과 공동 보호자 사이의 상호 작용을 방해할 것입니다. 펩타이드 결합 부위는 유사한 삼차 구조를 가지고 있지만 다른 TPR 모티프 도메인 간의 전반적인 상동성은 상대적으로 낮은7,Hsp90 및 특정 TPR 모티프 공동 chaperones 사이의 상호 작용을 차단 할 수있는 분자를 식별 할 수있는 기회를 제공. 이들 TPR-모티프 공동-샤페론 중, FK506 결합 단백질(FKBP) 51 및 FKBP52는 스테로이드 호르몬 수용체(SHR)의 조절제이며 암, 스트레스 관련 질환, 대사질환,알츠하이머병등 여러 스테로이드 호르몬 의존성 질환에 관여하고 있다. FKBP51 및 FKBP52 점유율은 80% 시퀀스 유사성을 >, FKBP52는 SHR 활동의 긍정적인 레귤레이터이며, FKBP51은 대부분의경우8의 부정적인 레귤레이터입니다. 따라서, 분자를 식별하는 것은, 특히 Hsp90과 FKBP51 또는 FKBP52 사이 상호 작용을 차단하는, 관련 질병을 위한 유망한 치료 잠재력을 제공합니다.
Mplified Luminescent Promomity Homogenous Assay (AlphaScreen)는 1994년 울만 EF 외9에의해 처음 개발되었다. 지금은 펩타이드 10, 단백질11,DNA12,RNA13및설탕(14)과같은 다양한 유형의 생물학적 상호 작용을 검출하는 데 널리 사용된다. 이 기법에서는, 구슬의 2종류(직경 200nm)가 있고, 하나는 기증자 비드이고 다른 하나는 수용자 비드이다. 생체 분자는 이 구슬에 고정됩니다; 그들의 생물학적 상호 작용은 기증자와 수용자 구슬을 근접으로 가져옵니다. 680 nm에서 기증자 비드의 광감제는 산소를 단일 산소로 조명하고 변환합니다. 단일 산소는 수명이 짧기 때문에 최대 200nm까지만 확산될 수 있습니다. 수용자 비드가 근접한 경우, 티옥센 유도체는 370 nm에서 단일 산소 발생 화학증과 반응합니다. 이 에너지는 520-620 nm15에서빛을 방출하기 위해 동일한 수용자 비드에서 형광을 더욱 활성화합니다. 생물학적 상호 작용이 중단되면 수용자 비드와 기증자 비드는 근접에 도달 할 수 없으므로 단일 산소 붕괴 및 낮은 생성 신호가 발생합니다.
여기서 우리는 Hsp90과 TPR 공동 chaperones, 특히 FKBP51 및 FKBP52 사이 상호 작용을 억제하는 작은 분자를 검열하기 위한 이 기술을 사용하여 프로토콜을 기술합니다. Hsp90 극한 C-테르미누스에 대응하는 10개의 아미노산 긴 펩티드를 수용자 구슬에 부착한다. 정제 된 GST 태그 TPR 공동 샤페론은 글루타티온 연결된 기증자 구슬과 상호 작용합니다. Hsp90 유래 펩티드와 TPR 모티프 공동 샤페론 간의 상호 작용이 구슬을 함께 가져오면 증폭 된 신호가 생성됩니다(도 1A). 선별된 소분자가 Hsp90과 TPR 모티프 공동 샤페론 간의 상호 작용을 억제할 수 있다면, 이러한 증폭 신호는 감소될것이다(도 1B). IC50은 정량적 측정을 통해 계산할 수 있습니다. 이 프로토콜은 모든 보호자로 확장 될 수있다 - TPR 모티프 공동 샤페론 관심의 상호 작용과 특히 Hsp90 과 FKBP51 또는 FKBP52 사이의 상호 작용을 차단, 새로운 분자의 개발에 매우 중요하다.

그림 1: 이 분석의 기본 원리. (A)정제된 GST-FKBP51은 글루타티온 연계 기증자 구슬과 상호 작용한다. Hsp90의 극단적인 C-테르미누스에 대응하는 10개의 아미노산 긴 펩티드는 수용자 구슬에 부착된다. FKBP51의 Hsp90 유래 펩티드와 TPR 도메인 간의 상호 작용은 기증자와 수용자 구슬을 근접하게 합니다. 680 nm에서 기증자 비드의 광감제는 산소를 단일 산소로 조명하고 변환합니다. 수용자 비드의 티옥센 유도체는 단일 산소와 반응하여 370 nm에서 화학 발광을 생성합니다. 이 에너지는 동일한 수용자 비드에서 형광을 더 활성화하여 520-620 nm에서 빛을 방출합니다. (B)소분자가 Hsp90과 FKBP51 사이의 상호 작용을 억제할 때, 기증자와 수용자 구슬은 근접에 도달할 수 없다. 그런 다음 짧은 수명 부패를 가진 단일 산소가 발생하며 감지 가능한 신호가 생성되지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
참고: 이 프로토콜에 대한 개요는 그림 2에표시됩니다.
1. GST-FKBP51 및 GST-FKBP52의 발현 및 정제(그림 2A)
-
플라스 미드
참고: 이미지 컨소시엄에서 인간 FKBP51(클론 id: 5723416)과 인간 FKBP52(클론 id: 7474554)용 cDNA 클론을 획득합니다.- 인간 FKBP51 DNA를 프라이머로 PCR으로 증폭(앞으로 5'GGATCCATGACTGATGAAGGT-3', 역전; 5'CTCGAGCTATTTGTCTCTCCAC-3') BamHI 및 XhoI 오버행 및 복제를 포함 한 BamHI / XhoI 제한 부위.
- 인간 FKBP52 DNA를 프라이머로 PCR으로 증폭(앞으로 5'-GAATTCATGACAGGAGATG-3', 역전; 5'-CTCGAGCTATGCCTCTCTCCAC-3') 에코리와 호이 오버행 및 에코리/XhoI 제한 부위에서 pGEX6-2 벡터로 클론을 함유하고 있습니다.
참고: PCR 반응 설정 및 조건표 1 및 표 2에표시됩니다. - 삽입된 서열을 확인하고 제조 프로토콜에 따라 화학적으로 유능한 대장균으로 플라스미드를 변환합니다.
-
단백질 발현 및 정제
- LB 용액을 만들기 위해 증류수 1L에 루리아 국물(LB) 베이스 25g을 넣습니다. 121 °C에서 15 분 동안 자동 복제합니다. 냉각 후 50 μg/mL 암피실린을 추가합니다.
- GST-FKBP51 또는 GST-FKBP52를 표현하는 박테리아의 식민지를 가지고 1.5 mL 튜브에 LB 용액의 500 μL과 혼합. 소용돌이.
- 알루미늄 호일로 덮인 Erlenmeyer 플라스크에 "1.2.2"의 혼합물을 LB 용액 1L에 넣습니다. 37°C에서 하룻밤 동안 셰이커에 Erlenmeyer 플라스크를 배양합니다.
- 1mM 이소프로필-β-D-티오갈라콘토사이드(IPTG)를 에렌마이어 플라스크에 첨가하여 단백질 발현을 유도하고 2시간 더 인큐베이션을 지속한다.
- 세포 펠릿을 얻으려면 원심분리기는 5,000 x g에서 15 분 동안. 상부체를 제거합니다.
참고: 세포 펠릿은 -20°C에 보관할 수 있습니다. - PBS의 40 mL에서 세포 펠릿을 다시 중단하고 얼음에 3 x 20 s를 초음파 처리합니다. 1 mM PMSF, 1 mM EDTA, 프로테아제 억제제 칵테일 (1 태블릿)을 추가하여 프로테오리시스를 방지합니다.
- 세포 이물질을 제거하고 5mL GST 트랩 기둥에 상퍼를 적용하기 위해 30분 50,000 x g의 현탁액을 원심분리합니다.
- 30mL PBS, 엘루트 GST-FKBP51 및 GST-FKBP52로 열을 세척한 후 PBS에서 10mM 글루타티온 5mL로 구성된다.
- 15mL 10.000 MWCO 원심분리 장치에 단백질 농축. 무료 글루타티온을 제거하려면 0.5배 PBS로 양면된 PD-10 컬럼을 통과하고 필터 원심분리기 장치에 다시 집중합니다.
- 단백질함유 분수를 수집합니다. SDS-PAGE에서 단백질을 확인하고 단백질 농도를 1 mg/mL로 조정합니다.
참고: 일반적인 단백질 수율은 2-5 mg/L 배양입니다. 단백질은 -20°C에서 보관할 수 있다.
2. Hsp90 C 단말 펩타이드를 수용자 구슬에 결합(도 2B)
-
Hsp90 펩티드 제제
- 10 개의 아미노산 펩타이드 NH2-EDASRMEEVD-COOH는 펩타이드 합성 서비스에 의해 인간 Hsp90 베타 이소폼 (UniProt ID : P08238)의 아미노산 714-724에 해당합니다.
- PBS에서 Hsp90 펩티드를 1 mg/mL 농도로 희석시다.
-
수락자 구슬 준비
- PBS에서 비응유수령구비드를 1 mg/mL 농도로 희석하고 1.5mL 튜브로 이송한다.
- 15 분 동안 16,000 x g에서 원심 분리로 세탁을 수행하십시오. 상체를 조심스럽게 제거합니다.
-
활용
- 구슬과 펩타이드 사이의 비율을 10:1로 설정합니다. 1.5mL 튜브에서 1 mg의 수용자 비드 펠릿(상술한 바와 같이 제조), PBS 1mL(pH 7.4), 희석 펩타이드 0.1 mg, 1.25 μL 의 Tween-20, 10 μL의 디아노보로하이드라이드 나트륨(NaBH3CN)을 첨가한다.
주의: NaBH3CN은 독성; 연기 후드와 장갑을 사용합니다. NaBH3CN 솔루션은 신선하게 준비해야 합니다. - 회전 셰이커에 종단 간 교반 (10-20 rpm)으로 37 °C에서 24 시간 동안 배양하십시오.
- 구슬과 펩타이드 사이의 비율을 10:1로 설정합니다. 1.5mL 튜브에서 1 mg의 수용자 비드 펠릿(상술한 바와 같이 제조), PBS 1mL(pH 7.4), 희석 펩타이드 0.1 mg, 1.25 μL 의 Tween-20, 10 μL의 디아노보로하이드라이드 나트륨(NaBH3CN)을 첨가한다.
-
반응 담금질 및 구슬 세척
- 반응에 1M Tris-HCl(pH 8.0) 용액의 20 μL을 추가하여 반응하지 않은 사이트를 차단합니다. 37°C에서 1h의 인큐베이션을 사용할 수 있습니다.
- 원심분리기는 4°C에서 15분 동안 16,000 x g(또는 최대 속도)에서 원심분리기. 상체를 제거하고 Tris-HCl 용액(100mMM, pH 8.0)의 1mL에서 비드 펠릿을 재연한다.
- 세정 단계를 세 번 반복합니다.
- 마지막 원심분리 후, 저장 버퍼에서 1 mg/mL에서 구슬을 재보종한다(0.01% 나트륨 아지드를 가진 PBS의 0.5× PBS의 1mL). 4°C 광 보호에 컨쥬게이트 수용자 비드 용액을 저장합니다.
주의: 아지드 나트륨은 독성이 있습니다. 연기 후드와 장갑을 사용합니다.
3. GST-FKBP51 또는 GST-FKBP52 및 Hsp90 C-말단 펩타이드 간의 상호 작용을 프로빙하는 분석, 및 작은 분자 질량 화합물과의억제(도 2C)
-
글루타티온 기증자 구슬과 상호 작용하는 GST 태그 단백질
- 384웰 플레이트에 반응을 설정합니다.
- 글루타티온 기증자 구슬의 10 μg/mL을 포함하는 용액을 0.5배 PBS, pH 7.4로 준비한다.
참고: 장시간 보관한 후 구슬이 정착하여 소용돌이를 겪어야 합니다. - GST-FKBP51 또는 GST-FKBP52를 10 μg/mL의 최종 농도에 추가합니다.
- 10 분 동안 25 °C에서 어둠 속에서 배양하십시오.
참고: 이 단계에서 GST 태그단백질은 구슬에 부착된 글루타티온과 상호 작용합니다. 각 우물에 대해, 이 혼합물의 22.5 μL이 사용될 것이다. 결합 파트너의 농도는 경험적으로 결정되어야 합니다. GST-FKBP51 및 GST-FKBP52를 적정하고 최상의 신호를 제공하는 농도를 선택합니다.
-
화합물 첨가
- DMSO에서 테스트 화합물의 직렬 희석을 합니다.
참고: 사용되는 농도는 일반적으로 10, 30, 100, 300, 1,000 및 3,000 μM입니다. - DMSO(음의 대조군) 또는 Hsp90 C 단말 펩타이드(양수 제어, 30 μM) 또는 DMSO의 화합물을 플레이트의 각 웰 모서리에 0.25 μL을 추가합니다. 모든 화합물 농도에 대 한 삼중 을 사용 합니다.
- 각 우물에 GST 태그 단백질을 가진 글루타티온 기증자 구슬을 포함하는 용액의 22.5 μL을 추가합니다.
- 손으로 는 부드럽게 접시를 흔들어 만 철저히 흔들어 주세요. 15 분 동안 25 °C에서 어둠 속에서 배양하십시오.
참고: 이 시간 동안 화합물은 Hsp90 C 단말 펩타이드 결합 부위에서 TPR 도메인과 상호 작용합니다.
- DMSO에서 테스트 화합물의 직렬 희석을 합니다.
-
수락자 비즈 추가
- HSp90 C 단말 펩타이드를 부착한 허용기 구슬을 0.5배 PBS에서 100 μg/mL로 희석합니다.
- 각 웰에 희석 된 수용자 구슬 2.25 μL을 추가합니다.
- 부드럽고 철저하게 섞으세요. 15 분 동안 25 °C에서 어둠 속에서 배양하십시오.
참고: 이 단계에서 기증자와 수용자 구슬은 단백질 펩티드 상호 작용에 의해 근접성으로 가져온다. 반응 혼합물의 최종 부피는 25 μL입니다. 따라서, 화합물의 최종 농도는 0.1에서 30 μM에 구역 수색됩니다.
-
플레이트 판독
참고: 관련 모드로 설정된 플레이트 판독기를 사용하여 플레이트를 읽습니다.- 계측기를 켜고 소프트웨어를 엽니다.
- 관련 프로토콜을 선택합니다.
- 플레이트 맵 편집을 클릭하고 플레이트에서 사용되는 웰을 선택하여 측정합니다.
- 다음을 클릭하여 선택한 프로토콜을 계속 실행하고 실행합니다.
- 측정 후 결과 표시를 클릭하여 결과를 봅니다.
- 데이터를 내보냅니다.
4. 데이터 분석
-
Z의 계수 및 신호 대 배경(S/B) 비율
- 다음 방정식을 사용하여 분석에 대한 Z 계수 및 S/B 비율을 계산합니다.
Z'=1-(3θpos+3θneg)/μ포즈-μ네그=16
S/B=μ네/μ포즈
여기서, σ 및 μ 각각 양성(Hsp90 C 단말 펩타이드, 30 μM) 및 음수(DMSO) 컨트롤의 표준 편차 및 수단을 나타낸다. Z의 요인 > 0.5는 분석이 스크리닝을 위해 충분히 견고하다는 것을 보장합니다. 분석 감도를 모니터링하기 위해 S/B 비율도 계산되었습니다.
- 다음 방정식을 사용하여 분석에 대한 Z 계수 및 S/B 비율을 계산합니다.
-
용량 응답 곡선 및 IC 50
참고: 비선형 회귀 분석을 사용하여 소프트웨어별로 Hsp90-cochaperones PPI 억제제의 데이터에 맞게 조정합니다.- 웰컴 대화 상자에서 XY 데이터 테이블을 만들고 X 번호를선택하고 Y Enter 3(트리클리케이트인 경우)은 나란히 열을 복제합니다.
- 샘플의 신호 데이터를 음수 대조군으로 정규화합니다. 농도 값을 X 열로 가져오고 신호 값을 Y 열로 가져옵니다.
- 변환 | 아래 변환 농도(X)를 분석하고 선택합니다. 정규화. 로가리텀으로 변환을 선택합니다.
참고: 이렇게 하면 농도가 로그 스케일로 바뀝을 바꿉시킵니다. 시작 농도가 0인 경우 0의 로가릿심이 정의되지 않으므로 해당 값을 잃지 않도록 효과적으로 0(예: 0.1 nM)인 매우 작은 숫자로 설정합니다. - XY 분석에서 비선형 회귀(곡선 맞춤)를 클릭하고 선택하여 용량 응답 억제를 열고 로그(억제제) 대 응답을 선택합니다.
- 확인을 클릭하여 결과(IC 50 값 포함) 및 그래프를 봅니다.
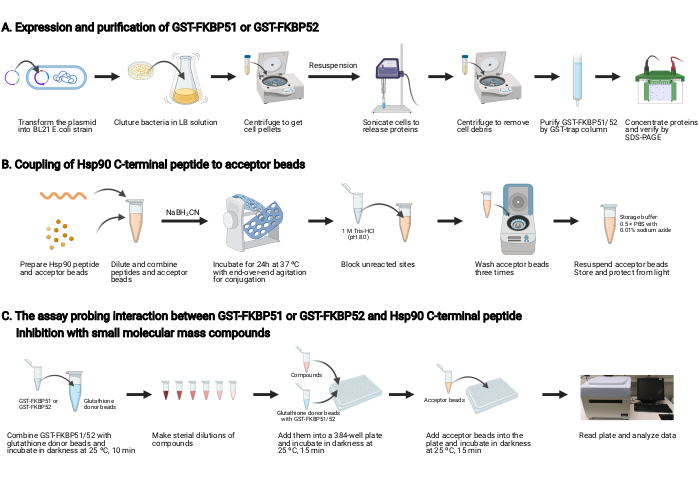
그림 2: 이 프로토콜의 회로도. (A)GST-FKBP51 및 GST-FKBP52의 발현 및 정제. (B)Hsp90 C 단말 펩타이드를 수용자 구슬로 결합한다. (C)GST-FKBP51 또는 GST-FKBP52 및 Hsp90 C-말단 펩타이드 간의 상호작용을 프로빙하는 분석. 작은 분자 질량 화합물억제. BioRender.com 만든 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
분석에서 Z의 요인과 S/B 비율은 각각 0.82 및 13.35입니다(그림 3A),우리의 분석이 높은 처리량 스크리닝에 강력하고 신뢰할 수 있음을 보여줍니다. 그런 다음 작은 분자 질량 화합물을 검사하는 데 사용했습니다. 도 3B는 선택된 소분자(D10)와 의아페론-코카페론 상호작용의 투여 의존억제를 제시한다. D10에 대한 용량 반응 곡선은 IC50의 값이 계산되...
토론
여기서 우리는 Hsp90과 TPR 모티프 공동 샤페론, 특히 FKBP51 및 FKBP52 사이의 상호 작용을 억제하는 작은 분자를 선별하기위한 분석방법을 사용하여 프로토콜을 설명합니다. 높은 Z 점수(>0.8)는 높은 처리량 형식의 견고성과 신뢰성을 보여줍니다. 결과는 1 시간 안에 얻을 수 있고, 구슬, 단백질 및 화합물의 소량이 요구됩니다. 또한,이 프로토콜은 쉽게 관심의 TPR 모티프 공동 샤페론 상호 작용 - 모든 Hs...
공개
저자는 이해 상충을 보고합니다.
감사의 말
이 연구는 스웨덴 연구 위원회 (2018-02843), 브레인 재단 (Fo 2019-0140), 카롤린스카 연구소, 건보르 및 요제프 아네스 재단, 매그너스 베르그발스 재단, 총 및 베르틸 스네스 재단, 토레 닐스 재단, 올드 아펠라 재단, 토르 닐스 재단의 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
참고문헌
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer's disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유