需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用同质珠为基础的检测的查佩龙-科查佩龙相互作用研究
摘要
该协议提出了一种利用谷胱甘肽相关的供体珠与 GST 融合的 TPR-motif 共同伴奏和接受珠以及 Hsp90 衍生肽来探索蛋白质- 蛋白质相互作用的技术。我们使用此技术筛选小分子,以破坏 Hsp90-FKBP51 或 Hsp90-FKBP52 相互作用,并识别出有效和选择性的 Hsp90-FKBP51 相互作用抑制剂。
摘要
针对热休克蛋白 90 (Hsp90) - 可可酮相互作用提供了专门调节 Hsp90 依赖细胞内过程的可能性。Hsp90 C 终点站保存的 MEEVD 五肽负责与共护的四肽重复 (TPR) 主题的相互作用。FK506 结合蛋白 (FKBP) 51 和 FKBP52 是两个类似的 TPR 主题共同伴奏涉及类固醇激素依赖性疾病具有不同的功能.因此,识别专门阻断Hsp90和FKBP51或FKBP52之间相互作用的分子为几种人类疾病提供了有希望的治疗潜力。在这里,我们描述了放大发光接近同质测定程序,以调查Hsp90与其合作伙伴FKBP51和FKBP52之间的相互作用。首先,我们以谷胱甘肽S转移酶(GST)标记形式纯化了含TPR图案的蛋白质FKBP51和FKBP52。利用与谷胱甘肽相关的供体珠与 GST 融合的 TPR-motif 蛋白和接受珠,以及 Hsp90 的 10 mer C 终端肽,我们探索了同质环境中的蛋白质-蛋白质相互作用。我们利用此检测屏蔽小分子,以破坏 Hsp90-FKBP51 或 Hsp90-FKBP52 相互作用,并识别出有效和选择性的 Hsp90-FKBP51 相互作用抑制剂。
引言
分子伴奏有助于蛋白质平衡,包括蛋白质折叠、运输和降解。它们调节几个细胞过程,与许多疾病有关,如癌症和神经退行性疾病1。热休克蛋白90(Hsp90)是最重要的伴奏之一,其功能取决于ATP水解驱动的构象变化,并与由其共同伴奏2调解的客户蛋白结合。尽管Hsp90作为治疗靶点的潜力显而易见,但微调其功能是一个很大的挑战。有几个Hsp90抑制剂针对N终端ATP结合区,已在临床试验中评估,但没有一个已被批准营销3。由于缺乏一个明确的配体绑定口袋4,针对Hsp90的C终端区域已经取得了有限的成功4。最近,小分子对Hsp90-cochaperone相互作用的破坏被作为替代策略5进行了研究。以Hsp90-cochaperone相互作用为目标不会引起一般细胞应激反应,并有可能具体调节各种细胞内过程。Hsp90 C 终点站保存的 MEEVD 五肽负责与共伴6的四肽重复 (TPR) 主题的相互作用。在人类蛋白质数据库中注释的736种TPR主题含图案的蛋白质中,有20种不同的蛋白质通过这种肽7与Hsp90相互作用。分子争夺MEEVD肽结合会破坏Hsp90和含有TPR域的共同伴奏之间的相互作用。肽结合场具有类似的第三级结构,但不同TPR主题域之间的整体同源性相对较低,提供了一个机会来识别分子,特别是能够阻止Hsp90和特定TPR-主题共同伴奏之间的相互作用。在这些TPR-motif共同伴奏中,FK506结合蛋白(FKBP)51和FKBP52是类固醇激素受体(SHR)信号的调节器,并涉及多种类固醇激素依赖性疾病,包括癌症、压力相关疾病、代谢疾病和阿尔茨海默氏症8。虽然FKBP51和FKBP52的份额>80%的序列相似性,但它们的功能不同:FKBP52是SHR活动的正调节器,而FKBP51在大多数情况下是负监管机构。因此,识别分子,特别是阻断Hsp90和FKBP51或FKBP52之间的相互作用,为相关疾病提供了有希望的治疗潜力。
1994年,乌尔曼EF等人首次研制出一种Mpl化L微生P生源性Asay(阿尔法屏幕)。现在,它被广泛用于检测不同类型的生物相互作用,如肽10,蛋白质11,DNA12,RNA13和糖14。在这项技术中,有两种珠子(直径200纳米),一种是捐赠珠,另一种是接受珠。生物分子固定在这些珠子上;他们的生物相互作用使捐赠者和接受者珠子接近。在680纳米处,捐赠珠中的光敏剂照亮并转换氧气为单氧。由于单氧寿命短,只能扩散至200纳米。如果接受珠在附近,其硫氧生成物与在370纳米下产生化疗的单氧发生反应。这种能量进一步激活荧光灯在同一接受珠发出光在520-620纳米15。如果生物相互作用中断,接受珠和供体珠无法接近,导致单氧衰变和低生成信号。
在这里,我们描述了使用这种技术筛选小分子,抑制Hsp90和TPR共同伴奏之间的相互作用的协议,特别是FKBP51和FKBP52。与Hsp90极端C终点站对应的10种氨基酸长肽附着在接受珠上。纯化 Gst 标记的 Tpr 共同伴奏与谷胱甘肽相关的捐赠珠子相互作用。当Hsp90衍生肽和TPR-motif共同伴奏器之间的相互作用将珠子聚集在一起时,就会产生放大信号(图1A)。如果筛选的小分子可以抑制Hsp90和TPR-主题共同伴奏之间的相互作用,这个放大的信号将减少(图1B)。他们的IC50 可以通过定量测量来计算。此协议可以扩展到任何伴奏 - TPR-motif 共同伴奏相互作用的兴趣,并在新分子的发展中非常重要,特别是阻止Hsp90和FKBP51或FKBP52之间的相互作用。

图1:本检测的基本原则。(A) 纯化GST-FKBP51与谷胱甘肽相关的捐赠珠子相互作用。与Hsp90极端C终点相对应的10种氨基酸长肽附着在接受珠上。Hsp90 衍生肽和 FKBP51 的 TPR 域之间的相互作用使捐赠者和接受者珠子接近。在680纳米处,捐赠珠中的光敏剂照亮并转换氧气为单氧。接受珠上的硫化物衍生物与单氧发生反应,在 370 nm 处产生化疗。这种能量进一步激活同一接收珠中的荧光,以 520-620 nm 发射光。(B) 当小分子抑制Hsp90和FKBP51之间的相互作用时,供体和接受珠无法接近。然后,寿命短的单氧衰变,并且不产生可检测的信号。请单击此处查看此图的较大版本。
研究方案
注:此协议概述显示在 图 2中。
1. GST-FKBP51 和 GST-FKBP52 的表达和净化 (图 2A)
-
质 粒
注:从图像联盟获取用于人类FKBP51(克隆 ID:5723416)和用于人类 FKBP52(克隆 ID:7474554)的 cDNA 克隆。- 用引物放大人类 Fkbp51 Dna (前进; 5 'Ggatccatactactgaggt - 3', 反向; 5 '- CTCGCTCTCTCCAC - 3'), 包含巴姆希和 Xhoi 悬垂, 克隆成 pgex6 - 1 载体在巴姆希 / Xhoi 限制站点。
- 用引物(前方;5'-加特卡特加特-3',反向;5'-CTCGGCTCTCTCCAC-3')放大人类FKBP52 DNA,其中含有EconRI和XhoI悬垂,克隆成pGEX6-2载体在EcoRI/XhoI限制站点。
注:PCR 反应设置和条件显示在 表 1 和 表 2中。 - 根据制造协议验证插入的序列,将质粒转化为化学上称职的大肠杆菌。
-
蛋白质表达和纯化
- 在 1 升蒸馏水中加入 25 克 Luria 肉汤 (LB) 基座,以制作 LB 溶液。在 121 °C 下自动将其高压 15 分钟。冷却后,加入50微克/mL安培素。
- 以表达 GST-FKBP51 或 GST-FKBP52 的细菌群为例,在 1.5 mL 管中与 500 μL 的 LB 溶液混合。旋涡。
- 在覆盖着铝箔的 Erlenmeyer 烧瓶中加入 1 L 的 LB 溶液中的"1.2.2"混合物。在 37 °C 的摇床中将埃伦迈尔烧瓶孵化过夜。
- 通过在埃伦迈尔烧瓶中加入1m异丙基-β-D硫化物(IPTG)来诱导蛋白质表达,并继续孵育2小时。
- 要获得细胞颗粒,离心机在 5,000 x g 为 15 分钟。取出超高超。
注:细胞颗粒可存储在 -20 °C 下。 - 将细胞颗粒重新悬念在 PBS 的 40 mL 中,并在冰上声波 3 x 20 s。加入 1 mM PMSF、1 m EDTA 和蛋白酶抑制剂鸡尾酒 (1 片), 以防止蛋白溶解。
- 将悬架离心 30 分钟 50,000 x g 以去除细胞碎片,并将超高纳特应用到 5 mL GST 陷阱柱上。
- 用 30 mL PBS 清洗柱子后,在 PBS 中用 5 mL 的 10 mM 谷胱甘肽清洗 GST-FKBP51 和 GST-FKBP52。
- 将蛋白质浓缩到 15 mL 10.000 MWCO 离心装置上。要去除免费谷胱甘肽,请通过 PD-10 列将浓缩物与 0.5 倍 PBS 平衡,并再次集中到滤芯离心机设备上。
- 收集含蛋白质的分数。验证 SDS-PAGE 中的蛋白质,并将蛋白质浓度调整为 1 毫克/毫升。
注:典型蛋白质产量为2-5毫克/升培养。蛋白质可以储存在-20°C。
2. 将Hsp90 C终端肽与接受珠耦合(图2B)
-
Hsp90 肽制剂
- 合成十种氨基酸肽NH2-EDASRMEEVD-COOH对应于人类Hsp90β异形(UniProt ID:P08238)的氨基酸714-724,通过肽合成服务。
- 将 PBS 中的 Hsp90 肽稀释至 1 毫克/mL 浓度。
-
接受者珠准备
- 将 PBS 中未合并的接受珠稀释至 1 毫克/mL 浓度,并转移到 1.5 mL 管中。
- 以离心机清洗 16,000 x g 进行 15 分钟。小心地取出超高等。
-
共轭
- 将珠子和肽的比例设定为 10:1。在含有1毫克接受珠颗粒的1.5mL管中(如上所述),加入1 mL的PBS(pH 7.4),0.1毫克稀释肽, 1.25 μL 的 Tween-20, 10 μL 的 400 mM 溶液氰化钠 (NaBH3CN) 在水中。
警告:纳BH3CN有毒:使用烟罩和手套。纳布3CN 解决方案应新鲜准备。 - 在 37 °C 下孵育 24 小时,在旋转摇床上进行端端搅拌(10-20 转/分)。
- 将珠子和肽的比例设定为 10:1。在含有1毫克接受珠颗粒的1.5mL管中(如上所述),加入1 mL的PBS(pH 7.4),0.1毫克稀释肽, 1.25 μL 的 Tween-20, 10 μL 的 400 mM 溶液氰化钠 (NaBH3CN) 在水中。
-
反应淬火和珠子清洗
- 添加 20 μL 的 1 M Tris-HCl (pH 8.0) 解决方案,以阻止未受反应的站点。在 37 °C 下孵育 1 小时。
- 离心机在 16,000 x g (或最大速度) 15 分钟在 4 °C. 取出超高颗粒,在 1 mL 的 Tris-HCl 溶液(100 mM,pH 8.0)中重新使用珠粒。
- 重复洗涤步骤三次。
- 上次离心后,在存储缓冲器(1 mL 0.5 × PBS 中以 1 毫克/兆升的存储缓冲器重新使用珠子,其中 0.01% 为防腐剂)。将结合的接受者珠子溶液存储在受保护的 4 °C 光下。
警告:钠酸钠有毒:使用烟罩和手套。
3. 检测GST-FKBP51或GST-FKBP52与Hsp90 C终端肽之间的相互作用,并抑制小分子质量化合物(图2C)
-
GST 标记的蛋白质与谷胱甘肽捐赠者珠子相互作用
- 在384井板块中设置反应。
- 准备包含 10 μg/mL 谷胱甘肽捐赠者珠的溶液,以 0.5 倍 PBS、pH 7.4 表示。
注:经过长时间的储存,珠子会稳定下来,需要涡流。 - 将 GST-FKBP51 或 GST-FKBP52 添加到 10 μg/mL 的最终浓度中。
- 在25°C的黑暗中孵育10分钟。
注:在此步骤中,GST 标记的蛋白质将与附着在珠子上的谷胱甘肽相互作用。对于每口井,将使用 22.5 μL 的混合物。约束合作伙伴的集中度必须由经验确定。提提 GST-FKBP51 和 GST-FKBP52,并选择提供最佳信号的浓度。
-
复合添加
- 对 DMSO 中的测试化合物进行串行稀释。
注:使用的浓度通常为 10、30、100、300、1,000 和 3,000 μM。 - 在板的每个井的一角添加 0.25 μL 的 DMSO(负控制)或 Hsp90 C 终端肽(正控制,30 μM)或化合物。使用三重酸盐进行每种复合浓度。
- 在每口油井中加入22.5微升含有谷胱甘肽供体珠的溶液,并加入GST标记的蛋白质。
- 用手轻轻摇动盘子,但要彻底。在 25 °C 的黑暗中孵育 15 分钟。
注:在此期间,化合物将在Hsp90 C终端肽结合站点与TPR域相互作用。
- 对 DMSO 中的测试化合物进行串行稀释。
-
接受者珠子添加
- 在 0.5x PBS 中将接收器珠与附加的 Hsp90 C 终端肽稀释至 100 μg/mL。
- 在每口井中加入 2.25 μL 稀释的接受珠。
- 轻轻但彻底地混合。在 25 °C 的黑暗中孵育 15 分钟。
注:在此步骤中,供体和接受珠被蛋白质肽相互作用拉近。反应混合物的最终体积为 25 微升。因此,化合物的最终浓度从0.1到30μM不等。
-
板读取
注:使用相关模式设置的板读取器阅读板。- 打开仪器并打开软件
- 选择相关协议。
- 单击 "编辑板图 "并选择板中使用的井进行测量。
- 单击 "下一步 "继续并 运行 所选协议。
- 测量后,单击 "显示结果 "查看结果。
- 导出数据。
4. 数据分析
-
Z 的因子和信号与背景 (S/B) 比率
- 使用以下方程计算测定中的 Z'因子和 S/B 比率:
Z'1-(3+pos=3=neg)/=μμ-
S/B=μ内格/μpos
其中,σ和μ分别表示正 (Hsp90 C 端肽、30 μM) 和负 (DMSO) 控件的标准偏差和手段。Z'因子> 0.5 将确保检测足够坚固,可以进行筛查。为了监测检测灵敏度,还计算了S/B比率。
- 使用以下方程计算测定中的 Z'因子和 S/B 比率:
-
剂量响应曲线和IC 50
注:使用非线性回归分析,通过软件来适应Hsp90-cochaperonesPPI抑制剂的数据。- 在"欢迎对话"中创建 XY 数据表并选择 X数字,Y Enter 3(如果三重)在并排列中复制值。
- 将样品的信号数据正常化为负对照组。将浓度值导入 X 列,将信号值导入 Y 列。
- 单击 "分析 "并选择"转换|下的转换 浓度 (X)" 正常化。选择 转换到对数。
注:这将将浓度转换为日志刻度。如果您的起始浓度为零,请将其设置为非常小的数字,该数字实际上是零(例如,0.1 nM),不会丢失这些值,因为没有定义零的对数。 - 单击分析并选择XY 分析下的非线性回归(曲线拟合),打开剂量响应抑制并选择日志(抑制剂)与响应 - 可变坡度。
- 单击 "确定" 查看 结果 (包含 IC50 值)和 图形。
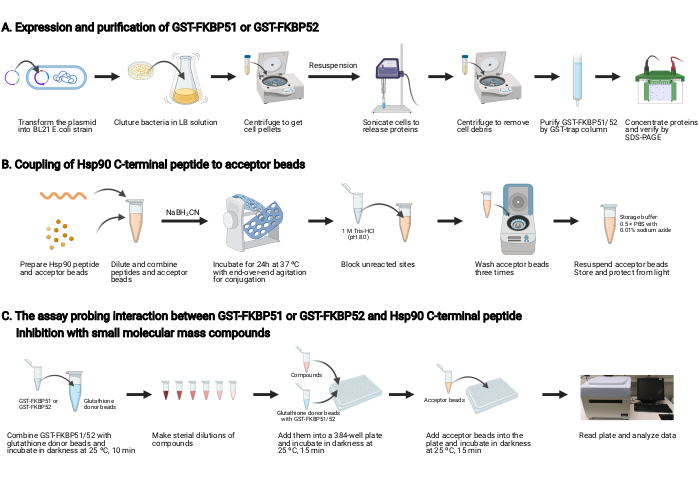
图2:本协议的示意图。(A ) GST-FKBP51 和 GST-FKBP52 的表达和纯化。(B) 将 Hsp90 C 终端肽与接受珠耦合。(C) 调查 GST-FKBP51 或 GST-FKBP52 和 Hsp90 C 终端肽之间的相互作用的检测。用小分子质量化合物抑制。使用 BioRender.com 创建请单击此处查看此图的较大版本。
结果
在我们的测定中,Z'因子和S/B比率分别为0.82和13.35(图3A),表明我们的测定对于高通量筛选是可靠可靠的。然后,我们用它来筛选小分子质量化合物。 图3B 对伴奏-协茶酮与选定小分子(D10)的相互作用呈现剂量依赖抑制。D10 的剂量响应曲线由非线性回归分析生成,根据该分析计算 IC50 值。D10 显示剂量依赖抑制在 Hsp90 - GST-FKBP51 和 Hsp90 - GST-FKB...
讨论
在这里,我们描述了一个协议,使用检测筛选小分子抑制Hsp90和TPR-motif共同伴奏之间的相互作用,特别是FKBP51和FKBP52。其高 Z 分数(>0.8)显示了高通量格式的坚固性和可靠性。结果可以在一小时内获得,需要少量的珠子、蛋白质和化合物。此外,此协议可以轻松扩展到任何 Hsp90/Hsp70 - TPR-主题共同伴奏感兴趣的相互作用。Hsp90 的几个 TPR-motif 共同伴奏与各种人类疾病有牵连,从阿尔茨海默氏症到自?...
披露声明
作者报告没有利益冲突。
致谢
这项研究得到了瑞典研究理事会(2018-02843)、大脑基金会(Fo 2019-0140)、卡罗林斯卡研究所老年病基金会、冈沃和约瑟夫·阿尼尔斯基金会、马格努斯·伯格瓦尔斯基金会、冈和伯蒂尔·斯托恩斯基金会、托雷·尼尔森医学研究基金会、玛格丽特·阿夫·乌格拉斯基金会和老仆人基金会的资助。
材料
| Name | Company | Catalog Number | Comments |
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
参考文献
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer's disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。