A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نظام ثقافة الجهاز الأمعاء المعوية لتحليل التفاعلات المضيف الميكروبيوتا
In This Article
Summary
تقدم هذه المقالة طريقة فريدة لتحليل تفاعلات الميكروبيوم المضيف باستخدام نظام جديد لثقافة أعضاء الأمعاء لتجارب الجسم الحي السابق.
Abstract
يسهل هيكل نسيج الأمعاء التفاعلات الوثيقة والمتبادلة بين المضيف والميكروبات المعوية. وهذه المحادثات المتبادلة حاسمة للحفاظ على التوازن المحلي والنظامي؛ التغييرات في تكوين الأمعاء الميكروبيوتا (dysbiosis) المنتسبين مع مجموعة واسعة من الأمراض البشرية. تشمل طرق تشريح التفاعلات بين المضيف والميكروبيوتا مقايضة متأصلة بين الحفاظ على بنية الأنسجة الفسيولوجية (عند استخدام نماذج حيوانية في الجسم الحي) ومستوى التحكم في عوامل التجربة (كما هو الحال في أنظمة زراعة الخلايا المختبرية البسيطة). لمعالجة هذه المفاضلة، طور يسشار وآخرون مؤخرا نظاما لزراعة الأعضاء المعوية. يحافظ النظام على بناء أنسجة القولون والسذاجة والآليات الخلوية ويسمح أيضا برقابة تجريبية مشددة ، مما يسهل التجارب التي لا يمكن إجراؤها بسهولة في الجسم الحي. وهو الأمثل لتشريح الاستجابات قصيرة الأجل لمختلف مكونات الأمعاء (مثل العناصر الظهارية والمناعية والخلايا العصبية) للاضطرابات الإنارة (بما في ذلك الميكروبات اللاهوائية أو الهوائية ، وعينات الميكروبات الكاملة من الفئران أو البشر ، والأدوية والأيض). هنا ، نقدم وصفا مفصلا لبروتوكول محسن لثقافة الأعضاء لشظايا الأمعاء المتعددة باستخدام جهاز ثقافة القناة الهضمية حسب الطلب. يمكن تصور استجابات المضيف للاضطرابات الإنارة عن طريق تلطيخ الفلورة المناعية لأقسام الأنسجة أو شظايا الأنسجة الكاملة التركيب ، أو التهجين في الموقع الفلوري (FISH) ، أو التصوير الفاصل زمنيا. يدعم هذا النظام مجموعة واسعة من القراءات، بما في ذلك تسلسل الجيل التالي، وقياس التدفق الخلوي، ومختلف المقايسات الخلوية والبيوكيميائية. بشكل عام ، يدعم نظام زراعة الأعضاء ثلاثي الأبعاد هذا ثقافة الأنسجة المعوية الكبيرة السليمة ولديه تطبيقات واسعة للتحليل عالي الدقة وتصور تفاعلات الكائنات الحية المجهرية المضيفة في بيئة الأمعاء المحلية.
Introduction
الأمعاء هي عضو معقد للغاية يحتوي على مجموعة واسعة من أنواع الخلايا (الخلايا الظهارية وخلايا الجهاز المناعي والخلايا العصبية وأكثر من ذلك) منظمة في بنية معينة تسمح للخلايا بالتفاعل والتواصل مع بعضها البعض ومع المحتوى الإنعائي (الكائنات الحية الدقيقة والطعام وما إلى ذلك) 1.حاليا، والأدوات البحثية المتاحة لتحليل التفاعلات المضيف الميكروبيوتا يشمل في ثقافات الخلايا المختبرية وفي نماذج الحيوانات في الجسم الحي 2. في نماذج الحيوانات في الجسم الحي توفير بناء الأنسجة الفسيولوجية3 ولكن مع ضعف السيطرة التجريبية والقدرة المحدودة على التلاعب ظروف التجربة. في نظم زراعة المختبر، من ناحية أخرى، استخدام الخلايا الأولية أو خطوط الخلية التي يمكن أن تستكمل مع الميكروبات4،وتقديم رقابة مشددة على المعلمات التجربة ولكن تفتقر إلى تعقيد الخلوية والهندسة المعمارية الأنسجة. تسمح المقايسات المختبرية الحديثة بالاستخدام المتقدم لعينات الأنسجة البشرية الصحية والمرضية ، مثل الأجهزة العضوية الظهارية المشتقة من الماوس أو المصادر البشرية5،6، والعينات التي تحاكي البيئة الدقيقة المخاطية7. مثال آخر هو "القناة الهضمية على رقاقة" المقايسة، والتي تشمل خط الخلية الظهارية القولونية البشرية (Caco2)، مصفوفة خارج الخلية والقنوات microfluidic لمحاكاة الحالة الفسيولوجية للأمعاء ثابت8. ومع ذلك ، كما متقدمة ومبتكرة كما في عينات المختبر قد تكون ، فإنها لا تحافظ على بنية الأنسجة الطبيعية أو تكوين الخلوية السذاجة.
لمعالجة ذلك، Yissachar وآخرون وضعت مؤخرا نظام ثقافة الجهاز السابق فيفو 9 (الشكل 1) الذي يحافظ على شظايا الأمعاء سليمة ex vivo،والاستفادة من مزايا كل من فيفو وفي نماذج المختبر. ويستند هذا النظام السابق فيفو زراعة الجهاز الأمعاء على جهاز ثقافة حسب الطلب الذي يدعم ثقافة متعددة من ستة أنسجة القولون، مما يسمح بفحص المدخلات التجريبية في ظل ظروف مماثلة مع السيطرة على مدخلات النظام والمخرجات. وقد أظهرت الأعمال الأخيرة أن هذا النظام هو قيمة لتحليل الاستجابات المعوية لبكتيريا الأمعاء الفردية9, عينات الميكروبات البشرية كلها10 ونواتج الأيض الميكروبية11. ويتيح هذا النظام، لأول مرة، دراسة هذه التفاعلات المبكرة بين المضيف والميكروبيوتا مع مستوى عال من السيطرة على المكونات المضيفة والميكروبية والبيئية. وعلاوة على ذلك، فإنه يسمح بمراقبة النظام والتلاعب به طوال التجربة، في الوقت الحقيقي.
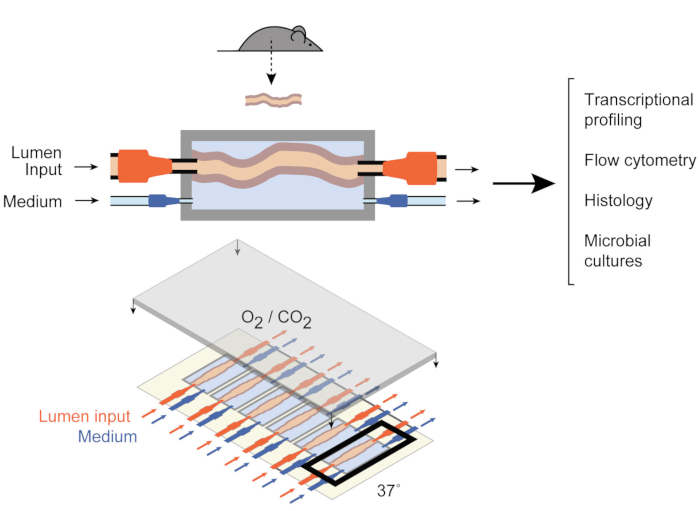
الشكل 1: تخطيطات جهاز ثقافة الأمعاء. يتم إرفاق جزء الأنسجة المعوية بالكامل بمنافذ الإخراج والمدخلات في الغرفة (العلوية) ، مع مضخات تنظم التدفق المتوسط داخل التجويف وفي الغرفة المتوسطة الخارجية. الجهاز بأكمله (أسفل) يحتوي على 6 غرف من هذا القبيل. وقد تم تعديل هذا الرقم من يسشار وآخرين 2017. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
يتبع هذا البروتوكول المبادئ التوجيهية لرعاية الحيوان التي وافقت عليها لجنة الأخلاقيات لرعاية الحيوان.
1. إعداد التجربة
- تصنيع جهاز ثقافة الجهاز الأمعاء (3 أيام)
- باستخدام طابعة ثلاثية الأبعاد، قم بطباعة القوالب البلاستيكية القابلة لإعادة الاستخدام لجهاز ثقافة الأعضاء (يحتوي الجهاز على 6 آبار، مع 24 فتحة صغيرة وكبيرة، ولغطاء غطاء الجهاز) (ملفات ثلاثية الأبعاد مرفقة).
ملاحظة: يمكن استخدام هذه القوالب البلاستيكية لتصنيع العديد من الأجهزة. - أدخل الإبر ذات النهاية الحادة (22 G و 18 G) إلى الوضع المناسب داخل قالب الجهاز ويلقي ما يقرب من 20 غرام من مزيج البوليديميثيلسيلوكسيان (PDMS) (نسبة الوزن 1:10 ، قاعدة إلى محفز) لمجموعة واحدة من الجهاز والغطاء.
- وضع قوالب في غرفة فراغ لمدة 30 دقيقة، لإزالة فقاعات الهواء من مزيج PDMS.
- احتضان القوالب في 55 درجة مئوية بين عشية وضحاها، لإكمال البلمرة PDMS.
- عندما يتم تعيين PDMS، سحب الإبر من القالب والإفراج بعناية الجهاز الثقافة وغطاء من قوالب بلاستيكية.
- إزالة بقايا PDMS من مخطط البئر باستخدام شفرة جراحية. إرفاق جهاز PDMS وغطاء الجهاز على زجاج غطاء (75 ملم × 50 مم شرائح صغيرة) باستخدام لاصق السيليكون غير سامة وترك أجزاء لتعيين بين عشية وضحاها (تطبيق الغراء على الجانب السلس من الجهاز).
- إدراج اثني عشر إبر 22 G للتشحيم واثني عشر الإبر 18 G للحسن. إصلاح جميع الإبر في مكان باستخدام السيليكون والسماح لها تعيين بين عشية وضحاها. أدخل إبرتين 18 G في غطاء الغطاء لتدفق الهواء السليم داخل وخارج جهاز ثقافة الجهاز الهضمي.
- تحقق من جميع الإبر بحثا عن تسرب باستخدام حقنة مملوءة بالماء. تأكد من عدم وجود تسرب من الآبار عن طريق ملء الآبار بالماء.
- ضع عقدتين جراحيتين على كل إبرة 22 G التي سيتم توصيلها إلى القولون. ضع الجهاز والغطاء في كيس ورقي أوتوكلاف وتعقيمه في الأوتوكلاف.
- باستخدام طابعة ثلاثية الأبعاد، قم بطباعة القوالب البلاستيكية القابلة لإعادة الاستخدام لجهاز ثقافة الأعضاء (يحتوي الجهاز على 6 آبار، مع 24 فتحة صغيرة وكبيرة، ولغطاء غطاء الجهاز) (ملفات ثلاثية الأبعاد مرفقة).
- متوسط الثقافة (0.5 ساعة)
- في غطاء محرك السيارة البيولوجية, خلط ما يلي (في أنبوب 50 مل): 37 مل من المتوسط دولبيككو المعدلة إيسكوف (IMDM), 10 مل من استبدال مصل KSR, 1 مل من الملحق B27, 0.5 مل من ملحق N2, 0.5 مل من 1 M HEPES العازلة, و 0.5 مل من الأحماض الأمينية غير الأساسية.
- تصفية وتخزين الوسط الكامل عند 4 °C.
- الأنابيب وإعداد أداة جراحية
- قطع طول المناسبة من أنابيب لومن المدخلات، والمدخلات جيدا، والتجويف الإخراج، وإخراج جيدا (12 أنابيب قصيرة وأنابيب طويلة 12). قم بتوصيل محول مناسب بكل جانب من الأنبوب.
- إعداد الأدوات الجراحية: مقص مستقيم، ملقط رقيقة 4x، و2x ملقط حاد.
- ضع الأنابيب والأدوات الجراحية في كيس ورقي أوتوكلاف وتعقيمها باستخدام الأوتوكلاف.
- إعداد المدخلات الإنارة (التحفيز المطلوب - البكتيريا والبراز والأدوية، وما إلى ذلك).
- قبل التجربة ، حدد الحمل البكتيري للثقافة البكتيرية ، عن طريق التخفيفات التسلسلية12، والثقافة في ظل الظروف الهوائية و / أو اللاهوائية.
- بعد حساب الحمل البكتيري ، تمييع الثقافات البكتيرية في الأنسجة المعقمة المتوسطة للحصول على التركيز البكتيري المطلوب. لعينات البراز، فلتر باستخدام مصفاة 100 ميكرومتر.
ملاحظة: للتحفيز غير البكتيري (المخدرات، الأيض، الخ)، تمييع المادة إلى التركيز المطلوب باستخدام وسيط ثقافة الأمعاء.
2. إعداد إعداد التجربة
- داخل حاضنة ثقافة الجهاز، قم بتشغيل وحدة المدفأة، وحددها إلى 37 درجة مئوية.
- إعداد مضخات وكذلك الحقن الإدخال والمخرجات.
- مدخلات متوسطة زراعة الأنسجة
- في غطاء محرك السيارة تدفق البيولوجية أو صفح، وملء المحاقن بئر المدخلات مع متوسطة الثقافة كاملة. يعتمد الحجم النهائي على مدة التجربة ومعدل التدفق؛ عادة 1 مل / ساعة بالإضافة إلى وسيلة إضافية للتطهير.
- قم بتوصيل الأنابيب بالمحاقن باستخدام محول قفل Luer. ضع المحاقن المملوءة في مضخات الحقن.
- تطهير المحاقن الإدخال. تأكد من أن متوسط البئر يتدفق من جميع الأنابيب إلى كوب نفايات.
- الإدخال لومينال
- ملء المحاقن المدخلات مضيئة مع العلاج التحفيز (البكتيريا والأدوية، الخ). يعتمد الحجم على مدة التجربة ومعدل التدفق (عادة 30 ميكرولتر/ساعة بالإضافة إلى وسيط إضافي للتطهير).
- قم بتوصيل الأنابيب بالمحاقن باستخدام محول قفل Luer. ضع المحاقن المملوءة في مضخات الحقن.
- تطهير المحاقن الإدخال. تأكد من تدفق التحفيز من جميع الأنابيب إلى كوب النفايات. كن حذرا من تلويث التحفيزات المختلفة.
- النواتج
- ضع المحاقن الفارغة في مضخات حقن الإخراج (وضع المضخة المحدد إلى "الانسحاب").
- إعداد الجهاز
- تعيين المنظم الذي يتحكم في خليط الغاز (95٪ O2 + 5٪ CO2) معدل تدفق لطيف، والحد الأدنى من التدفق.
- فحص الجهاز في غطاء صفح.
- مسح الإبر من الجهاز مع IMDM معقمة لغسل الإبر.
- إضافة 500 ميكرولتر من المتوسطة ثقافة عقيمة في كل بئر من الجهاز.
- التحضير لتشريح الأنسجة
- ضع الأدوات الجراحية العقيمة داخل غطاء غطاء الرأس.
- ملء حقنة 10 مل مع IMDM معقمة وربط معقمة (autoclaved) 22 G إبرة حادة نهاية لمسح القولون.
3. ثقافات الأعضاء
- الفئران التضحية وتشريح الأنسجة
- في غطاء صفح، التضحية الفئران 12-14 يوما من العمر عن طريق قطع الرأس. رش الفئران مع الإيثانول 70٪ ووضع الفئران على لوحة بلاستيكية.
- باستخدام مقص حاد والملقط، تشريح الماوس والخروج من الجهاز الهضمي من المعدة إلى فتحة النهم عن طريق قطع جميع الدهون والأنسجة الضامة. قطع القولون ووضعه على لوحة جديدة.
ملاحظة: تقليل الاتصال مع أنسجة القولون. لا تلمس الجزء الأوسط من أنسجة القولون. عقد الأنسجة بلطف وفقط على حواف الأنسجة.
- تدفق القولون وغسل
- تحت مجهر تشريح، قم بتدفق محتوى القولون برفق باستخدام IMDM معقم (إلى الجانب القريب) باستخدام حقنة 10 مل المعدة (الخطوة 2.7.2). بعد إزالة البراز من الأنسجة المعوية، ضع القولون في لوحة بئر جديدة 6 مليئة 0.5 مل من IMDM معقمة.
- توصيل النقطتين بالجهاز
- خذ الأنسجة وربطها بعناية على إبرة 22 G وجعل ربطة عنق ضيقة مع اثنين من المواضيع. عند هذه النقطة، من الضروري الحفاظ على الاتجاه الصحيح للقولون إلى تدفق التجويف (قريب = الإدخال، القاصي = الإخراج). كرر الخطوات 3.2-3.3 لجميع الأنسجة 6.
- تحقق من أن تأمينات Luer إبرة الإدخال فارغة من الوسيطة. إذا لم يكن كذلك، إفراغها. إضافة التحفيز إلى قفل إبرة Luer (لتجنب دخول فقاعات الهواء إلى التجويف). كرر هذه الخطوة لكل القولون مع التحفيز المناسب.
- تأكد من توصيل جميع الأنسجة ووضع غطاء الغطاء فوق الجهاز.
- توصيل جهاز ثقافة الجهاز بالمضخات
- ضع الجهاز في الغرفة التي يتم التحكم في درجة حرارتها مسبقا (37 درجة مئوية).
- توصيل تدفق الغاز
- قم بتوصيل محول الغاز بغطاء الغطاء باستخدام إبرة الإدخال المناسبة.
- قم بتوصيل أنابيب الإدخال والإخراج بالجهاز.
ملاحظة: قم بتوصيل جانب القولون القريبة إلى أحواض الإدخال.
- تطهير التجويف مع مدخلات التحفيز.
- تدفق التحفيز الإنارة بلطف من خلال القناة الهضمية والتحقق من تدفق متوسط في أنابيب الإخراج.
- غسل المتوسطة الخارجية.
- غسل المتوسط الخارجي 3 مرات (تعيين مضخات بمعدل 600 ميكرولتر / دقيقة لكل من المدخلات والمخرجات جيدا). كل غسل يأخذ 1 دقيقة (بدءا من إفراغ البئر).
- ابدأ التجربة.
- بدء تشغيل المضخات بالمعدلات التالية:
معدل التدفق: التجويف: مدخل - 30 ميكرولتر/ساعة، إخراج- 35 ميكرولتر/ساعة
وسيط خارجي: مدخل- 1000 ميكرولتر/ساعة، مخرج- 950 ميكرولتر/ساعة
ملاحظة: يمكن أن يختلف وقت التجربة بين 30 دقيقة إلى 24 ساعة.
- بدء تشغيل المضخات بالمعدلات التالية:
- نهاية التجربة (تصل إلى 24 ساعة لثقافات أعضاء القولون)
- افصل جميع الأنابيب عن الجهاز.
- قطع الأنسجة من الإبر والاستمرار في قراءات المطلوب.
النتائج
يحافظ نظام زراعة أعضاء الأمعاء على صلاحية الأنسجة في الجسم الحي السابق. تم تقييم صلاحية الأنسجة طوال فترة الاستزراع. تم احتضان شظايا أنسجة القولون في نظام زراعة أعضاء الأمعاء وثابتة بعد 2/12/24 ساعة الثقافة. تم التحقق من سلامة طبقة الخلية الظهارية المعوية (IEC) عن طريق تلطيخ immunofluorescence باس...
Discussion
تصف هذه المقالة بروتوكولا محسنا لثقافات أعضاء الأمعاء الحية السابقة التي طورها Yissachar وآخرون مؤخرا (نشرت9 وبيانات غير منشورة). يدعم نظام زراعة أعضاء الأمعاء ثقافة متعددة الخلايا لشظايا الأمعاء السليمة مع الحفاظ على التدفق الإنارة. ويوفر السيطرة الكاملة على البيئة داخل وخ...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر الأعضاء السابقين والحاليين في مختبر Yissachar على مساهماتهم القيمة في تحسين بروتوكول نظام زراعة أعضاء الأمعاء. نشكر يائيل لور على تحريره النقدي للمخطوطة. وقد دعم هذا العمل مؤسسة العلوم الإسرائيلية (المنحة رقم 3114831)، ومؤسسة العلوم الإسرائيلية - البرنامج المشترك للمعهد العريض (المنحة رقم 8165162)، وصندوق غاسنر للبحوث الطبية، إسرائيل.
Materials
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
References
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved