Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein intestinales Darmorgankultursystem zur Analyse von Wirt-Mikrobiota-Interaktionen
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt eine einzigartige Methode zur Analyse von Wirt-Mikrobiom-Interaktionen unter Verwendung eines neuartigen Darmorgankultursystems für Ex-vivo-Experimente vor.
Zusammenfassung
Die Struktur des Darmgewebes ermöglicht enge und mutualistische Interaktionen zwischen dem Wirt und der Darmmikrobiota. Diese Gespräche sind entscheidend für die Aufrechterhaltung der lokalen und systemischen Homöostase; Veränderungen der Zusammensetzung der Darmmikrobiota (Dysbiose) sind mit einer Vielzahl von menschlichen Krankheiten verbunden. Methoden zur Sezierung von Wirt-Mikrobiota-Interaktionen umfassen einen inhärenten Kompromiss zwischen der Erhaltung der physiologischen Gewebestruktur (bei Verwendung von In-vivo-Tiermodellen) und dem Grad der Kontrolle über die Versuchsfaktoren (wie in einfachen In-vitro-Zellkultursystemen). Um diesen Kompromiss anzugehen, haben Yissachar et al. kürzlich ein Darmorgankultursystem entwickelt. Das System bewahrt eine naive Dickdarmgewebekonstruktion und zelluläre Mechanismen und ermöglicht auch eine strenge experimentelle Kontrolle, was Experimente erleichtert, die in vivonicht ohne weiteres durchgeführt werden können. Es ist optimal für die Sezierung kurzfristiger Reaktionen verschiedener Darmkomponenten (wie epitheliale, immunologische und neuronale Elemente) auf luminale Störungen (einschließlich anaerober oder aerober Mikroben, ganzer Mikrobiotaproben von Mäusen oder Menschen, Medikamenten und Metaboliten). Hier präsentieren wir eine detaillierte Beschreibung eines optimierten Protokolls für die Organkultur mehrerer Darmfragmente mit einem maßgeschneiderten Darmkulturgerät. Wirtsreaktionen auf luminale Störungen können durch Immunfluoreszenzfärbung von Gewebeabschnitten oder Gewebefragmenten ganzer Montierung, Fluoreszenz-in-situ-Hybridisierung (FISH) oder Zeitrafferbildgebung sichtbar gemacht werden. Dieses System unterstützt eine Vielzahl von Auslesungen, einschließlich Next-Generation-Sequenzierung, Durchflusszytometrie und verschiedene zelluläre und biochemische Assays. Insgesamt unterstützt dieses dreidimensionale Organkultursystem die Kultur von großem, intaktem Darmgewebe und hat breite Anwendungen für die hochauflösende Analyse und Visualisierung von Wirt-Mikrobiota-Interaktionen in der lokalen Darmumgebung.
Einleitung
Der Darm ist ein hochkomplexes Organ, das eine breite Palette von Zelltypen (Epithelzellen, Zellen des Immunsystems, Neuronen und mehr) enthält, die in einer bestimmten Struktur organisiert sind, die es den Zellen ermöglicht, miteinander und mit dem Luminalgehalt (Mikrobiota, Nahrung usw.) zu interagieren und zu kommunizieren. 1.Derzeit umfasst die Forschungs-Toolbox, die für die Analyse von Wirt-Mikrobiota-Interaktionen zur Verfügung steht, In-vitro-Zellkulturen und In-vivo-Tiermodelle 2. In-vivo-Tiermodelle bieten eine physiologische Gewebekonstruktion3, jedoch mit schlechter experimenteller Kontrolle und begrenzter Fähigkeit, die Versuchsbedingungen zu manipulieren. In-vitro-Kultursysteme hingegen verwenden Primärzellen oder Zelllinien, die mit Mikroben4ergänzt werden können und eine strenge Kontrolle über die Experimentparameter bieten, aber die zelluläre Komplexität und die Gewebearchitektur fehlen. Moderne In-vitro-Assays ermöglichen die fortgeschrittene Verwendung gesunder und pathologischer menschlicher Gewebeproben, wie Epithelorganoide aus Maus- oder menschlichen Quellen5,6und Proben, die die Schleimhautmikroumgebung nachahmen7. Ein weiteres Beispiel ist der "Gut on a Chip"-Assay, der die menschliche Kolonepithelzelllinie (Caco2), die extrazelluläre Matrix und mikrofluidische Kanäle umfasst, um den physiologischen Zustand der Darminvariante nachzuahmen8. So fortschrittlich und innovativ In-vitro-Proben auch sein mögen, sie behalten jedoch keine normale Gewebearchitektur oder naive Zellzusammensetzung bei.
Um dies zu beheben, haben Yissachar et al. kürzlich ein ex vivo Organkultursystem9 (Abbildung 1) entwickelt, das intakte Darmfragmente ex vivoaufrechterhält und von den Vorteilen sowohl in vivo als auch in vitro Modellen profitiert. Dieses Ex-vivo-Darmorgankultursystem basiert auf einem maßgeschneiderten Kulturgerät, das eine multiplexierte Kultur von sechs Dickdarmgeweben unterstützt, so dass experimentelle Inputs unter vergleichbaren Bedingungen untersucht und gleichzeitig die Ein- und Ausgänge des Systems gesteuert werden können. Jüngste Arbeiten haben gezeigt, dass dieses System für die Analyse von Darmreaktionen auf einzelne Darmbakterien9, ganze menschliche Mikrobiotaproben10 und mikrobielle Metaboliten11wertvoll ist. Dieses System ermöglicht zum ersten Mal die Untersuchung dieser frühen Wirt-Mikrobiota-Interaktionen mit einem hohen Maß an Kontrolle über die Wirts-, Mikrobien- und Umweltkomponenten. Darüber hinaus ermöglicht es die Überwachung und Manipulation des Systems während des gesamten Experiments in Echtzeit.
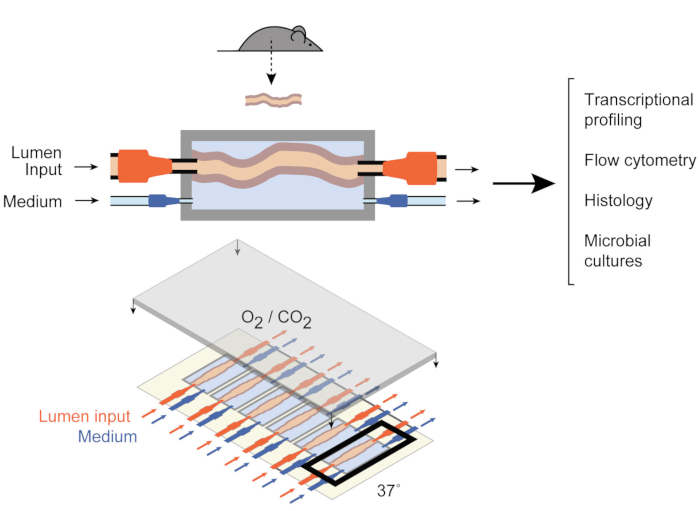
Abbildung 1: Schemata der Darmkulturvorrichtung. Ein ganzes Darmgewebefragment ist an den Ausgangs- und Eingangsanschlüssen der Kammer (oben) befestigt, wobei Pumpen den Medienfluss innerhalb des Lumens und in der externen Mediumkammer regulieren. Das gesamte Gerät (unten) enthält 6 solcher Kammern. Diese Zahl wurde von Yissachar et al. 2017 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Dieses Protokoll folgt den von der Ethikkommission für Tierschutz genehmigten Tierpflegerichtlinien.
1. Versuchsvorbereitung
- Herstellung des Darmorgankulturgeräts (3 Tage)
- Drucken Sie mit einem 3D-Drucker die wiederverwendbaren Kunststoffformen für das Organkulturgerät (das Gerät hat 6 Vertiefungen mit 24 kleinen und großen Löchern und für den Deckel des Geräts) (3D-Dateien beigefügt).
HINWEIS: Diese Kunststoffformen können für die Herstellung zahlreicher Geräte verwendet werden. - Setzen Sie die stumpfen Nadeln (22 G & 18 G) an die entsprechende Position innerhalb der Geräteform ein und gießen Sie etwa 20 g Polydimethylsiloxan (PDMS) -Mischung (1:10 Gewichtsverhältnis, Basis zu Katalysator) für einen Satz des Geräts und des Deckels.
- Legen Sie die Formen für 30 Minuten in eine Vakuumkammer, um Luftblasen aus dem PDMS-Mix zu entfernen.
- Inkubieren Sie die Formen über Nacht bei 55 °C, um die PDMS-Polymerisation abzuschließen.
- Wenn das PDMS eingestellt ist, ziehen Sie die Nadeln aus der Form heraus und lösen Sie vorsichtig das Kulturgerät und den Deckel aus den Kunststoffformen.
- Entfernen Sie PDMS-Rückstände aus dem Brunnenumriss mit einer chirurgischen Klinge. Befestigen Sie das PDMS-Gerät und die Geräteabdeckung mit ungiftigem Silikonkleber auf einem Deckglas (75 mm x 50 mm Mikroobjektträger) und lassen Sie die Teile über Nacht einwirken (tragen Sie den Kleber auf die glatte Seite des Geräts auf).
- Setzen Sie zwölf 22 G-Nadeln für das Lumen und zwölf 18-G-Nadeln für den Brunnen ein. Fixieren Sie alle Nadeln mit Silikon und lassen Sie es über Nacht einwirken. Führen Sie zwei 18 G-Nadeln in den Deckel ein, um den luftigen Luftstrom in und aus dem Darmorgankulturgerät zu gewährleisten.
- Überprüfen Sie alle Nadeln mit einer mit Wasser gefüllten Spritze auf Lecks. Überprüfen Sie, ob keine Lecks aus den Brunnen austreten, indem Sie die Brunnen mit Wasser füllen.
- Legen Sie zwei chirurgische Knoten auf jede 22 G-Nadel, die mit dem Dickdarm verbunden wird. Legen Sie das Gerät und den Deckel in eine Autoklavenpapiertüte und sterilisieren Sie sie in einem Autoklaven.
- Drucken Sie mit einem 3D-Drucker die wiederverwendbaren Kunststoffformen für das Organkulturgerät (das Gerät hat 6 Vertiefungen mit 24 kleinen und großen Löchern und für den Deckel des Geräts) (3D-Dateien beigefügt).
- Kulturmedium (0,5 h)
- Mischen Sie in einer biologischen Haube Folgendes (in 50 ml Röhrchen): 37 ml Isco's Modified Dulbecco's Medium (IMDM), 10 ml KSR Serumersatz, 1 ml B27-Ergänzung, 0,5 ml N2-Ergänzung, 0,5 ml 1 M HEPES-Puffer und 0,5 ml nicht essentielle Aminosäuren.
- Filtern und lagern Sie das gesamte Medium bei 4 °C.
- Schlauch- und OP-Werkzeugvorbereitung
- Schneiden Sie die entsprechende Länge der Röhren für das Eingangslumen, den Eingangsbrunnen, das Ausgangslumen und das Ausgangsrohr (12 kurze Röhren und 12 lange Röhren). Schließen Sie an jeder Seite des Rohrs einen geeigneten Adapter an.
- Bereiten Sie die chirurgischen Werkzeuge vor: gerade Schere, 4x dünne Zette und 2x scharfe Zette.
- Legen Sie die Röhrchen und die chirurgischen Werkzeuge in eine Autoklavenpapiertüte und sterilisieren Sie sie mit einem Autoklaven.
- Bereiten Sie den Luminal-Input vor (gewünschte Stimulation - Bakterien, Stuhl, Medikamente usw.).
- Vor dem Experiment die Bakterienlast der Bakterienkultur durch serielle Verdünnungen12und Kultur unter aeroben und/oder anaeroben Bedingungen bestimmen.
- Nach der Berechnung der Bakterienlast verdünnen Sie die Bakterienkulturen in sterilem Gewebekulturmedium, um die erforderliche Bakterienkonzentration zu erhalten. Für Kotproben mit einem 100 μm Sieb filtern.
HINWEIS: Zur nichtbakteriellen Stimulation (Medikamente, Metaboliten usw.) verdünnen Sie die Substanz mit dem Darmkulturmedium auf die erforderliche Konzentration.
2. Vorbereitung des Versuchsaufbaus
- Schalten Sie im Organkultur-Inkubator die Heizeinheit ein und stellen Sie sie auf 37 °C ein.
- Richten Sie die Pumpen sowie die Ein- und Ausgangsspritzen ein.
- Input des Gewebekulturmediums
- Füllen Sie in einer biologischen oder laminaren Strömungshaube die Eingangsspritzen mit vollständigem Kulturmedium. Das endgültige Volumen hängt von der Dauer des Experiments und der Durchflussrate ab; in der Regel 1 ml/h plus zusätzliches Medium zur Spülung.
- Verbinden Sie die Schläuche mit dem Luer-Lock-Adapter mit den Spritzen. Legen Sie die gefüllten Spritzen in die Spritzenpumpen.
- Reinigen Sie die Eingangsspritzen. Achten Sie darauf, dass das Brunnenmedium aus allen Rohren in ein Altglas fließt.
- Luminaler Eingang
- Füllen Sie die luminalen Eingangsspritzen mit stimulationsbehandlung (Bakterien, Medikamente usw.). Das Volumen hängt von der Dauer des Experiments und der Durchflussrate ab (in der Regel 30 μL/h plus zusätzliches Medium für die Spülung).
- Verbinden Sie die Schläuche mit dem Luer-Lock-Adapter mit den Spritzen. Legen Sie die gefüllten Spritzen in die Spritzenpumpen.
- Reinigen Sie die Eingangsspritzen. Stellen Sie sicher, dass die Stimulation aus allen Rohren in ein Altglas fließt. Achten Sie darauf, die verschiedenen Stimulationen nicht zu kontaminieren.
- Ausgaben
- Legen Sie die leeren Spritzen in die Ausgangsspritzenpumpen (Pumpenmodus auf "Entnahme" einstellen).
- Geräteeinrichtung
- Stellen Sie den Regler ein, der den Gasgemisch (95% O2 + 5% CO2)Durchfluss steuert, für einen sanften, minimalen Durchfluss.
- Untersuchen Sie das Gerät in einer laminaren Motorhaube.
- Spülen Sie die Nadeln des Geräts mit sterilem IMDM, um die Nadeln zu waschen.
- Fügen Sie 500 μL steriles Kulturmedium in jede Vertiefung des Geräts hinzu.
- Vorbereitung für die Gewebedissektion
- Legen Sie die sterilen chirurgischen Werkzeuge in die laminare Motorhaube.
- Füllen Sie eine 10-ml-Spritze mit sterilem IMDM und verbinden Sie eine sterile (autoklavierte) 22 G stumpfe Nadel zum Spülen des Dickdarms.
3. Orgelkulturen
- Mäuseopfer und Gewebedissektion
- In einer laminaren Kapuze 12-14 Tage alte Mäuse durch Enthauptung opfern. Besprühen Sie die Mäuse mit 70% Ethanol und legen Sie die Mäuse auf eine Plastikplatte.
- Sezieren Sie mit einer scharfen Schere und Einer zette die Maus und nehmen Sie den Verdauungstrakt vom Magen bis zum Anus heraus, indem Sie das gesamte Fett und Bindegewebe schneiden. Schneiden Sie den Doppelpunkt ab und legen Sie ihn auf eine neue Platte.
HINWEIS: Minimieren Sie den Kontakt mit dem Dickdarmgewebe. Berühren Sie nicht den mittleren Teil des Dickdarmgewebes. Halten Sie das Gewebe vorsichtig und nur an den Rändern des Gewebes.
- Dickdarm spülen und waschen
- Unter einem Seziermikroskop den Dickdarminhalt vorsichtig mit sterilem IMDM (in die proximale Seite) mit der vorbereiteten 10-ml-Spritze (Schritt 2.7.2) spülen. Nachdem Sie den Kot aus dem Darmgewebe entfernt haben, legen Sie den Dickdarm in eine neue 6-Well-Platte, die mit 0,5 ml sterilem IMDM gefüllt ist.
- Verbinden des Doppelpunkts mit dem Gerät
- Nehmen Sie das Taschentuch und verbinden Sie es vorsichtig mit der 22 G-Nadel und machen Sie eine enge Verbindung mit den beiden Fäden. An dieser Stelle ist es unerlässlich, die korrekte Ausrichtung des Dickdarms zum Lumenfluss beizubehalten (proximal = Eingang, distal = Ausgang). Wiederholen Sie die Schritte 3.2-3.3 für alle 6 Gewebe.
- Stellen Sie sicher, dass die Luer-Sperren der Eingangsnadel leer vom Medium sind. Wenn nicht, leeren Sie sie. Fügen Sie Stimulationen zur Eingangsnadel Luer Lock hinzu (um das Eindringen von Luftblasen in das Lumen zu vermeiden). Wiederholen Sie diesen Schritt für jeden Dickdarm mit der entsprechenden Stimulation.
- Überprüfen Sie, ob alle Taschentücher verbunden sind, und legen Sie den Deckel auf das Gerät.
- Anschließen der Organkulturvorrichtung an die Pumpen
- Legen Sie das Gerät in die vorgeheizte temperaturgeführte Kammer (37 °C).
- Gasstrom anschließen
- Schließen Sie den Gasadapter mit der entsprechenden Eingangsnadel an den Deckel an.
- Schließen Sie die Ein- und Ausgangsröhren an das Gerät an.
HINWEIS: Schließen Sie die proximale Dickdarmseite an die Eingangswannen an.
- Reinigen Sie das Lumen mit den Stimulationseingängen.
- Fließende Luminalstimulation sanft durch den Darm und überprüfen Sie den Mediumfluss in den Ausgangsrohren.
- Externes Medium waschen.
- Waschen Sie das externe Medium 3 Mal (stellen Sie die Pumpen auf eine Rate von 600 μL / min für Deneingang und den Ausgang ein). Jede Wäsche dauert 1 minute (beginnend mit dem Entleeren des Brunnens).
- Starten Sie das Experiment.
- Starten Sie die Pumpen mit den folgenden Geschwindigkeiten:
Durchfluss: Lumen: Eingang- 30 μL/h, Ausgang- 35 μL/h
Externes Medium: Eingang - 1000 μL/h, Ausgang - 950 μL/h
HINWEIS: Die Experimentierzeit kann zwischen 30 Minuten und 24 Stunden variieren.
- Starten Sie die Pumpen mit den folgenden Geschwindigkeiten:
- Ende des Experiments (bis zu 24 h für Dickdarmorgankulturen)
- Trennen Sie alle Röhren vom Gerät.
- Trennen Sie das Gewebe von den Nadeln und fahren Sie mit den gewünschten Auslesungen fort.
Ergebnisse
Das Darmorgankultursystem erhält die Lebensfähigkeit des Gewebes ex vivo. Die Bewertung der Gewebelebensfähigkeit erfolgte während des gesamten Kulturzeitraums. Dickdarmgewebefragmente wurden im Darmorgankultursystem inkubiert und nach 2/12/24 h-Kultur fixiert. Die Integrität der intestinalen Epithelzelle (IEC) wurde durch Immunfluoreszenzfärbung mit E-Cadherin und Cytokeratin-18-Antikörpern validiert. Ebenso wurden schleimgefüllte Speisebleszellen im Dickdarmepithel und Schleimsekretion innerhalb des L...
Diskussion
Dieser Artikel beschreibt ein optimiertes Protokoll für Ex-vivo-Darmorgankulturen, das Yissachar et al. kürzlich entwickelt haben (veröffentlichte9 und unveröffentlichte Daten). Das Darmorgankultursystem unterstützt die multiplexierte Kultur intakter Darmfragmente bei gleichzeitiger Aufrechterhaltung des Luminalflusses. Es bietet die volle Kontrolle über die intra- und extralumnale Umgebung (einschließlich Stimulationsdosis, Expositionszeit und Durchflussrate) und bewahrt die naive...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken ehemaligen und gegenwärtigen Mitgliedern des Yissachar-Labors für ihre wertvollen Beiträge zur Optimierung des Protokolls des Darmorgankultursystems. Wir danken Yael Laure für die kritische Bearbeitung des Manuskripts. Diese Arbeit wurde von der Israel Science Foundation (Förderkennzeichen 3114831), der Israel Science Foundation - Broad Institute Joint Program (Zuschuss Nr. 8165162) und dem Gassner Fund for Medical Research, Israel, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Referenzen
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten