需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分析宿主-微生物群相互作用的肠道肠道器官培养系统
摘要
本文提出了一种独特的方法,利用一种新的肠道器官培养系统进行 前体内 实验来分析宿主-微生物群相互作用。
摘要
肠道组织的结构促进宿主和肠道微生物群之间的密切和相互作用。这些交叉会谈对于维持局部和系统性平衡至关重要:肠道微生物群成分(肌瘤)的变化与广泛的人类疾病有关。解剖宿主-微生物群相互作用的方法包括生理组织结构保存( 在体内 动物模型中使用时)和控制实验因子(如简单的 体外 细胞培养系统)之间的固有权衡。为了解决这一权衡,Yissachar等人最近开发了肠道器官培养系统。该系统保留了天真的结肠组织结构和细胞机制,它也允许严格的实验控制,促进实验,不能轻易 在体内进行。它最适合解剖各种肠道成分(如上皮、免疫学和神经元元素)对发光扰动(包括厌氧或有氧微生物、小鼠或人类的整个微生物群样本、药物和代谢物)的短期反应。在这里,我们使用定制的肠道培养装置,详细描述了多个肠道片段的器官培养优化协议。通过组织部分或全安装组织片段的免疫荧光染色、荧光就地杂交(FISH)或延时成像,可以可视化主机对发光扰动的反应。该系统支持广泛的读数,包括下一代测序、流细胞学以及各种细胞和生化检测。总体而言,这种三维器官培养系统支持大型完整肠道组织培养,对局部肠道环境中宿主-微生物群相互作用的高分辨率分析和可视化具有广泛的应用。
引言
肠道是一种高度复杂的器官,包含多种细胞类型(上皮细胞、免疫系统细胞、神经元等),组织在特定结构中,允许细胞相互作用和交流,并具有发光量(微生物群、食物等)1.目前,可用于分析宿主-微生物群相互作用的研究工具箱包括体外细胞培养和体内动物模型2。在体内动物模型提供了一个生理组织结构3,但实验控制不力,操纵实验条件的能力有限。另一方面,体外培养系统使用原细胞或细胞系,这些细胞线可以补充微生物4,对实验参数提供严格控制,但缺乏细胞复杂性和组织结构。现代体外测定允许高级使用健康和病理的人体组织样本,如从小鼠或人类来源5,6,和模拟粘膜微环境7的上皮器官。另一个例子是"芯片上的古特"检测,其中包括人类结肠上皮细胞系(Caco2)、细胞外基质和微流体通道,以模拟肠道不变体8的生理状况。然而,尽管体外样本可能先进和创新,它们不能维持正常的组织结构或天真的细胞组成。
为了解决这个问题,Yissachar等人最近开发了一种前体内器官培养系统9(图1),它能保持完整的肠道片段,同时受益于体内和体外模型的优势。这个前体内肠道器官培养系统基于一个定制的文化装置,支持六个结肠组织的多路复用培养物,允许在可比条件下检查实验输入,同时控制系统的输入和输出。最近的研究表明,该系统对于分析肠道对个体肠道细菌的反应很有价值,9个,全人类微生物群样本10个,微生物代谢物11个。该系统首次允许研究这些早期宿主-微生物群相互作用,对宿主、微生物和环境成分进行高度控制。此外,它允许在整个实验中实时监控和操纵系统。
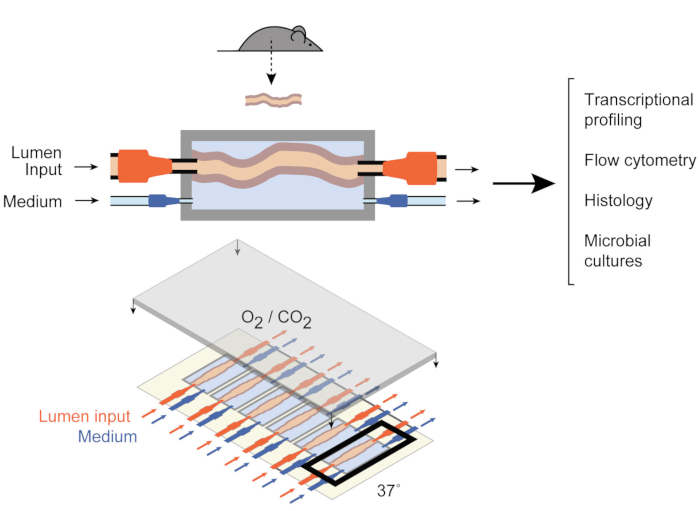
图1:肠道培养装置的原理图。 整个肠道组织片段连接到腔室的输出和输入端口(顶部),泵调节流明内和外部中室的中流。整个设备(底部)包含 6 个此类室。这个数字已经从2017年Yissachar等人修改。 请单击此处查看此图的较大版本。
研究方案
本议定书遵循动物福利伦理委员会批准的动物护理准则。
1. 实验准备
- 肠道器官培养装置的制造(3天)
- 使用 3D 打印机,打印可重复使用的塑料模具用于器官培养装置(设备有 6 口井,有 24 个大大小小的孔,以及设备盖盖)(附加 3D 文件)。
注:这些塑料模具可用于制造许多设备。 - 将钝端针头(22 G + 18 G)插入设备模具内的适当位置,为一组设备和盖子铸造约 20 克聚二甲基硅氧烷 (PDMS) 混合物(1:10 重量比,基对催化剂)。
- 将模具放在真空室中 30 分钟,以去除 PDMS 混合物中的气泡。
- 在 55 °C 的夜间孵育模具,以完成 PDMS 聚合。
- 设置 PDMS 时,从模具中取出针头,小心地从塑料模具中释放培养装置和盖子。
- 使用手术刀片从井轮廓中取出 PDMS 残留物。使用无毒硅胶粘剂将 PDMS 设备和设备盖子连接到盖玻璃(75 mm x 50 mm 微滑梯)上,让部件在一夜之间设置(将胶水涂在设备光滑的一侧)。
- 为流明插入12个22G针,为井插入12个18G针。使用硅胶固定所有针头,让它在一夜之间固定。将两根 18 G 针插入盖盖,以便适当的空气进出肠道器官培养装置。
- 使用充满水的注射器检查所有针头是否有泄漏。通过给井中加水,检查井内没有泄漏。
- 在连接到结肠的每个 22 G 针上放置两个手术结。将设备和盖子放在高压纸袋中,并在高压灭菌器中消毒。
- 使用 3D 打印机,打印可重复使用的塑料模具用于器官培养装置(设备有 6 口井,有 24 个大大小小的孔,以及设备盖盖)(附加 3D 文件)。
- 文化介质 (0.5 小时)
- 在生物罩里 混合以下(在50 mL管):37 mL的伊斯科夫的修改杜尔贝科的中型(IMDM),10 mL的KSR血清更换,1 mL的B27补充,0.5mL的N2补充,0.5 mL的1M HEPES缓冲,和0.5mL的非必需氨基酸。
- 过滤器,并将完整介质存储在 4 °C 下。
- 管子和手术工具准备
- 切割适当的管长度,用于输入流明、输入井、输出流明和输出良好(12 个短管和 12 个长管)。将适当的适配器连接到管子的每一侧。
- 准备手术工具:直剪刀、4倍薄钳和2倍锋利钳。
- 将管子和手术工具放入高压纸袋中,然后使用高压灭菌器进行消毒。
- 准备发光输入(所需的刺激 - 细菌,粪便,药物等)。
- 在实验之前,通过连续稀释12,以及有氧和/或厌氧条件下培养,确定细菌培养物的细菌负荷。
- 计算细菌负荷后,稀释无菌组织培养介质中的细菌培养物,以获得所需的细菌浓度。对于粪便样本,使用 100 μm 过滤器过滤。
注:对于非非药物刺激(药物、代谢物等),使用肠道培养基将物质稀释到所需的浓度。
2. 实验设置准备
- 在器官培养孵化器内,打开加热器单元,将其设置为 37 °C。
- 设置泵以及输入和输出注射器。
- 组织培养介质输入
- 在生物或层压流罩中,将输入井注射器填充完整的培养介质。最终体积取决于实验的持续时间和流速:通常 1 mL/h 外加额外的介质用于清除。
- 使用 Luer 锁适配器将管子连接到注射器。将充满的注射器放入注射器泵中。
- 清除输入注射器。确保井介质从所有管子流出到废玻璃中。
- 发光输入
- 用刺激治疗(细菌、药物等)填充发光输入注射器。体积取决于实验的持续时间和流速(通常为 30 μL/h 加上额外的清除介质)。
- 使用 Luer 锁适配器将管子连接到注射器。将充满的注射器放入注射器泵中。
- 清除输入注射器。确保刺激从所有管子中流出,进入废玻璃。小心不要污染不同的刺激。
- 输出
- 将空注射器放入输出注射器泵(将泵模式设置为"取款")。
- 设备设置
- 设置控制气体混合物(95% O2 = 5% CO2)流速的调节器,以获得温和、最小的流量。
- 在层压罩中检查设备。
- 用无菌 IMDM 冲洗设备的针头以洗针头。
- 在设备的每口井中加入 500 μL 的无菌培养介质。
- 组织解剖准备
- 将无菌手术工具放入层罩内。
- 用无菌IMDM填充10mL注射器,并连接无菌(自动克隆)22G钝端针头,用于冲洗结肠。
3. 器官文化
- 老鼠牺牲和组织解剖
- 在层罩中,通过斩首来牺牲12-14天大的老鼠。用70%的乙醇喷洒小鼠,并将小鼠放在塑料板上。
- 使用锋利的剪刀和钳子,解剖小鼠,通过切割所有的脂肪和结缔组织,从胃到肛门取出消化道。切开结肠,放在一个新的盘子里。
注意:尽量减少与结肠组织的接触。不要触摸结肠组织的中间部分。轻轻地将组织握住,只在组织的边缘。
- 结肠冲洗和洗涤
- 在解剖显微镜下,用准备好的 10 mL 注射器(步骤 2.7.2)用无菌 IMDM(进入近端)轻轻冲洗结肠含量。从肠道组织中取出粪便后,将结肠放入新的6井盘中,里面装满了0.5mL的无菌IMDM。
- 将结肠连接到设备
- 取出纸巾,小心地将其连接到 22 G 针上,并与两根线紧密相连。此时,必须保持结肠对流明流的正确方向(近视 = 输入、基座 = 输出)。所有 6 个组织重复步骤 3.2-3.3。
- 验证输入针 Luer 锁是否从介质中空。如果没有,就清空它们。在输入针 Luer 锁中添加刺激(以避免气泡进入流明)。用适当的刺激为每个结肠重复此步骤。
- 检查所有组织是否连接,并将盖盖盖放在设备顶部。
- 将器官培养装置连接到泵
- 将设备放入预加热温度控制室(37 °C)。
- 连接气流
- 使用适当的输入针将气体适配器连接到盖盖。
- 将输入和输出管连接到设备。
注意:将近端结肠侧连接到输入浴缸。
- 用刺激输入清除流明。
- 轻轻地流过肠道的发光刺激,并验证输出管中的中流。
- 清洗外部介质。
- 清洗外部介质 3 次(将泵设置为 600 μL/min,用于输入和输出良好)。每次清洗需要 1 分钟(从清空井开始)。
- 开始实验。
- 以以下速率启动泵:
流量: 流明: 输入 - 30 μL/h, 输出 - 35 μL/h
外部介质:输入- 1000 μL/h,输出- 950 μL/h
注:实验时间可能在 30 分钟到 24 小时之间变化。
- 以以下速率启动泵:
- 实验结束(结肠器官培养高达24小时)
- 断开设备上的所有管子。
- 断开针头的组织,继续所需的读数。
结果
肠道器官培养系统维持组织生存能力 。 在整个培养期对组织生存能力进行了评估。结肠组织片段在肠道器官培养系统中孵育,并在2/12/24h培养后固定。肠道上皮细胞(IEC)层的完整性通过使用E-卡德林和细胞角蛋白-18抗体的免疫荧光染色来验证。同样,如Ki-67染色(图2)所示,在结肠上皮和流明内粘液分泌物中检测到粘液填充的血小板细胞,并在结肠墓穴中增殖IEC。?...
讨论
本文描述了Yissachar等人最近开发的一种针对前体内肠道器官培养物的优化协议(已发布9个和未发表的数据)。肠道器官培养系统支持完整肠道片段的多重培养,同时保持发光流动。它提供完全控制内部和外发光环境(包括刺激剂量,暴露时间和流速),并保持天真的肠道组织结构及其细胞复杂性9。
协议中的关键步骤包括以下步骤。...
披露声明
作者没有什么可透露的。
致谢
我们感谢Yissachar实验室的过去和现在的成员在优化肠道器官培养系统协议方面做出的宝贵贡献。我们感谢耶尔·劳尔对手稿进行批判性编辑。这项工作得到了以色列科学基金会(第3114831号赠款)、以色列科学基金会-博德研究所联合方案(第8165162号赠款)和以色列加斯纳医学研究基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
参考文献
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。