Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un sistema de cultivo de órganos intestinales intestinales para analizar las interacciones huésped-microbiota
En este artículo
Resumen
Este artículo presenta un método único para analizar las interacciones huésped-microbioma utilizando un nuevo sistema de cultivo de órganos intestinales para experimentos ex vivo.
Resumen
La estructura del tejido intestinal facilita interacciones cercanas y mutualistas entre el huésped y la microbiota intestinal. Estas conversaciones cruzadas son cruciales para mantener la homeostasis local y sistémica; los cambios en la composición de la microbiota intestinal (disbiosis) se asocian con una amplia gama de enfermedades humanas. Los métodos para diseccionar las interacciones huésped-microbiota abarcan una compensación inherente entre la preservación de la estructura fisiológica del tejido (cuando se utilizan modelos animales in vivo) y el nivel de control sobre los factores del experimento (como en los sistemas simples de cultivo celular in vitro). Para abordar esta compensación, Yissachar et al. desarrollaron recientemente un sistema de cultivo de órganos intestinales. El sistema conserva una construcción ingenua del tejido del colon y mecanismos celulares y también permite un control experimental estricto, facilitando experimentaciones que no se pueden realizar fácilmente in vivo. Es óptimo para diseccionar respuestas a corto plazo de varios componentes intestinales (como elementos epiteliales, inmunológicos y neuronales) a perturbaciones luminales (incluidos microbios anaeróbicos o aeróbicos, muestras de microbiota completa de ratones o humanos, medicamentos y metabolitos). Aquí, presentamos una descripción detallada de un protocolo optimizado para el cultivo de órganos de múltiples fragmentos intestinales utilizando un dispositivo de cultivo intestinal hecho a medida. Las respuestas del huésped a las perturbaciones luminales se pueden visualizar mediante tinción de inmunofluorescencia de secciones de tejido o fragmentos de tejido de montaje completo, hibridación fluorescente in situ (FISH) o imágenes de lapso de tiempo. Este sistema admite una amplia gama de lecturas, incluida la secuenciación de próxima generación, la citometría de flujo y varios ensayos celulares y bioquímicos. En general, este sistema de cultivo de órganos tridimensionales admite el cultivo de tejidos intestinales grandes e intactos y tiene amplias aplicaciones para el análisis de alta resolución y la visualización de las interacciones huésped-microbiota en el entorno intestinal local.
Introducción
El intestino es un órgano altamente complejo que contiene una amplia gama de tipos de células (células epiteliales, células del sistema inmune, neuronas y más) organizadas en una estructura particular que permite a las células interactuar y comunicarse entre sí y con el contenido luminal (microbiota, alimentos, etc.) 1. Actualmente, la caja de herramientas de investigación disponible para analizar las interacciones huésped-microbiota incluye cultivos celulares in vitro y modelos animales in vivo 2. Los modelos animales in vivo proporcionan una construcción fisiológica del tejido3 pero con un control experimental deficiente y una capacidad limitada para manipular las condiciones del experimento. Los sistemas de cultivo in vitro, por otro lado, utilizan células primarias o líneas celulares que se pueden complementar con microbios4,ofreciendo un control estricto sobre los parámetros del experimento, pero carecen de la complejidad celular y la arquitectura del tejido. Los ensayos in vitro modernos permiten el uso avanzado de muestras de tejido humano sanas y patológicas, como organoides epiteliales derivados de fuentes de ratón ohumanas 5,6,y muestras que imitan el microambiente de la mucosa7. Otro ejemplo es el ensayo 'gut on a chip', que incluye la línea celular epitelial colónica humana (Caco2), la matriz extracelular y los canales microfluídicos para imitar la condición fisiológica del invariante intestinal8. Sin embargo, por muy avanzadas e innovadoras que puedan ser las muestras in vitro, no mantienen una arquitectura tisular normal ni una composición celular ingenua.
Para abordar eso, Yissachar et al. desarrollaron recientemente un sistema de cultivo de órganos ex vivo 9 (Figura 1)que mantiene intactos los fragmentos intestinales ex vivo,beneficiándose de las ventajas de los modelos in vivo e in vitro. Este sistema de cultivo de órganos intestinales ex vivo se basa en un dispositivo de cultivo personalizado que admite un cultivo multiplexado de seis tejidos del colon, lo que permite examinar las entradas experimentales en condiciones comparables mientras se controlan las entradas y salidas del sistema. Trabajos recientes han demostrado que este sistema es valioso para analizar las respuestas intestinales a bacterias intestinales individuales9,muestras enteras de microbiota humana10 y metabolitos microbianos11. Este sistema permite, por primera vez, el estudio de estas interacciones tempranas huésped-microbiota con un alto nivel de control sobre los componentes huésped, microbianos y ambientales. Además, permite monitorizar y manipular el sistema a lo largo del experimento, en tiempo real.
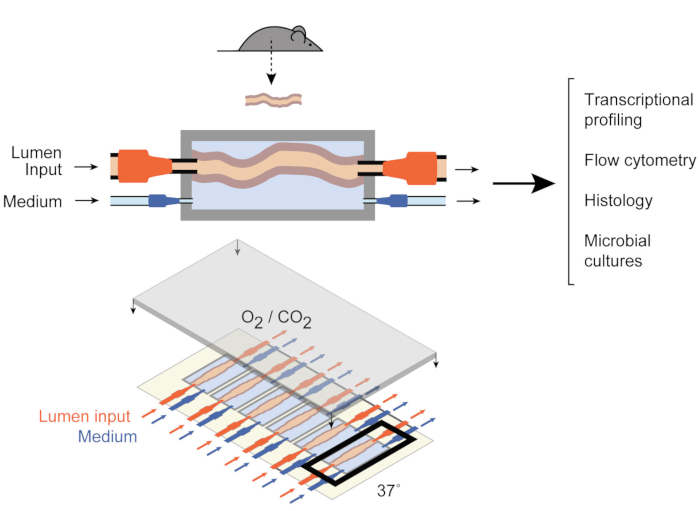
Figura 1: Esquemas del dispositivo de cultivo intestinal. Un fragmento de tejido intestinal entero está unido a los puertos de salida y entrada de la cámara (arriba), con bombas que regulan el flujo medio dentro del lumen y en la cámara media externa. Todo el dispositivo (parte inferior) contiene 6 cámaras de este tipo. Esta cifra ha sido modificada a partir de Yissachar et al. 2017. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Este protocolo sigue las pautas de cuidado animal aprobadas por el comité de ética para el bienestar animal.
1. Preparación del experimento
- Fabricación del dispositivo de cultivo de órganos intestinales (3 días)
- Usando una impresora 3D, imprima los moldes de plástico reutilizables para el dispositivo de cultivo de órganos (el dispositivo tiene 6 pozos, con 24 orificios pequeños y grandes, y para la tapa de la cubierta del dispositivo) (archivos 3D adjuntos).
NOTA: Estos moldes de plástico se pueden utilizar para la fabricación de numerosos dispositivos. - Inserte las agujas de extremo romo (22 G y 18 G) en la posición adecuada dentro del molde del dispositivo y funda aproximadamente 20 g de mezcla de polidimetilsiloxano (PDMS) (relación de peso 1:10, base a catalizador) para un juego del dispositivo y la tapa.
- Coloque los moldes en una cámara de vacío durante 30 minutos, para eliminar las burbujas de aire de la mezcla PDMS.
- Incubar los moldes a 55 °C durante la noche, para completar la polimerización de PDMS.
- Cuando se configure el PDMS, saque las agujas del molde y suelte cuidadosamente el dispositivo de cultivo y la tapa de los moldes de plástico.
- Elimine los residuos de PDMS del contorno del pozo con una cuchilla quirúrgica. Coloque el dispositivo PDMS y la cubierta del dispositivo en un vidrio de cubierta (micro portaobjetos de 75 mm x 50 mm) con adhesivo de silicio no tóxico y deje que las piezas se fijen durante la noche (aplique el pegamento en el lado liso del dispositivo).
- Inserte doce agujas de 22 G para el lumen y doce agujas de 18 G para el pozo. Fije todas las agujas en su lugar con silicona y déjelo colocar durante la noche. Inserte dos agujas de 18 G en la tapa de la cubierta para un flujo de aire adecuado dentro y fuera del dispositivo de cultivo de órganos intestinales.
- Revise todas las agujas en busca de fugas con una jeringa llena de agua. Verifique que no haya fugas de los pozos llenando los pozos con agua.
- Coloque dos nudos quirúrgicos en cada aguja de 22 G que se conectará al colon. Coloque el dispositivo y la tapa en una bolsa de papel para autoclave y esterilize en un autoclave.
- Usando una impresora 3D, imprima los moldes de plástico reutilizables para el dispositivo de cultivo de órganos (el dispositivo tiene 6 pozos, con 24 orificios pequeños y grandes, y para la tapa de la cubierta del dispositivo) (archivos 3D adjuntos).
- Medio de cultivo (0,5 h)
- En una campana biológica, mezcle lo siguiente (en tubo de 50 ml): 37 ml del medio modificado de Dulbecco (IMDM) de Iscove, 10 ml de reemplazo sérico KSR, 1 ml de suplemento de B27, 0,5 ml de suplemento de N2, 0,5 ml de tampón HEPES de 1 M y 0,5 ml de aminoácidos no esenciales.
- Filtrar y conservar el medio completo a 4 °C.
- Preparación de tubos y herramientas quirúrgicas
- Corte la longitud adecuada de los tubos para el lúmen de entrada, el pozo de entrada, el lumen de salida y el pozo de salida (12 tubos cortos y 12 tubos largos). Conecte un adaptador apropiado a cada lado del tubo.
- Prepare las herramientas quirúrgicas: tijeras rectas, 4 veces las forrórceps delgadas y 2 veces las afiladas.
- Coloque los tubos y las herramientas quirúrgicas en una bolsa de papel de autoclave y esterilízcalos con un autoclave.
- Prepare la entrada luminal (estimulación deseada: bacterias, heces, medicamentos, etc.).
- Antes del experimento, determinar la carga bacteriana del cultivo bacteriano, mediante diluciones seriadas12,y cultivo en condiciones aeróbicas y/o anaeróbicas.
- Después de calcular la carga bacteriana, diluya los cultivos bacterianos en un medio de cultivo de tejidos estériles para obtener la concentración bacteriana requerida. Para muestras fecales, filtre con un colador de 100 μm.
NOTA: Para la estimulación no bacteriana (fármacos, metabolitos, etc.), diluya la sustancia a la concentración requerida utilizando el medio de cultivo intestinal.
2. Preparación de la configuración del experimento
- Dentro de la incubadora de cultivo de órganos, encienda la unidad de calentador y configúntela a 37 ° C.
- Configure las bombas, así como las jeringas de entrada y salida.
- Entrada de medio de cultivo de tejidos
- En una campana de flujo biológico o laminar, llene las jeringas del pozo de entrada con un medio de cultivo completo. El volumen final depende de la duración del experimento y del caudal; generalmente 1 ml / h más medio adicional para purga.
- Conecte los tubos a las jeringas con el adaptador Luer-lock. Coloque las jeringas llenas en las bombas de jeringa.
- Purgue las jeringas de entrada. Asegúrese de que el medio del pozo fluya desde todos los tubos hacia un vaso de desecho.
- Entrada luminal
- Llene las jeringas de entrada luminal con tratamiento de estimulación (bacterias, medicamentos, etc.). El volumen depende de la duración del experimento y del caudal (generalmente 30 μL/h más medio adicional para purga).
- Conecte los tubos a las jeringas con el adaptador Luer-lock. Coloque las jeringas llenas en las bombas de jeringa.
- Purgar jeringas de entrada. Asegúrese de que la estimulación fluya fuera de todos los tubos hacia un vaso de desecho. Tenga cuidado de no contaminar los diferentes estímulos.
- Salidas
- Coloque las jeringas vacías en las bombas de jeringa de salida (configure el modo de bomba en "retirada").
- Configuración del dispositivo
- Establezca el regulador que controla la mezcla de gases (95% O2 + 5% CO2)para un flujo suave y mínimo.
- Examine el dispositivo en una campana laminar.
- Enjuague las agujas del dispositivo con IMDM estéril para lavar las agujas.
- Añadir 500 μL de medio de cultivo estéril en cada pozo del dispositivo.
- Preparación para la disección de tejidos
- Coloque las herramientas quirúrgicas estériles dentro de la capucha laminar.
- Llene una jeringa de 10 ml con IMDM estéril y conecte una aguja estéril (autoclave) de 22 G de extremo romo para el enrojecimiento del colon.
3. Cultivos de órganos
- Sacrificio de ratones y disección de tejidos
- En una capucha laminar, sacrifica ratones de 12-14 días de edad por decapitación. Rocíe los ratones con 70% de etanol y coloque los ratones en una placa de plástico.
- Usando tijeras y pórceps afilados, diseccione al ratón y saque el tracto digestivo desde el estómago hasta el ano cortando toda la grasa y los tejidos conectivos. Corte el colon y colóquelo en un plato nuevo.
NOTA: Minimice el contacto con el tejido del colon. No toque la parte media del tejido del colon. Sostenga el tejido suavemente y solo en los bordes del tejido.
- Enjuague y lavado de colon
- Bajo un microscopio de disección, enjuague suavemente el contenido del colon con IMDM estéril (en el lado proximal) con la jeringa de 10 ml preparada (paso 2.7.2). Después de extraer las heces del tejido intestinal, coloque el colon en una nueva placa de 6 pozos llena de 0.5 ml de IMDM estéril.
- Conexión de los dos puntos al dispositivo
- Tome el pañuelo y conéctelo cuidadosamente a la aguja de 22 G y haga un lazo apretado con los dos hilos. En este punto, es imperativo mantener la orientación correcta del colon al flujo de lúmenes (proximal = entrada, distal = salida). Repita los pasos 3.2-3.3 para los 6 tejidos.
- Verifique que los bloqueos Luer de la aguja de entrada estén vacíos del medio. Si no, vacíalos. Agregue estimulaciones a la aguja de entrada Luer lock (para evitar la entrada de burbujas de aire en el lumen). Repita este paso para cada colon con la estimulación adecuada.
- Compruebe que todos los tejidos estén conectados y coloque la tapa de la cubierta encima del dispositivo.
- Conexión del dispositivo de cultivo de órganos a las bombas
- Coloque el dispositivo en la cámara de temperatura controlada precalentada (37 °C).
- Conecte el flujo de gas
- Conecte el adaptador de gas a la tapa de la cubierta con la aguja de entrada adecuada.
- Conecte los tubos de entrada y salida al dispositivo.
NOTA: Conecte el lado del colon proximal a las tinas de entrada.
- Purgar el lumen con las entradas de estimulación.
- Fluya suavemente la estimulación luminal a través del intestino y verifique el flujo medio en los tubos de salida.
- Lavar el medio externo.
- Lave el medio externo 3 veces (configure las bombas a una velocidad de 600 μL / min tanto para el pozo de entrada como para el de salida). Cada lavado dura 1 minuto (comenzando por vaciar el pozo).
- Comience el experimento.
- Arranque las bombas a las siguientes velocidades:
Caudal: lumen: entrada- 30 μL/h, salida- 35 μL/h
Medio externo: entrada- 1000 μL/h, salida- 950 μL/h
NOTA: El tiempo del experimento puede variar entre 30 min y 24 h.
- Arranque las bombas a las siguientes velocidades:
- Fin del experimento (hasta 24 h para cultivos de órganos de colon)
- Desconecte todos los tubos del dispositivo.
- Desconecte los tejidos de las agujas y continúe con las lecturas deseadas.
Resultados
El sistema de cultivo de órganos intestinales mantiene la viabilidad del tejido ex vivo. La evaluación de la viabilidad del tejido se realizó durante todo el período de cultivo. Los fragmentos de tejido del colon se incubaron en el sistema de cultivo de órganos intestinales y se fijaron después de un cultivo de 2/12/24 h. La integridad de la capa de células epiteliales intestinales (IEC) se validó mediante tinción de inmunofluorescencia utilizando anticuerpos E-cadherina y citoqueratina-18. Asimismo, se...
Discusión
Este artículo describe un protocolo optimizado para cultivos de órganos intestinales ex vivo que Yissachar et al. han desarrollado recientemente (datos publicados9 y no publicados). El sistema de cultivo de órganos intestinales admite el cultivo multiplexado de fragmentos intestinales intactos mientras mantiene el flujo luminal. Proporciona un control total sobre el entorno intra y extra-luminal (incluyendo la dosis de estimulación, el tiempo de exposición y el caudal) y preserva la ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los miembros pasados y presentes del laboratorio de Yissachar por sus valiosas contribuciones en la optimización del protocolo del sistema de cultivo de órganos intestinales. Agradecemos a Yael Laure por la edición crítica del manuscrito. Este trabajo fue apoyado por la Fundación de Ciencia de Israel (subvención No. 3114831), la Fundación de Ciencia de Israel - Programa Conjunto del Instituto Broad (subvención No. 8165162) y el Fondo Gassner para la Investigación Médica, Israel.
Materiales
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Referencias
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados