A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מערכת תרבית איברי מעיים לניתוח אינטראקציות מארח-מיקרוביוטה
In This Article
Summary
מאמר זה מציג שיטה ייחודית לניתוח אינטראקציות בין מארח למיקרוביום באמצעות מערכת תרבית איברי מעיים חדשנית לניסויים ex vivo.
Abstract
המבנה של רקמת המעי מאפשר אינטראקציות קרובות והדדיות בין הפונדקאי למיקרוביוטה במעיים. שיחות צולבות אלה חיוניות לשמירה על הומאוסטזיס מקומי ומערכתי; שינויים בהרכב המיקרוביוטה במעיים (דיסביוזיס) מקשרים למגוון רחב של מחלות אנושיות. שיטות לנתח אינטראקציות בין מארח למיקרוביוטה מקיפות החלפה אינהרנטית בין שימור מבנה הרקמה הפיזיולוגית (בעת שימוש במודלים של בעלי חיים של vivo) לבין רמת השליטה על גורמי הניסוי (כמו במערכות פשוטות בתרבית תאי חוץ גופיה). כדי לטפל בהחלפה זו, Yissachar ואח ' פיתחו לאחרונה מערכת תרבית איברי מעיים. המערכת משמרת בניית רקמת המעי הגס הנאיבית ומנגנונים תאיים והיא גם מאפשרת שליטה ניסיונית הדוקה, ומאפשרת ניסויים שלא ניתן לבצע בקלות ב- vivo. זה אופטימלי לנתח תגובות לטווח קצר של רכיבי מעיים שונים (כגון אפיתל, אלמנטים אימונולוגיים ונוירולוגיים) כדי הפרעות זוהר (כולל חיידקים אנאירוביים או אירוביים, דגימות מיקרוביוטה שלמות מעכברים או בני אדם, תרופות ומטבוליטים). כאן, אנו מציגים תיאור מפורט של פרוטוקול ממוטב לתרבות איברים של שברי מעיים מרובים באמצעות מכשיר תרבות מעיים מותאם אישית. תגובות מארחות להפרעות זוהרות יכולות להיות חזותיות על ידי כתמים אימונופלואורסצנטיים של מקטעי רקמות או שברי רקמות של הר שלם, הכלאה פלואורסצנטית במקום (FISH), או הדמיה לשגות זמן. מערכת זו תומכת במגוון רחב של קריאות, כולל רצף הדור הבא, ציטומטריית זרימה וביקורים תאיים וביוכימיים שונים. בסך הכל, מערכת תרבית איברים תלת ממדית זו תומכת בתרבות של רקמות מעיים גדולות ושלמות ויש לה יישומים רחבים לניתוח ברזולוציה גבוהה והדמיה של אינטראקציות בין מארח למיקרוביוטה בסביבת המעיים המקומית.
Introduction
המעי הוא איבר מורכב ביותר המכיל מגוון רחב של סוגי תאים (תאי אפיתל, תאי מערכת החיסון, נוירונים ועוד) המאורגן במבנה מסוים המאפשר לתאים לקיים אינטראקציה ולתקשר זה עם זה ועם התוכן הלומינלי (מיקרוביוטה, מזון וכו '). 1.נכון לעכשיו, ארגז הכלים המחקרי הזמין לניתוח אינטראקציות מארח-מיקרוביוטה כולל תרביות תאים במבחנה ומודלים של בעלי חיים ב- vivo 2. מודלים של בעלי חיים ב-Vivo מספקים בניית רקמות פיזיולוגיות3, אך עם שליטה ניסיונית לקויה ויכולת מוגבלת לתפעל את תנאי הניסוי. במערכות תרבית במבחנה, לעומת זאת, להשתמש בתאים ראשוניים או קווי תאים שניתן להשלים עם חיידקים4, המציע שליטה הדוקה על הפרמטרים הניסוי אבל חסר את המורכבות התאית ואת ארכיטקטורת הרקמות. בדיקות במבחנה מודרניות מאפשרות שימוש מתקדם בדגימות רקמה אנושית בריאה ופתולוגית, כמו אורגנוידים אפיתל שמקורם בעכבר או ממקורות אנושיים5,6, ודגימות המחקות את המיקרו-סביבה הרירית7. דוגמה נוספת היא "המעיים על שבב" assay, הכולל את קו התא אפיתל המעי הגס האנושי (Caco2), מטריצה חוץ תאית וערוצים microfluidic לחקות את המצב הפיזיולוגי של invariantהמעיים 8. עם זאת, מתקדם וחדשני כמו דגימות במבחנה עשוי להיות, הם אינם שומרים על ארכיטקטורת רקמות נורמלית או הרכב תאי נאיבי.
כדי להתמודד עם זה, Yissachar ואח ' פיתחו לאחרונה מערכת תרבות איברים ex vivo 9 (איור 1) השומרת על שברי מעיים שלמים ex vivo,נהנה מהיתרונות של הן ב- vivo והן במודלים במבחנה. מערכת זו של תרבית איברי המעיים ex vivo מבוססת על התקן תרבות מותאם אישית התומך בתרבית מולטיפלקסים של שש רקמות המעי הגס, ומאפשר לבחון תשומות ניסיוניות בתנאים דומים תוך שליטה על התשומות והתפוקות של המערכת. עבודות אחרונות הוכיחו כי מערכת זו היא בעלת ערך לניתוח תגובות מעיים לחיידקי מעיים בודדים 9 ,דגימותמיקרוביוטה אנושיות שלמות10 ומטבוליטים מיקרוביאליים11. מערכת זו מאפשרת, לראשונה, לחקור את האינטראקציות המוקדמות בין המארח למיקרוביוטה עם רמה גבוהה של שליטה על הרכיבים המארחים, המיקרוביאליים והסביבתיים. יתר על כן, הוא מאפשר ניטור ומניפולציה של המערכת לאורך כל הניסוי, בזמן אמת.
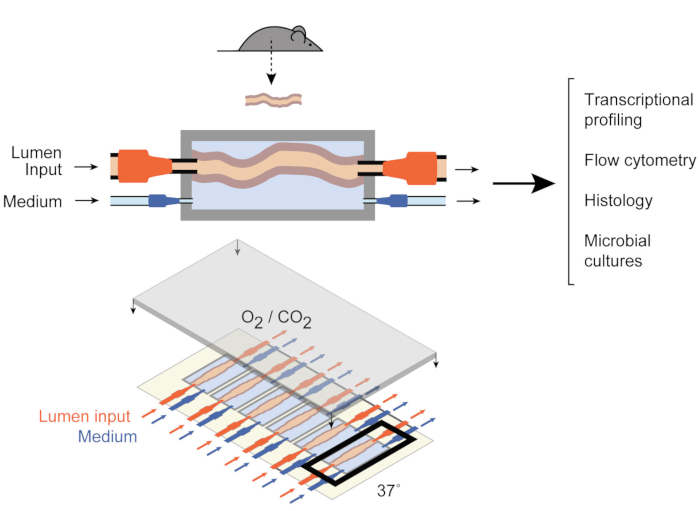
איור 1: שרטוטים של מכשיר תרבות המעיים. שבר רקמת מעיים שלם מחובר ליציאות היציאה והקלט של התא (למעלה), עם משאבות המסדירות את הזרימה הבינונית בתוך הלומן ובתא הבינוני החיצוני. המכשיר כולו (התחתון) מכיל 6 תאים כאלה. נתון זה שונה מישאר ואח' 2017. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
פרוטוקול זה תואם את הנחיות הטיפול בבעלי חיים שאושרו על ידי ועדת האתיקה לרווחת בעלי החיים.
1. הכנת ניסוי
- ייצור של מכשיר תרבות איברי המעיים (3 ימים)
- באמצעות מדפסת תלת-ממד, הדפס את תבניות הפלסטיק הניתנות לשימוש חוזר עבור התקן תרבות האיברים (להתקן יש 6 בארות, עם 24 חורים קטנים וגדולים, ולכסה כיסוי המכשיר) (קבצים תלת-ממדיים מצורפים).
הערה: תבניות פלסטיק אלה עשויות לשמש לייצור מכשירים רבים. - הכנס את המחטים קהות הקצה (22 G ו 18 G) למיקום המתאים בתוך תבנית המכשיר ויצוק כ 20 גרם של תערובת polydimethylsiloxane (PDMS) (יחס משקל 1:10, בסיס לזרז) עבור קבוצה אחת של המכשיר והמכסה.
- מניחים את התבניות בתא ואקום למשך 30 דקות, כדי להסיר בועות אוויר מתערובת PDMS.
- לדגור את התבניות ב 55 °C (55 °F) לילה, כדי להשלים PDMS פילמור.
- כאשר PDMS מוגדר, לשלוף את המחטים מן התבנית בזהירות לשחרר את מכשיר התרבות ואת המכסה מן תבניות פלסטיק.
- הסר שאריות PDMS מקווי המתאר של הבאר באמצעות להב כירורגי. חברו את התקן ה-PDMS ואת כיסוי המכשיר לכוס כיסוי (75 מ"מ x 50 מ"מ מיקרו שקופיות) באמצעות דבק סיליקון לא רעיל והותיר את החלקים מוגדרים למשך הלילה (החל את הדבק על הצד החלק של המכשיר).
- הכנס 12 מחטים 22 G עבור לומן ו12 18 G מחטים עבור הבאר. תקן את כל המחטים במקום באמצעות סיליקון ולתת לו להגדיר בן לילה. הכנס שתי מחטי 18 G לתוך מכסה הכיסוי לזרימת אוויר נכונה פנימה והחוצה של מכשיר תרבות איברי המעיים.
- בדוק את כל המחטים לדליפות באמצעות מזרק מלא מים. בדוק כי אין דליפה מן בארות על ידי מילוי בארות במים.
- הנח שני קשרים כירורגיים על כל מחט 22 G כי יהיה מחובר המעי הגס. מניחים את ההתקן והמכסה בשקית נייר אוטומטית ומעקרים בהפעלה אוטומטית.
- באמצעות מדפסת תלת-ממד, הדפס את תבניות הפלסטיק הניתנות לשימוש חוזר עבור התקן תרבות האיברים (להתקן יש 6 בארות, עם 24 חורים קטנים וגדולים, ולכסה כיסוי המכשיר) (קבצים תלת-ממדיים מצורפים).
- מדיום תרבות (0.5 שעות)
- בברדס ביולוגי, לערבב את הדברים הבאים (בצינור 50 מ"ל): 37 מ"ל של מדיום Dulbecco שונה של Iscove (IMDM), 10 מ"ל של החלפת סרום KSR, 1 מ"ל של תוסף B27, 0.5 מ"ל של תוסף N2, 0.5 מ"ל של 1 M HEPES חוצץ, ו 0.5 מ"ל של חומצות אמינו לא חיוניות.
- סנן ואחסן את המדיום המלא ב- 4 °C (7°F).
- הכנת צינורות וכלי ניתוח
- לחתוך את האורך המתאים של צינורות עבור לומן קלט, קלט היטב, לומן פלט, ופלט היטב (12 צינורות קצרים 12 צינורות ארוכים). חבר מתאם מתאים לכל צד של הצינור.
- הכן את הכלים הכירורגיים: מספריים ישרים, מלקחיים דקים פי 4 ומלקחיים חדים פי 2.
- מניחים את הצינורות ואת הכלים הכירורגיים בשקית נייר אוטומטית ומעקרים אותם באמצעות autoclave.
- הכן את הקלט הזוהר (גירוי רצוי - חיידקים, שרפרף, תרופות וכו ').
- לפני הניסוי, לקבוע את העומס החיידקי של תרבית החיידקים, על ידי דילול סדרתי12, ותרבות בתנאים אירוביים ו / או אנאירוביים.
- לאחר חישוב העומס החיידקי, לדלל את תרביות החיידקים במדיום תרבית רקמות סטריליות כדי להשיג את ריכוז החיידקים הנדרש. עבור דגימות צואה, לסנן באמצעות מסננת 100 מיקרומטר.
הערה: עבור גירוי לאבקטריאלי (תרופות, מטבוליטים, וכו '), לדלל את החומר לריכוז הנדרש באמצעות מדיום תרבית המעיים.
2. הכנת התקנה של ניסוי
- בתוך החממה של תרבות האיברים, הפעל את יחידת התנור, והגדר אותה ל -37 מעלות צלזיוס.
- הגדר את המשאבות, כמו גם את מזרקי הקלט והפלט.
- קלט בינוני של תרבית רקמות
- במכסה המנוע הביולוגי או הזרימה למינארי, מלאו את מזרקי קלט היטב במדיום תרבות מלא. הנפח הסופי תלוי במשך הניסוי ובקצב הזרימה; בדרך כלל 1 מ"ל / שעה בתוספת מדיום נוסף לטיהור.
- חבר את הצינורות למזרקים באמצעות מתאם מנעול Luer. מניחים את המזרקים המלאים במשאבות המזרק.
- טהר את מזרקי הקלט. ודא כי בינוני היטב זורם מכל הצינורות לתוך פסולת.
- קלט זוהר
- מלאו את מזרקי הקלט הזוהרים בטיפול בגירוי (חיידקים, תרופות וכו'). הנפח תלוי במשך הניסוי ובקצב הזרימה (בדרך כלל 30 μL/h בתוספת מדיום נוסף לטיהור).
- חבר את הצינורות למזרקים באמצעות מתאם מנעול Luer. מניחים את המזרקים המלאים במשאבות המזרק.
- טיהור מזרקי קלט. ודא כי הגירוי לזרום מתוך כל הצינורות לתוך פסולת. היזהר לא לזהם את הגירויים השונים.
- פלטי
- הניחו את המזרקים הריקים במשאבות מזרק היציאה (הגדר מצב משאבה ל'משיכה').
- כיוונון התקן
- הגדר את הווסת השולט בתערובת הגז (95% O2 + 5% CO 2 ) קצבזרימהלזרימה עדינה ומינימלית.
- תבדוק את המכשיר במכסה המנוע.
- לשטוף את המחטים של המכשיר עם IMDM סטרילי לשטוף את המחטים.
- הוסף 500 μL של מדיום תרבות סטרילית לתוך כל באר של המכשיר.
- הכנה לפירוק רקמות
- שים את הכלים הכירורגיים הסטריליים בתוך מכסה המנוע למינאר.
- מלא מזרק 10 מ"ל עם IMDM סטרילי ולחבר סטרילי (autoclaved) 22 G מחט קהה סוף לשטיפה של המעי הגס.
3. תרביות איברים
- הקרבת עכברים ותחוש רקמות
- בשכונת למינאר, להקריב עכברים בני 12-14 יום על ידי עריפת ראש. מרססים את העכברים ב-70% אתנול ומניחים את העכברים על צלחת פלסטיק.
- באמצעות מספריים חדים ומלקחיים, לנתח את העכבר ולהוציא את מערכת העיכול מהבטן לפי הטבעת על ידי חיתוך כל רקמות השומן והחיבור. חותכים את המעי הגס ומניחים אותו על צלחת חדשה.
הערה: מזער את המגע עם רקמת המעי הגס. אין לגעת בחלק האמצעי של רקמת המעי הגס. החזק את הרקמה בעדינות ורק בשולי הרקמה.
- שטיפה ושטיפה של המעי הגס
- תחת מיקרוסקופ ניתוח, יש לשטוף בעדינות את תוכן המעי הגס עם IMDM סטרילי (לצד הפרוקסימלי) עם מזרק מוכן של 10 מ"ל (שלב 2.7.2). לאחר הסרת הצואה מרקמת המעי, מניחים את המעי הגס בצלחת חדשה 6 היטב מלא 0.5 מ"ל של IMDM סטרילי.
- חיבור נקודתיים להתקן
- קח את הרקמה בזהירות לחבר אותו על מחט 22 G ולעשות עניבה הדוקה עם שני החוטים. בשלב זה, זה הכרחי כדי לשמור על הכיוון הנכון של המעי הגס לזרימת לומן (פרוקסימלי = קלט, דיסטלי = פלט). חזור על שלבים 3.2-3.3 עבור כל 6 הרקמות.
- ודא שמנעולי לויר מחט הקלט ריקים מהמדיום. אם לא, תרוקן אותם. הוסף גירויים לסלסל Luer מחט הקלט (כדי למנוע כניסה של בועות אוויר לתוך לומן). חזור על שלב זה עבור כל מעי גס עם הגירוי המתאים.
- בדוק כי כל הרקמות מחוברות ומניחים את מכסה הכיסוי על גבי המכשיר.
- חיבור התקן תרבות האיברים למשאבות
- מניחים את המכשיר בתא שמבוקר טמפרטורה מחומם מראש (37 °C (37 °F).
- חיבור זרימת גז
- חבר את מתאם הגז למכסה הכיסוי באמצעות מחט הקלט המתאימה.
- חבר את צינורות הקלט והפלט להתקן.
הערה: חבר את הצד הפרוקסימלי של המעי הגס לאמבטיות הקלט.
- לטהר את הלומן עם תשומות הגירוי.
- להזרים בעדינות גירוי זוהר דרך המעיים ולאמת זרימה בינונית בצינורות היציאה.
- לשטוף מדיום חיצוני.
- לשטוף את המדיום החיצוני 3 פעמים (להגדיר את המשאבות בקצב של 600 μL / min עבור קלט פלט היטב). כל שטיפה אורכת דקה אחת (החל מרוקן הבאר).
- תתחילו בניסוי.
- התחל את המשאבות בקצבים הבאים:
קצב זרימה: לומן: קלט- 30 μL / h, פלט- 35 μL / h
מדיום חיצוני: קלט- 1000 μL/h, פלט- 950 μL/h
הערה: זמן הניסוי יכול להשתנות בין 30 דקות ל-24 שעות.
- התחל את המשאבות בקצבים הבאים:
- סוף הניסוי (עד 24 שעות לתרבויות איברי המעי הגס)
- נתק את כל הצינורות מהמכשיר.
- נתק את הרקמות מן המחטים ולהמשיך לקריאות הרצויות.
תוצאות
מערכת תרבית איברי המעיים שומרת על כדאיות רקמות ex vivo. הערכת הכדאיות של הרקמה נעשתה לאורך כל תקופת התרבות. שברי רקמת המעי הגס דוגרו במערכת תרבית איברי המעיים ותוקנו בעקבות תרבית 2/12/24 h. שלמות שכבת תאי האפיתל במעיים (IEC) אומתה על ידי כתמי אימונופלואורסצנטיות באמצעות נוגדנים E-cadherin ו- ציטוק?...
Discussion
מאמר זה מתאר פרוטוקול ממוטב לתרבויות איברי המעיים ex vivo כי Yissachar ואח ' פיתחו לאחרונה(פורסם 9 נתונים שלא פורסמו). מערכת תרבית איברי המעיים תומכת בתרבית מולטיפלקסים של שברי מעיים שלמים תוך שמירה על זרימה זוהרת. הוא מספק שליטה מלאה על הסביבה הפנים-אור-זוהרת (כולל מינון גירוי, זמ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לחברי מעבדת יששכר בעבר ובהווה על תרומתם החשובה באופטימיזציה של פרוטוקול מערכת תרבות איברי הבטן. אנו מודים ליעל לור על העריכה הביקורתית של כתב היד. עבודה זו נתמכה על ידי הקרן הישראלית למדע (מענק מס' 3114831), הקרן הישראלית למדע - תכנית משותפת של מכון רחב (מענק מס' 8165162) וקרן גאסנר למחקר רפואי.
Materials
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
References
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved