Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Система культуры органов кишечника для анализа взаимодействия хозяина и микробиоты
В этой статье
Резюме
В этой статье представлен уникальный метод анализа взаимодействий хозяина и микробиома с использованием новой системы культуры органов кишечника для экспериментов ex vivo.
Аннотация
Структура ткани кишечника способствует тесному и взаимному взаимодействию между хозяином и кишечной микробиотой. Эти перекрестные переговоры имеют решающее значение для поддержания местного и системного гомеостаза; изменения в составе микробиоты кишечника (дисбактериоз) связаны с широким спектром заболеваний человека. Методы препарирования взаимодействий хозяина и микробиоты включают в себя неотъемлемый компромисс между сохранением физиологической структуры ткани (при использовании животных моделей in vivo) и уровнем контроля над факторами эксперимента (как в простых системах культивирования клеток in vitro). Чтобы устранить этот компромисс, Yissachar et al. недавно разработали систему культуры кишечных органов. Система сохраняет наивную конструкцию ткани толстой кишки и клеточные механизмы, а также позволяет осуществлять жесткий экспериментальный контроль, облегчая эксперименты, которые не могут быть легко выполнены in vivo. Он оптимален для рассечения кратковременные реакции различных компонентов кишечника (таких как эпителиальные, иммунологические и нейронные элементы) на просветные возмущения (включая анаэробные или аэробные микробы, образцы целой микробиоты от мышей или людей, лекарства и метаболиты). Здесь мы представляем подробное описание оптимизированного протокола для культуры органов из нескольких фрагментов кишечника с использованием специально изготовленного устройства для культивации кишечника. Реакции хозяина на люминальные возмущения могут быть визуализированы иммунофлуоресцентным окрашиванием участков ткани или фрагментов ткани целиком, флуоресцентной гибридизацией in-situ (FISH) или покадровой визуализацией. Эта система поддерживает широкий спектр считывания, включая секвенирование следующего поколения, проточную цитометрию и различные клеточные и биохимические анализы. В целом, эта трехмерная система культуры органов поддерживает культуру больших, интактных тканей кишечника и имеет широкое применение для анализа высокого разрешения и визуализации взаимодействий хозяина и микробиоты в местной кишечной среде.
Введение
Кишечник является очень сложным органом, содержащим широкий спектр типов клеток (эпителиальные клетки, клетки иммунной системы, нейроны и т. Д.), Организованный в определенную структуру, которая позволяет клеткам взаимодействовать и общаться друг с другом и с содержанием просвета (микробиота, пища и т. Д.). 1. В настоящее время исследовательский инструментарий, доступный для анализа взаимодействий хозяина и микробиоты, включает в себя культуры клеток in vitro и модели животных in vivo 2. Животные модели in vivo обеспечивают физиологическую тканевую конструкцию3, но с плохим экспериментальным контролем и ограниченной способностью манипулировать условиями эксперимента. Системы культивирования in vitro, с другой стороны, используют первичные клетки или клеточные линии, которые могут быть дополнены микробами4,предлагая жесткий контроль над параметрами эксперимента, но не имея клеточной сложности и архитектуры тканей. Современные анализы in vitro позволяют использовать расширенные образцы здоровых и патологических тканей человека, такие как эпителиальные органоиды, полученные из мышиных или человеческих источников5,6,и образцы, которые имитируют микросреду слизистой оболочки7. Другим примером является анализ «кишечник на чипе», который включает в себя эпителиальную клеточную линию толстой кишки человека (Caco2), внеклеточный матрикс и микрофлюидные каналы для имитации физиологического состояния инварианта кишечника8. Однако, какими бы продвинутыми и инновационными ни были образцы in vitro, они не поддерживают нормальную тканевую архитектуру или наивный клеточный состав.
Чтобы решить эту проблему, Yissachar et al. недавно разработали систему культуры органов ex vivo 9 (рисунок 1),которая поддерживает неповрежденные фрагменты кишечника ex vivo,извлекая выгоду из преимуществ моделей как in vivo, так и in vitro. Эта система культивирования органов кишечника ex vivo основана на специально изготовленном устройстве для культивирования, которое поддерживает мультиплексированную культуру шести тканей толстой кишки, позволяя исследовать экспериментальные входы в сопоставимых условиях, контролируя входы и выходы системы. Недавние работы продемонстрировали, что эта система ценна для анализа кишечных реакций на отдельные кишечные бактерии9,образцы всей микробиоты человека10 и микробные метаболиты11. Эта система позволяет впервые изучать эти ранние взаимодействия хозяин-микробиота с высоким уровнем контроля над компонентами хозяина, микробами и окружающей средой. Кроме того, он позволяет контролировать и манипулировать системой на протяжении всего эксперимента в режиме реального времени.
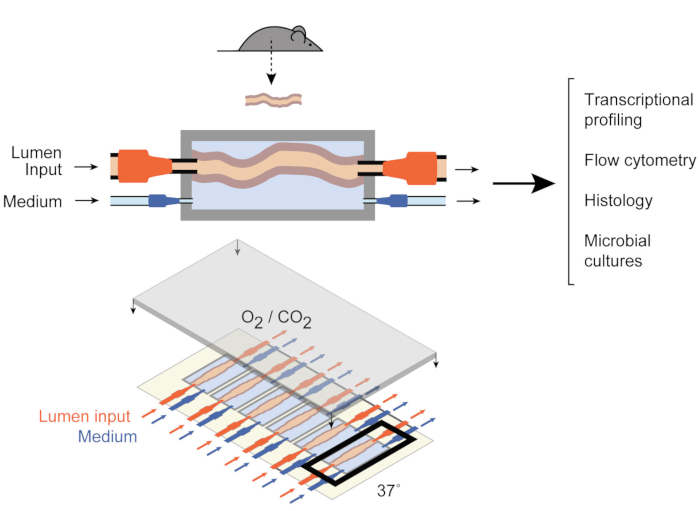
Рисунок 1:Схемы устройства кишечной культуры. Целый фрагмент кишечной ткани прикрепляется к выходному и входному портам камеры (верхней), с насосами, регулирующими поток среды внутри просвета и во внешней средней камере. Все устройство (днище) содержит 6 таких камер. Эта цифра была изменена с Yissachar et al. 2017. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Этот протокол следует руководящим принципам ухода за животными, утвержденным комитетом по этике для защиты животных.
1. Подготовка эксперимента
- Изготовление устройства для культивирования органов кишечника (3 дня)
- С помощью 3D-принтера распечатайте многоразовые пластиковые формы для устройства для культуры органов (устройство имеет 6 лунок, с 24 маленькими и большими отверстиями, а также для крышки устройства) (3D-файлы прилагаются).
ПРИМЕЧАНИЕ: Эти пластиковые формы могут быть использованы для изготовления многочисленных устройств. - Вставьте тупые иглы (22 г и 18 г) в соответствующее положение в пресс-форме устройства и отлить примерно 20 г смеси полидиметилсилоксана (PDMS) (весовое отношение 1:10, основание к катализатору) для одного комплекта устройства и крышки.
- Поместите формы в вакуумную камеру на 30 минут, чтобы удалить пузырьки воздуха из смеси PDMS.
- Инкубируйте формы при 55 °C в течение ночи, чтобы завершить полимеризацию PDMS.
- Когда PDMS установлен, вытащите иглы из формы и осторожно отпустите устройство для культивовки и крышку из пластиковых форм.
- Удалите остатки PDMS из контура скважины с помощью хирургического лезвия. Прикрепите устройство PDMS и крышку устройства к покровному стеклу (микрополки 75 мм x 50 мм) с помощью нетоксичного силиконового клея и оставьте детали для установки на ночь (нанесите клей на гладкую сторону устройства).
- Вставьте двенадцать игл 22 г для просвета и двенадцать игл по 18 г для колодца. Закрепите все иглы на месте с помощью силикона и дайте ему сложиться на ночь. Вставьте две иглы по 18 г в крышку крышки для правильного притока воздуха в устройство для культивирование органов кишечника и выхода из него.
- Проверьте все иглы на наличие утечек с помощью заполненного водой шприца. Проверьте, чтобы из колодцев не было протечек, заполнив колодцы водой.
- Поместите два хирургических узла на каждую иглу 22 G, которая будет соединена с толстой кишкой. Поместите устройство и крышку в автоклавный бумажный пакет и стерилизуйте в автоклаве.
- С помощью 3D-принтера распечатайте многоразовые пластиковые формы для устройства для культуры органов (устройство имеет 6 лунок, с 24 маленькими и большими отверстиями, а также для крышки устройства) (3D-файлы прилагаются).
- Культуральная среда (0,5 ч)
- В биологической вытяжке смешайте следующее (в пробирке 50 мл): 37 мл модифицированной среды Dulbecco (IMDM) Iscove, 10 мл замены сыворотки KSR, 1 мл добавки B27, 0,5 мл добавки N2, 0,5 мл буфера 1 M HEPES и 0,5 мл заменимых аминокислот.
- Отфильтруйте и храните полную среду при 4 °C.
- Подготовка трубок и хирургических инструментов
- Отрежьте трубки соответствующей длины для входного просвета, входного колодца, выходного светового и выходного колодца (12 коротких трубок и 12 длинных трубок). Подключите соответствующий адаптер к каждой стороне трубки.
- Подготовьте хирургические инструменты: прямые ножницы, 4 тонких щипца и 2 острых щипца.
- Поместите трубки и хирургические инструменты в автоклавный бумажный пакет и стерилизуйте их с помощью автоклава.
- Подготовьте светосветный вход (желаемая стимуляция – бактерии, стул, лекарственные препараты и т.д.).
- Перед экспериментом определяют бактериальную нагрузку бактериальной культуры путем последовательных разведений12и культуры в аэробных и/или анаэробных условиях.
- После расчета бактериальной нагрузки разводят бактериальные культуры в стерильной тканевой культуральной среде для получения необходимой бактериальной концентрации. Для образцов фекалий фильтруйте с помощью ситечкового фильтра 100 мкм.
ПРИМЕЧАНИЕ: Для небактериальной стимуляции (лекарственные средства, метаболиты и др.) разводят вещество до необходимой концентрации с помощью кишечных культуральных сред.
2. Подготовка к установке эксперимента
- Внутри инкубатора культуры органов включите нагреватель и установите его на 37 °C.
- Настройте насосы, а также входные и выходные шприцы.
- Вход среды культуры тканей
- В биологическом или ламинарной вытяжке заполните входные шприцы колодца полноценной питательной средой. Конечный объем зависит от продолжительности эксперимента и скорости потока; обычно 1 мл/ч плюс дополнительная среда для продувки.
- Подключите трубки к шприцам с помощью адаптера Luer-lock. Поместите заполненные шприцы в шприцевые насосы.
- Очистите входные шприцы. Убедитесь, что среда скважины вытекает из всех труб в отработанное стекло.
- Люминальный вход
- Наполните световые входные шприцы стимулирующей обработкой (бактериями, лекарственными препаратами и т.д.). Объем зависит от продолжительности эксперимента и расхода (обычно 30 мкл/ч плюс дополнительная среда для продувки).
- Подключите трубки к шприцам с помощью адаптера Luer-lock. Поместите заполненные шприцы в шприцевые насосы.
- Продувка входных шприцев. Убедитесь, что стимуляция вытекает из всех трубок в отработанное стекло. Будьте осторожны, чтобы не загрязнить различные стимуляции.
- Выходы
- Поместите пустые шприцы в выходные шприцевые насосы (установите режим насоса на «вывод»).
- Настройка устройства
- Установите регулятор, который контролирует расход газовой смеси (95% O2 + 5% CO2)для щадящего, минимального расхода.
- Осмотрите устройство в ламинарной вытяжке.
- Промывайте иглы устройства стерильным IMDM для промывки игл.
- Добавляют 500 мкл стерильной питательной среды в каждую скважину устройства.
- Подготовка к рассечению тканей
- Поместите стерильные хирургические инструменты внутрь ламинарного капюшона.
- Заполните шприц 10 мл стерильным IMDM и соедините стерильную (автоклавную) иглу тупого конца 22 г для промывки толстой кишки.
3. Органные культуры
- Жертвоприношение мышей и рассечение тканей
- В ламинарной капюшоне приносят в жертву 12-14 дневных мышей путем обезглавливания. Опрыскивайте мышей 70% этанолом и помещайте мышей на пластиковую тарелку.
- С помощью острых ножниц и щипцов рассекают мышь и вынимают пищеварительный тракт из желудка в анус, разрезая все жировые и соединительные ткани. Вырежьте толстую кишку и поместите ее на новую пластину.
ПРИМЕЧАНИЕ: Минимизируйте контакт с тканью толстой кишки. Не прикасайтесь к средней части ткани толстой кишки. Держите ткань осторожно и только по краям ткани.
- Промывка и промывка толстой кишки
- Под рассеченным микроскопом осторожно промыть содержимое толстой кишки стерильным IMDM (в проксимальную сторону) приготовленным шприцем 10 мл (этап 2.7.2). После удаления кала из кишечной ткани поместите толстую кишку в новую 6-хорошо заполненную 0,5 мл стерильного IMDM.
- Подключение двоеточия к устройству
- Возьмите ткань и осторожно соедините ее на игле 22 г и сделайте плотную завязку двумя нитями. В этот момент необходимо поддерживать правильную ориентацию толстой кишки к потоку просвета (проксимальный = вход, дистальный = выход). Повторите шаги 3.2-3.3 для всех 6 тканей.
- Убедитесь, что входные иглы Luer замки пусты от среды. Если нет, опустошите их. Добавьте стимуляции к входной игле замка Луера (чтобы избежать попадания пузырьков воздуха в просвет). Повторите этот шаг для каждой толстой кишки с соответствующей стимуляцией.
- Убедитесь, что все ткани соединены и поместите крышку крышки поверх устройства.
- Подключение устройства для культивовки органов к насосам
- Поместите устройство в предварительно нагретую камеру с регулируемой температурой (37 °C).
- Подключение потока газа
- Подключите газовый адаптер к крышке крышки с помощью соответствующей входной иглы.
- Подключите входную и выходную трубки к устройству.
ПРИМЕЧАНИЕ: Подключите проксимальную сторону толстой кишки к входным ваннам.
- Очистите просвет с помощью стимулирующих входов.
- Осторожно протекайте просветную стимуляцию через кишечник и проверяйте поток среды в выходных трубках.
- Мойте наружную среду.
- Промыть внешнюю среду 3 раза (установить насосы со скоростью 600 мкл/мин как для входной, так и для выходной скважины). Каждая стирка занимает 1 мин (начиная с опорожнения колодца).
- Начните эксперимент.
- Запускайте насосы со следующими скоростями:
Расход: люмен: входной - 30 мкл / ч, выходной - 35 мкл / ч
Внешняя среда: входная - 1000 мкл/ч, выходная - 950 мкл/ч
ПРИМЕЧАНИЕ: Время эксперимента может варьироваться от 30 минут до 24 часов.
- Запускайте насосы со следующими скоростями:
- Окончание эксперимента (до 24 ч для культур органов толстой кишки)
- Отсоедините все трубки от устройства.
- Отсоедините ткани от игл и продолжайте к нужным показаниям.
Результаты
Система культивирование органов кишечника поддерживает жизнеспособность тканей ex vivo. Оценка жизнеспособности тканей проводилась на протяжении всего периода культивации. Фрагменты ткани толстой кишки инкубировали в системе культуры органов кишечника и фиксировали после культу...
Обсуждение
В этой статье описывается оптимизированный протокол для культур органов кишечника ex vivo, который недавно разработали Yissachar et al. (опубликованные9 и неопубликованные данные). Система культуры органов кишечника поддерживает мультиплексированную культуру неповрежденных ...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим бывших и нынешних членов лаборатории Иссахара за их ценный вклад в оптимизацию протокола системы культуры органов кишечника. Мы благодарим Яэль Лор за критическое редактирование рукописи. Эта работа была поддержана Израильским научным фондом (грант No 3114831), Совместным фондом израильского научного фонда - Института Броуда (грант No 8165162) и Фондом медицинских исследований Гасснера, Израиль.
Материалы
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Ссылки
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены