JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
호스트-미생물군유병 상호 분석을 위한 장 내 장관 장기 배양 시스템
요약
이 문서는 전 생체 내 실험을 위한 새로운 창자 기관 배양 시스템을 사용하여 호스트-미생물군유전체 상호 작용을 분석하기 위한 독특한 방법을 제시합니다.
초록
창 자 조직의 구조 호스트와 창 자 microbiota 사이 밀접 하 고 상호 상호 상호 작용을 촉진. 이러한 교차 회담은 지역적이고 체계적인 항상성을 유지하는 데 매우 중요합니다. 창자 microbiota 조성에 변경 (dysbiosis) 인간의 질병의 넓은 배열과 연결. 숙주-미생물군유동성 상호작용을 해부하는 방법은 생리조직 구조(생체내 동물 모델에서 사용할 때)와 실험 인자에 대한 제어 수준(간단한 체외 세포 배양 시스템에서와 같이)의 보존 중 내재된 절충을 포함한다. 이 절충을 해결하기 위해 Yissachar 외는 최근에 장 기관 배양 시스템을 개발했습니다. 이 시스템은 순진한 결장 조직 구조 및 세포 메커니즘을 보존하고 또한 엄격한 실험 제어를 허용, 쉽게 생체 내에서수행 할 수없는 실험을 촉진. 발광 성 변류 (혐기성 또는 호기성 미생물, 쥐 또는 인간, 약물 및 대사 산물의 전체 미생물 샘플 포함)에 다양한 창자 구성 요소 (예 : 상피, 면역 학적 및 뉴런 요소)의 단기 반응을 해부하는 것이 최적입니다. 여기에서는 맞춤형 창자 배양 장치를 사용하여 여러 장 조각의 장기 문화에 최적화된 프로토콜에 대한 자세한 설명을 제공합니다. 발광 성 변투에 대한 숙주 반응은 조직 섹션 또는 전산 조직 단편의 면역 형광 염색, 처투 내 혼성화 (FISH) 또는 시간 경과 이미징에 의해 시각화 될 수 있습니다. 이 시스템은 차세대 시퀀싱, 유동 세포측정, 다양한 세포 및 생화학 적 분석을 포함한 광범위한 판독을 지원합니다. 전반적으로, 이 3차원 기관 배양 시스템은 크고 온전한 장 조직의 배양을 지원하고 현지 창자 환경에서 숙주 미생물 작용의 고해상도 분석 및 시각화를 위한 광범위한 응용을 가지고 있습니다.
서문
소장은 세포가 상호 작용하고 발광 함량 (microbiota, 음식 등)과 상호 작용하고 통신 할 수있는 특정 구조로 조직 된 광범위한 세포 유형 (상피 세포, 면역 계통 세포, 뉴런 등을 포함하는 매우 복잡한 기관)입니다. 1. 현재, 숙주 -microbiota 상호 작용을 분석할 수 있는 연구 툴박스에는 체외 세포 배양 및 생체 내 동물 모델2를포함한다. 생체 내 동물 모델은 생리조직 구조3을 제공하지만 실험 조절이 불량하고 실험 조건을 조작할 수 있는 능력이 제한적이다. 시험관 내 배양 시스템은, 다른 한편으로는, 미생물4로 보충될 수 있는 1차 세포 또는 세포주를 사용하여실험파라미터를 단단히 통제하지만 세포 복잡성 및 조직 아키텍처가 결여된다. 현대 체외 학적 제는 마우스 또는 인간소스에서파생 된 상피 오르가노이드와 같은 건강하고 병리학적인 인간 조직 샘플의 고급 사용을허용5,6,점막 미세 환경을 모방 샘플7. 또 다른 예는 인간 대장 상피 세포주 (Caco2), 세포외 매트릭스 및 미세 유체 채널을 포함하는 '칩에 내장'분석8. 그러나, 시험관 내 샘플처럼 고급적이고 혁신적인 바와 같이, 그들은 정상적인 조직 아키텍처 또는 순진한 세포 조성을 유지하지 않습니다.
이를 해결하기 위해 Yissachar 외는 최근 생체 내 및 체외 모델 모두의 장점을 활용하여 온전한 장 부각 을유지하는 전 생체 오르간 배양 시스템9(그림 1)을 개발했다. 이 전 생체 내 창자 장기 배양 시스템은 6개의 결장 조직의 멀티플렉스 배양을 지원하는 맞춤형 배양 장치를 기반으로 하며, 시스템의 입력 및 출력을 제어하면서 유사한 조건에서 실험 입력을 검토할 수 있도록 합니다. 최근 연구는 이 시스템이 개별 장내 세균9,전체 인간 미생물대사산물 10 및 미생물 대사산물(11)에 대한장 내 반응을 분석하는 데 유용하다는 것을 입증하였다. 이 시스템은 처음으로 숙주, 미생물 및 환경 구성 요소에 대한 높은 수준의 제어와 이러한 초기 숙주 - 미생물 상호 작용의 연구를 할 수 있습니다. 또한 실험 전반에 걸쳐 실시간으로 시스템을 모니터링하고 조작할 수 있습니다.
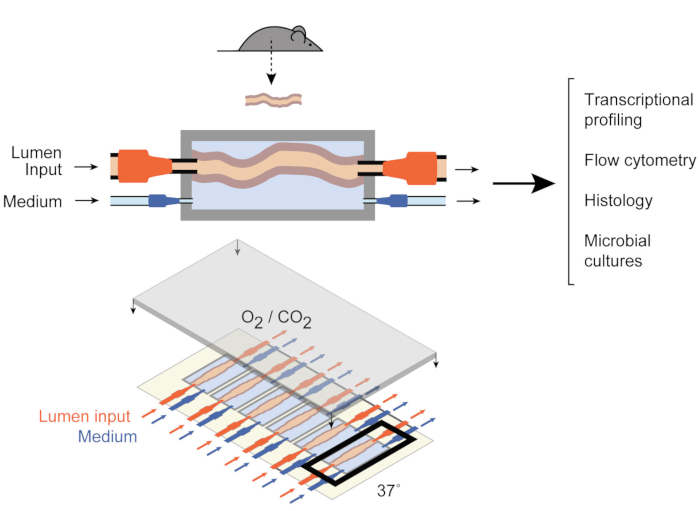
그림 1: 창자 배양 장치의 회로도. 전체 장 조직 단편은 챔버(top)의 출력 및 입력 포트에 부착되며, 펌프는 루멘 내부와 외부 중간 챔버에서 중간 흐름을 조절한다. 전체 장치(아래쪽)에는 6개의 챔버가 포함되어 있습니다. 이 수치는 Yissachar 외 2017에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
이 프로토콜은 동물 복지 윤리위원회가 승인한 동물 관리 지침을 따릅니다.
1. 실험 준비
- 창자 장기 배양 장치의 제조 (3 일)
- 3D 프린터를 사용하여 장기 배양 장치에 재사용 가능한 플라스틱 금형을 인쇄합니다(장치에는 24개의 크고 큰 구멍이 있는 6개의 우물이 있고, 장치 커버 뚜껑의 경우)(3D 파일이 부착됨).
참고: 이러한 플라스틱 금형은 수많은 장치의 제조에 사용될 수 있습니다. - 무딘 말단 바늘(22 G & 18G)을 장치 몰드 내의 적절한 위치에 삽입하고 1세트의 장치 및 뚜껑에 대해 폴리디메틸실록산(PDMS) 믹스(1:10 중량 비, 베이스 대 촉매)를 약 20g캐스팅한다.
- 금형을 진공 챔버에 30분 동안 놓고 PDMS 믹스에서 기포를 제거합니다.
- PDMS 중합을 완료하기 위해 하룻밤 동안 55 °C에서 금형을 배양합니다.
- PDMS가 설정되면 금형에서 바늘을 꺼내 서 조심스럽게 플라스틱 금형에서 배양 장치 와 뚜껑을 해제합니다.
- 수술 용 블레이드를 사용하여 우물 윤곽선에서 PDMS 잔류물을 제거합니다. 비독성 실리콘 접착제를 사용하여 PDMS 장치 와 장치 커버를 커버 유리 (75mm x 50mm 마이크로 슬라이드)에 부착하고 부품을 하룻밤 도록 둡니다 (장치의 매끄러운 면에 접착제를 적용).
- 루멘에 12 G 바늘을 삽입하고 12 18 G 바늘을 잘 넣습니다. 실리콘을 사용하여 모든 바늘을 제자리에 고정하고 하룻밤 도록 하십시오. 창자 장기 배양 장치의 적절한 공기 흐름을 위해 커버 뚜껑에 18 G 바늘 두 개를 삽입합니다.
- 물로 채워진 주사기를 사용하여 모든 바늘이 누출된 지검을 확인합니다. 우물을 물로 채우면 우물에서 누출이 없는지 확인하십시오.
- 결장과 연결되는 각 22 G 바늘에 두 개의 수술 매듭을 놓습니다. 장치와 뚜껑을 오토클레이브 종이 봉투에 넣고 오토클레이브로 살균합니다.
- 3D 프린터를 사용하여 장기 배양 장치에 재사용 가능한 플라스틱 금형을 인쇄합니다(장치에는 24개의 크고 큰 구멍이 있는 6개의 우물이 있고, 장치 커버 뚜껑의 경우)(3D 파일이 부착됨).
- 배양 매체 (0.5h)
- 생물학적 후드에서, 다음을 혼합 (50 mL 튜브): 37 mL 의 이스코브의 수정 된 덜벡코의 매체 (IMDM), KSR 혈청 교체의 10 mL, B27 보충의 1 mL, N2 보충의 0.5 mL, 0.5 ML 의 1 M HEPES 버퍼, 및 0.5 mL 의 필수 아미노산.
- 전체 매체를 4°C로 저장합니다.
- 튜빙 및 수술 도구 준비
- 입력 루멘, 입력 우물, 출력 루멘 및 출력 웰 (12 짧은 튜브 및 12 긴 튜브)에 대한 튜브의 적절한 길이를 잘라. 튜브의 각 측면에 적절한 어댑터를 연결합니다.
- 스트레이트 가위, 4배 얇은 집게, 2배 날카로운 집게 등 수술 도구를 준비합니다.
- 튜브와 수술 도구를 오토클레이브 종이 봉투에 넣고 오토클레이브를 사용하여 소독합니다.
- 발광 입력 (원하는 자극 - 박테리아, 대변, 약물 등)을 준비합니다.
- 실험 전에, 세균 배양의 세균적 부하를 결정, 직렬희석에 의해(12)및 유산소 조건 하에서 배양.
- 세균 부하를 계산한 후, 세균성 배양을 멸균 조직 배양 배지에서 희석하여 필요한 세균 농도를 얻습니다. 배설물 샘플의 경우 100 μm 여과기를 사용하여 필터링합니다.
참고: 비균 자극(약물, 대사산물 등)의 경우, 장 배양 배지를 사용하여 필요한 농도로 물질을 희석시다.
2. 실험 설정 준비
- 장기 배양 배양 내부, 히터 유닛을 켜고 37°C로 설정한다.
- 펌프와 입력 및 출력 주사기를 설정합니다.
- 조직 배양 배지 입력
- 생물학적 또는 라미나르 플로우 후드에서 입력 우물 주사기를 완전한 배양 배지로 채웁니다. 최종 볼륨은 실험의 지속 시간과 유량에 따라 달라집니다. 일반적으로 1 mL / h 플러스 제거를위한 추가 매체.
- Luer 잠금 어댑터를 사용하여 튜브를 주사기에 연결합니다. 채워진 주사기를 주사기 펌프에 놓습니다.
- 입력 주사기를 제거합니다. 모든 튜브에서 폐기물 유리로 우물 매체가 흘러나오는지 확인하십시오.
- 발광 입력
- 발광 입력 주사기를 자극 치료(박테리아, 약물 등)로 채웁니다. 볼륨은 실험 기간과 유량(일반적으로 30 μL/h+ 제거를 위한 추가 배지)에 따라 달라집니다.
- Luer 잠금 어댑터를 사용하여 튜브를 주사기에 연결합니다. 채워진 주사기를 주사기 펌프에 놓습니다.
- 입력 주사기를 제거합니다. 자극이 모든 튜브에서 폐 유리로 흘러 나오는지 확인합니다. 다른 자극을 오염시키지 않도록 주의하십시오.
- 출력
- 출력 주사기 펌프에 빈 주사기를 놓습니다(펌프 모드를 '철수'로 설정).
- 장치 설정
- 부드럽고 최소한의 흐름에 대한 가스 혼합물(95% O2 + 5%CO2)을제어하는 레귤레이터를 설정합니다.
- 라미나르 후드에서 장치를 검사합니다.
- 멸균 IMDM으로 장치의 바늘을 플러시하여 바늘을 씻으시다.
- 장치의 각 웰에 멸균 배양 배지 의 500 μL을 추가합니다.
- 조직 해부에 대한 준비
- 라미나르 후드 내부에 멸균 수술 도구를 넣습니다.
- 멸균 IMDM으로 10mL 주사기를 채우고 결장의 플러싱을 위해 멸균(autoclaved) 22 G 무딘 엔드 바늘을 연결합니다.
3. 장기 문화
- 마우스 희생 및 조직 해부
- 라미나르 후드에서 12-14일 된 쥐를 참수하여 희생하십시오. 70%의 에탄올로 마우스를 분사하고 마우스를 플라스틱 접시에 놓습니다.
- 날카로운 가위와 집게를 사용하여 마우스를 해부하고 모든 지방과 결합 조직을 절단하여 위장에서 항문까지 소화관을 꺼내십시오. 결장절단을 잘라 새 접시에 놓습니다.
참고: 결장 조직과의 접촉을 최소화합니다. 결장 조직의 중간 부분을 만지지 마십시오. 조직을 부드럽게 잡고 조직의 가장자리에서만 유지합니다.
- 결장 세척 및 세척
- 해부 현미경하에서, 준비된 10mL 주사기(단계 2.7.2)로 멸균 IMDM(근위면으로)으로 결장 함량을 부드럽게 플러시한다. 장 조직에서 대변을 제거 한 후, 멸균 IMDM의 0.5 mL로 채워진 새로운 6 웰 플레이트에 결장배치.
- 결장 과 장치 연결
- 조직을 가지고 조심스럽게 22 G 바늘에 연결하고 두 스레드와 꽉 넥타이를 만들 수 있습니다. 이 시점에서, 루멘 흐름에 결장의 올바른 방향을 유지하는 것이 필수적이다 (근위 = 입력, 탈구 = 출력). 6개의 조직에 대해 3.2-3.3 단계를 반복합니다.
- 입력 바늘 Luer 잠금이 매체에서 비어 있는지 확인합니다. 그렇지 않은 경우, 그들을 비우게. 입력 바늘 Luer 잠금에 자극을 추가 (루멘에 기포의 입력을 피하기 위해). 적절한 자극으로 각 결장에 대해 이 단계를 반복합니다.
- 모든 조직이 연결되어 있는지 확인하고 장치 위에 덮개 뚜껑을 배치합니다.
- 장기 배양 장치를 펌프에 연결
- 장치를 예열 된 온도 제어 챔버 (37 °C)에 넣습니다.
- 가스 흐름 연결
- 적절한 입력 바늘을 사용하여 가스 어댑터를 커버 뚜껑에 연결합니다.
- 입력 및 출력 튜브를 장치에 연결합니다.
참고: 근접 결장 면을 입력 욕조에 연결합니다.
- 자극 입력으로 루멘을 제거합니다.
- 용기를 통해 발광 자극을 부드럽게 흐르고 출력 튜브의 중간 흐름을 확인합니다.
- 외부 매체를 세척합니다.
- 외부 매체를 3번 세척합니다(펌프를 입력 및 출력 모두에 대해 600 μL/min의 속도로 설정하십시오). 각 세척은 1 분 정도 걸립니다 (우물을 비우는 것으로 시작).
- 실험을 시작합니다.
- 펌프를 다음 속도로 시작합니다.
유량: 루멘: 입력- 30 μL/h, 출력- 35 μL/h
외부 매체: 입력- 1000 μL/h, 출력- 950 μL/h
참고: 실험 시간은 30분에서 24시간 사이로 다를 수 있습니다.
- 펌프를 다음 속도로 시작합니다.
- 실험 종료(결장 장기 배양을 위한 최대 24시간)
- 장치에서 모든 튜브를 분리합니다.
- 바늘에서 조직을 분리하고 원하는 판독을 계속합니다.
결과
창자 기관 배양 시스템은 조직 생존성 ex vivo를 유지합니다. 조직 생존가능성에 대한 평가는 배양 기간 내내 이루어졌다. 결장 조직 단편은 창자 기관 배양 시스템에서 배양되었고 2/12/24 h 배양 에 따라 고정되었습니다. 장 상피 세포 (IEC) 층 무결성은 E-카데린과 사이토케라틴-18 항체를 사용하여 면역 형광 염색에 의해 검증되었다. 마찬가지로, 루멘 내의 대장 상피 및 점액 분비내의 점액이 ...
토론
이 문서는 Yissachar 등최근 개발 한 ex vivo 창자 장기 문화에 대한 최적화 된 프로토콜을 설명합니다 (게시된 9 및 게시되지 않은 데이터). 창자 기관 배양 시스템은 발광 흐름을 유지하면서 온전한 장 조각의 멀티플렉스 배양을 지원합니다. 그것은 내- 및 초광도 환경 (자극 복용량, 노출 시간 및 유량을 포함)에 대한 완전한 제어를 제공하고 순진한 장 조직 구조와 세포 복잡?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 창자 기관 문화 시스템 프로토콜을 최적화에 그들의 귀중 한 기여에 대 한 Yissachar 실험실의 과거와 현재 회원 감사. 원고의 비판적 편집에 대한 야엘 로어에게 감사드립니다. 이 작품은 이스라엘 과학 재단 (3114831 보조금 없음), 이스라엘 과학 재단 - 브로드 연구소 공동 프로그램 (8165162 보조금) 및 의료 연구를위한 가스너 기금, 이스라엘에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Modified Dulbecco's Medium with Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
참고문헌
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유