A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير والتحليل الآليان لتحديد كمية الماكروبينوسومات الموسومة بالفلورسنت
In This Article
Summary
تعد المقايسات الآلية باستخدام الصفائح الدقيقة متعددة الآبار طرقا مفيدة لتحديد منظمي المسارات من خلال السماح بتقييم العديد من الظروف في تجربة واحدة. هنا ، قمنا بتكييف بروتوكول التصوير والقياس الكمي الراسخ في macropinosome إلى تنسيق microplate 96-well وتوفير مخطط شامل للأتمتة باستخدام قارئ لوحات متعدد الأوضاع.
Abstract
Macropinocytosis هو مسار امتصاص غير محدد في مرحلة السوائل يسمح للخلايا باستيعاب شحنات كبيرة خارج الخلية ، مثل البروتينات ومسببات الأمراض وحطام الخلايا ، من خلال داء الخلايا الداخلية بالجملة. يلعب هذا المسار دورا أساسيا في مجموعة متنوعة من العمليات الخلوية ، بما في ذلك تنظيم الاستجابات المناعية واستقلاب الخلايا السرطانية. وبالنظر إلى هذه الأهمية في الوظيفة البيولوجية، فإن فحص ظروف زراعة الخلايا يمكن أن يوفر معلومات قيمة من خلال تحديد المنظمين لهذا المسار وتحسين الظروف لاستخدامها في اكتشاف أساليب علاجية جديدة. تصف الدراسة تقنية تصوير وتحليل آلي باستخدام معدات مختبرية قياسية وقارئ لوحات متعدد الأوضاع لتصوير الخلايا من أجل القياس الكمي السريع لمؤشر الخلايا الكبيرة في الخلايا الملتصقة. تعتمد الطريقة الآلية على امتصاص ديكستران الفلورسنت عالي الوزن الجزيئي ويمكن تطبيقها على 96 لوحة دقيقة لتسهيل تقييمات الظروف المتعددة في تجربة واحدة أو عينات ثابتة مثبتة على أغطية زجاجية. ويهدف هذا النهج إلى زيادة قابلية التكرار إلى أقصى حد والحد من التباين التجريبي مع توفير الوقت والفعالية من حيث التكلفة.
Introduction
يسمح المسار الداخلي غير المحدد لندرة الخلايا الكبيرة للخلايا باستيعاب مجموعة متنوعة من المكونات خارج الخلية، بما في ذلك العناصر الغذائية والبروتينات والمستضدات ومسببات الأمراض، من خلال الامتصاص الأكبر للسوائل خارج الخلية ومكوناتها1. على الرغم من أهميته لبيولوجيا العديد من أنواع الخلايا، إلا أنه يوصف بشكل متزايد مسار زيادة عدد الخلايا الكبيرة بأنه يلعب دورا أساسيا في بيولوجيا الورم، حيث، من خلال امتصاص الخلايا السرطانية الكبيرة، تكون قادرة على البقاء والتكاثر في وجود بيئة دقيقة مستنفدة للمغذيات2،3. يوفر امتصاص الجزيئات الكبيرة خارج الخلية ، بما في ذلك الألبومين والمصفوفة خارج الخلية ، وحطام الخلايا الميتة ، مصدرا غذائيا بديلا لإنتاج الكتلة الحيوية عن طريق إنشاء الأحماض الأمينية والسكريات والدهون والنيوكليوتيدات من خلال هدم البضائع بوساطة اندماج الماكروبينوسوم والليزوسوم 4،5،6،7،8.
تحريض وتنظيم كثرة الخلايا الكبيرة معقدة ويمكن أن تختلف اعتمادا على السياق الخلوي. حتى الآن ، تم تحديد العديد من محفزات زيادة عدد الخلايا الكبيرة وتشمل الأربطة ، مثل عامل نمو البشرة (EGF) ، وعامل النمو المشتق من الصفائح الدموية (PDGF) ، و galectin-3 ، و Wnt3A9,10,11,12,13. بالإضافة إلى ذلك ، يمكن أن تؤدي ظروف الزراعة التي تحاكي البيئة الدقيقة للورم إلى تنشيط المسار. الأورام الغدية في القنوات البنكرياسية (PDAC) محرومة من المغذيات ، خاصة بالنسبة للغلوتامين الحمضي الأميني ، الذي يتسبب في اعتماد كل من الخلايا السرطانية والخلايا الليفية المرتبطة بالسرطان (CAFs) على زيادة ندرة الخلايا الكبيرة للبقاء على قيد الحياة7،13،14،15. علاوة على ذلك، يمكن لضغوط الورم، مثل نقص الأكسجة والإجهاد التأكسدي، تنشيط مسار الكسح هذا16. بالإضافة إلى العديد من المؤثرين الخارجيين الذين يمكنهم تحفيز زيادة عدد الخلايا الكبيرة ، تتحكم مجموعة متنوعة من المسارات داخل الخلايا في تكوين macropinosome. التحول بوساطة راس الورمي يكفي لبدء آلية الخلايا الكبيرة ، وتظهر أنواع متعددة من السرطان زيادة الخلايا الكبيرة التأسيسية التي يحركها راس الورمي 4،5،9،17. بدلا من ذلك ، تم تحديد تنشيط Ras من النوع البري والمسارات المستقلة عن Ras لتنشيط macropinocytosis في الخلايا السرطانية و CAFs10،11،15،18. أدى استخدام نماذج مختلفة في المختبر بالاشتراك مع العلاجات المثبطة إلى تحديد العديد من معدلات ندرة الخلايا الكبيرة ، والتي تشمل مبادلات الصوديوم والهيدروجين ، و GTPase Rac1 الصغير ، و phosphoinositide 3-kinase (PI3K) ، و kinase المنشط p21 (Pak) ، و AMP-activated protein kinase (AMPK) 4,13,15 . ومع ذلك ، بالنظر إلى العديد من العوامل والظروف الموصوفة التي تنظم ندرة الخلايا الكبيرة ، فمن المتصور أن العديد من المعدلات والمحفزات الأخرى لا تزال غير مكتشفة. يمكن تسهيل تحديد المعدلات والمحفزات الجديدة من خلال التقييم الآلي للعديد من الحالات في تجربة واحدة. يمكن لهذه المنهجية أن تلقي الضوء على العوامل التي ينطوي عليها تكوين الماكروبينوسوم وقد تسمح باكتشاف جزيئات صغيرة جديدة أو بيولوجية تستهدف هذا المسار.
هنا ، قمنا بتكييف بروتوكولنا الذي تم إنشاؤه مسبقا لتحديد مدى ندرة الخلايا السرطانية في الخلايا السرطانية في المختبر إلى تنسيق microplate 96-well والتصوير الآلي وتحديد الكم19,20. يعتمد هذا البروتوكول على الفحص المجهري الفلوري ، والذي أصبح معيارا في هذا المجال لتحديد ندرة الخلايا الكبيرة في المختبر وفي الجسم الحي 4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. يمكن تمييز Macropinosomes عن مسارات الخلايا الداخلية الأخرى من خلال قدرتها على استيعاب الجزيئات الكبيرة الكبيرة ، مثل dextran عالي الوزن الجزيئي (أي 70 kDa) 2,3,4,20,21,22,23. وبالتالي ، يمكن تعريف macropinosomes من خلال امتصاص الفلوروفور خارج الخلية المسمى 70 kDa dextran. ونتيجة لذلك ، تظهر الحويصلات ذات الخلايا الكبيرة على شكل مجموعات داخل الخلايا من البقع الفلورية بأحجام تتراوح بين 0.2-5 ميكرومتر. يمكن تصوير هذه الثقوب مجهريا وتحديدها كميا لاحقا لتحديد مدى ندرة الخلايا الكبيرة في الخلية - "مؤشر الخلايا الكبيرة".
في هذا البروتوكول ، يتم وصف الخطوات الأساسية لتصور الماكروبينوسومات في الخلايا الملتصقة في المختبر على صفيحة دقيقة من 96 بئرا وأغطية باستخدام معدات المختبرات القياسية (الشكل 1). بالإضافة إلى ذلك ، يتم توفير التوجيهات لأتمتة الحصول على الصور وتحديد كميتها لمؤشر macropinocytic باستخدام قارئ لوحة متعدد الأوضاع لتصوير الخلايا. تقلل هذه الأتمتة من الوقت والتكلفة والجهد مقارنة ببروتوكولاتنا الموصوفة سابقا19,20. بالإضافة إلى ذلك ، فإنه يتجنب الحصول على التصوير وتحليله بشكل غير مقصود ، وبالتالي يعزز قابلية التكرار والموثوقية. يمكن بسهولة تكييف هذه الطريقة مع أنواع الخلايا المختلفة أو قارئات الألواح أو استخدامها لتحديد ميزات macropinosome البديلة ، مثل الحجم والعدد والموقع. الطريقة الموصوفة هنا مناسبة بشكل خاص لفحص ظروف زراعة الخلايا التي تحفز ندرة الخلايا الكبيرة ، أو تحديد المعدلات الجديدة ، أو تحسين تركيزات الأدوية للمثبطات المعروفة.
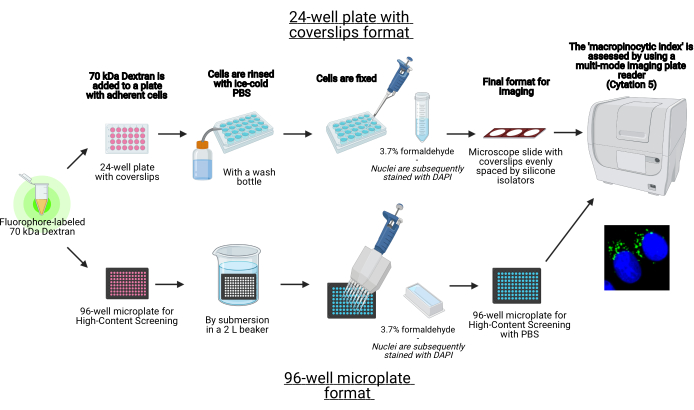
الشكل 1: مخطط للفحص الآلي لتحديد "مؤشر الخلايا الكبيرة" في الخلايا الملتصقة. تم إنشاؤه باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. إعداد المواد
- قم بإذابة 70 كيلو دالتون ديكستران الموسوم ب FITC أو رباعي ميثيل الرودامين (TMR) في PBS للحصول على محلول 20 ملغم / مل. تخزين aliquots في -20 درجة مئوية.
- قم بإذابة DAPI في ddH2O للحصول على محلول 1 ملغم / مل. تخزين aliquots في -20 درجة مئوية.
تحذير: DAPI هو مادة مسرطنة محتملة ويجب التعامل معه بعناية. - في يوم التثبيت ، قم بإعداد الفورمالديهايد الطازج بنسبة 3.7٪ من درجة ACS في PBS.
تحذير: الفورمالديهايد هو مادة مسرطنة مثبتة ومعروفة وسامة إذا تم استنشاقها. اصنع المحلول في غطاء دخان كيميائي لتجنب الاستنشاق والتعامل معه بعناية. - تحضير الأغطية المغسولة بالحمض.
- استخدم دورقا بسعة 500 مل وحمام مائي لتسخين 28 جم من أغطية زجاج البورسليكات بقطر 12 مم وسماكة #1.5 لمدة 24 ساعة عند 56 درجة مئوية في 100 مل من 1 M HCl. قم بإغلاق الكأس بغلاف بلاستيكي لتجنب التبخر المكثف.
تحذير: حمض الهيدروكلوريك هو حمض قوي شديد التآكل وبالتالي يجب التعامل معه بعناية واستخدامه في غطاء الدخان الكيميائي لتجنب الاستنشاق. - اغسل الأغطية بالماء المقطر. كرر الغسيل 4 مرات. ثم اغسل الأغطية بالإيثانول بنسبة 95٪. كرر الغسيل 4 مرات.
- قم بتخزين الأغطية المغسولة بالحمض في طبق زراعة الخلايا في درجة حرارة الغرفة لاستخدامها في المستقبل من خلال الحفاظ على العقم من خلال الغمر في 95٪ من الإيثانول. ختم الطبق مع parafilm لتجنب التبخر واسعة النطاق.
- استخدم دورقا بسعة 500 مل وحمام مائي لتسخين 28 جم من أغطية زجاج البورسليكات بقطر 12 مم وسماكة #1.5 لمدة 24 ساعة عند 56 درجة مئوية في 100 مل من 1 M HCl. قم بإغلاق الكأس بغلاف بلاستيكي لتجنب التبخر المكثف.
2. إعداد الخلايا
- باستخدام لوحة زراعة أنسجة متقاربة مقاس 10 سم مع الخلايا الملتصقة ذات الاهتمام ، قم بشفط الوسائط وشطف الخلايا ب 5 مل من DPBS ، يتم تسخينها مسبقا عند 37 درجة مئوية.
- افصل الخلايا عن اللوحة بإضافة 1.5 مل من التريبسين المسخن مسبقا بنسبة 0.25٪ واحتضانه عند 37 درجة مئوية.
ملاحظة: يجب تحديد وقت حضانة التربسين اللازم لفصل الخلايا ذات الأهمية تجريبيا ويمكن تأكيده من خلال مراقبة الانفصال تحت المجهر الضوئي التقليدي. - اجمع الخلايا في أنبوب طرد مركزي سعة 15 مل وأضف 4.5 مل من الوسائط الكاملة لإخماد التربسين.
- قم بتكوير الخلايا عن طريق الطرد المركزي لمدة 3 دقائق عند 200 × g وشفط السوبرناتانت.
- أعد تعليق حبيبات الخلية في حجم كاف من الوسائط الكاملة المسخنة مسبقا للحصول على تعليق خلية واحدة للبذر.
- انتقل إلى زرع الخلايا على صفيحة من 24 بئرا مع أغطية أو تنسيق صفيحة صغيرة من 96 بئرا (الشكل 1).
ملاحظة: يجب تحديد عدد الخلايا المراد زرعها تجريبيا لكل خط خلوي حيث تختلف معدلات الانتشار والحجم بين خطوط الخلايا. تم تحسين هذا البروتوكول للخلايا السرطانية الملتصقة بنسبة 80٪ من التقاء الخلايا في يوم وضع العلامات على macropinosome. قد يؤثر التقاء الخلايا على قدرة الخلايا على الخلايا الكبيرة ، ويجب أيضا تحديد ذلك تجريبيا.- لوحة 24 بئر مع شكل غطاء
- أضف أغطية إلى صفيحة زراعة الأنسجة المكونة من 24 بئرا ، واستخدم الملقط للإمساك بغطاء واحد من حمام الإيثانول. اضغط على الغطاء على الجدار الداخلي للصفيحة لإزالة الإيثانول الزائد ووضع الغطاء مسطحا في قاع البئر.
- دع الإيثانول يتبخر واغسل الغطاء 2 مرات باستخدام DPBS.
- زرع الخلايا الموجودة أعلى الغطاء عن طريق إضافة 500 ميكرولتر من تعليق الخلية إلى كل بئر. ضع الخلايا في حاضنة خلايا 37 درجة مئوية مع 5٪ CO2 حتى يصل التقاء الخلايا إلى 60٪ -80٪ في اليوم السابق لوضع العلامات على macropinosome.
- في اليوم السابق لوضع العلامات على الماكروبينوسوم ، قم بشفط الوسائط من الآبار وإضافة 500 ميكرولتر من الوسائط الخالية من المصل المسلية المسخنة مسبقا إلى كل بئر ووضع الخلايا في حاضنة خلايا 37 درجة مئوية مع 5٪ CO2 لمدة 16-24 ساعة.
ملاحظة: اعتمادا على الظروف المراد دراستها ، يوصى باستخدام الوسائط الخالية من المصل لتقليل آثار عوامل النمو التي يمكن أن تحفز ندرة الخلايا الكبيرة والتي توجد عادة في المصل. ومع ذلك ، ينبغي النظر في أن تجويع المصل قد يؤثر على العمليات الخلوية الأخرى ، مثل الانتشار والالتهام الذاتي. نظرا لأن المصل المتبقي يمكن أن يؤثر على قدرة الخلايا على الخلايا ، بالإضافة إلى نشاط المثبطات ، يمكن تحسين إزالة المصل عن طريق شطف الخلايا بلطف 1 أو 2 مرات باستخدام 500 ميكرولتر من DPBS المحموم مسبقا.
- تنسيق 96 بئر ميكروبليت
- انقل تعليق الخلية إلى خزان كاشف سعة 25 مل. باستخدام ماصة متعددة القنوات (8 أو 12 قناة) ، قم بزرع 100 ميكرولتر من تعليق الخلية إلى كل بئر من صفيحة فحص سوداء عالية المحتوى ذات 96 بئرا مع أوليفين دوري واضح بصريا أو قاع زجاجي.
- ضع الخلايا في حاضنة خلايا 37 درجة مئوية مع 5٪ CO2 حتى يصل التقاء الخلايا إلى 60٪ -80٪ في اليوم السابق لوضع العلامات على macropinosome.
- في اليوم السابق لوضع العلامات على الماكروبينوسوم، قم بإزالة الوسائط والتخلص منها من كل بئر باستخدام ماصة متعددة القنوات (8 أو 12 قناة) أو محول شفط متعدد القنوات للحصول على نصائح قياسية متصلة بمضخة تفريغ.
- باستخدام خزان كاشف وماصة متعددة القنوات (8 أو 12 قناة) ، أضف بلطف 100 ميكرولتر من الوسائط الخالية من المصل المسلية المسخنة مسبقا إلى كل بئر. ضع الخلايا في حاضنة خلايا 37 درجة مئوية مع 5٪ CO2 لمدة 16-24 ساعة.
ملاحظة: اعتمادا على الظروف المراد دراستها ، يوصى باستخدام الوسائط الخالية من المصل لتقليل آثار عوامل النمو التي يمكن أن تحفز ندرة الخلايا الكبيرة والتي توجد عادة في المصل. ومع ذلك ، ينبغي النظر في أن تجويع المصل قد يؤثر على العمليات الخلوية الأخرى ، مثل الانتشار والالتهام الذاتي. نظرا لأن المصل المتبقي يمكن أن يؤثر على قدرة الخلايا على الخلايا ، بالإضافة إلى نشاط المثبطات ، يمكن تحسين إزالة المصل عن طريق شطف الخلايا بلطف 1 أو 2 مرات باستخدام 100 ميكرولتر DPBS المحموم مسبقا.
- لوحة 24 بئر مع شكل غطاء
3. وضع العلامات على الماكروبينوسوم
- لوحة 24 بئر مع شكل غطاء
- استنشاق الآبار وأضف 200 ميكرولتر من الوسائط الخالية من المصل مع 1 ملغ / مل من الفلوروفور المسمى بالوزن الجزيئي العالي (70 كيلو دالون). ضع الخلايا في حاضنة خلايا 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: اعتمادا على الظروف المراد دراستها ، بدلا من استخدام وسائط جديدة ، قد يفضل إعادة استخدام الوسائط المشروطة لتحميل الدكستران لأنها تحتوي على عوامل إفرازية أو مكملة ، مثل EGF أو المركبات المثبطة ، على التوالي ، والتي يمكن أن تؤثر على قدرة الخلايا على الخلايا الكبيرة. - استنشق الوسائط واغسل الخلايا بلطف ولكن بسرعة 5 مرات باستخدام PBS البارد باستخدام زجاجة غسيل مبردة مسبقا. هز الطبق باليد بقوة أثناء الغسيل للمساعدة في إزاحة مجاميع الدكستران التي تصبح عالقة في الأغطية.
- إصلاح الخلايا عن طريق إضافة 350 ميكرولتر من 3.7 ٪ الفورمالديهايد واحتضان لمدة 20 دقيقة. ثم ، استطلع محلول التثبيت واغسل الخلايا باستخدام PBS مرتين.
- لطخ النوى مع 350 ميكرولتر من 2 ميكروغرام / مل DAPI في PBS. بعد 20 دقيقة ، استنشق محلول DAPI واغسل الخلايا باستخدام PBS ثلاث مرات.
- قم بلصق عوازل السيليكون جنبا إلى جنب على شريحة المجهر للحصول على تباعد متساو وتوطين قابل للتكرار للأغطية ، وهو مطلوب لأتمتة التصوير (الشكل 2A ، B).
ملاحظة: يمكن ملء شريحة المجهر بأكملها بما مجموعه 3 عوازل. - لكل غطاء ، أضف قطرة من وسائط تركيب التألق المتصلب على شريحة المجهر داخل المساحة المفتوحة للعازل (الشكل 2C). التقط غطاء باستخدام ملقط وقم بإزالة PBS الزائد عن طريق النقر برفق على جانب الغطاء على منديل خال من الوبر.
- ضع الغطاء رأسا على عقب على قطرة وسائط التركيب (الشكل 2D). اضغط برفق على الغطاء باستخدام ملقط مغلق لإزالة الفقاعات من وسائط التركيب (الشكل 2E).
- قم بتخزين الشرائح في بيئة مظلمة واسمح لوسائط التركيب بالجفاف في درجة حرارة الغرفة، وعادة ما يستغرق الأمر من 16 إلى 24 ساعة. يمكن الآن تصوير الشرائح أو تخزينها عند -20 درجة مئوية لمدة تصل إلى أسبوعين.
- قبل التصوير ، قم بإزالة العوازل من شريحة المجهر. دع الشرائح تتوازن مع درجة حرارة الغرفة ونظف الأغطية باستخدام قضيب ذو رؤوس قطنية مبلل بمنظف زجاجي خال من الأمونيا. بعد ذلك ، استخدم قضيب نظيف ذو رؤوس قطنية مبلل بالإيثانول بنسبة 70٪ لتنظيف الغطاء وتركه جافا.
- استنشاق الآبار وأضف 200 ميكرولتر من الوسائط الخالية من المصل مع 1 ملغ / مل من الفلوروفور المسمى بالوزن الجزيئي العالي (70 كيلو دالون). ضع الخلايا في حاضنة خلايا 37 درجة مئوية لمدة 30 دقيقة.
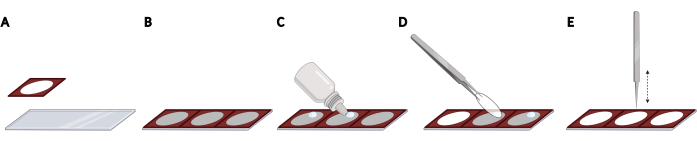
الشكل 2: وضع أغطية على شريحة مجهرية باستخدام عوازل السيليكون. (أ) يتم ضغط عوازل السيليكون والالتزام بشريحة المجهر. (ب) يمكن ملء شريحة المجهر بأكملها بما مجموعه 3 عوازل ، مما يؤدي إلى تباعد متساو وتوطين قابل للتكرار لقسائم الغطاء. (ج) لكل غطاء ، أضف قطرة من وسائط تركيب التألق على شريحة المجهر داخل المساحة المفتوحة للعازل. (د) باستخدام الملقط ، التقط غطاء من اللوحة المكونة من 24 بئرا وضعه رأسا على عقب على قطرة وسائط التركيب. (ه) عند وجود فقاعات بين شريحة الغطاء وشريحة المجهر، انقر برفق على الغطاء باستخدام ملقط مغلق لإزالة الفقاعات. تم إنشاؤه باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تنسيق 96 بئر ميكروبليت
- قم بشفط الآبار باستخدام محول شفط متعدد القنوات متصل بفراغ وأضف 40 ميكرولتر من الوسائط الخالية من المصل مع 1 مجم / مل من الفلوروفور المسمى بالوزن الجزيئي العالي (70 كيلو دال) إلى الآبار. احتضن الخلايا في حاضنة خلايا 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: اعتمادا على الظروف المراد دراستها ، بدلا من استخدام وسائط جديدة ، قد يفضل إعادة استخدام الوسائط المشروطة لتحميل الدكستران لأنها تحتوي على عوامل مفرزة أو مكملة ، مثل EGF أو المركبات المثبطة ، على التوالي التي يمكن أن تؤثر على قدرة الخلايا على الخلايا الكبيرة. - تخلص من الوسائط الموجودة في الصفيحة الدقيقة عن طريق تحريك اللوحة يدويا رأسا على عقب في كوب فارغ سعة 5 لتر (الشكل 3A).
- شطف الخلايا في الصفيحة الدقيقة عن طريق غمر الصفيحة ببطء عموديا ، بزاوية طفيفة ، في كوب سعة 2 لتر مملوء ب PBS البارد (الشكل 3B) ثم تخلص من PBS في الصفيحة الدقيقة عن طريق تحريك اللوحة رأسا على عقب في كوب سعة 5 لتر (الشكل 3C). كرر 2 مرات.
ملاحظة: الخلايا التي ترتبط بشكل ضعيف بصفيحة التصوير الدقيقة قد تنفصل أثناء هذه العملية. إذا لزم الأمر ، يمكن أيضا شفط الآبار باستخدام محول شفط متعدد القنوات أو غسلها بلطف باستخدام PBS باستخدام ماصة متعددة القنوات. ستتطلب معالجة صفيحة صغيرة واحدة من 96 بئرا حوالي 2 لتر من PBS المثلج البارد. إذا كان من المقرر تحليل المزيد من الألواح ، فاستخدم دقا أكبر ، وأضف 1 لتر من PBS المثلج البارد لكل لوحة إضافية أو قم بتحديث PBS البارد عند الضرورة. - بعد التخلص من PBS من الشطف الأخير ، قم بإصلاح الخلايا لمدة 20 دقيقة في درجة حرارة الغرفة عن طريق إضافة 100 ميكرولتر من الفورمالديهايد بنسبة 3.7٪ في PBS إلى كل بئر باستخدام خزان كاشف 25 مل وماصة متعددة القنوات (الشكل 3D).
- قم بإزالة محلول التثبيت واغسل الخلايا باستخدام PBS مرتين باستخدام تقنية الغمر والنقر. قم بتلطيخ النوى ب 100 ميكرولتر من 2 ميكروغرام / مل DAPI في PBS لكل بئر.
- بعد 20 دقيقة ، اشطف الخلايا ثلاث مرات باستخدام PBS البارد باستخدام تقنية الغمر والخفقان الموضحة أعلاه (الخطوة 3.2.3). قم بإزالة أي PBS متبقية عن طريق النقر على الصفيحة الدقيقة رأسا على عقب على مسح خال من الوبر وإضافة 100 ميكرولتر من PBS الطازج إلى كل بئر باستخدام خزان كاشف سعة 25 مل وماصة متعددة القنوات. صور الخلايا الآن أو قم بتخزينها مغطاة من الضوء عند 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
ملاحظة: بدلا من ذلك ، يمكن استخدام محلول الجلسرين في PBS (بدلا من PBS) للتصوير والتخزين لتحقيق استقرار أفضل للتألق (الشكل 4A). - قبل التصوير ، دع اللوحة تتوازن مع درجة حرارة الغرفة. امسح الصفيحة الدقيقة الجافة بمنديل خال من الوبر.
- قم بشفط الآبار باستخدام محول شفط متعدد القنوات متصل بفراغ وأضف 40 ميكرولتر من الوسائط الخالية من المصل مع 1 مجم / مل من الفلوروفور المسمى بالوزن الجزيئي العالي (70 كيلو دال) إلى الآبار. احتضن الخلايا في حاضنة خلايا 37 درجة مئوية لمدة 30 دقيقة.
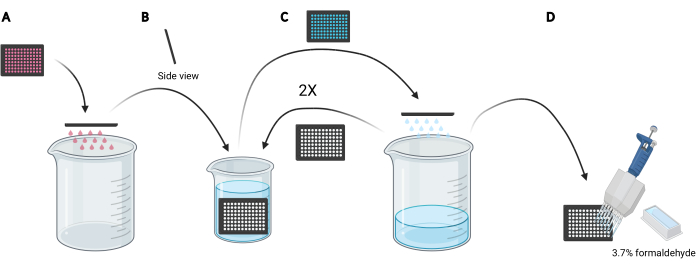
الشكل 3: شطف الصفيحة الدقيقة المكونة من 96 بئرا للتحضير للتثبيت. (أ) أفرغ الصفيحة الدقيقة من الوسائط في كوب سعة 5 لتر عن طريق النقر يدويا. (ب) عموديا وبزاوية طفيفة ، قم بغمر الصفيحة الدقيقة ببطء في كوب سعة 2 لتر مملوء ب PBS البارد المثلج. (ج) قم بإفراغ الصفيحة الدقيقة من PBS في الكأس سعة 5 لتر عن طريق النقر يدويا. كرر خطوات الغسيل كما هو موضح في B مرتين. (د) بعد إفراغ PBS في الصفيحة الدقيقة للمرة الأخيرة ، أضف 100 ميكرولتر 3.7٪ من الفورمالديهايد إلى الآبار ، باستخدام ماصة متعددة القنوات. تم إنشاؤه باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التصوير الآلي للماكروبينوسوم
يمكن التقاط صور للميكروبينوسومات باستخدام مجهر فلورسنت قياسي ، كما هو موضح سابقا19,20. ومع ذلك ، يمكن تحسين مثل هذا الإجراء من حيث الكفاءة من خلال الأتمتة ، خاصة عند تقييم العديد من ظروف زراعة الخلايا المختلفة. يمكن تحقيق أتمتة الحصول على الصور عبر قارئ لوحات متعدد الأوضاع لتصوير الخلايا ، مما يقلل من الجهد عن طريق تقليل إجراءات المعالجة ، والأهم من ذلك ، يزيد من قابلية تكرار البيانات وموثوقيتها من خلال الحصول على الصور بطريقة غير متحيزة. تتوفر أنظمة تصوير متعددة تجاريا ، وستختلف الاتجاهات بين الأدوات. هنا ، يتم وصف الحصول على الصور باستخدام Cytation 5. ومع ذلك، يمكن تكييف البروتوكول الوارد أدناه مع كل صك على حدة من خلال الالتزام بالمبادئ التوجيهية التالية:
- قم بإنشاء بروتوكول أتمتة للحصول على الصور ذات الهدف الجوي 40x في قناة الطول الموجي لفلوروفور ديكستران (FITC / TMR) و DAPI.
ملاحظة: يظهر مثبط ندرة الخلايا الكبيرة EIPA شائع الاستخدام تألقا ذاتيا في قناة FITC ، خاصة عند الإثارة السابقة في قناة DAPI. المركبات الأخرى التي يتم اختبارها قد تعرض أيضا التألق الذاتي. للتحايل على هذه المشكلة، يساعد تعيين اكتساب الصورة ليحدث أولا في القناة ذات الطول الموجي الأعلى للإثارة (FITC/TMR) وثانيا في قناة DAPI على تجنب حدوث ذلك. - قم بتحسين إعدادات التعرض باستخدام عينة من المتوقع أن تحتوي على أعلى مستوى من ندرة الخلايا الكبيرة لتجنب التعرض المفرط، مما قد يؤدي إلى تشبع الإشارة وفقدان بيانات الكثافة. استخدم إعدادات التركيز البؤري التي تحدد موقع العينة بسهولة وثبات لإنتاج صور عالية الجودة.
- احصل على صور متعددة عبر كل بئر أو غطاء لمراعاة تباين العينة والحصول على تمثيل دقيق للعينة.
- بمجرد تحديد إعدادات التصوير، استخدم نفس الإعدادات لكل عينة داخل التجربة.
- اتبع هذه الإرشادات للحصول على صورة ماكروبينوسوم عند استخدام برنامج Cytation 5 وGen5:
- لوحة 24 بئر مع شكل غطاء
- ابدأ تشغيل قارئ الألواح وأدخل شرائح المجهر رأسا على عقب باستخدام حامل الشرائح.
- افتح قارئ الصفائح الدقيقة وبرنامج التصوير ، وقم بإنشاء بروتوكول جديد بالنقر فوق البروتوكولات ، وإنشاء جديد. انقر نقرا مزدوجا فوق الإجراء وحدد نوع اللوحة.
ملاحظة: إذا لم يكن نوع اللوحة متوفرا، فأضف نوع اللوحة إلى البرنامج بالنقر فوق النظام > أنواع الألواح > إضافة لوحة، واستخدام أبعاد اللوحة كما هو موضح من قبل الشركة المصنعة. لسهولة الاستخدام ، يتم توفير قالب لشريحتين مجهريتين مع ثلاث أغطية متباعدة باستخدام عوازل السيليكون في الملف التكميلي 1. - للوصول إلى إعدادات التصوير، حدد الإجراءات > صورة > صورة مقلوبة وانقر فوق موافق. استخدم هدف مرحلة PL FL 40x مع ميزة FOV العريضة وميزة ضبط التركيز البؤري التلقائي.
- بالنسبة للقناة الأولى، حدد مكعب LED المقابل لملصق الفلوروفور dextran (GFP أو RFP). قم بإلغاء النقر فوق التعرض التلقائي وانقر فوق زر رمز المجهر لتحسين إعدادات التعرض. عند تحديد إعدادات التعرض المناسبة ، انقر فوق حفظ الإعدادات.
ملاحظة: اضبط إعدادات التعريض الضوئي باستخدام عينة من المتوقع أن تحتوي على أعلى مستوى من ندرة الخلايا الكبيرة لتجنب الصور المفرطة التعرض، مما قد يؤدي إلى تشبع الإشارة وفقدان بيانات الكثافة. - كرر الخطوة السابقة للقناة الثانية باستخدام مكعب DAPI LED.
- اضبط إعدادات التركيز البؤري التلقائي لكل قناة من قنوات التألق، وحدد خيارات التركيز. ألغ تحديد طريقة التركيز البؤري الافتراضية واستخدم التركيز البؤري التلقائي مع المسح الضوئي الاختياري والتركيز البؤري التلقائي بدون المسح الضوئي الاختياري لقناة dextran-fluorophore وDAPI، على التوالي. انقر فوق موافق لحفظ الإعدادات.
ملاحظة: يمكن تقليل مسافة المسح الضوئي إلى 200 ميكرومتر والزيادة إلى 20 ميكرومتر لزيادة كفاءة التركيز البؤري التلقائي. الفحص الاختياري مطلوب للتركيز البؤري التلقائي الكافي على العينات ذات التألق المنخفض. يحدث هذا عادة عند تحليل الحالات ذات ندرة الخلايا الكبيرة المنخفضة ، مثل عندما يتم تثبيط زيادة عدد الخلايا الكبيرة أو عدم وجودها بالفطرة. - استخدم خيار تعريف المنارات لأتمتة الحصول على الصور في مناطق مختلفة من الغطاء الزجاجي. انقر فوق رمز المجهر وأضف إشارات بالنقر فوق نافذة الصورة ونقل المرحلة إلى المنطقة التالية. عند تحديد العدد المناسب من المناطق، انتقل إلى الشريحة التالية وكرر العملية. لوضع اللمسات الأخيرة ، انقر فوق حفظ الإعدادات.
ملاحظة: للحصول على تمثيل جيد لندرة الخلايا الكبيرة عبر العينة، حدد حوالي 20 منارات موزعة بالتساوي عبر الغطاء (الشكل 4B). يمكن استخدام منارات أقل ، ولكن قد يتعين استبعاد بعض الصور من تحليل الصور بعد الحصول عليها بسبب تناقضات الجودة ، مثل عندما تكون الصورة خارج نطاق التركيز البؤري أو تحتوي على فقاعات أو بقع فلورسنت ولطخات. - لإكمال ضبط إعدادات التصوير ، انقر فوق موافق. لتصوير الأغلفة، حدد إنشاء تجربة جديدة واقرأ الآن من أدوات البروتوكول. احفظ البروتوكول والتجربة عند مطالبتك بذلك.
- لوحة 24 بئر مع شكل غطاء
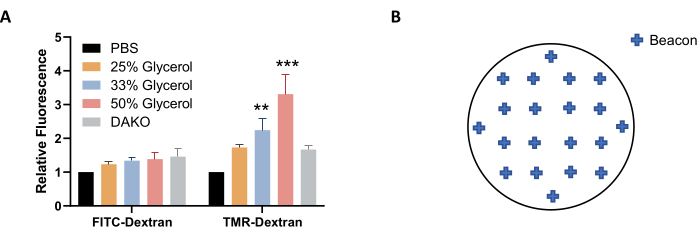
الشكل 4: تحسين ظروف الحصول على الصورة . (أ) زيادة تركيز الجلسرين يزيد من تألق TMR-dextran ، كما هو محدد في خلايا AsPC-1 المعالجة ب EGF. (ب) مثال على إحداثيات منارات التصوير للحصول التلقائي على الصور عند استخدام لوحة ال 24 بئرا بتنسيق أغطية الشكل. يوضح الرسم البياني الشريطي متوسط التألق النسبي مع SEM ل 5 تجارب. تم تحديد الدلالة الإحصائية بواسطة ANOVA ثنائي الاتجاه ، بالنسبة إلى PBS. ** ص < 0.01؛ ص < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تنسيق 96 بئر ميكروبليت
- ابدأ تشغيل قارئ الألواح وأدخل اللوحة الدقيقة.
- افتح قارئ الصفائح الدقيقة وبرنامج التصوير ، وقم بإنشاء بروتوكول جديد بالنقر فوق البروتوكولات ، وإنشاء جديد. انقر نقرا مزدوجا فوق الإجراء وحدد نوع اللوحة.
ملاحظة: إذا لم يكن نوع اللوحة متوفرا، فأضف نوع اللوحة إلى البرنامج بالنقر فوق أنواع لوحات > النظام > إضافة لوحة، واستخدام أبعاد اللوحة كما هو موضح من قبل الشركة المصنعة. لسهولة الاستخدام ، يتم توفير قالب لوحات CellCarrier-96 Ultra Microplates من PerkinElmer في الملف التكميلي 2. - للوصول إلى إعدادات التصوير، حدد الإجراءات > صورة > مصور مقلوب وانقر فوق موافق. استخدم هدف مرحلة PL FL 40x مع FOV العريض ومبيت التركيز البؤري التلقائي.
- بالنسبة للقناة الأولى، حدد مكعب LED المقابل لملصق الفلوروفور dextran (GFP أو RFP). قم بإلغاء النقر فوق التعرض التلقائي وانقر فوق زر رمز المجهر لتحسين إعدادات التعرض. عند تحديد إعدادات التعرض المناسبة ، انقر فوق حفظ الإعدادات.
ملاحظة: أثناء تحسين إعدادات التعرض، يمكن أن يحدث تبييض فلوري كبير. يمكن أن يؤدي ذلك إلى إعدادات تتسبب في التعرض المفرط عند تصوير حقل جديد. لذلك، تحقق من صحة إعدادات التعرض عن طريق التحقق من حقل غير مكشوف بعد والتأكد من عدم حدوث أي تشبع للإشارة في الإعدادات المحددة. لا تقم بتضمين الآبار المستخدمة لتحسين إعداد التعرض في القياس الكمي للماكروبينوسوم ، حيث انخفض التألق نتيجة للتبييض أثناء التحسين. اضبط إعدادات التعريض الضوئي باستخدام عينة من المتوقع أن تحتوي على أعلى مستوى من ندرة الخلايا الكبيرة لتجنب الصور المفرطة التعرض، مما قد يؤدي إلى تشبع الإشارة وفقدان بيانات الكثافة. - كرر الخطوة السابقة للقناة الثانية باستخدام مكعب DAPI LED.
- اضبط إعدادات التركيز البؤري التلقائي لكل قناة من قنوات التألق، وحدد خيارات التركيز. ألغ تحديد طريقة التركيز البؤري الافتراضية واستخدم التركيز البؤري التلقائي بالليزر. التقط مسحا مرجعيا بعد تحديد المستوى البؤري للحصول على التصور الأمثل للماكروبينوسومات والنواة. انقر فوق موافق لحفظ الإعدادات.
ملاحظة: يمكن تقليل مسافة المسح الضوئي إلى 400 ميكرومتر والزيادة إلى 3 ميكرومتر لزيادة كفاءة التركيز البؤري التلقائي. لكي يعمل خيار التركيز البؤري التلقائي بالليزر بشكل صحيح، قم بتنظيف الجزء السفلي من اللوحة، وجفف اللوحة وامسحها بمسح خال من الوبر قبل التصوير. يعد التركيز البؤري التلقائي بالليزر طريقة متفوقة للتركيز البؤري لأنه يتطلب الحد الأدنى من الوقت للعثور على المستوى البؤري. ويمكن استخدام طرق تركيز أخرى، ولكن نظرا لعدم إضافة أي مضاد للتلاشي إلى الآبار، فإن هذه الطرق قد تسبب تبييضا كبيرا للعينات مما سيؤثر سلبا على جمع البيانات. - اضبط الإزاحة الأفقية والرأسية على الصفر وضمن صورة واحدة حدد مونتاج بدون تداخل واستخدم صور 3 × 3 ، اعتمادا على عدد الخلايا المطلوب تضمينها في التحليل.
ملاحظة: اعتمادا على حجم الخلايا وكثافتها، يمكن التقاط صور أكثر أو أقل للحصول على تقييم تمثيلي لكثرة الخلايا الكبيرة في جميع أنحاء العينة. عند تقييم ندرة الخلايا الكبيرة في خلايا AsPC-1 أو MIA PaCa-2 في ظل ظروف متفاوتة ، لا تلاحظ أي اختلافات في تفسير البيانات بين إطار صورة 2 × 2 أو 4 × 4 ، على الرغم من أن التباين بين العينات المكررة قد يزداد عند التقاط صور أقل (الشكل 5A ، B). ستؤثر زيادة أو تقليل حجم الإطار على الوقت الذي يستغرقه مسح اللوحة. اعتمادا على وقت التعرض ، ستستغرق الصفيحة الدقيقة الكاملة المكونة من 96 بئرا حوالي 1-1.5 ساعة للمسح الضوئي بالكامل باستخدام إطار 3 × 3. سينخفض الإطار 2 × 2 و 4 × 4 إلى النصف أو الضعف في ذلك الوقت ، على التوالي. - لإكمال ضبط إعدادات التصوير ، انقر فوق موافق.
- لتصوير اللوحة، حدد إنشاء تجربة جديدة واقرأ الآن من أدوات البروتوكول. احفظ البروتوكول والتجربة عند مطالبتك بذلك.
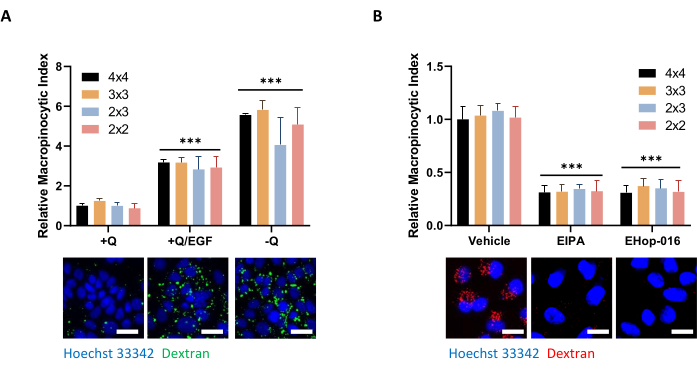
الشكل 5: ظروف التحكم لتقييم ندرة الخلايا الكبيرة في خلايا PDAC. (أ) تعرض خلايا AsPC-1 ندرة الخلايا الكبيرة استجابة لتحفيز EGF 100 نانوغرام / مل لمدة 5 دقائق أو الحرمان من الجلوتامين لمدة 24 ساعة. للحصول على الصور، تم التقاط إطارات صور 4 × 4 أو 3 × 3 أو 2 × 3 أو 2 × 2 لتحديد تأثير عدد الصور على جودة البيانات. (ب) تظهر خلايا MIA PaCa-2 ندرة الخلايا الكبيرة المكونة التي يتم تثبيطها بواسطة علاج لمدة 30 دقيقة مع 75 ميكرومتر EIPA أو علاج 2-h مع 10 ميكرومتر EHop-016. تم التقاط إطارات الصور كما في A. شريط المقياس = 25 ميكرومتر. تظهر الرسوم البيانية الشريطية متوسط مؤشر الخلايا الكبيرة النسبية مع SD من 1 تجربة مع 4 نسخ متماثلة. تم تحديد الدلالة الإحصائية بواسطة ANOVA ثنائي الاتجاه بالنسبة إلى +Q أو حالة السيارة. p < 0.001 يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحديد مؤشر الخلايا الكبيرة
"مؤشر الخلايا الكبيرة" هو مدى ندرة الخلايا الكبيرة التي يتم تحديدها عن طريق تحديد كمية امتصاص الدكستران الفلورسنت لكل خلية باستخدام التصوير المجهري19. تحقيقا لهذه الغاية ، يتم استخدام الصور المكتسبة لتحديد كمية الدكستران الداخلي عن طريق قياس شدة التألق الكلية أو المنطقة الإيجابية للتألق والعدد الإجمالي للخلايا كما هو محدد بواسطة تلطيخ DAPI. يمكن إجراء هذا التحليل باستخدام برامج معالجة وتحليل الصور مفتوحة المصدر ، مثل Cell Profiler أو FIJI / ImageJ ، كما هو موضح سابقا19,20. ومع ذلك ، عند العمل مع قارئ لوحة متعدد الأوضاع ، قد يتضمن البرنامج المقدم مع الأداة تطبيقات تحليل مدمجة يمكن استخدامها لأغراض حساب مؤشر macropinocytic. في بعض الحالات، قد لا يكون خط أنابيب تحليل البرامج المدمج واضحا تماما للمستخدم. لذلك يوصى بالتحقق من صحة البرنامج في مرحلة مبكرة بالمقارنة مع إجراء غير آلي ، مثل Cell Profiler أو FIJI / ImageJ. يمكن تكييف هذا البروتوكول مع أدوات برامج معالجة الصور وتحليلها الأخرى من خلال الالتزام بالتعليمات العامة التالية:
- بالنسبة إلى DAPI وصورة dextran المقابلة ، اطرح الخلفية عن طريق تطبيق الوظيفة المناسبة ، والتي تسمى في كثير من الأحيان دالة الكرة المتداولة. اضبط الإعدادات بحيث يتم تقليل ضوضاء الخلفية إلى الحد الأدنى من تأثير الطرح أو عدم وجود تأثير طرح على إشارة DAPI و dextran.
- باستخدام حقل يحتوي على إشارة ديكستران عالية، حدد إعدادات إشارة الكثافة، التي تسمى غالبا دالة العتبة، لتحديد النوى وتحديد إعداد إشارة الحد الأدنى للكثافة المطلوب لتحديد الماكروبينوسومات فقط.
- بالنسبة لصورة الدكستران، احسب إجمالي التألق ضمن تحديد macropinosome الذي تم إنشاؤه أو استخدم التحديد لتحديد المساحة الإجمالية الموجبة للدكستران.
- بالنسبة لصورة DAPI، استخدم التحديد لتحديد عدد النوى في الصورة لتعكس عدد الخلايا الموجودة.
- لتحديد مؤشر الخلايا الكبيرة، قسم إجمالي فلورة الدكستران أو المساحة على عدد الخلايا التي يحددها DAPI.
- كرر خطوات التحليل هذه لجميع الصور التي تم الحصول عليها والتي تطبق نفس الإعدادات الرقمية طوال الوقت.
- اتبع هذه الإرشادات لتحديد مؤشر الخلايا الكبيرة عند استخدام برنامج Gen5:
ملاحظة: تم التحقق من صحة خط أنابيب التحليل المدمج ولم يكتشف أي اختلافات في الحساب بالنسبة إلى فيجي/ImageJ (الشكل 6 ألف).- بعد اكتمال التصوير ، حدد صورة ذات مستوى عال من ندرة الخلايا الكبيرة. قم بإزالة إشارة الخلفية، وانقر فوق عملية (الشكل التكميلي 1A) وحدد خيار المعالجة المسبقة للصورة.
- بالنسبة لقناة dextran ، قم بإلغاء تحديد Auto واستخدم قطر كرة متدحرجة يبلغ 5 ميكرومتر ، وحدد أولويات النتائج الدقيقة وقم بتنعيم الصورة باستخدام دورة 1.
- بالنسبة لقناة DAPI ، استخدم المعالجة المسبقة التلقائية و 1 دورة سلسة. انقر فوق موافق وأضف خطوة المعالجة المسبقة للصورة إلى البروتوكول ؛ انقر فوق إضافة خطوة. بعد ذلك ، حدد الصورة المعالجة ضمن عرض الصورة (الشكل التكميلي 1B) وانقر فوق الزر تحليل (الشكل التكميلي 1C).
- ضمن إعدادات التحليل، قم بتعيين النوع إلى تحليل خلوي. حدد قناة DAPI وانقر على الخيارات (الشكل التكميلي 2A).
- بالنسبة للقناع الأساسي، باستخدام صورة DAPI المعالجة، قم بإنشاء قناع لتحديد نوى واحدة. استخدم الخلفية المظلمة والخيار تلقائي . بالإضافة إلى ذلك ، حدد الإعدادات التي تسمح باختيار القناع للنوى المفردة وعند الانتهاء ، انقر فوق الزر تطبيق لتحديد ما إذا كان يتم تطبيق القناع بشكل مناسب.
ملاحظة: قد يعمل تنشيط خيارات تقسيم الكائنات الملامسة وملء الثقوب في الأقنعة بشكل أفضل لتحديد نوى واحدة. قد يلزم ضبط الحد الأدنى والحد الأقصى لأحجام الكائنات اعتمادا على خط الخلية ويتم تعيينها بشكل شائع في نطاق 5-40 ميكرومتر. يمكن تضمين كائنات الحافة الأساسية ، ويجب تحليل الصورة بأكملها. يمكن تطبيق شريط التمرير لضبط تحديد القناع على شدة الإشارة. - بعد ذلك ، قم بتطبيق قناع ثانوي لتحسين إعدادات تحديد البطريق الفلوري الماكروبينوسوم. استخدم دالة القياس داخل قناع ثانوي وقم بتوسيع القناع الأساسي بمقدار 40 ميكرومتر اعتمادا على حجم الخلايا.
- استخدم الدالة Threshold وطريقة Threshold in Mask لتحديد مناطق dextran الموجبة. انقر فوق تطبيق لتحديد ما إذا كانت الإعدادات يتم تطبيقها بشكل صحيح.
ملاحظة: لتحديد قيمة العتبة، استخدم أداة ملف تعريف خط العرض (الشكل التكميلي 2B) وارسم خطا فوق منطقة موجبة للدكستران (الشكل التكميلي 2C). استخدم الكثافة المقاسة لتحديد أفضل إعداد لإنشاء قناع يحدد الماكروبينوسومات ويستبعد إشارة الخلفية (الشكل التكميلي 2D). - بعد إنشاء أقنعة مناسبة لتحديد النوى والماكروبينوسومات، انقر فوق علامة التبويب المقاييس المحسوبة وحدد تحديد أو إنشاء مقاييس ذات أهمية على مستوى الكائن.
- أزل جميع المقاييس الموجودة وأضف المقاييس المتكاملة والمساحة لتحليل القناع الثانوي. انقر فوق موافق وحدد حساب وإظهار للمقاييس الجديدة. عند الانتهاء ، انقر فوق موافق وحدد إضافة STEP لإضافة التحليل والحسابات إلى البروتوكول.
- احفظ البروتوكول النهائي للاستخدام في المستقبل، وانقر فوق ملف وحفظ البروتوكول باسم.
- بعد الانتهاء من تحليل البيانات، حدد المقاييس ذات الأهمية وقم بتصدير البيانات لتحديد مؤشر الخلايا الكبيرة. حدد مؤشر الخلايا الكبيرة على النحو التالي:
تألق ديكستران لكل خلية = كائن Int_2[فلوروفور ديكستران]
مساحة ديكستران لكل خلية = كائن Area_2[فلوروفور ديكستران]
ملاحظة: بالنسبة للوحة ذات ال 24 بئرا ذات تنسيق أغطية ، تعكس المقاييس متوسط مؤشر macropinocytic لكل صورة. بدلا من ذلك ، يمكن حساب مؤشر macropinocytic يدويا للعينة بأكملها عن طريق قسمة مجموع "المنطقة" أو "التكامل" لجميع الصور على إجمالي "عدد الخلايا". الفرق بين هذه الأساليب في حساب مؤشر macropinocytic هو الحد الأدنى في معظم الإعدادات. بالنسبة لتنسيق الصفائح الدقيقة المكونة من 96 بئرا ، يتم حساب مؤشر الخلايا الكبيرة كمتوسط للعينة بأكملها. - احفظ بروتوكول التصوير والتحليل الآلي اللاحق. أعد استخدام البروتوكول للتجارب المستقبلية مع نفس الفلوروفورات.
ملاحظة: عند استخدام وظيفة التركيز البؤري التلقائي بالليزر، يجب إجراء فحص مرجعي جديد عند تحليل خط خلية مختلف نظرا لأن النوى والماكروبينوسومات ربما تكون موضعية في مستوى مختلف. في كل مرة يتم فيها إجراء تجربة جديدة باستخدام بروتوكول محدد مسبقا، يجب تحسين إعدادات التعرض لتلك التجربة.
6. إضافة العلاجات
يمكن دمج العلاجات الخلوية (الجزيئات الصغيرة ، والبيولوجيا ، وعوامل النمو ، والأيضات ، وما إلى ذلك) في أي مرحلة من مراحل البروتوكول ، وسيعتمد التوقيت الدقيق على أهداف وغايات الدراسة.
- قم بإعداد الخلايا كما في القسم 2.
- قبل إضافة العلاجات ذات الاهتمام مباشرة ، قم بإعداد العلاجات والضوابط المناسبة بضعف تركيزاتها النهائية في وسائط خالية من المصل. قم بإعداد العلاجات بحجم يساوي حجم عدد الآبار المكررة التي يتم تقييمها.
ملاحظة: بالنظر إلى الدور الذي يمكن أن تلعبه العوامل المفرزة في التحكم في الوظائف الخلوية ، قد يفضل تخفيف العلاجات ذات الأهمية في الوسائط المشروطة. لهذه الأغراض ، قد يكون من المفيد زرع أطباق إضافية ، مثل أطباق زراعة الخلايا 6 سم أو 10 سم ، عند إعداد الخلايا كما هو موضح في القسم 2 لتوليد الوسائط المشروطة لإعداد حلول العلاج. - دون إزالة الوسائط من البئر ، أضف حلا واحدا جيدا من محلول العلاج إلى كل بئر. رج الطبق لضمان الخلط المناسب. احتضان الخلايا لمقدار الوقت المطلوب.
- تابع مع القسم 3.
ملاحظة: عند إضافة الدكستران ، يؤدي استخدام الوسائط الجديدة إلى إزالة العلاجات المضافة ، مما قد يؤثر على مستوى ندرة الخلايا الكبيرة. لذلك ، قد يفضل إضافة الدكستران مباشرة إلى الآبار دون شفط أو بدلا من ذلك إعادة إضافة العلاجات أو إعادة استخدام الوسائط المشروطة لإعداد محلول الدكستران.
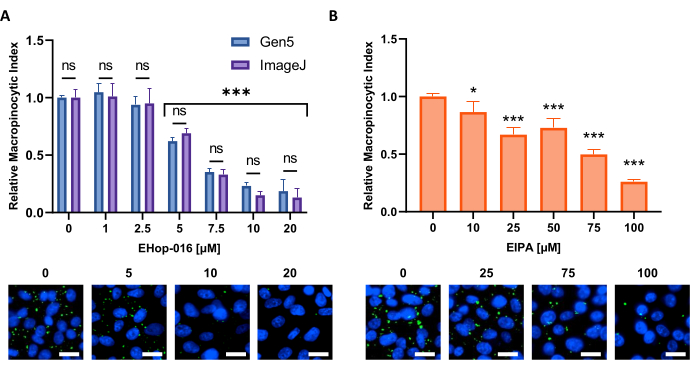
الشكل 6: إجراء منحنى استجابة الجرعة لمثبطات ندرة الخلايا الكبيرة. مثال على البيانات التي تم الحصول عليها عند اختبار مثبطات ندرة الخلايا الكبيرة المعروفة في خط خلية جديد. تم استخدام الخلايا PATU8998T لشكل الصفائح الدقيقة 96 جيدا وعولجت لمدة 2 ساعة و 30 دقيقة مع التركيزات المشار إليها من (A) EHop-16 و (B) EIPA ، على التوالي. لا تظهر مقارنة النتائج التي تم الحصول عليها من خلال تحليل الصور بواسطة برنامج Gen5 أو ImageJ أي اختلافات كبيرة بين النهجين كما هو موضح في ns في (A). شريط المقياس = 25 ميكرومتر. تظهر الرسوم البيانية الشريطية متوسط و SD لتجربة واحدة مع 4 نسخ متماثلة. تم تحديد الدلالة الإحصائية من خلال ANOVA أحادي أو ثنائي الاتجاه ، مقارنة بالحالات غير المعالجة. * ص < 0.05 ؛ ص < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
عندما يتم اتباع خطوات وتعديل البروتوكول الموصوف أعلاه وفقا لذلك ، يجب أن توفر النتائج التجريبية النهائية معلومات حول ما إذا كانت ظروف زراعة الخلايا المدروسة أو مثبطات تحفز أو تقلل من ندرة الخلايا الكبيرة في خط اهتمام الخلية. ولتعزيز صحة هذه النتائج، سيسمح إدراج شروط التحكم بالتدقيق في ال...
Discussion
تعتمد جودة التجارب والحصول على البيانات بشكل كبير على جودة الكواشف ، وتحسين الإعدادات ، ونظافة الأغطية والألواح الدقيقة. وينبغي أن تعطي النتائج النهائية الحد الأدنى من التباين بين النسخ المتماثلة؛ ومع ذلك ، فإن الاختلافات البيولوجية تحدث بشكل طبيعي أو قد تكون ناجمة عن عدد من العوامل. قد ?...
Disclosures
C.C. هو مخترع على براءة اختراع صادرة بعنوان "تشخيص السرطان والعلاجات واكتشاف الأدوية المرتبطة ب macropinocytosis" ، براءة الاختراع رقم: 9,983,194.
Acknowledgements
تم دعم هذا العمل من خلال منح NIH / NCI (R01CA207189 ، R21CA243701) إلى C.C. KMO.G. حاصل على جائزة زمالة ما بعد الدكتوراه TRDRP (T30FT0952). BioTek Cytation 5 هو جزء من Sanford Burnham Prebys Cell Imaging Core ، الذي يتلقى دعما ماليا من منحة دعم مركز NCI للسرطان (P30 CA030199). تم إنشاء الأشكال 1-3 باستخدام BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved