A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה וניתוח אוטומטיים לכימות של מקרופינומיסומים המסומנים בפלואורסצנטות
In This Article
Summary
בדיקות אוטומטיות באמצעות מיקרו-פלטות מרובות היטב הן גישות מועילות לזיהוי רגולטורים של מסלולים בכך שהן מאפשרות הערכה של מספר רב של תנאים בניסוי אחד. כאן, התאמנו את פרוטוקול ההדמיה והכימות של המקרופינום המבוסס היטב לפורמט מיקרו-לוחית של 96 בארות ומספקים מתאר מקיף לאוטומציה באמצעות קורא לוחות רב-מצבי.
Abstract
Macropinocytosis הוא מסלול ספיגה לא ספציפי של שלב הנוזלים המאפשר לתאים להפנים מטען חוץ-תאי גדול, כגון חלבונים, פתוגנים ופסולת תאים, באמצעות אנדוציטוזיס בתפזורת. מסלול זה ממלא תפקיד חיוני במגוון תהליכים תאיים, כולל ויסות תגובות חיסוניות וחילוף חומרים של תאים סרטניים. בהתחשב בחשיבות זו בתפקוד הביולוגי, בחינת תנאי תרבית התאים יכולה לספק מידע רב ערך על ידי זיהוי רגולטורים של מסלול זה ואופטימיזציה של תנאים להיות מועסקים בגילוי גישות טיפוליות חדשניות. המחקר מתאר טכניקת הדמיה וניתוח אוטומטית באמצעות ציוד מעבדה סטנדרטי וקורא לוחות רב-מצבי הדמיית תאים לכימות המהיר של האינדקס המקרופאינוציטי בתאים דבקים. השיטה האוטומטית מבוססת על ספיגת dextran פלואורסצנטי במשקל מולקולרי גבוה וניתן ליישם אותה על מיקרופלסטיק 96-well כדי להקל על הערכות של תנאים מרובים בניסוי אחד או דגימות קבועות המותקנות על כיסויי זכוכית. גישה זו נועדה למקסם את הרבייה ולהפחית את השונות הניסיונית תוך חיסכון בזמן וחסכוני.
Introduction
המסלול האנדוציטי הלא ספציפי של מקרופינוציטוזיס מאפשר לתאים להפנים מגוון רכיבים חוץ-תאיים, כולל חומרים מזינים, חלבונים, אנטיגנים ופתוגנים, באמצעות ספיגה בתפזורת של נוזל חוץ-תאי ומרכיביו1. למרות חשוב עבור הביולוגיה של סוגי תאים רבים, יותר ויותר, מסלול macropinocytosis מתואר לשחק תפקיד חיוני בביולוגיה של הגידול, שבו, באמצעות ספיגה macropinocytic, תאים סרטניים מסוגלים לשרוד ולהתרבות בנוכחות microenvironment מזין מדולדל2,3. ספיגת מקרומולקולות חוץ-תאיות, כולל אלבומין ומטריצה חוץ-תאית, ופסולת תאים נמקיים, מספקת מקור מזין חלופי לייצור ביומסה על ידי יצירת חומצות אמינו, סוכרים, שומנים ונוקלאוטידים באמצעות מקרופינוזה ו-lysosome בתיווך קטבוליזם מטען4,5,6,7,8.
האינדוקציה והרגולציה של מקרופינוציטוזה הם מורכבים ויכולים להשתנות בהתאם להקשר התאי. עד כה זוהו מספר ממריצים של מקרופינוציטוזיס וכוללים ליגנדים, כגון גורם גדילה אפידרמלי (EGF), גורם גדילה נגזר טסיות דם (PDGF), גלקטין-3, ו Wnt3A9,10,11,12,13. בנוסף, תנאי פולחן המחקים את microenvironment הגידול יכול לעורר את ההפעלה של המסלול. גידולי אדנוקרצינומה בלבלב (PDAC) סובלים ממחסור בחומרים מזינים, במיוחד עבור חומצת האמינו גלוטמין, הגורמת הן לתאים סרטניים והן לפיברובלסטים הקשורים לסרטן (CAFs) להסתמך על מקרופינוציטוזה להישרדות7,13,14,15. יתר על כן, לחצי גידול, כגון היפוקסיה ומתח חמצוני, יכול להפעיל את מסלול ניקוי זה16. בנוסף למשפיעים החיצוניים הרבים שיכולים לגרום למקרופאינוציטוזה, מגוון מסלולים תאיים שולטים בהיווצרות מקרופינום. טרנספורמציה אונקוגנית בתיווך ראס מספיקה כדי ליזום את המכונות המקרופינוציטיות, וסוגי סרטן מרובים מציגים מקרופינוציטוזיס מונחה ראס אונקוגני4,5,9,17. לחלופין, סוג פראי הפעלה ראס מסלולים עצמאיים ראס זוהו כדי להפעיל macropinocytosis בתאים סרטניים ו CAFs10,11,15,18. השימוש במודלים שונים של הפריה חוץ גופית בשילוב עם טיפולים מעכבים הביא לזיהוי של מספר אפננים macropinocytosis, הכוללים מחליפי נתרן-מימן, GTPase Rac1 קטן, זרחן phosphoinositide 3-קינאז (PI3K), קינאז מופעל p21 (Pak), וקינאז חלבון מופעל AMP (AMPK)4,13,15 . עם זאת, בהתחשב בשפע של גורמים ותנאים המתוארים המסדירים macropinocytosis, זה מתקבל על הדעת כי הרבה יותר אפננים וגירויים להישאר לא ידוע. זיהוי של אפננים וגירויים חדשניים יכול להיות קל על ידי הערכה אוטומטית של שפע של תנאים בניסוי אחד. מתודולוגיה זו יכולה לשפוך אור על הגורמים המעורבים בהיווצרות מקרופינום ועשויה לאפשר גילוי של מולקולות קטנות או ביולוגיות חדשניות המכוונות למסלול זה.
כאן, התאמנו את הפרוטוקול שלנו שהוקם בעבר לקביעת היקף המקרופאינוציטוזיס בתאי סרטן במבחנה לפורמט מיקרו-פלטה של 96 well והדמיה וכימות אוטומטיים19,20. פרוטוקול זה מבוסס על מיקרוסקופיה פלואורסצנטית, שהפכה לסטנדרט בתחום לקביעת מקרופינוציטוזיס במבחנה וב- vivo4,5,6,7,9,10,11,11,12,13,15,16,17,18, 19,20,21,22. ניתן להבחין בין מקרופינומיסומים למסלולים אנדוציטיים אחרים באמצעות יכולתם להפנים מקרומולקולות גדולות, כגון דקסטרן במשקל מולקולרי גבוה (כלומר, 70 kDa)2,3,4,20,20,21,22,23. לכן, מקרופינוזומים ניתן להגדיר באמצעות ספיגה של פלואורופור מנוהל מחוץ לתאים שכותרתו 70 kDa dextran. כתוצאה מכך, שלפוחיות מקרופינוציטיות מתבטאות כאשכולות תאיים של פונקטה פלואורסצנטית בגדלים הנעים בין 0.2-5 מיקרומטר. אלה puncta ניתן לדמיין מיקרוסקופי ולאחר מכן לכמת כדי לקבוע את מידת macropinocytosis בתא - "אינדקס macropinocytic".
בפרוטוקול זה מתוארים השלבים החיוניים להדמיית מקרופינומיסמים בתאים דביקים במבחנה על לוחית מיקרו-פלטה בת 96 well וכיסויים באמצעות ציוד מעבדה סטנדרטי (איור 1)." בנוסף, ההוראות להפוך את רכישת התמונה לאוטומטית וכימות האינדקס המקרו-פינוציטי באמצעות קורא לוחות מרובה מצבים הדמיה תא מסופקים. אוטומציה זו מפחיתה את הזמן, העלות והמאמץ בהשוואה לפרוטוקולים שתוארו בעבר19,20. בנוסף, הוא נמנע מרכישה וניתוח הדמיה מוטה בשוגג ובכך משפר את יכולת הרבייה והאמינות. שיטה זו יכולה להיות מותאמת בקלות לסוגי תאים שונים או קוראי לוחות או להיות מנוצלת כדי לקבוע תכונות מקרופינום חלופיות, כגון גודל, מספר ומיקום. השיטה המתוארת להלן מתאימה במיוחד לסינון של תנאי תרבית התא הגורמים macropinocytosis, זיהוי של אפננים חדשים, או אופטימיזציה של ריכוזי סמים של מעכבים ידועים.
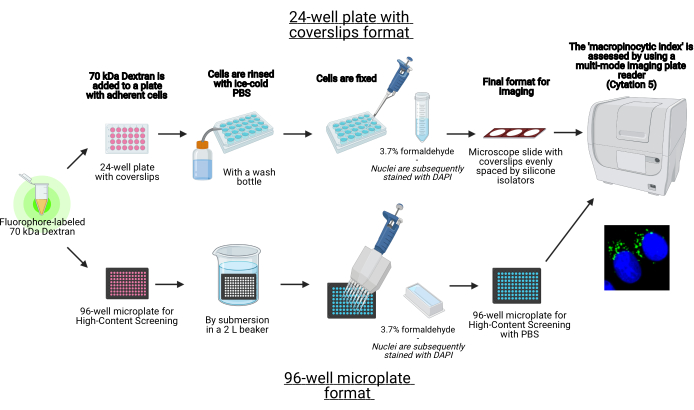
איור 1: סכמטי של הבדיקה האוטומטית כדי לקבוע את 'האינדקס המקרו-פינוציטי' בתאים דבקים. נוצר באמצעות BioRender. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. הכנת חומרים
- להמיס 70 kDa dextran מסומן עם FITC או tetramethylrhodamine (TMR) ב- PBS כדי לקבל פתרון 20 מ"ג / מ"ל. לאחסן את aliquots ב -20 °C (50 °F).
- יש להמיס את DAPI ב-ddH2O כדי לקבל פתרון של 1 מ"ג/מ"ל. לאחסן את aliquots ב -20 °C (50 °F).
זהירות: DAPI הוא מסרטן פוטנציאלי ויש לטפל בו בזהירות. - ביום הקיבעון, להכין טרי 3.7% פורמלדהיד כיתה ACS ב- PBS.
אזהרה: פורמלדהיד הוא חומר מסרטן קבוע וידוע והוא רעיל אם נשאף. הפוך את הפתרון במכסה המנוע אדים כימיים כדי למנוע שאיפה ולטפל בזהירות. - הכינו כיסויים שטופים בחומצה.
- השתמש בכוס 500 מ"ל ואמבט מים כדי לחמם 28 גרם של כיסויי זכוכית בורוסיליקט בקוטר 12 מ"מ ועובי #1.5 עבור 24 שעות ב 56 °C (56 °F) ב 100 מ"ל של 1 M HCl. לאטום את הכוס עם ניילון נצמד כדי למנוע אידוי נרחב.
זהירות: HCl היא חומצה חזקה כי הוא מאכל מאוד ולכן יש לטפל בזהירות ולהשתמש במכסה המנוע אדים כימיים כדי למנוע שאיפה. - לשטוף את כיסויים עם מים מזוקקים. חזור על הכביסה 4 פעמים. ואז לשטוף את כיסויים עם 95% אתנול. חזור על הכביסה 4 פעמים.
- יש לאחסן את כיסויי החומצה בצלחת תרבית תאים בטמפרטורת החדר לשימוש עתידי על ידי שמירה על סטריליות באמצעות טבילה ב-95% אתנול. לאטום את המנה עם parafilm כדי למנוע אידוי נרחב.
- השתמש בכוס 500 מ"ל ואמבט מים כדי לחמם 28 גרם של כיסויי זכוכית בורוסיליקט בקוטר 12 מ"מ ועובי #1.5 עבור 24 שעות ב 56 °C (56 °F) ב 100 מ"ל של 1 M HCl. לאטום את הכוס עם ניילון נצמד כדי למנוע אידוי נרחב.
2. הכנת תאים
- באמצעות צלחת תרבית רקמות משולבת 10 ס"מ עם התאים החסידים של עניין, לשאוף את התקשורת ולשטוף את התאים עם 5 מ"ל של DPBS, לפני המלחמה ב 37 °C (57 °F).
- נתק את התאים מהצלחת על ידי הוספת 1.5 מ"ל של טריפסין 0.25% טריפסין לפני המלחמה ודגרה בטמפרטורה של 37 מעלות צלזיוס.
הערה: זמן הדגירה טריפסין הנדרש כדי לנתק את התאים של עניין צריך להיות נחוש אמפירית והוא יכול להיות מאושר על ידי התבוננות ניתוק תחת מיקרוסקופ אור קונבנציונאלי. - לאסוף את התאים בצינור צנטריפוגה 15 מ"ל ולהוסיף 4.5 מ"ל של מדיה מלאה כדי להרוות את הטריפסין.
- גלולה את התאים על ידי צנטריפוגה במשך 3 דקות ב 200 x גרם ושאיפה את supernatant.
- Resuspend גלולה התא בנפח נאות של מדיה מלאה לפני המלחמה כדי לקבל השעיה תא יחיד עבור זריעה.
- המשך לזרוע את התאים על צלחת של 24 בארות עם כיסויים או תבנית מיקרו-לוחית של 96 בארות (איור 1).
הערה: יש לקבוע אמפירית את מספר התאים שיש לזרוע עבור כל קו תא, שכן שיעורי ההתפשטות והגודל משתנים בין שורות התאים. פרוטוקול זה עבר אופטימיזציה עבור תאים סרטניים דבקים עם 80% מפגש תאים ביום של תיוג מקרופינום. מפגש תאים עשוי להשפיע על היכולת המקרו-פינוציטית, ויש לקבוע זאת גם אמפירית.- צלחת 24-well עם פורמט כיסוי
- הוסיפו כיסויים לצלחת תרבית רקמות של 24 בארות, השתמשו במלקחיים כדי לאחוז במכת כיסוי אחת מאמבט האתנול. הקש על כיסוי על הקיר הפנימי של הצלחת כדי להסיר אתנול עודף ומניחים את כיסוי שטוח על החלק התחתון של באר.
- תן אתנול להתאדות ולשטוף את כיסוי 2 פעמים עם DPBS.
- זרע את התאים על גבי כיסוי על ידי הוספת 500 μL של השעיית התא לכל באר. מניחים את התאים בחממה של 37 °C עם 5% CO2 עד שמפגש התאים מגיע ל-60%-80% ביום שלפני תיוג מקרופינום.
- יום לפני תיוג מקרופינום, שאפו את המדיה מהבארות והוסיפו 500 μL של מדיה ללא סרום מראש לכל באר ומניחים את התאים בחממה של 37 °C עם 5% CO2 עבור 16-24 שעות.
הערה: בהתאם לתנאים שיש לחקור, מומלץ להשתמש במדיה ללא סרום כדי להפחית את ההשפעות של גורמי גדילה שיכולים לגרום למקרופאינוציטוזה ואשר נמצאים בדרך כלל בסרום. עם זאת, יש לקחת בחשבון כי רעב בסרום עשוי להשפיע על תהליכים תאיים אחרים, כגון התפשטות אוטופגיה. כמו סרום שיורית יכול להשפיע על היכולת macropinocytic של תאים, כמו גם פעילות מעכבת, הסרת סרום ניתן לשפר על ידי שטיפה עדינה של התאים 1 או 2 פעמים עם 500 μL של DPBS לפני המלחמה.
- תבנית מיקרו-לוחית של 96 בארות
- מעבירים את ההשעיה התאית למאגר ריאגנט של 25 מ"ל. באמצעות פיפטה רב ערוצית (8 או 12 ערוצים), זרע 100 μL של השעיית התא לכל באר של מיקרופלט הקרנה שחור 96-well-תוכן גבוה עם אולפין מחזורי ברור אופטית או זכוכית תחתונה.
- מניחים את התאים בחממה של 37 °C עם 5% CO2 עד שמפגש התאים מגיע ל-60%-80% ביום שלפני תיוג מקרופינום.
- יום לפני תיוג מקרופינום, הסר וזרוק את המדיה מכל באר באמצעות פיפטה רב-ערוצית (8 או 12 ערוצים) או מתאם שאיפה רב ערוצי לקבלת טיפים סטנדרטיים המחוברים למשאבת ואקום.
- באמצעות מאגר ריאגנט ופיפטה רב-ערוצית (8 או 12 ערוצים), הוסיפו בעדינות 100 μL של מדיה נטולת סרום לפני המלחמה לכל באר. מניחים את התאים בחממה של 37 °C עם 5% CO2 עבור 16-24 שעות.
הערה: בהתאם לתנאים שיש לחקור, מומלץ להשתמש במדיה ללא סרום כדי להפחית את ההשפעות של גורמי גדילה שיכולים לגרום למקרופאינוציטוזה ואשר נמצאים בדרך כלל בסרום. עם זאת, יש לקחת בחשבון כי רעב בסרום עשוי להשפיע על תהליכים תאיים אחרים, כגון התפשטות אוטופגיה. כמו סרום שיורית יכול להשפיע על היכולת macropinocytic של תאים, כמו גם פעילות מעכב, הסרת סרום ניתן לשפר על ידי שטיפה עדינה של התאים 1 או 2 פעמים עם 100 μL מראש DPBS.
- צלחת 24-well עם פורמט כיסוי
3. תיוג מקרופינום
- צלחת 24-well עם פורמט כיסוי
- שאפו את הבארות והוסיפו בחזרה 200 μL של מדיה ללא סרום עם 1 מ"ג / מ"ל פלואורופור שכותרתו משקל מולקולרי גבוה (70 kDa) dextran. מניחים את התאים בחממת תאים של 37 °C °C במשך 30 דקות.
הערה: בהתאם לתנאים שיש ללמוד, במקום להשתמש במדיה טרייה, שימוש חוזר במדיה המותנית לטעינת dextran עשוי להיות מועדף מכיוון שהוא יכיל גורמים מופרשים או משלימים, כגון EGF או תרכובות מעכבות, בהתאמה, שיכולים להשפיע על היכולת המקו-פינוציטית של התאים. - שאפו את המדיה ושטפו בעדינות אך במהירות את התאים 5 פעמים עם PBS קר כקרח באמצעות בקבוק כביסה מקורר מראש. לחצו בחוזקה את הצלחת ביד במהלך הכביסה כדי לסייע בהסרת אגרגטים דקסטרניים שנדבקים לכיסויים.
- לתקן את התאים על ידי הוספת 350 μL של 3.7% פורמלדהיד ודגרה במשך 20 דקות. לאחר מכן, לשאוף את פתרון הקיבעון ולשטוף את התאים עם PBS פעמיים.
- להכתים את הגרעינים עם 350 μL של 2 מיקרוגרם / מ"ל DAPI ב- PBS. לאחר 20 דקות, לשאוף את פתרון DAPI ולשטוף את התאים עם PBS שלוש פעמים.
- דבקו במבודדי סיליקון זה לצד זה בשקופית מיקרוסקופ כדי לקבל ריווח אחיד ולוקליזציה הניתנת לשחזור של כתמי הכיסוי, הנדרשים לאוטומציית הדמיה (איור 2A,B).
הערה: ניתן לאכלס את שקופית המיקרוסקופ כולה ב- 3 מבודדים בסך הכל. - עבור כל משטח כיסוי, הוסיפו טיפה של מדיית הרכבה פלואורסצנטית מתקשה במגלשת המיקרוסקופ בתוך המרחב הפתוח של המבודד (איור 2C). הרימו כיסוי באמצעות מלקחיים והסירו PBS עודף על ידי הקשה עדינה על הצד של כיסויים על מגבון ללא מוך.
- הניחו את כיסוי הכיסוי הפוך על טיפת המדיה המתלהמת (איור 2D). הקישו בעדינות על כיסוי הכיסוי באמצעות מלקחיים סגורים כדי להסיר בועות ממדיית ההרכבה (איור 2E).
- אחסן את השקופיות בסביבה חשוכה ואפשר למדיה ההרכבה להתייבש בטמפרטורת החדר, בדרך כלל לוקח 16-24 שעות. כעת ניתן לצלם שקופיות או לאחסן אותן בטמפרטורה של -20 °C (60 °F) למשך עד שבועיים.
- לפני הדמיה, הסר את המבודדים משוקופית המיקרוסקופ. תן למגלשות להשתוות לטמפרטורת החדר ולנקות את כיסויי הכיסוי באמצעות אפליקטור עם קצה כותנה רטוב עם מנקה זכוכית ללא אמוניה. לאחר מכן, השתמשו במוליך נקי עם קצה כותנה רטוב עם 70% אתנול לניקוי ולהשאיר את כיסוי הכיסוי יבש.
- שאפו את הבארות והוסיפו בחזרה 200 μL של מדיה ללא סרום עם 1 מ"ג / מ"ל פלואורופור שכותרתו משקל מולקולרי גבוה (70 kDa) dextran. מניחים את התאים בחממת תאים של 37 °C °C במשך 30 דקות.
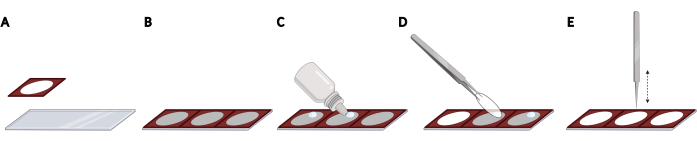
איור 2: הצבת כיסויים על שקופית מיקרוסקופ עם מבודדי סיליקון. (A) מבודדי סיליקון נלחצים ונדבקים לשקופית מיקרוסקופ. (ב) ניתן לאכלס את שקופית המיקרוסקופ כולה ב- 3 מבודדים בסך הכל, וכתוצאה מכך ניתן למרווח זוגי ולוקליזציה הניתנת לשחזור של כתמי הכיסוי. (ג) עבור כל כיסוי, הוסף טיפה של מדיית הרכבה פלואורסצנטית על שקופית המיקרוסקופ בתוך המרחב הפתוח של המבודד. (D) באמצעות מלקחיים, הרימו כיסוי מהצלחת בת 24 הבאר והניחו אותה הפוכה על טיפת המדיה המתעצמת. (ה) כאשר קיימות בועות בין כיסוי הכיסוי לשקופית המיקרוסקופ, הקש בעדינות על כיסוי הכיסוי באמצעות מלקחיים סגורים כדי להסיר בועות. נוצר באמצעות BioRender. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תבנית מיקרו-לוחית של 96 בארות
- שאפו את הבארות באמצעות מתאם שאיפה רב-ערוצי המחובר לוואקום והוסיפו 40 μL של מדיה ללא סרום עם 1 מ"ג / מ"ל פלואורופור בעל תווית של משקל מולקולרי גבוה (70 kDa) dextran בחזרה לבארות. לדגור את התאים בחממה תא 37 °C (37 °F) במשך 30 דקות.
הערה: בהתאם לתנאים שיש ללמוד, במקום להשתמש במדיה טרייה, שימוש חוזר במדיה המותנית לטעינת dextran עשוי להיות מועדף מכיוון שהוא יכיל גורמים מופרשים או משלימים, כגון תרכובות EGF או מעכבים, בהתאמה שיכולים להשפיע על היכולת המקרפינוציטית של התאים. - השליכו את המדיה במיקרו-לוחית על-ידי הבהוב ידני של הצלחת לכדי ריקה של 5 ליטר (איור 3A).
- שטפו את התאים במיקרו-לוחית על ידי טבילה איטית של הצלחת אנכית, בזווית קלה, לכוס 2 ליטר מלאה ב-PBS קר כקרח (איור 3B) ולאחר מכן השליכו את ה-PBS במיקרו-לוחית על ידי הבהוב הצלחת הפוך לכוס 5 L (איור 3C). חזור על הפעולה 2 פעמים.
הערה: תאים הנצמדים בצורה חלשה למיקרו-לוחית ההדמיה עשויים להתנתק במהלך תהליך זה. במידת הצורך, ניתן גם לשאוף בארות עם מתאם שאיפה רב ערוצית או לשטוף בעדינות רבה יותר עם PBS באמצעות פיפטה רב ערוצית. עיבוד לוחית אחת של 96 בארות תדרוש כ-2 ליטר של PBS קר כקרח. אם יש לנתח צלחות נוספות, השתמש בכוס גדולה יותר, והוסף 1 L של PBS קר כקרח עבור כל צלחת נוספת או לרענן את PBS קר כקרח לפי הצורך. - לאחר סילוק ה-PBS מהשטיפה האחרונה, תקן את התאים למשך 20 דקות בטמפרטורת החדר על ידי הוספת 100 μL של 3.7% פורמלדהיד ב-PBS לכל באר באמצעות מאגר ריאגנט של 25 מ"ל ופיפטה רב-ערוצית (איור 3D).
- הסר את פתרון הקיבעון ולשטוף את התאים עם PBS פעמיים באמצעות טכניקת שקיעה והבהוב. להכתים את הגרעינים עם 100 μL של 2 מיקרוגרם / מ"ל DAPI ב PBS לכל באר.
- לאחר 20 דקות, לשטוף את התאים שלוש פעמים עם PBS קר כקרח באמצעות טכניקת טבילה והבהוב המתואר לעיל (שלב 3.2.3). הסר כל שאריות PBS על ידי הקשה על המיקרו-לוחית הפוכה על מגבון ללא מוך והוסף 100 μL של PBS טרי לכל באר באמצעות מאגר ריאגנט 25 מ"ל ופיפטה רב ערוצית. דמיינו את התאים עכשיו או אחסנו אותם מכוסים מאור בטמפרטורה של 4 מעלות צלזיוס למשך עד שבוע.
הערה: לחלופין, פתרון של גליצרול ב-PBS (במקום PBS) יכול לשמש להדמיה ואחסון כדי לייצב טוב יותר את הפלואורסצנטיות (איור 4A). - לפני ההדמיה, תן לצלחת להשתוות לטמפרטורת החדר. נגב את המיקרו-לוחית יבשה עם מגבון ללא מוך.
- שאפו את הבארות באמצעות מתאם שאיפה רב-ערוצי המחובר לוואקום והוסיפו 40 μL של מדיה ללא סרום עם 1 מ"ג / מ"ל פלואורופור בעל תווית של משקל מולקולרי גבוה (70 kDa) dextran בחזרה לבארות. לדגור את התאים בחממה תא 37 °C (37 °F) במשך 30 דקות.
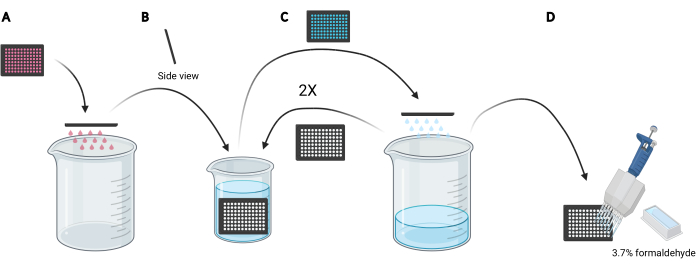
איור 3: שטיפה של המיקרו-לוחית בת 96 הבאר כדי להתכונן לקיבעון. (א) רוקן את המיקרו-לוחית של המדיה לכוס 5 L על-ידי הבהוב ידני. (B) אנכית ובזווית קלה, הטביעו באיטיות את המיקרו-לוחית בכוס 2 ליטר מלאה ב-PBS קר כקרח. (ג) רוקן את המיקרו-לוחית של PBS לתוך 5 L על-ידי הבהוב ידני. חזור על שלבי הכביסה כמתואר ב - B פעמיים. (D) לאחר ריקון ה- PBS במיקרו-לוחית בפעם האחרונה, הוסף 100 μL 3.7% פורמלדהיד לבארות, באמצעות פיפטה רב ערוצית. נוצר באמצעות BioRender. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. הדמיית מקרופינום אוטומטית
תמונות של מקרופינוזומים ניתן ללכוד באמצעות מיקרוסקופ פלואורסצנטי סטנדרטי, כפי שתואר בעבר 19,20. עם זאת, הליך כזה ניתן לשפר במונחים של יעילות באמצעות אוטומציה, במיוחד בעת הערכת תנאים רבים שונים של תרבית התא. אוטומציה של רכישת תמונה יכולה להתבצע באמצעות קורא לוחות מרובה מצבים הדמיה תא, אשר מקטין את המאמץ על ידי הפחתת הליכי טיפול, וחשוב מכך, מגביר את רבייה ואמינות נתונים על ידי רכישת תמונות בצורה לא משוחדת. מערכות הדמיה מרובות זמינות מסחרית, והכיוונים יהיו שונים בין מכשירים. כאן, רכישת תמונות באמצעות Cytation 5 מתואר. עם זאת, ניתן להתאים את הפרוטוקול שלהלן לכל מכשיר בודד על ידי דבקות בהנחיות הבאות:
- צור פרוטוקול אוטומציה כדי לרכוש את התמונות עם מטרת אוויר 40x בערוץ אורך הגל של פלואורופור dextran (FITC / TMR) ו- DAPI.
הערה: מעכב macropinocytosis נפוץ EIPA מציג autofluorescence בערוץ FITC, במיוחד כאשר נרגש בעבר בערוץ DAPI. תרכובות אחרות שנבדקות עשויות גם להציג זרם אוטומטי. כדי לעקוף בעיה זו, הגדרת רכישת התמונה שתתרחש תחילה בערוץ עם אורך הגל של עירור הגבוה ביותר (FITC/TMR) ושנית בערוץ DAPI מסייעת למנוע התרחשות זו. - מטב את הגדרות החשיפה באמצעות מדגם הצפוי להיות ברמה הגבוהה ביותר של macropinocytosis כדי למנוע חשיפת יתר, אשר עלול לגרום לרוויה של האות ואובדן נתוני אינטנסיביות. השתמש בהגדרות מיקוד המאתרות את המדגם בקלות ובעקביות כדי להפיק תמונות באיכות גבוהה.
- השג תמונות מרובות על פני כל באר או כיסוי כדי להסביר את השונות המדגם ולקבל ייצוג מדויק של המדגם.
- לאחר קביעת הגדרות ההדמיה, השתמש באותן הגדרות עבור כל דגימה בניסוי.
- בצע את ההוראות הבאות לרכישת תמונה מקרופינום בעת שימוש בתוכנת Cytation 5 ו- Gen5:
- צלחת 24-well עם פורמט כיסוי
- הפעל את קורא הלוחות והכנס את שקופיות המיקרוסקופ הפוך באמצעות מחזיק השקופיות.
- פתח את קורא המיקרו-פלטה ואת תוכנת ההדמיה, צור פרוטוקול חדש על-ידי לחיצה על פרוטוקולים וצור חדש. לחץ פעמיים על שגרה ובחר את סוג הצלחת.
הערה: אם סוג הלוח אינו זמין, הוסף את סוג הלוח לתוכנה על-ידי לחיצה על סוגי לוחות > מערכת > הוסף צלחת, ושימוש במידות הלוח כפי שסופקו על-ידי היצרן. לנוחות השימוש, התבנית עבור שתי שקופיות מיקרוסקופ עם שלושה כיסויים מרווחים באמצעות מבודדי הסיליקון מסופקת בקובץ משלים 1. - כדי לגשת להגדרות ההדמיה, בחרו ' פעולות > תמונה > תמונה הפוכה' ולחצו על 'אישור'. השתמש במטרה שלב 40x, PL FL עם FOV רחב ומיקוד אוטומטי Binning.
- עבור הערוץ הראשון, בחר את קוביית ה- LED המתאימה לתווית הפלואורופור של dextran (GFP או RFP). בטלו את לחיצה על 'חשיפה אוטומטית ' ולחצו על לחצן סמל המיקרוסקופ כדי למטב את הגדרות החשיפה. לאחר קביעת הגדרות החשיפה המתאימות, לחץ על שמור הגדרות.
הערה: התאם את הגדרות החשיפה באמצעות מדגם הצפוי להיות ברמה הגבוהה ביותר של macropinocytosis כדי למנוע חשיפת יתר של תמונות, אשר יכול לגרום לרוויה של האות ואובדן נתוני אינטנסיביות. - חזור על השלב הקודם עבור הערוץ השני באמצעות קוביית DAPI LED.
- הגדר את הגדרות המיקוד האוטומטי עבור כל ערוץ פלואורסצנטיות, בחר אפשרויות מיקוד. בטל את הבחירה בשיטת המיקוד המוגדרת כברירת מחדל והשתמש במיקוד אוטומטי עם סריקה אופציונלית ומיקוד אוטומטי ללא סריקה אופציונלית עבור ערוץ dextran-fluorophore ו- DAPI, בהתאמה. לחץ על אישור כדי לשמור את ההגדרות.
הערה: ניתן להפחית את מרחק הסריקה ל-200 מיקרומטר ולהגדיל את ההפרש ל-20 מיקרומטר כדי להגביר את יעילות המיקוד האוטומטי. הסריקה האופציונלית נדרשת למיקוד אוטומטי הולם בדגימות בעלות פלואורסצנטיות נמוכה. זה קורה בדרך כלל בעת ניתוח תנאים עם macropinocytosis נמוך, כגון כאשר macropinocytosis מעוכב או לא נוכח מטבעו. - השתמש באפשרות הגדרת משואות כדי להפוך את רכישת התמונות לאוטומטית באזורים שונים של כיסוי הכיסוי. לחץ על סמל המיקרוסקופ והוסף משואות על-ידי לחיצה בחלון התמונה והזזת הבמה לאזור הבא. לאחר בחירת מספר האזורים המתאים, עבור אל נקודת הכיסוי הבאה וחזור על התהליך. כדי לסיים, לחץ על שמור הגדרות.
הערה: כדי לקבל ייצוג טוב של מקרופינוציטוזה על פני המדגם, בחר כ-20 משואות המופצות באופן שווה על-פני כיסוי הכיסוי (איור 4B). ניתן להשתמש בפחות משואות, אך ייתכן שיהיה צורך להוציא תמונות מסוימות מניתוח תמונה לאחר הרכישה עקב פערי איכות, כגון כאשר התמונה אינה ממוקדת או מכילה בועות או כתמים פלואורסצנטיים וכתמים. - כדי להשלים את התאמת הגדרות ההדמיה, לחץ על אישור. כדי לדמות את כתמי הכיסוי, בחר צור ניסוי חדש וקרא כעת מתוך כלי הפרוטוקול. שמור את הפרוטוקול ואת הניסוי כאשר תתבקש לעשות זאת.
- צלחת 24-well עם פורמט כיסוי
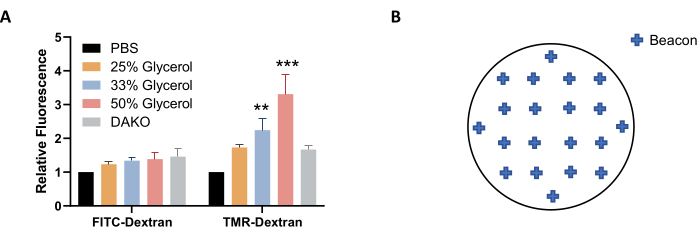
איור 4: מיטוב התנאים לרכישת תמונה. (A) הגדלת ריכוז הגליצרול מגבירה את הפלואורסצנטיות של TMR-dextran, כפי שנקבע בתאי AsPC-1 שטופלו ב-EGF. (ב) קואורדינטות לדוגמה של משואות הדמיה לרכישת תמונה אוטומטית בעת שימוש בלוח 24-well עם תבנית כיסוי. גרף העמודות מציג את הפלואורסצנטיות היחסית הממוצעת עם SEM של 5 ניסויים. מובהקות סטטיסטית נקבעה על ידי ANOVA דו-כיוונית, ביחס ל- PBS. ** עמ' < 0.01; עמ' < 0.001. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תבנית מיקרו-לוחית של 96 בארות
- הפעל את קורא הלוחות והכנס את המיקרו-לוחית.
- פתח את קורא המיקרו-פלטה ואת תוכנת ההדמיה, צור פרוטוקול חדש על-ידי לחיצה על פרוטוקולים וצור חדש. לחץ פעמיים על שגרה ובחר את סוג הצלחת.
הערה: אם סוג הלוח אינו זמין, הוסף את סוג הלוח לתוכנה על-ידי לחיצה על סוגי לוחות > מערכת > הוסף צלחת, ושימוש במידות הלוחות כפי שסופקו על-ידי היצרן. כדי להקל על השימוש, התבנית עבור CellCarrier-96 Ultra Microplates מ PerkinElmer מסופק קובץ משלים 2. - כדי לגשת להגדרות ההדמיה, בחר פעולות > תמונה > Imager הפוך ולחץ על אישור. השתמש במטרה שלב PL FL 40x עם FOV רחב ומיקוד אוטומטי Binning.
- עבור הערוץ הראשון, בחר את קוביית ה- LED המתאימה לתווית הפלואורופור של dextran (GFP או RFP). בטלו את לחיצה על 'חשיפה אוטומטית ' ולחצו על לחצן סמל המיקרוסקופ כדי למטב את הגדרות החשיפה. לאחר קביעת הגדרות החשיפה המתאימות, לחץ על שמור הגדרות.
הערה: במהלך המיטוב של הגדרות החשיפה, הלבנת פלואורסצנטיות משמעותית יכולה להתרחש. הדבר עלול לגרום להגדרות הגורמות לחשיפת יתר בעת הדמיית שדה חדש. לכן, אמת את הגדרות החשיפה על-ידי בדיקת שדה שטרם נחשף והבטחה כי לא מתרחשת רוויה של האות בהגדרות שנבחרו. אין לכלול את הבארות המשמשות לאופטימיזציה של הגדרת החשיפה בכימות המקרופינום, שכן הפלואורסצנטיות ירדה כתוצאה מהלבנה במהלך האופטימיזציה. התאם את הגדרות החשיפה באמצעות מדגם הצפוי להיות ברמה הגבוהה ביותר של macropinocytosis כדי למנוע תמונות חשיפת יתר, אשר יכול לגרום לרוויה של האות ואובדן נתוני אינטנסיביות. - חזור על השלב הקודם עבור הערוץ השני באמצעות קוביית DAPI LED.
- הגדר את הגדרות המיקוד האוטומטי עבור כל ערוץ פלואורסצנטיות, בחר אפשרויות מיקוד. בטלו את הבחירה בשיטת המיקוד המוגדרת כברירת מחדל והשתמשו במיקוד אוטומטי בלייזר. לכוד סריקת ייחוס לאחר קביעת מישור המוקד להדמיה אופטימלית של מקרופינוזומים וגרעינים. לחץ על אישור כדי לשמור את ההגדרות.
הערה: ניתן להפחית את מרחק הסריקה ל-400 מיקרומטר ולהגדיל את ההפרש ל-3 מיקרומטר כדי להגביר את יעילות המיקוד האוטומטי. כדי שהאפשרות למיקוד אוטומטי בלייזר תפעל כראוי, נקו את תחתית הצלחת, יבשו ונגבו את הצלחת עם מגבון ללא מוך לפני ההדמיה. המיקוד האוטומטי בלייזר הוא שיטה מעולה למיקוד מכיוון שהוא דורש זמן מינימלי כדי למצוא את מישור המוקד. ניתן להשתמש בשיטות מיקוד אחרות, אך מכיוון שלא נוספה אנטי-עמעום לבארות, שיטות אלה עלולות לגרום להלבנה משמעותית של הדגימות אשר ישפיעו לרעה על איסוף הנתונים. - הגדר את ההיסט האופקי והאנכי לאפס ותחת תמונה בודדת בחר מונטאז' ללא חפיפה והשתמש ב- 3 x 3 תמונות, בהתאם למספר התאים הרצויים להיכלל בניתוח.
הערה: בהתאם לגודל ולצפיפות של התאים, פחות או יותר תמונות ניתן לקחת כדי לקבל הערכה מייצגת של macropinocytosis לאורך המדגם. בהערכת מקרופינוציטוזה בתאי AsPC-1 או MIA PaCa-2 בתנאים משתנים, לא נצפים הבדלים בפרשנות הנתונים בין מסגרת תמונה של 2 x 2 x 2 או 4 x 4, אם כי ניתן להבחין בווריאציה בין דגימות משוכפלות עשויה לגדול בעת צילום פחות תמונות (איור 5A,B). הגדלה או הקטנה של גודל המסגרת תשפיע על הזמן שלוקח לסרוק את הצלחת. בהתאם לזמן החשיפה, מיקרו-לוחית מלאה של 96 well תיקח בערך 1-1.5 שעות כדי לסרוק לחלוטין באמצעות מסגרת 3 x 3. מסגרת של 2 x 2 ו-4 x 4 תחצה או תכפיל את הזמן הזה, בהתאמה. - כדי להשלים את התאמת הגדרות ההדמיה, לחץ על אישור.
- כדי לדמות את הלוחה, בחר צור ניסוי חדש וקרא כעת מתוך כלי הפרוטוקול. שמור את הפרוטוקול ואת הניסוי כאשר תתבקש לעשות זאת.
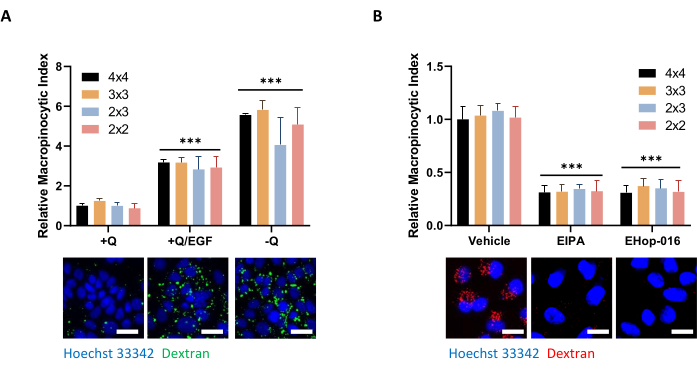
איור 5: תנאי בקרה להערכת מקרופינוציטוזה בתאי PDAC. (A) תאי AsPC-1 מציגים מקרופינוציטוזה בתגובה לגירוי EGF של 100 ננוגרם/מ"ל למשך 5 דקות או חסך גלוטמין למשך 24 שעות. לרכישת תמונות, מסגרות תמונה של 4 x 4, 3 x 3, 2 x 3 או 2 x 2 צולמו כדי לקבוע את ההשפעה של מספר התמונות על איכות הנתונים. (B) תאי MIA PaCa-2 מראים מקרופינוציטוזה מכוננת המעכבת על ידי טיפול של 30 דקות עם 75 מיקרומטר EIPA או טיפול 2 שעות עם 10 מיקרומטר EHop-016. מסגרות תמונה צולמו כמו ב - A. סרגל קנה מידה = 25 מיקרומטר. תרשימי עמודות מציגים את האינדקס המקרופינוציטי היחסי הממוצע עם SD של ניסוי 1 עם 4 שכפולים. המשמעות הסטטיסטית נקבעה על ידי ANOVA דו-כיווני ביחס למצב +Q או רכב. p < 0.001 אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. קביעת האינדקס המקרו-פינוציטי
'אינדקס macropinocytic' הוא היקף macropinocytosis הסלולר שנקבע על ידי כימות ספיגת dextran פלואורסצנטית לכל תא באמצעות הדמיה מיקרוסקופית19. לשם כך, התמונות שנרכשו משמשות כדי לקבוע את כמות ה- dextran המופנמת על-ידי מדידת עוצמת הפלואורסצנטיות הכוללת או האזור החיובי לפלואורסצנטיות ואת המספר הכולל של תאים כפי שנקבעו על-ידי כתמי DAPI. ניתוח זה יכול להתבצע באמצעות תוכנת עיבוד וניתוח תמונה בקוד פתוח, כגון Profiler תא או FIJI / ImageJ, כפי שתואר בעבר 19,20. עם זאת, בעת עבודה עם קורא לוחות מרובה מצבים התוכנה המסופקת עם המכשיר עשויה לכלול יישומי ניתוח מובנים שניתן להשתמש בהם לצורך חישוב האינדקס המקו-פינוציטי. במקרים מסוימים, ייתכן שצבר ניתוח התוכנה המובנה לא יהיה ברור לחלוטין למשתמש. לכן מומלץ לאמת את התוכנה בשלב מוקדם בהשוואה להליך לא אוטומטי, כגון מאבחן תאים או FIJI / ImageJ. ניתן להתאים פרוטוקול זה לכלי תוכנה אחרים לעיבוד וניתוח תמונה על-ידי דבקות בהוראות הכלליות הבאות:
- עבור ה- DAPI ותמונת dextran המתאימה, הפחת את הרקע על-ידי החלת הפונקציה המתאימה, הנקראת לעתים קרובות פונקציית הכדור המתגלגל. התאם את ההגדרות כך שרעשי הרקע ימוזערו ויהיה אפקט חיסור מינימלי עד אפסי ב- DAPI ובאות dextran.
- באמצעות שדה עם אות dextran גבוה, לקבוע את הגדרות אות העוצמה, המכונה לעתים קרובות פונקציית הסף, כדי לבחור את הגרעינים ולקבוע את הגדרת האות בעוצמה המינימלית הנדרשת כדי לבחור רק את המקרופאינוזומים.
- עבור תמונת dextran, חשב את הפלואורסצנטיות הכוללת בתוך בחירת המקרופאינום שנוצרה או השתמש בבחירה כדי לקבוע את האזור החיובי הכולל עבור dextran.
- בתמונת DAPI, השתמשו בבחירה כדי לקבוע את מספר הגרעינים בתמונה כדי לשקף את מספר התאים הקיימים.
- כדי לקבוע את האינדקס המקרופאינוציטי, חלק את הפלואורסצנטיות או האזור הכוללים של dextran במספר התאים שנקבעו על-ידי DAPI.
- חזור על שלבי ניתוח אלה עבור כל התמונות שנרכשו המחילים את אותן הגדרות מספריות לאורך כל הדרך.
- בצע את ההוראות הבאות לקביעת האינדקס המקרו-פינוציטי בעת שימוש בתוכנת Gen5:
הערה: צינור הניתוח המובנה אומת ולא זוהה הבדלים בחישוב ביחס לפיג'י/ImageJ (איור 6A).- לאחר השלמת ההדמיה, בחר תמונה עם רמה גבוהה של מקרופינוציטוזה. הסירו את אות הרקע, לחצו על 'תהליך' (איור משלים 1A) ובחרו באפשרות 'עיבוד מראש של תמונה'.
- עבור ערוץ dextran, בטלו את הבחירה באפשרות 'אוטומטי' והשתמשו בקוטר כדור מתגלגל של 5 מיקרומטר, תעדפו תוצאות עדינות והחליקו את התמונה במחזור אחד.
- עבור ערוץ DAPI, השתמש בעיבוד מקדים אוטומטי ובמחזור חלק אחד. לחץ על אישור והוסף את שלב העיבוד המקדים של התמונה לפרוטוקול; לחץ על הוסף שלב. לאחר מכן, בחרו בתמונה המעובדת תחת הפריסה של התמונה (איור משלים 1B) ולחצו על הלחצן 'נתח ' (איור משלים 1C).
- תחת הגדרות ניתוח, הגדר את הסוג לניתוח סלולרי. בחרו בערוץ DAPI ולחצו על 'אפשרויות' (איור משלים 2A).
- למסיכה הראשית, באמצעות תמונת DAPI המעובדת, צרו מסיכה לבחירת גרעינים בודדים. השתמש ברקע הכהה ובאפשרות אוטומטי . בנוסף, קבע אילו הגדרות מאפשרות בחירת מסיכה של גרעינים בודדים וכאשר סיים, לחץ על לחצן החל כדי לקבוע אם המסיכה מוחלת כראוי.
הערה: הפעלת האפשרויות 'פיצול נגיעה' ו'חורי מילוי במסכות ' עשויה לפעול בצורה הטובה ביותר לבחירת גרעינים בודדים. ייתכן שיהיה צורך להתאים את גודל האובייקט המינימלי והמקסימלי בהתאם לקו התא והם מוגדרים בדרך כלל בטווח של 5-40 מיקרומטר. ניתן לכלול אובייקטי קצה ראשי , ויש לנתח את התמונה כולה. ניתן להחיל את המחוון כדי להתאים את בחירת המסיכה לעוצמת האות. - לאחר מכן, החל מסיכה משנית כדי למטב את ההגדרות לבחירת הסימון הפלואורסצנטי המקרופינוזי. השתמשו בפונקציה 'מדידה בתוך מסיכה משנית' והרחיבו את המסיכה הראשית ב-40 מיקרומטר בהתאם לגודל התאים.
- השתמש בפונקציה Threshold ובפעולת השירות Threshold in Mask כדי לבחור את אזורי ה- dextran החיוביים. לחץ על החל כדי לקבוע אם ההגדרות מוחלות כראוי.
הערה: כדי לקבוע את ערך הסף, השתמשו בכלי 'הצג פרופיל קו ' (איור משלים 2B) ושרטטו קו מעל אזור חיובי לדקסטרן (איור משלים 2C). השתמשו בעוצמה הנמדדת כדי לקבוע את ההגדרה הטובה ביותר ליצירת מסיכה שבוחרת מקרופינוזומים ולא כוללת אות רקע (איור 2D משלים). - לאחר יצירת מסיכות מתאימות לבחירת גרעינים ומקרופינומים, לחץ על הכרטיסיה מדדים מחושבים ובחר בחר או צור מדדים ברמת האובייקט.
- הסר את כל המדדים הקיימים והוסף את המדדים אינטגרל ואזור לניתוח המסיכה המשנית. לחץ על אישור ובחר חשב והצג עבור המדדים החדשים. בסיום, לחץ על אישור ובחר הוסף שלב כדי להוסיף את הניתוח והחישובים לפרוטוקול.
- שמור את הפרוטוקול הסופי לשימוש עתידי, לחץ על קובץ ושמירה פרוטוקול בשם.
- לאחר סיום ניתוח הנתונים, בחר את מדדי הריבית וייצא את הנתונים כדי לקבוע את האינדקס המקרו-פינוציטי. קבע את האינדקס המקרו-פינוציטי כדלקמן:
פלואורסצנטיות Dextran לכל תא = אובייקט Int_2[פלואורופור Dextran]
אזור Dextran לכל תא = אובייקט Area_2[פלואורופור Dextran]
הערה: עבור לוחית 24 באר עם תבנית כיסוי, המדדים משקפים את הממוצע של האינדקס המקרו-פינוציטי הממוצע לתמונה. לחלופין, ניתן לחשב את האינדקס המקרופינוציטי באופן ידני עבור המדגם כולו על-ידי חלוקת סכום 'האזור' או 'אינטגרל' עבור כל התמונות לפי 'ספירת התאים' הכוללת. ההבדל בין גישות אלה בחישוב האינדקס המקרו-פינוציטי הוא מינימלי ברוב ההגדרות. עבור תבנית המיקרו-לוחית של 96 well, האינדקס המקרופינוציטי מחושב כממוצע עבור המדגם כולו. - שמור את הפרוטוקול להדמיה ואת הניתוח האוטומטי הבא. השתמש שוב בפרוטוקול לניסויים עתידיים עם אותם פלואורופורים.
הערה: בעת שימוש בפונקציית המיקוד האוטומטי בלייזר, יש לבצע סריקת ייחוס חדשה כאשר יש לנתח קו תאים אחר מכיוון שגרעינים ומקרופינומים עשויים להיות מותאמים למישור אחר. בכל פעם שניסוי חדש מבוצע באמצעות פרוטוקול שנקבע בעבר, יש למטב את הגדרות החשיפה לניסוי זה.
6. הוספת טיפולים
טיפולים בתאים (מולקולות קטנות, ביולוגיה, גורמי גדילה, מטבוליטים וכו ') ניתן לשלב בכל שלב של הפרוטוקול, ואת העיתוי המדויק יהיה תלוי המטרות והמטרות של המחקר.
- הכן את התאים כמו בסעיף 2.
- רגע לפני הוספת הטיפולים המעניינים, הכינו את הטיפולים ואת הבקרות המתאימות בריכוזים הסופיים הכפולים שלהם במדיה נטולת סרום. הכן את הטיפולים בנפח השווה לנפח של מספר בארות לשכפל מוערך.
הערה: בהתחשב בתפקיד שגורמים מופרשים יכולים למלא בשליטה על תפקודים תאיים, ניתן להעדיף לדלל את הטיפולים המעניינים במדיה מותנית. למטרות אלה, זה עשוי להיות מועיל לזרוע צלחות נוספות, כגון 6 ס"מ או 10 ס"מ מנות תרבית התא, בעת הכנת תאים כמתואר בסעיף 2 כדי ליצור את המדיה המותנית להכנת פתרונות הטיפול. - מבלי להסיר את המדיה מהבאר, להוסיף אחד נפח היטב של פתרון טיפול לכל באר. לנער את הצלחת כדי להבטיח ערבוב נכון. לדגור על התאים למשך הזמן הרצוי.
- המשך עם סעיף 3.
הערה: בעת הוספת dextran, השימוש במדיה טרייה גורם להסרת הטיפולים הנוספים, אשר עשוי להשפיע על רמת macropinocytosis. לכן, ניתן להעדיף להוסיף dextran ישירות לבארות מבלי לשאוף או לחילופין להוסיף מחדש את הטיפולים או שימוש חוזר בתקשורת המותנית כדי להכין את הפתרון dextran.
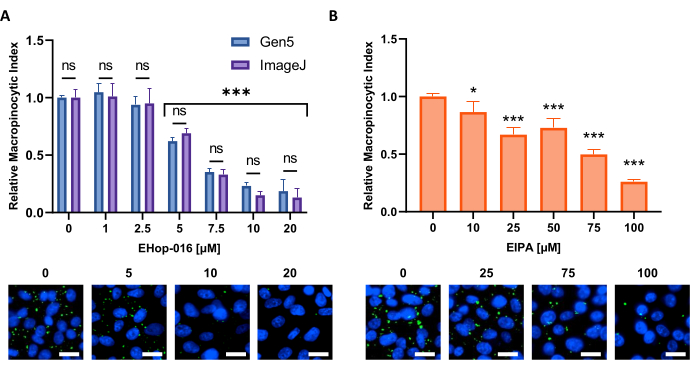
איור 6: ביצוע עקומת תגובת מינון למעכבי מקרופינוציטוזה. נתונים לדוגמה שהושגו בעת בדיקת מעכבי מקרופינוציטוזה ידועים בקו תא חדש. תאי PATU8998T שימשו לפורמט 96-well microplate וטופלו במשך 2 שעות ו -30 דקות עם הריכוזים המצוינים של (A) EHop-16 ו- (B) EIPA, בהתאמה. השוואת התוצאות שהושגו באמצעות ניתוח תמונה על ידי תוכנת Gen5 או ImageJ אינה מראה הבדלים משמעותיים בין שתי הגישות כפי שצוין על ידי ns in (A). סרגל קנה מידה = 25 מיקרומטר. תרשימי עמודות מציגים את הממוצע ואת ה- SD של ניסוי יחיד עם 4 עותקים משוכפלים. מובהקות סטטיסטית נקבעה על ידי ANOVA חד-כיווני או דו-כיווני, בהשוואה לתנאים שלא טופלו. * עמ' < 0.05; עמ' < 0.001. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
כאשר השלבים וההתאמה של הפרוטוקול המתואר לעיל מתבצעים בהתאם, התוצאות הניסיוניות הסופיות צריכות לספק מידע על אם תנאי תרבית התא הנחקרים או מעכבים לגרום או להפחית macropinocytosis בקו התא של עניין. כדי לחזק את תוקפם של ממצאים אלה, הכללת תנאי הבקרה תאפשר לבחון את התוצאות כדי לקבוע אם הניסוי הושלם בהצל?...
Discussion
איכות הניסויים ורכישת הנתונים תלויה מאוד באיכות הריאגנטים, באופטימיזציה של ההגדרות ובניקיון כיסויי הכיסוי והמיקרו-לוחית. התוצאות הסופיות צריכות לתת שונות מינימלית בין שכפולים; עם זאת, שינויים ביולוגיים מתרחשים באופן טבעי או עלולים להיגרם בדרך אחרת על ידי מספר גורמים. צפיפות תאים עלולה ל...
Disclosures
C.C. הוא ממציא על פטנט שהונפק שכותרתו ''אבחון סרטן, טיפוליות, וגילוי תרופות הקשורים macropinocytosis,' פטנט מס ': 9,983,194.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH / NCI (R01CA207189, R21CA243701) ל- C.C. KMO.G. הוא מקבל פרס מלגת פוסט-דוקטורט TRDRP (T30FT0952). BioTek Cytation 5 הוא חלק מליבת הדמיית התאים של סנפורד ברנהם פרביס, המקבלת תמיכה כספית ממענק התמיכה של מרכז הסרטן NCI (P30 CA030199). איורים 1-3 נוצרו באמצעות BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved