このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
蛍光標識マクロピノソームの定量のための自動イメージングおよび分析
要約
マルチウェルマイクロプレートを用いた自動アッセイは、単一の実験で多数の条件の評価を可能にすることによって経路調節因子を同定するための有利なアプローチである。ここでは、十分に確立されたマクロピノソームイメージングおよび定量プロトコルを96ウェルマイクロプレート形式に適合させ、マルチモードプレートリーダーを使用した自動化の包括的な概要を提供します。
要約
マクロピノサイトーシスは、バルクエンドサイトーシスを介して、細胞がタンパク質、病原体、および細胞破片などの大きな細胞外貨物を内在化させることを可能にする非特異的な液相取り込み経路である。この経路は、免疫応答および癌細胞代謝の調節を含む様々な細胞プロセスにおいて不可欠な役割を果たす。生物学的機能におけるこの重要性を考えると、細胞培養条件を調べることは、この経路の調節因子を特定し、新規治療アプローチの発見に使用される条件を最適化することによって、貴重な情報を提供することができる。この研究は、接着細胞における大ピノサイト指数の迅速な定量化のための標準的な実験装置および細胞イメージングマルチモードプレートリーダーを使用した自動イメージングおよび分析技術について記述している。この自動化方法は、高分子量蛍光デキストランの取り込みに基づいており、96ウェルマイクロプレートに適用して、1回の実験で複数の条件の評価を容易にするか、ガラスカバースリップに取り付けられた固定サンプルを容易にすることができます。このアプローチは、再現性を最大化し、実験の変動を低減しながら、時間を節約し、費用対効果を高めることを目的としています。
概要
マクロピノサイトーシスの非特異的なエンドサイトーシス経路は、細胞外液およびその構成成分のバルク取り込みを通じて、細胞が栄養素、タンパク質、抗原、病原体を含む様々な細胞外成分をインターナライズすることを可能にする1。多くの細胞型の生物学にとって重要であるが、マクロピノサイトーシス経路は、マクロピノサイトーシスの取り込みを通じて、腫瘍細胞が栄養枯渇した微小環境の存在下で生存し増殖することができる腫瘍生物学において不可欠な役割を果たすことがますます説明されている2,3。アルブミンおよび細胞外マトリックス、ならびに壊死性細胞破片を含む細胞外巨大分子の取り込みは、マクロピノソームおよびリソソーム融合媒介貨物異化作用を介してアミノ酸、糖、脂質およびヌクレオチドを生成することによってバイオマス生産のための代替栄養源を提供する4,5,6,7,8。
マクロピノサイトーシスの誘導および調節は複雑であり、細胞の状況に応じて変化し得る。これまでに、マクロピノサイトーシスのいくつかの誘導物質が同定されており、リガンド、例えば上皮成長因子(EGF)、血小板由来成長因子(PDGF)、ガレクチン-3、およびWnt3A9、10、11、12、13が含まれる。さらに、腫瘍微小環境を模倣する培養条件は、経路の活性化を誘発し得る。膵管腺癌(PDAC)腫瘍は、特にアミノ酸グルタミンのために栄養を奪われており、癌細胞と癌関連線維芽細胞(CAF)の両方が生存のためにマクロピノサイトーシスに依存する原因となります7,13,14,15。さらに、低酸素症や酸化ストレスなどの腫瘍ストレスは、この消去経路を活性化することができます16。マクロピノサイトーシスを誘導することができる多数の外因性インフルエンサーに加えて、様々な細胞内経路がマクロピノソーム形成を制御する。発癌性Ras媒介形質転換は、マクロピノシー機構を開始するのに十分であり、複数の癌型は発癌性Ras駆動構成的マクロピノサイトーシスを示す4,5,9,17。あるいは、野生型Ras活性化およびRas非依存性経路は、癌細胞およびCAFs10、11、15、18におけるマクロピノサイトーシスを活性化することが同定されている。インヒビター治療と組み合わせた様々なインビトロモデルの使用により、ナトリウム - 水素交換体、小型GTPase Rac1、ホスホイノシチド3-キナーゼ(PI3K)、p21活性化キナーゼ(Pak)、およびAMP活性化プロテインキナーゼ(AMPK)を含むいくつかのマクロピノサイトーシスモジュレーターの同定がもたらされました4,13,15.しかし、マクロピノサイトーシスを調節する多数の記載された因子および条件を考えると、さらに多くのモジュレーターおよび刺激が未発見のままであると考えられる。新規モジュレーターおよび刺激の同定は、単一の実験における多数の条件の自動評価によって促進され得る。この方法論は、マクロピノソーム形成に関与する因子に光を当てることができ、この経路を標的とする新規小分子または生物製剤の発見を可能にする可能性がある。
ここでは、インビトロで癌細胞におけるマクロピノサイトーシスの程度を決定するための以前に確立されたプロトコルを96ウェルマイクロプレート形式に適合させ、自動化されたイメージングおよび定量化19,20。このプロトコールは蛍光顕微鏡法に基づいており、これはインビトロおよびインビボでマクロピノサイトーシスを決定する分野で標準となっている4、5、6、7、9、10、11、12、13、15、16、17、18、 19,20,21,22。マクロピノソームは、高分子量デキストラン(すなわち、70kDa)2、3、4、20、21、22、23などの大きな巨大分子をインターナライズする能力を介して、他のエンドサイトーシス経路と区別することができる。したがって、マクロピノソームは、細胞外投与されたフルオロフォア標識70kDaデキストランの取り込みによって定義することができる。その結果、大ピノサイト小胞は、0.2〜5μmの大きさの蛍光穿刺の細胞内クラスターとして現れる。これらの穿刺を顕微鏡で画像化し、続いて定量化して、細胞内のマクロピノサイトーシスの程度(「マクロピノサイト指数」)を決定することができる。
このプロトコルでは、標準的な実験装置を使用して、96ウェルマイクロプレートおよびカバースリップ上に接着細胞中のマクロピノソームをインビトロで視覚化するための重要な手順が説明されています(図1)。加えて、細胞イメージングマルチモードプレートリーダーを用いたマクロピノサイト指数の画像取得および定量化を自動化するための指示が提供される。この自動化により、前述のプロトコルと比較して、時間、コスト、労力が削減されます19,20。さらに、意図せずに偏った画像の取得と分析を回避し、再現性と信頼性を向上させます。この方法は、異なる細胞型またはプレートリーダーに容易に適合させることができ、またはサイズ、数、および位置などの代替マクロピノソーム特徴を決定するために利用することができる。本明細書に記載の方法は、マクロピノサイトーシスを誘導する細胞培養条件のスクリーニング、新規モジュレーターの同定、または既知の阻害剤の薬物濃度の最適化に特に適している。
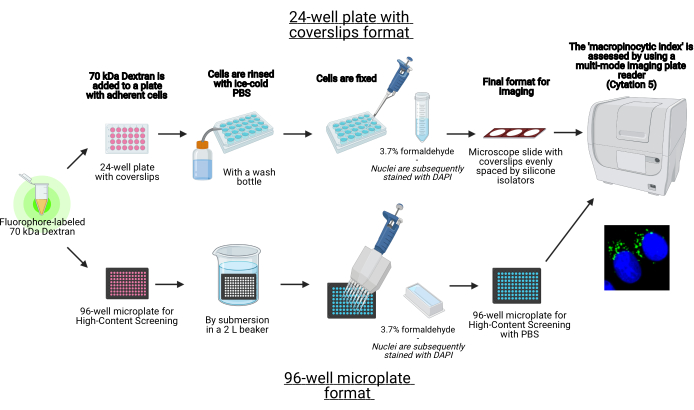
図1:接着細胞における「大ピノサイト指数」を決定するための自動アッセイの概略図。バイオレンダーを使用して作成されました。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. 材料の準備
- FITCまたはテトラメチルローダミン(TMR)で標識した70kDaデキストランをPBSに溶解し、20mg/mL溶液を得る。アリコートを-20°Cで保管する。
- DAPIをddH2Oに溶解し、1mg/mLの溶液を得る。アリコートを-20°Cで保管する。
注意: DAPI は発がん性物質の可能性があるため、取り扱いには注意が必要です。 - 固定当日、PBS中の新鮮な3.7%ACSグレードホルムアルデヒドを調製する。
警告: ホルムアルデヒドは固定剤で、発癌物質として知られており、吸入すると有毒です。吸入を避け、慎重に扱うために、化学ヒュームフードに溶液を作ります。 - 酸で洗ったカバースリップを用意する。
- 500 mL ビーカーとウォーターバスを使用して、直径 12 mm、厚さ #1.5 のホウケイ酸ガラス製カバースリップ 28 g を 100 mL の 1 M HCl で 56 °C で 24 時間加熱します。広範な蒸発を避けるために、ビーカーをプラスチックラップでシールします。
注意: HCl は腐食性の高い強酸であるため、吸入を避けるために慎重に取り扱い、化学ヒュームフード内で使用してください。 - カバースリップを蒸留水で洗ってください。洗浄を4回繰り返す。その後、カバースリップを95%エタノールで洗ってください。洗浄を4回繰り返す。
- 酸洗浄したカバースリップを室温で細胞培養皿に保管し、95%エタノールに浸すことで無菌性を維持し、将来の使用に備えます。広範な蒸発を避けるために、パラフィルムで皿を密封する。
- 500 mL ビーカーとウォーターバスを使用して、直径 12 mm、厚さ #1.5 のホウケイ酸ガラス製カバースリップ 28 g を 100 mL の 1 M HCl で 56 °C で 24 時間加熱します。広範な蒸発を避けるために、ビーカーをプラスチックラップでシールします。
2. 細胞の作製
- 目的の接着細胞を有するコンフルエントな10cm組織培養プレートを用いて、培地を吸引し、5mLのDPBSで細胞をすすぎ、37°Cで予温した。
- 予め加温した0.25%トリプシンを1.5 mL加え、37°Cでインキュベートすることにより、細胞をプレートから剥離する。
注:目的の細胞を剥離するのに必要なトリプシンのインキュベーション時間は経験的に決定されるべきであり、従来の光学顕微鏡下で剥離を観察することによって確認することができる。 - 細胞を15 mLの遠沈管に集め、4.5 mLの完全培地を加えてトリプシンをクエンチします。
- 200 x g で3分間遠心分離して細胞をペレット化し、上清を吸引する。
- 細胞ペレットを適当な量の予温した完全培地に再懸濁し、播種用の単一細胞懸濁液を得た。
- カバースリップ付きの24ウェルプレートまたは96ウェルマイクロプレートフォーマットで細胞を播種します(図1)。
注:増殖速度およびサイズが細胞株間で異なるため、播種する細胞数は各細胞株について経験的に決定されるべきである。このプロトコールは、マクロピノソーム標識の日に80%の細胞コンフルエンシーを有する付着性癌細胞に対して最適化されている。細胞コンフルエンシーは、大脳神経能力に影響を及ぼす可能性があり、これも経験的に決定されるべきである。- カバースリップフォーマットの24ウェルプレート
- カバースリップを24ウェル組織培養プレートに追加し、鉗子を使用してエタノール浴から単一のカバースリップを把持する。カバースリップをプレートの内壁に叩きつけて余分なエタノールを除去し、カバースリップを井戸の底に平らに置きます。
- エタノールを蒸発させ、カバースリップをDPBSで2回洗浄する。
- 各ウェルに500 μLの細胞懸濁液を加えて、カバースリップの上に細胞を播種する。マクロピノソーム標識の前日に細胞コンフルエントが60%〜80%に達するまで、5%CO2 を含む37°Cの細胞インキュベーターに細胞を置く。
- マクロピノソーム標識の前日に、ウェルから培地を吸引し、予め加温した無血清培地を各ウェルに500μL加え、細胞を5%CO2 を含む37°Cの細胞インキュベーターに16〜24時間置く。
注:研究する条件に応じて、マクロピノサイトーシスを誘導し、血清中に通常存在する成長因子の影響を軽減するために、無血清培地が推奨される。しかし、血清飢餓は、増殖やオートファジーなどの他の細胞プロセスに影響を与える可能性があることを考慮する必要があります。残留血清は細胞の大ピノサイト能力および阻害剤活性に影響を与える可能性があるため、500μLの予備加温DPBSで細胞を1〜2回穏やかにすすぐことにより、血清の除去を改善することができる。
- 96ウェルマイクロプレートフォーマット
- 細胞懸濁液を25mL試薬リザーバに移す。マルチチャンネルピペット(8チャンネルまたは12チャンネル)を使用して、光学的に透明な環状オレフィンまたはガラス底を備えた黒色96ウェル高含有量スクリーニングマイクロプレートの各ウェルに100μLの細胞懸濁液をシードします。
- マクロピノソーム標識の前日に細胞コンフルエントが60%〜80%に達するまで、5%CO2 を含む37°Cの細胞インキュベーターに細胞を置く。
- マクロピノソーム標識の前日に、マルチチャンネルピペット(8チャンネルまたは12チャンネル)または真空ポンプに取り付けられた標準チップ用のマルチチャンネル吸引アダプターを使用して、各ウェルから培地を取り出して廃棄します。
- 試薬リザーバとマルチチャンネルピペット(8チャンネルまたは12チャンネル)を使用して、100 μLの予温した無血清培地を各ウェルに静かに加えます。細胞を5%CO2 を含む37°Cの細胞インキュベーターに16〜24時間置く。
注:研究する条件に応じて、マクロピノサイトーシスを誘導し、血清中に通常存在する成長因子の影響を軽減するために、無血清培地が推奨される。しかし、血清飢餓は、増殖やオートファジーなどの他の細胞プロセスに影響を与える可能性があることを考慮する必要があります。残留血清は細胞のマクロピノサイト能力および阻害剤活性に影響を与える可能性があるため、予め加温したDPBS100μLで細胞を1〜2回穏やかにすすぐことにより、血清の除去を改善することができる。
- カバースリップフォーマットの24ウェルプレート
3. マクロピノソーム表示
- カバースリップフォーマットの24ウェルプレート
- ウェルを吸引し、1 mg/mL の蛍光色素標識高分子量 (70 kDa) デキストランを含む無血清培地 200 μL を再び加えます。細胞を37°Cの細胞インキュベーターに30分間置く。
注:研究する条件に応じて、新鮮な培地を使用する代わりに、細胞の大ピノサイト能力に影響を与える可能性のあるEGFまたは阻害剤化合物などの分泌または補充された因子をそれぞれ含むため、デキストランローディングのために馴化培地を再利用することが好ましい場合があります。 - 培地を吸引し、予め冷却された洗浄ボトルを使用して氷冷PBSで細胞を穏やかに、しかし迅速に洗浄する。洗濯中に手でプレートをしっかりと振って、カバースリップにくっついたデキストラン凝集体を脱落させてください。
- 350 μLの3.7%ホルムアルデヒドを加え、20分間インキュベートして細胞を固定する。その後、固定液を吸引し、PBSで細胞を2回洗浄する。
- PBS中の350 μLの2 μg/mL DAPIで核を染色する。20分後、DAPI溶液を吸引し、PBSで細胞を3回洗浄する。
- シリコーンアイソレータを顕微鏡スライド上に並べて接着し、イメージングの自動化に必要なカバースリップの均一な間隔と再現性のある位置決めを取得します(図2A、B)。
メモ:顕微鏡スライド全体には、合計3つのアイソレータを取り付けることができます。 - 各カバースリップについて、アイソレータのオープンスペース内の顕微鏡スライドに硬化蛍光マウント媒体を1滴加えます(図2C)。鉗子を使ってカバースリップを拾い上げ、糸くずの出ないワイプでカバースリップの側面を軽く叩いて余分なPBSを取り除きます。
- カバースリップを裏返しにして、取り付けメディアの落下の上に置きます(図2D)。閉じた鉗子を使用してカバースリップを軽く叩き、取り付けメディアから気泡を取り除きます(図2E)。
- スライドを暗い環境に保管し、マウントメディアを室温(通常は16~24時間)で乾燥させます。スライドを画像化したり、-20 °C で最大 2 週間保存したりできるようになりました。
- イメージングする前に、顕微鏡スライドからアイソレータを取り外します。スライドを室温まで平衡させ、アンモニアフリーのガラスクリーナーで濡らした綿先のアプリケーターを使用してカバースリップを清掃します。その後、70%エタノールで濡らした綿先のきれいなアプリケーターを使用して、カバースリップをきれいにし、乾かしたままにします。
- ウェルを吸引し、1 mg/mL の蛍光色素標識高分子量 (70 kDa) デキストランを含む無血清培地 200 μL を再び加えます。細胞を37°Cの細胞インキュベーターに30分間置く。
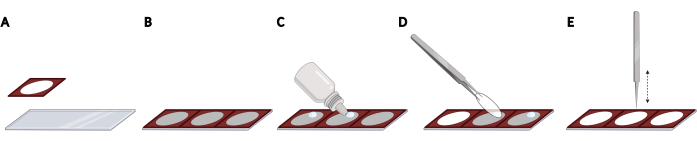
図2:シリコーンアイソレータを備えた顕微鏡スライドにカバースリップを載せる 。(A)シリコーンアイソレータをプレスし、顕微鏡スライドに接着する。(B)顕微鏡スライド全体に合計3つのアイソレータを装着することができ、カバースリップの間隔が均一で再現可能な位置決めが得られます。(C)各カバースリップについて、アイソレータのオープンスペース内の顕微鏡スライド上に蛍光マウント媒体を1滴加える。(D)鉗子を使用して、24ウェルプレートからカバースリップを拾い上げ、マウントメディアの落下の上に逆さまに置きます。(E)カバースリップと顕微鏡スライドの間に気泡がある場合は、閉じた鉗子を使用してカバースリップを優しく叩き、気泡を除去します。バイオレンダーを使用して作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
- 96ウェルマイクロプレートフォーマット
- 真空に取り付けたマルチチャンネル吸引アダプターを使用してウェルを吸引し、1 mg/mL 蛍光色素標識高分子量 (70 kDa) デキストランを含む無血清培地 40 μL をウェルに戻します。細胞を37°Cの細胞インキュベーター内で30分間インキュベートする。
注:研究する条件によっては、新鮮な培地を使用する代わりに、細胞の大ピノサイト能力に影響を与える可能性のあるEGFまたは阻害剤化合物などの分泌または補充された因子をそれぞれ含むため、デキストランローディングのために馴化培地を再利用することが好ましい場合があります。 - マイクロプレート内のメディアを廃棄するには、プレートを裏返して空の5 Lビーカーに入れます(図3A)。
- 氷冷PBSを充填した2Lビーカーにプレートを垂直に、わずかな角度でゆっくりと沈めてマイクロプレート内の細胞をすすぎ(図3B)、続いてプレートを5Lビーカーに逆さまにフリックしてマイクロプレート内のPBSを処分します(図3C)。これを2回繰り返します。
メモ:イメージングマイクロプレートに弱く付着した細胞は、このプロセス中に剥離することがあります。必要に応じて、ウェルをマルチチャンネル吸引アダプターで吸引することも、マルチチャンネルピペットを使用してPBSでより穏やかに洗浄することもできます。1枚の96ウェルマイクロプレートを処理するには、約2Lの氷冷PBSが必要です。より多くのプレートを分析する場合は、より大きなビーカーを使用し、追加のプレートごとに1 Lの氷冷PBSを追加するか、必要に応じて氷冷PBSをリフレッシュします。 - 最後のすすぎからPBSを廃棄した後、25 mL試薬リザーバおよびマルチチャネルピペットを使用して、PBS中の3.7%ホルムアルデヒド100 μLを各ウェルに加えることによって、室温で20分間細胞を固定する(図3D)。
- 固定溶液を取り出し、沈水およびフリック技術を用いてPBSで細胞を2回洗浄する。1ウェルあたり100 μLのPBS中の2 μg/mL DAPIで核を染色する。
- 20分後、上述の水没およびフリック技術を用いて、氷冷PBSで細胞を3回すすいでください(ステップ3.2.3)。マイクロプレートをリントフリーのワイプの上に逆さまに叩きつけて残留PBSを除去し、25mL試薬リザーバとマルチチャンネルピペットを使用して100μLの新鮮なPBSを各ウェルに加えます。細胞を今すぐ画像化するか、4°Cの光から覆って最大1週間保管してください。
注:あるいは、(PBSの代わりに)PBS中のグリセロールの溶液をイメージングおよび保存に使用して、蛍光をよりよく安定化させることもできます(図4A)。 - イメージングする前に、プレートを室温まで平衡化させます。マイクロプレートを糸くずの出ないワイプで拭き取ります。
- 真空に取り付けたマルチチャンネル吸引アダプターを使用してウェルを吸引し、1 mg/mL 蛍光色素標識高分子量 (70 kDa) デキストランを含む無血清培地 40 μL をウェルに戻します。細胞を37°Cの細胞インキュベーター内で30分間インキュベートする。
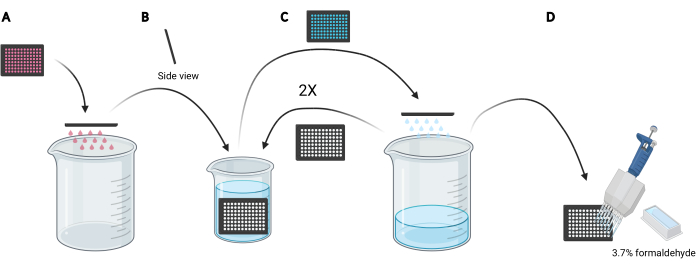
図3:96穴マイクロプレートをすすぎ、固定の準備をする。 (A)メディアの入ったマイクロプレートを5Lビーカーに空にするには、手動でフリックします。(B)マイクロプレートを垂直に、わずかな角度で、氷冷PBSで満たされた2Lビーカーにゆっくりと沈める。(C)PBSのマイクロプレートを5Lビーカーに手動でフリックして空にします。 B で説明した洗浄工程を2回繰り返します。(d)マイクロプレート内のPBSを最後に空にした後、マルチチャンネルピペットを用いて、ウェルに3.7%ホルムアルデヒド100 μLを加える。バイオレンダーを使用して作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
4. マクロピノソームイメージングの自動化
マクロピノソームの画像は、前述のように、標準的な蛍光顕微鏡を用いて撮影することができる19,20。しかし、このような手順は、特に多数の異なる細胞培養条件を評価する場合、自動化による効率の点で改善することができます。画像取得の自動化は、セルイメージングマルチモードプレートリーダーを介して実現することができ、ハンドリング手順を減らすことで労力を軽減し、重要なことに、偏りのない方法で画像を取得することでデータの再現性と信頼性を向上させます。複数のイメージングシステムが市販されており、機器によって方向が異なります。ここでは、Cytation5を用いた画像の取得について説明する。ただし、以下のプロトコルは、次のガイドラインに従うことで、個々の計測器に合わせて調整できます。
- 自動化プロトコルを作成して、デキストラン蛍光色素分子(FITC/TMR)とDAPIの波長チャネルに40倍の対空物レンズで画像を取得します。
注:一般的に使用されるマクロピノサイトーシス阻害剤EIPAは、特にDAPIチャネルで以前に励起された場合に、FITCチャネルにおいて自己蛍光を示す。試験中の他の化合物も自己蛍光を示す可能性がある。この問題を回避するには、励起波長が最も高いチャンネル(FITC/TMR)で最初に画像集録を行い、DAPIチャンネルで2番目に画像集録を行うように設定すると、この発生を回避できます。 - 最高レベルのマクロピノサイトーシスがあると予測されるサンプルを使用して露出設定を最適化し、信号の飽和や強度データの損失につながる可能性のある過剰暴露を回避します。サンプルを簡単かつ一貫して見つけるフォーカス設定を使用して、高品質の画像を生成します。
- 各ウェルまたはカバースリップ全体で複数の画像を取得して、サンプルの変動性を考慮し、サンプルの正確な表現を取得します。
- イメージング設定が決定されたら、実験内の各サンプルに同じ設定を使用します。
- Cytation 5およびGen5ソフトウェアを使用する場合のマクロピノソーム画像取得については、次の手順に従ってください。
- カバースリップフォーマットの24ウェルプレート
- プレートリーダーを起動し、スライドホルダーを使用して顕微鏡スライドを逆さまに挿入します。
- マイクロプレートリーダーとイメージングソフトウェアを開き、[プロトコル]をクリックして新しい プロトコルを作成し、[ 新規作成]をクリックします。[ 手順] をダブルクリックし、プレートタイプを選択します。
メモ: プレートタイプが使用できない場合は、「システム>プレートタイプ」 >「プレートを追加」をクリックし、製造元から提供されたプレート寸法を使用して、プレートタイプをソフトウェアに追加します。使いやすくするために、シリコーンアイソレータを使用して3つのカバースリップを間隔をあけた2つの顕微鏡スライドのテンプレートは、 補足ファイル1に用意されています。 - イメージング設定にアクセスするには、[ アクション]>[イメージ]>[反転イメージャ ]を選択し、[ OK]をクリックします。40x、PL FL位相対物レンズを ワイドFOV と オートフォーカスビニングで使用します。
- 最初のチャンネルでは、デキストラン蛍光色素標識(GFPまたはRFP)に対応するLEDキューブを選択します。 「自動 露出」のクリックを解除し、顕微鏡アイコンボタンをクリックして露出設定を最適化します。適切な露出設定が決定したら、[ 設定の保存]をクリックします。
メモ:最高レベルのマクロピノサイトーシスがあると予測されるサンプルを使用して露出設定を調整し、信号の飽和や強度データの損失につながる可能性のある画像の露出過多を回避します。 - DAPI LED キューブを使用して、2 番目のチャネルに対して前の手順を繰り返します。
- 蛍光チャンネルごとにオートフォーカス設定を行い、 フォーカスオプションを選択します。デフォルトのフォーカス方法の選択を解除し、デキストラン蛍光色素分子と DAPI チャンネルに対して、オプションスキャンでオートフォーカスを、 オプションスキャンなしでオートフォーカス をそれぞれ使用します。[ OK ]をクリックして設定を保存します。
メモ:スキャン距離を200 μmに減らし、20 μmに増分してオートフォーカス効率を高めることができます。オプションのスキャンは、蛍光の低いサンプルに適切なオートフォーカスを行うために必要です。これは通常、マクロピノサイトーシスが阻害されている場合や先天的に存在しない場合など、マクロピノサイトーシスが低い条件を分析する場合に発生します。 - [ビーコンの定義]オプションを使用して、カバースリップのさまざまな領域での画像の取得を自動化します。顕微鏡アイコンをクリックし、画像ウィンドウをクリックしてステージを次の領域に移動してビーコンを追加します。適切な数の領域が選択されたら、次のカバースリップに移動し、このプロセスを繰り返します。完了するには、[設定の保存]をクリックします。
注:サンプル全体のマクロピノサイトーシスを良好に表現するには、カバースリップ全体に均等に分布する約20個のビーコンを選択します(図4B)。使用できるビーコンは少なくなりますが、画像に焦点が合っていない場合や、気泡や蛍光のしみや汚れが含まれている場合など、品質の不一致により、取得後に画像分析から除外する必要がある画像もあります。 - イメージング設定の調整を完了するには、[OK]をクリックします。カバースリップをイメージするには、[プロトコル ツール] から [新しい実験の作成] と [今すぐ読み取る] を選択します。プロンプトが表示されたら、プロトコルと実験を保存します。
- カバースリップフォーマットの24ウェルプレート
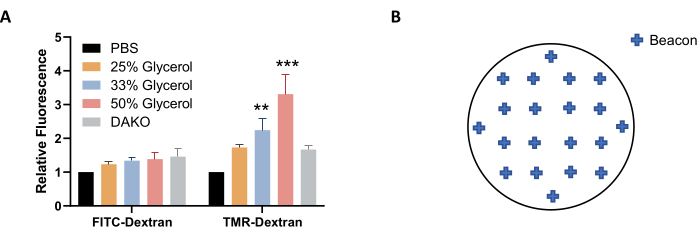
(A)グリセロール濃度を増加させると、EGFで処理したAsPC-1細胞で決定されたTMR-デキストラン蛍光が増加する。(B)カバースリップ形式の24ウェルプレートを使用した場合の自動画像取得のための画像ビーコンの座標例。棒グラフは、5回の実験のSEMによる平均相対蛍光を示す。統計的有意性は、PBSに対する二元配置分散分析によって決定された。** p < 0.01;p<0.001。この図の拡大版を表示するには、ここをクリックしてください。
- 96ウェルマイクロプレートフォーマット
- プレートリーダーを起動し、マイクロプレートを挿入します。
- マイクロプレートリーダーとイメージングソフトウェアを開き、[プロトコル]をクリックして新しい プロトコルを作成し、[ 新規作成]をクリックします。[ 手順] をダブルクリックし、プレートタイプを選択します。
メモ: プレートタイプが使用できない場合は、「システム>プレートタイプ」 >「プレートを追加」をクリックし、製造元から提供されたプレート寸法を使用して、プレートタイプをソフトウェアに追加します。使いやすさのために、PerkinElmerのCellCarrier-96ウルトラマイクロプレートのテンプレートは 、補足ファイル2に記載されています。 - イメージング設定にアクセスするには、[ アクション]>[画像]>[反転イメージャー ]を選択し、[ OK]をクリックします。40x PL FL フェーズ目標を ワイド FOV および オートフォーカス ビニングで使用します。
- 最初のチャンネルでは、デキストラン蛍光色素標識(GFPまたはRFP)に対応するLEDキューブを選択します。 「自動 露出」のクリックを解除し、顕微鏡アイコンボタンをクリックして露出設定を最適化します。適切な露出設定が決定したら、[ 設定の保存]をクリックします。
注:露光設定の最適化中に、著しい蛍光漂白が発生する可能性があります。これにより、新しいフィールドがイメージされるときに露出オーバーが発生する設定になる可能性があります。したがって、まだ露出していないフィールドをチェックし、選択した設定で信号の飽和が発生しないようにして、露出設定を検証します。マクロピノソーム定量における露光設定の最適化に使用されるウェルは、最適化中の漂白の結果として蛍光が減少したため、含めないでください。最高レベルのマクロピノサイトーシスがあると予測されるサンプルを使用して露出設定を調整し、信号の飽和や強度データの損失につながる可能性のある画像の露出過多を回避します。 - DAPI LED キューブを使用して、2 番目のチャネルに対して前の手順を繰り返します。
- 蛍光チャンネルごとにオートフォーカス設定を行い、 フォーカスオプションを選択します。デフォルトのフォーカス方法の選択を解除し、 レーザーオートフォーカスを使用します。マクロピノソームと核の最適な視覚化のために焦点面を決定した後、参照スキャンをキャプチャします。[ OK ]をクリックして設定を保存します。
メモ:スキャン距離を400 μmに、増分を3 μmに減らすことで、オートフォーカス効率を高めることができます。レーザーオートフォーカスオプションを正しく機能させるには、プレートの底部を清掃し、乾かしてから糸くずの出ないワイプでプレートを拭いてからイメージングしてください。レーザーオートフォーカスは、焦点面を見つけるのに最小限の時間しか必要としないため、焦点を合わせるための優れた方法です。他のフォーカス法を用いてもよいが、ウェルに退色防止剤が加えられていないため、これらの方法はサンプルの著しい漂白を引き起こし、データの収集に悪影響を及ぼす可能性がある。 - 水平オフセットと垂直オフセットをゼロに設定し、[単一画像]で[オーバーラップなしのモンタージュ]を選択し、解析に含めるセルの数に応じて3 x 3の画像を使用します。
注:細胞のサイズおよび密度に応じて、多かれ少なかれ画像を撮影して、サンプル全体のマクロピノサイトーシスの代表的な評価を得ることができます。AsPC-1またはMIA PaCa-2細胞におけるマクロピノサイトーシスを様々な条件下で評価すると、2 x 2または4 x 4のフォトフレーム間でデータ解釈に差は認められないが、複製サンプル間のばらつきはより少ない写真を撮ると増加する可能性がある(図5A、B)。フレームのサイズを増減すると、プレートのスキャンにかかる時間に影響します。露光時間にもよりますが、フル96ウェルマイクロプレートは、3 x 3フレームを使用して完全にスキャンするのに約1〜1.5時間かかります。2 x 2 と 4 x 4 のフレームは、それぞれその時間を半分または 2 倍にします。 - イメージング設定の調整を完了するには、[ OK]をクリックします。
- プレートをイメージするには、[プロトコル ツール] から [新しい実験の作成] と [今すぐ読み取る] を選択します。プロンプトが表示されたら、プロトコルと実験を保存します。
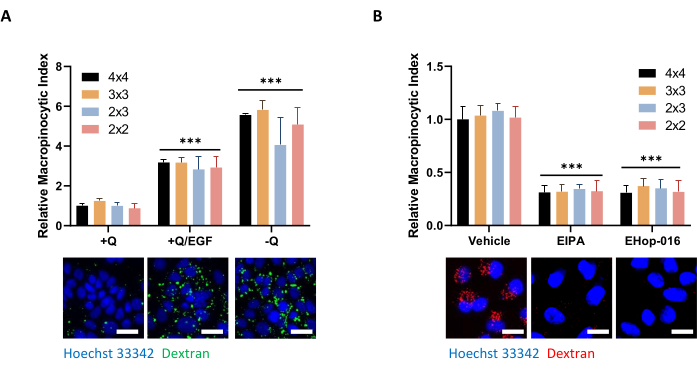
(A)AsPC-1細胞は、100ng/mLのEGF刺激を5分間またはグルタミン欠乏に対して24時間応答してマクロピノサイトーシスを示す。画像取得では、4 x 4、3 x 3、2 x 3、または2 x 2の額縁を撮影し、データ品質に対する写真数の影響を判断しました。(B)MIA PaCa-2細胞は、75μM EIPAによる30分間処理または10μM EHop-016による2時間処理によって阻害される構成的マクロピノサイトーシスを示す。額縁はAのように撮影しました。スケールバー = 25 μm。棒グラフは、4回の反復を伴う1回の実験のSDを用いた平均相対大脳球指数を示す。統計的有意性は、+Qまたは車両状態に対する二元配置分散分析によって決定された。p < 0.001 この図の拡大版を表示するには、ここをクリックしてください。
5. マクロピノサイト指数の決定
「マクロピノサイト指数」とは、顕微鏡画像を用いて細胞当たりの蛍光デキストラン取り込みを定量することによって決定される細胞マクロピノサイトーシスの程度である19。この目的のために、取得した画像を使用して、DAPI染色によって決定された総蛍光強度または蛍光陽性領域および総細胞数を測定することによって、インターナライズドデキストランの量を決定する。この解析は、前述のように、セルプロファイラやFIJI/ImageJなどのオープンソースの画像処理および解析ソフトウェアで実行できます19,20。ただし、マルチモードプレートリーダーで作業する場合、機器に付属のソフトウェアには、大ピノサイト指数を計算する目的で使用できる組み込みの解析アプリケーションが含まれている場合があります。場合によっては、組み込みのソフトウェア分析パイプラインがユーザーに完全には見えないことがあります。したがって、セルプロファイラやFIJI/ImageJなどの自動化されていない手順と比較して、早い段階でソフトウェアを検証することをお勧めします。このプロトコルは、次の一般的な指示に従うことによって、他の画像処理および解析ソフトウェアツールに適合させることができます。
- DAPI および対応するデキストラン画像の場合、ローリングボール関数と呼ばれることが多い適切な関数を適用して背景を減算します。バックグラウンドノイズが最小限に抑えられ、DAPI信号とデキストラン信号に対する減算効果が最小限またはまったくならないように設定を調整します。
- デキストラン信号の高いフィールドを使用して、しばしば閾値関数と呼ばれる強度信号設定を決定し、核を選択し、マクロピノソームのみを選択するために必要な最小強度信号設定を決定する。
- デキストラン画像の場合、作成されたマクロピノソーム選択内の総蛍光を計算するか、選択を使用してデキストランの全面積陽性を決定します。
- DAPI 画像の場合、選択を使用して画像内の核の数を決定し、存在する細胞の数を反映します。
- マクロピノサイト指数を決定するには、全デキストラン蛍光または面積をDAPIによって決定された細胞数で除算する。
- 取得したすべての画像について、これらの解析手順を繰り返し、全体を通して同じ数値設定を適用します。
- Gen5ソフトウェアを使用するときに大ピノサイト指数を決定するには、次の手順に従ってください。
注:組み込みの解析パイプラインが検証され、Fiji/ImageJ(図 6A).- イメージングが完了したら、高レベルのマクロピノサイトーシスを有する画像を選択する。背景信号を削除し、「処理」(補足図1A)をクリックして、「画像の前処理」オプションを選択します。
- デキストランチャンネルの場合は、「 自動 」の選択を解除し、5 μm のローリングボール直径を使用し、細かい結果を優先し、1 サイクルで画像を滑らかにします。
- DAPI チャネルの場合は、自動前処理と 1 スムーズサイクルを使用します。[OK]をクリックし、画像の前処理ステップをプロトコルに追加します。「ステップの追加」をクリックします。次に、イメージのロールアウト (補足図 1B) で処理済みのイメージを選択し、[解析] ボタン (補足図 1C) をクリックします。
- [ 解析設定] で、[ タイプ ] を [ セルラー解析] に設定します。DAPIチャンネルを選択し、[ オプション ]をクリックします(補足図2A)。
- プライマリマスクの場合は、処理されたDAPIイメージを使用して、単一の核を選択するマスクを作成します。暗い背景と 自動 オプションを使用します。さらに、単一の核のマスク選択を許可する設定を決定し、終了したら 「適用」 ボタンをクリックして、マスクが適切に適用されているかどうかを判断します。
メモ: 「 タッチオブジェクトを分割」 オプションと「 マスクの穴を埋め」 オプションを有効にすると、単一の核を選択するのに最適です。最小および最大のオブジェクトサイズは、細胞株に応じて調整する必要があり、最も一般的には5〜40μmの範囲に設定されます。 プライマリエッジオブジェクト を含めることができ、画像全体を分析する必要があります。スライダを適用して、マスクの選択範囲を信号強度に合わせて調整できます。 - 次に、二次マスクを適用して、マクロピノソーム蛍光プンクタを選択するための設定を最適化します。 「セカンダリマスク内で測定」 機能を使用し、セルのサイズに応じてプライマリマスクを 40 μm 拡大します。
- 「しきい値」機能と「マスクのしきい値」メソッドを使用して、正のデキストラン領域を選択します。[適用]をクリックして、設定が正しく適用されているかどうかを確認します。
メモ: しきい値を決定するには、ラインプロファイルの表示ツール(補足図2B)を使用し、デキストラン陽性領域(補足図2C)に線を引きます。測定された強度を使用して最適な設定を決定し、マクロピノソームを選択し、バックグラウンド信号を除外するマスクを作成します(補足図2D)。 - 核とマクロピノソームを選択するための適切なマスクを作成したら、[ 計算メトリック] タブをクリックし、[ 対象のオブジェクトレベルのメトリックを選択または作成]を選択します。
- 存在するすべてのメトリックを削除し、セカンダリマスクの分析のために 積分 メトリックと 面積 メトリックを追加します。[ OK ] をクリックし、新しいメトリックに対して [ 計算 と 表示 ] を選択します。完了したら、[ OK ]をクリックし、[ ADD STEP ]を選択して、分析と計算をプロトコルに追加します。
- 完成したプロトコルを将来使用するために保存し、[ ファイル ] をクリックして [プロトコルを名前を付けて保存] をクリックします。
- データ分析が完了したら、目的のメトリックを選択し、データをエクスポートしてマクロピノサイト指数を決定します。マクロピノサイト指数を次のように決定します。
細胞当たりのデキストラン蛍光=対象Int_2[デキストラン蛍光団]
セルあたりのデキストラン面積=物体Area_2[デキストラン蛍光団]
注: カバースリップ形式の 24 ウェルプレートの場合、メトリックは画像ごとの平均大ピノサイト指数の平均を反映します。あるいは、マクロピノサイト指数は、すべての画像の「面積」または「積分」の合計を合計「セル数」で割ることによって、サンプル全体について手動で計算することができます。マクロピノサイト指数を計算する際のこれらのアプローチの違いは、ほとんどの設定で最小限です。96ウェルマイクロプレートフォーマットの場合、マクロピノサイト指数はサンプル全体の平均として計算されます。 - イメージングとその後の自動分析のためにプロトコルを保存します。このプロトコルは、同じ蛍光色素を使用した将来の実験に再利用できます。
注:レーザーオートフォーカス機能を使用する場合、核とマクロピノソームは異なる平面に局在する可能性があるため、異なる細胞株を分析する場合は、新しい基準スキャンを行う必要があります。以前に決定したプロトコルを使用して新しい実験を実行するたびに、その実験の露出設定を最適化する必要があります。
6.治療の追加
細胞治療(小分子、生物製剤、成長因子、代謝産物など)は、プロトコルのどの段階でも組み込むことができ、正確なタイミングは研究の目的と目的に依存する。
- セクション 2 のようにセルを準備します。
- 目的の処置を追加する直前に、処置および適切な対照を無血清培地中の最終濃度の2倍で調製する。評価される反復ウェルの数の体積に等しい体積で処理を準備する。
注:分泌因子が細胞機能を制御する上で果たし得る役割を考えると、条件付け培地で関心のある治療を希釈することが好ましいかもしれない。これらの目的のために、セクション2で説明したように細胞を調製する際に、6cmまたは10cm細胞培養皿などの追加のプレートを播種して、処理溶液の調製のための馴化培地を生成することが有用であり得る。 - ウェルから培地を除去せずに、1ウェル容量の処理溶液を各ウェルに加える。プレートを振って、適切な混合を確認します。細胞を所望の時間インキュベートする。
- セクション 3 に進みます。
注:デキストランを添加する場合、新鮮な培地を使用すると、追加された治療が除去され、マクロピノサイトーシスのレベルに影響を与える可能性があります。したがって、デキストラン溶液を調製するために、処置を吸引または代替的に再添加するか、または馴化培地を再利用することなく、デキストランを直接ウェルに添加することが好ましい場合がある。
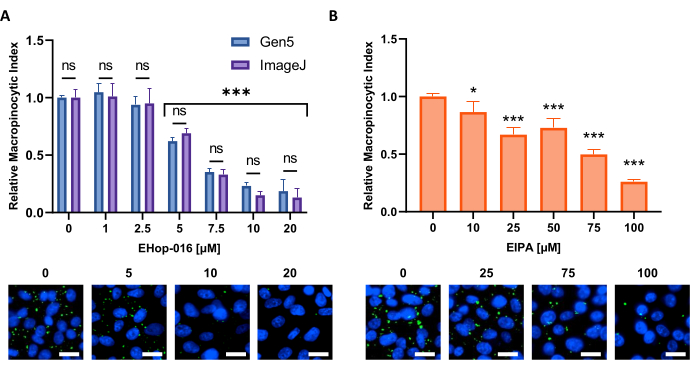
図6:マクロピノサイトーシス阻害剤についての用量反応曲線を行う。 新しい細胞株において既知のマクロピノサイトーシス阻害剤を試験したときに得られる例示データ。PATU8998T細胞を96ウェルマイクロプレートフォーマットに使用し、それぞれ(A)EHop-16および(B)EIPAの指示された濃度で2時間および30分間処理した。Gen5ソフトウェアまたはImageJによる画像解析によって得られた結果を比較すると、(A)のnsで示すように、2つのアプローチの間に有意差は示されていない。スケールバー = 25 μm。棒グラフは、4回の反復による単一実験の平均とSDを示す。統計的有意性は、未処理条件と比較して、一元配置または二元配置分散分析によって決定された。* p < 0.05; p < 0.001. この図の拡大版を表示するには、ここをクリックしてください。
結果
上述のプロトコールのステップおよび調整がそれに応じて行われるとき、最終的な実験結果は、研究された細胞培養条件または阻害剤が、目的の細胞株におけるマクロピノサイトーシスを誘導または減少させるかどうかについての情報を提供するべきである。これらの知見の妥当性を強化するために、対照条件を含めることで、実験が正常に完了したかどうかを判断するために結果を精査す?...
ディスカッション
実験とデータ収集の品質は、試薬の品質、設定の最適化、カバースリップとマイクロプレートの清浄度に大きく依存します。最終結果は、反復間の変動が最小限に抑えられるはずです。しかし、生物学的変異は自然に起こるか、そうでなければ多くの要因によって引き起こされる可能性があります。細胞密度は、細胞がマクロピノサイトーシス誘導剤または阻害剤に多かれ少なかれ応答する?...
開示事項
C.C.は、「マクロピノサイトーシスに関連する癌診断、治療薬、および創薬」と題する発行済み特許の発明者であり、特許第9,983,194号。
謝辞
この研究は、TRDRPポスドクフェローシップ賞(T30FT0952)の受賞者であるC.C. KMO.G.へのNIH/NCI助成金(R01CA207189、R21CA243701)によって支援されました。BioTek Cytation 5は、NCI Cancer Center Support Grant(P30 CA030199)から財政的支援を受けているSanford Burnham Prebys Cell Imaging Coreの一部です。図 1 ~ 3 は、BioRender を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
参考文献
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved