JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
형광 표기 매크로피노좀의 정량화를 위한 자동화된 이미징 및 분석
요약
멀티웰 마이크로플레이트를 사용하는 자동화된 해석은 단일 실험에서 다양한 조건의 평가를 허용함으로써 경로 조절기관을 식별하는 데 유리한 접근 방식입니다. 여기에서는 잘 확립된 매크로피노솜 이미징 및 정량화 프로토콜을 96웰 마이크로플레이트 형식으로 조정했으며 멀티 모드 플레이트 판독기를 사용하여 자동화를 위한 포괄적인 개요를 제공합니다.
초록
Macropinocytosis는 세포가 대량 내세포증을 통해 단백질, 병원균 및 세포 파편과 같은 큰 세포외 화물을 내면화할 수 있는 비특이적 유체 상 섭취 경로입니다. 이 통로는 면역 반응과 암 세포 대사의 조절을 포함하여 다양한 세포 프로세스에서 필수적인 역할을 합니다. 생물학적 기능에 있는 이 중요성을 감안할 때, 세포 배양 조건을 검토하는 것은 이 통로의 레귤레이터를 확인하고 새로운 치료 접근의 발견에 이용될 조건을 최적화해서 귀중한 정보를 제공할 수 있습니다. 이 연구는 부착 된 세포에서 매크로 피노키틱 인덱스의 신속한 정량화를 위한 표준 실험실 장비 및 세포 이미징 다중 모드 플레이트 리더를 사용하여 자동화 된 이미징 및 분석 기술을 설명합니다. 자동화된 방법은 고분자 형광 dextran의 섭취를 기반으로 하며 유리 커버립에 장착된 하나의 실험 또는 고정 샘플에서 여러 조건의 평가를 용이하게 하기 위해 96웰 마이크로플레이트에 적용할 수 있다. 이 방법은 재현성을 극대화하고 실험적 변화를 줄이는 동시에 시간 절약과 비용 효율적인 방식을 목표로 합니다.
서문
macropinocytosis의 비 특이적 내세포 통로는 세포세포 액체와 그 성분의 대량 섭취를 통해 영양분, 단백질, 항원 및 병원균을 포함한 다양한 세포 외 구성 요소를 내면화 할 수 있습니다1. 수많은 세포 모형의 생물학을 위해 중요하더라도, 점점, macropinocytosis 통로는 종양 생물학에 있는 필수적인 역할을 하기 위하여 기술됩니다, 여기서, 대식세포 섭취를 통해, 종양 세포는 영양 고갈된 microenvironment2의 존재에서 생존하고 증식할 수 있습니다2,3. 알부민 및 세포 외 매트릭스및 괴사 세포 파편을 포함한 세포 외 거대 분자의 섭취는 거형 및 리소솜 및 리소성 융합 매개화물 이화 이화증4,5,6,7,8을 통해 아미노산, 설탕, 지질 및 뉴클레오티드를 생성하여 바이오매스 생산을위한 대체 영양소 소스를 제공합니다.
거시피노세포증의 유도 및 조절은 복잡하고 세포 상황에 따라 달라질 수 있습니다. 지금까지, 거형피노세포증의 몇몇 유도체가 확인되고 표피 성장인자(EGF), 혈소판 유래 성장인자(PDGF), galectin-3 및 Wnt3A9,10,11,12,13과 같은 리간드를 포함하고 있다. 또한, 종양 미세 환경을 모방하는 배양 조건은 통로의 활성화를 시작할 수 있다. 췌장 덕트 아데노암종 (PDAC) 종양은 특히 암세포와 암 관련 섬유아세포 (CAFs)를 모두 생존을 위한 매크로 피노세포증에 의존하는 아미노산 글루타민을 위해 영양 박탈입니다7,13,14,15. 더욱이, 저산소증 및 산화 스트레스와 같은 종양 응력은, 이 청소 통로를 활성화할 수 있습니다16. 거시화증을 유도할 수 있는 수많은 외외성 인플루언서 외에도, 다양한 세포내 통로가 거시성 형성을 제어한다. 종양 유발 Ras 매개 변환은 대식세포 기계를 시작하기에 충분하며, 다중 암 유형은 종양genic Ras 구동 구성 매크로 피노세포4,5,9,17를 나타낸다. 대안적으로, 야생형 Ras 활성화 및 Ras 독립적인 통로는 암세포및 CAFs10,11,15,18에서 macropinocytosis를 활성화하기 위하여 확인되었습니다. 억제제 처리와 결합하여 다양한 체외 모델을 사용하면 나트륨 수소 교환기, 소형 GTPase Rac1, 인포이티드 3키나제(PI3K), p21 활성화 키나아제(Pak), AMP 활성화 단백질 키나제(AMPK,15,15)를 포함하는 여러 매크로피노시토시스 변조기를 식별하게 되었습니다. . 그러나, 거시적인 세포토증을 조절하는 기술된 요인 및 조건의 무리를 감안할 때, 더 많은 변조기와 자극이 발견되지 않은 채로 남아 있다는 것을 생각할 수 있습니다. 새로운 변조기와 자극의 식별은 단일 실험에서 다양한 조건의 자동화된 평가에 의해 촉진될 수 있다. 이 방법론은 거형 형성에 관련되되거나 이 통로를 표적으로 하는 새로운 작은 분자 또는 생물학의 발견을 허용할 수 있습니다.
여기에서, 우리는 96 웰 마이크로 플레이트 형식 및 자동화된 화상 진찰 및 정량화19,20에 시험관 내암세포증의 정도를 결정하기 위한 우리의 이전에 확립된 프로토콜을 조정했습니다. 본 프로토콜은 형광 현미경 검사법을 기반으로 하며, 이는 시험관 내 및 생체 내에서 거피노세포증을 결정하는 분야에서 표준이 되었으며, 생체 내에서 4,5,6,7,9,9,10,12,12,15,15,17,18, 19,20,21,22. 매크로피노솜은 고분자 량 dextran(즉, 70 kDa)2,3,4,20,21,22,23과 같은 대형 거대 분자를 내면화하는 능력을 통해 다른 내세포 경로와 구별될 수 있다. 따라서, 거시피노솜은 세포외 투여형 형광소-표지70 kDa dextran의 섭취를 통해 정의될 수 있다. 그 결과, 매크로피노시성 소포는 0.2-5 μm에 이르는 크기의 형광 문크타의 세포내 클러스터로 나타납니다. 이러한 말장난은 세포내의 대식세포증의 정도를 결정하기 위해 현미경으로 이미지화되고 이후에 정량화될 수 있다- '대식세포 지수'.
이 프로토콜에서, 표준 실험실 장비를 사용하여 96웰 마이크로 플레이트 및 커버립에 체외에서 부착 된 세포에서 대식체를 시각화하는 필수적인 단계가 설명된다 (그림 1). 또한, 셀 이미징 다중 모드 플레이트 판독기를 이용하여 매크로피노사이클 지수의 이미지 수집 및 정량화를 자동화하는 방향이 제공된다. 이 자동화는 이전에 설명한 프로토콜19,20에 비해 시간, 비용 및 노력을 줄여줍니다. 또한 의도하지 않게 편향된 이미징 수집 및 분석을 방지하여 재현성과 신뢰성을 향상시킵니다. 이 방법은 다른 세포 유형 또는 플레이트 판독기에 쉽게 적응하거나 크기, 숫자 및 위치와 같은 대체 매크로 피노솜 특징을 결정하는 데 활용할 수 있습니다. 본 명세서에 기재된 방법은 거시피노세포증을 유도하는 세포 배양 조건의 선별, 새로운 변조기의 식별 또는 알려진 억제제의 약물 농도의 최적화에 특히 적합하다.
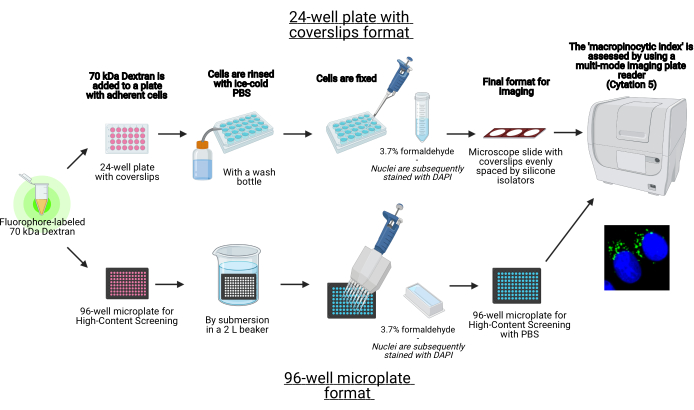
그림 1: 고동체 세포의 '대식세포 지수'를 결정하는 자동화된 분석의 회로도. BioRender를 사용하여 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 재료 의 준비
- 20 mg/mL 용액을 얻기 위해 PBS에서 FITC 또는 테트라메틸lr호다민(TMR)으로 표시된 70kDa dextran을 용해하십시오. 알리쿼트를 -20°C에 저장합니다.
- ddH2O에 DAPI를 용해하여 1 mg/mL 용액을 얻습니다. 알리쿼트를 -20°C에 저장합니다.
주의: DAPI는 잠재적인 발암물질이며 신중하게 처리되어야 합니다. - 고정 당일 PBS에서 3.7% ACS 등급 포름알데히드를 준비합니다.
주의: 포름알데히드는 고정성, 알려진 발암물질이며 흡입시 독성이 있습니다. 흡입을 피하고 조심스럽게 처리하기 위해 화학 연기 후드의 용액을 만드십시오. - 산세척 커버립을 준비합니다.
- 500mL 비커와 수조를 사용하여 직경 12mm의 보로실리케이트 유리 커버립 28g과 1M HCl의 100mL에서 56°C에서 24시간 동안 1.5g의 두께를 가열하여 광범위한 증발을 피하기 위해 플라스틱 랩으로 비커를 밀봉하십시오.
주의: HCl은 부식성이 높고 따라서 흡입을 피하기 위해 화학 연기 후드에 사용되어야하는 강한 산입니다. - 커버립을 증류수로 씻으시다. 워시를 4번 반복합니다. 그런 다음 커버립을 95% 에탄올로 씻습니다. 워시를 4번 반복합니다.
- 95% 에탄올에 침을 통해 멸균을 유지하여 향후 사용을 위해 실온에서 산 세척 커버립을 실온에 저장합니다. 광범위한 증발을 피하기 위해 파라필름으로 접시를 밀봉하십시오.
- 500mL 비커와 수조를 사용하여 직경 12mm의 보로실리케이트 유리 커버립 28g과 1M HCl의 100mL에서 56°C에서 24시간 동안 1.5g의 두께를 가열하여 광범위한 증발을 피하기 위해 플라스틱 랩으로 비커를 밀봉하십시오.
2. 세포 준비
- 관심있는 신봉세포를 가진 10cm 조직 배양판을 사용하여, 미디어를 흡인하고 37°C에서 예동된 DPBS의 5mL로 세포를 헹구는다.
- 플레이트에서 세포를 분리하여 1.5mL의 예열 된 0.25 % 트립신과 37 °C에서 배양하십시오.
참고: 관심 있는 세포를 분리하는 데 필요한 트립신 인큐베이션 시간은 경험적으로 결정되어야 하며 종래의 광 현미경하에서 분리를 관찰하여 확인할 수 있다. - 15mL 원심분리기 튜브에서 세포를 수집하고 트립신을 담금질하기 위해 완전한 매체의 4.5 mL을 추가합니다.
- 200 x g 에서 3 분 동안 원심 분리에 의해 세포를 펠렛하고 슈퍼 나탄을 흡인.
- 파종에 대한 단일 세포 현탁액을 얻기 위해 미리 온전한 매체의 적절한 부피에서 세포 펠릿을 다시 중단한다.
- 커버립 또는 96웰 마이크로플레이트 포맷으로 24웰 플레이트에 세포를 시드합니다(그림 1).
참고: 증식율과 크기는 세포주 마다 다르기 때문에 시드되는 세포의 수는 각 세포주에 대해 경험적으로 결정되어야 합니다. 이 프로토콜은 매크로 피노솜 라벨링 당일 80%의 세포 결합을 가진 부착된 암세포에 최적화되었습니다. 세포 합류는 거시적인 용량에 영향을 미칠 수 있으며, 이것은 또한 경험적으로 결정되어야 합니다.- 커버슬립 포맷이 있는 24웰 플레이트
- 24웰 티슈 배양 판에 커버립을 추가하고, 집게를 사용하여 에탄올 욕조에서 하나의 커버슬립을 잡습니다. 커버슬립을 플레이트 내부 벽에 탭하여 과도한 에탄올을 제거하고 커버슬립을 우물 바닥에 평평하게 놓습니다.
- 에탄올이 증발하여 DPBS로 커버슬립을 2번 세척합니다.
- 각 웰에 셀 서스펜션의 500 μL을 추가하여 커버슬립 위에 세포를 시드합니다. 세포 결합이 매크로 피노솜 라벨링 전날 60%-80%에 도달할 때까지 37°C 세포 인큐베이터에 셀을 5%의 CO2 로 배치합니다.
- 전날 거시성 라벨링, 우물에서 미디어를 흡인하고, 각 우물에 미리 워동된 혈청 없는 매체의 500 μL을 추가하고 세포를 16-24h에 대해 5%의 CO2 로 37°C 셀 인큐베이터에 넣습니다.
참고: 연구해야 할 조건에 따라 혈청이 없는 매체는 거시적인 세포증을 유발할 수 있는 성장 인자의 영향을 감소시키고 일반적으로 혈청에 존재하는 것이 좋습니다. 그러나 혈청 기아가 증식 및 자가식과 같은 다른 세포 과정에 영향을 줄 수 있다고 간주해야 합니다. 잔류 혈청은 세포의 대식세포 용량뿐만 아니라 억제제 활동에 영향을 줄 수 있기 때문에, 전동DPBS의 500 μL로 세포를 1~2회 부드럽게 헹구면 혈청제거를 개선할 수 있다.
- 96웰 마이크로플레이트 포맷
- 셀 서스펜션을 25mL 시약 저장소로 이송합니다. 멀티채널 파이펫(8 또는 12채널)을 사용하여, 광학적으로 맑은 사이클리 올레핀 또는 유리 바닥이 있는 블랙 96웰 의 고함량 스크리닝 마이크로플레이트의 각 웰에 셀 서스펜션의 100 μL을 시드한다.
- 세포 결합이 매크로 피노솜 라벨링 전날 60%-80%에 도달할 때까지 37°C 세포 인큐베이터에 셀을 5%의 CO2 로 배치합니다.
- 전날 에는 멀티채널 파이펫(8또는 12채널) 또는 진공 펌프에 부착된 표준 팁에 대한 멀티채널 포부 어댑터를 사용하여 각 우물에서 미디어를 제거하고 폐기합니다.
- 시약 저장소와 멀티 채널 파이펫 (8 또는 12 채널)을 사용하여 각 우물에 미리 따뜻해지는 혈청없는 매체 100 μL을 부드럽게 추가합니다. 세포를 37°C 세포 인큐베이터에 16-24h동안 5% CO2 로 배치한다.
참고: 연구해야 할 조건에 따라 혈청이 없는 매체는 거시적인 세포증을 유발할 수 있는 성장 인자의 영향을 감소시키고 일반적으로 혈청에 존재하는 것이 좋습니다. 그러나 혈청 기아가 증식 및 자가식과 같은 다른 세포 과정에 영향을 줄 수 있다고 간주해야 합니다. 잔류 혈청은 세포의 대식세포 용량뿐만 아니라 억제제 활동에 영향을 줄 수 있기 때문에, 100 μL 예동 DPBS로 세포를 1~2회 부드럽게 헹구면 혈청제거를 개선할 수 있다.
- 커버슬립 포맷이 있는 24웰 플레이트
3. 매크로 피노솜 라벨
- 커버슬립 포맷이 있는 24웰 플레이트
- 우물을 흡인하고 1 mg / mL 플루오로포레 라벨 높은 분자량 (70 kDa) dextran와 혈청없는 매체의 200 μL을 다시 추가합니다. 세포를 37°C 세포 인큐베이터에 30분 동안 배치합니다.
참고: 연구해야 할 조건에 따라, 신선한 매체를 사용하는 대신, 세포의 대식세포 용량에 영향을 미칠 수 있는 EGF 또는 억제제 화합물과 같은 분비 또는 보충 된 인자를 포함하기 때문에 디엑스트라른 로딩을 위해 조건부 미디어를 재사용하는 것이 바람직할 수 있다. - 미디어를 흡인하고 미리 냉각된 세척 병을 사용하여 얼음처럼 차가운 PBS로 셀을 5회 부드럽게 씻어냅니다. 세차 하는 동안 손으로 접시를 단단히 흔들어 커버립에 달라 지는 데스테인 골재를 단조로합니다.
- 3.7%의 포름알데히드3.7%를 추가하고 20분 동안 배양하여 세포를 수정합니다. 그런 다음 고정 용액을 흡인하고 PBS로 셀을 두 번 세척합니다.
- PBS에서 2 μg/mL DAPI의 350 μL로 핵을 얼룩지게 합니다. 20 분 후, DAPI 용액을 흡인하고 PBS 세 번으로 세포를 씻어.
- 이미징 자동화에 필요한 커버립의 간격과 재현 가능한 국소화를 얻기 위해 현미경 슬라이드에 실리콘 이졸기를 나란히 부착합니다(그림 2A, B).
참고: 전체 현미경 슬라이드는 총 3개의 개소기로 채워질 수 있습니다. - 각 커버슬립에 대해, 이솔레이터의 열린 공간 내의 현미경 슬라이드에 경화 형광 장착 매체의 방울을 추가한다(도 2C). 집게를 사용하여 커버슬립을 선택하고 보풀이 없는 물티슈에 커버립의 측면을 부드럽게 눌러 과도한 PBS를 제거합니다.
- 커버슬립을 장착 용지 한 방울에 거꾸로 놓습니다(그림 2D). 닫힌 포셉을 사용하여 커버슬립을 부드럽게 탭하여 장착 매체에서 거품을 제거합니다(그림 2E).
- 슬라이드를 어두운 환경에 저장하고 장착 용지가 실온에서 건조할 수 있도록 하여 일반적으로 16-24h를 복용합니다. 슬라이드는 이제 최대 2주 동안 -20°C에서 이미지화또는 저장될 수 있다.
- 이미징하기 전에 현미경 슬라이드에서 개소기를 제거합니다. 슬라이드가 실온에 평형화하고 암모니아가없는 유리 클리너로 젖은 면 팁 어플리케이터를 사용하여 커버립을 청소하십시오. 그 후 70%에탄올로 젖은 깨끗한 면 팁 어플리케이터를 사용하여 커버슬립을 건조하게 청소하고 방치합니다.
- 우물을 흡인하고 1 mg / mL 플루오로포레 라벨 높은 분자량 (70 kDa) dextran와 혈청없는 매체의 200 μL을 다시 추가합니다. 세포를 37°C 세포 인큐베이터에 30분 동안 배치합니다.
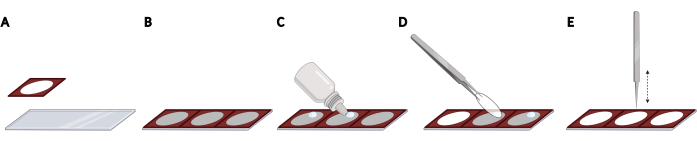
그림 2: 실리콘 이졸기를 장착한 현미경 슬라이드에 커버립을 배치합니다. (B) 전체 현미경 슬라이드는 총 3개의 개소기로 채워질 수 있으며, 그 결과 커버립의 간격과 재현 가능한 국소화를 초래할 수 있습니다. (C) 각 커버슬립에 대해, 이솔레이터의 열린 공간 내에서 현미경 슬라이드에 형광 장착 매체한방울을 추가한다. (D) 집게를 사용하여 24웰 플레이트에서 커버슬립을 집어 들고 마운팅 미디어의 드롭에 거꾸로 놓습니다. (E) 커버슬립과 현미경 슬라이드 사이에 거품이 있을 때, 닫힌 포셉을 사용하여 커버슬립을 부드럽게 탭하여 거품을 제거합니다. BioRender를 사용하여 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 96웰 마이크로플레이트 포맷
- 진공에 부착된 멀티채널 포부 어댑터를 사용하여 우물을 흡입하고 1 mg/mL 플루오로포어로 표시된 고분자량(70 kDa)을 우물에 다시 부착하여 40 μL의 혈청 프리 미디어를 첨가합니다. 37°C 세포 인큐베이터에서 세포를 30분 동안 배양한다.
참고: 연구해야 할 조건에 따라, 신선한 매체를 사용하는 대신, 세포의 대식세포 용량에 영향을 미칠 수 있는 EGF 또는 억제제 화합물과 같은 분비 또는 보충제 인자를 함유할 수 있기 때문에, 디엑스트라른 로딩을 위해 조절된 매체를 재사용하는 것이 바람직할 수 있다. - 접시를 빈 5 L 비커(그림 3A)로 거꾸로 가볍게 밀어 마이크로 플레이트에 미디어를 폐기합니다.
- 마이크로 플레이트내의 세포를 천천히 수직으로 잠그고, 약간의 각도로, 얼음 차가운 PBS(그림 3B)로 채워진 2L 비커로 헹구고, 그 후 5L 비커(그림 3C)로 판을 거꾸로 밀어 마이크로플레이트에 PBS를 폐기한다. 2번 반복합니다.
참고: 이미징 마이크로 플레이트에 약하게 부착되는 세포는 이 과정에서 분리될 수 있습니다. 필요한 경우, 우물은 멀티 채널 포부 어댑터로 흡입하거나 멀티 채널 파이펫을 사용하여 PBS로 부드럽게 세척 할 수 있습니다. 96웰 마이크로플레이트 1개를 가공하려면 약 2L의 얼음차가운 PBS가 필요합니다. 더 많은 플레이트를 분석하려면 더 큰 비커를 사용하고, 각 추가 플레이트에 1 L의 얼음 차가운 PBS를 추가하거나 필요에 따라 얼음처럼 차가운 PBS를 새로 고칩니다. - 마지막 헹구에서 PBS를 폐기한 후, 25mL 시약 저수지와 멀티채널 파이펫(도 3D)을 사용하여 PBS에 3.7%의 포름알데히드100μL을 각각 첨가하여 실온에서 20분 동안 세포를 고정한다.
- 고정 용액을 제거하고 잠수 및 플릭 기술을 사용하여 PBS로 셀을 두 번 세척합니다. 잘 PBS에서 2 μg/mL DAPI의 100 μL로 핵을 얼룩.
- 20분 후, 상기에 기재된 침수 및 플릭 기술을 사용하여 얼음-차가운 PBS로 세 번 세포를 헹구는 다(단계 3.2.3). 마이크로 플레이트를 린트가 없는 와이프에 거꾸로 눌러 잔여 PBS를 제거하고 25mL 시약 저장소및 멀티 채널 파이펫을 사용하여 각각 100 μL의 신선한 PBS를 각 웰에 추가하십시오. 지금 세포를 이미지하거나 최대 1 주일 동안 4 °C에서 빛에서 덮여 저장합니다.
참고: 대안적으로, PBS(PBS 대신)에서 글리세롤의 용액을 이미징 및 저장에 사용할 수 있으며 형광을 더 잘 안정화할 수 있습니다(그림 4A). - 이미징 하기 전에 플레이트가 실온에 평형화하도록 하십시오. 소접시를 보풀이 없는 닦아 서 말리십시오.
- 진공에 부착된 멀티채널 포부 어댑터를 사용하여 우물을 흡입하고 1 mg/mL 플루오로포어로 표시된 고분자량(70 kDa)을 우물에 다시 부착하여 40 μL의 혈청 프리 미디어를 첨가합니다. 37°C 세포 인큐베이터에서 세포를 30분 동안 배양한다.
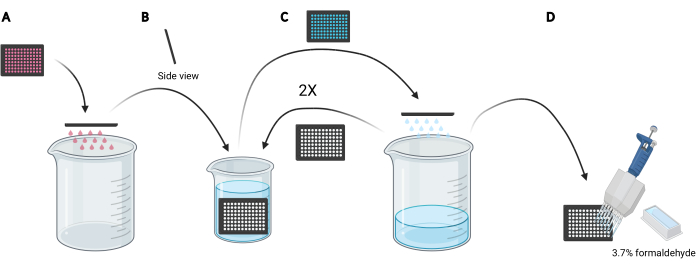
그림 3: 고정을 준비하기 위해 96웰 마이크로 플레이트를 헹구세요. (A) 수동으로 깜박임으로써 용지의 마이크로 플레이트를 5 L 비커로 비웁니다. (B) 수직및 약간의 각도로, 얼음차가운 PBS로 채워진 2 L 비커에 마이크로 플레이트를 천천히 잠급니다. (C) 수동으로 깜박임으로써 PBS의 마이크로 플레이트를 5 L 비커로 비웁니다. B 에 설명된 대로 세척 단계를 두 번 반복합니다. (D) 마지막으로 마이크로 플레이트에서 PBS를 비우고 나서, 멀티채널 파이펫을 사용하여 우물에 100 μL 3.7%의 포름알데히드를 추가한다. BioRender를 사용하여 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 자동 매크로 피노솜 이미징
거형의 이미지는 이전에 설명된 바와 같이 표준 형광 현미경을 사용하여 캡처될 수 있다19,20. 그러나, 이러한 절차는 자동화를 통해 효율성의 관점에서 개선 될 수있다, 특히 수많은 다른 세포 배양 조건을 평가할 때. 이미지 수집의 자동화는 세포 이미징 멀티 모드 플레이트 판독기를 통해 달성될 수 있으며, 이는 처리 절차를 줄임으로써 노력을 줄이고, 중요한 것은 편견없는 방식으로 이미지를 획득하여 데이터 재현성과 신뢰성을 증가시킨다는 것입니다. 여러 이미징 시스템이 시판되고 방향은 계측기마다 다릅니다. 여기서, Cytation 5를 사용하여 이미지를 획득하는 것이 설명된다. 그러나 아래 프로토콜은 다음 지침을 준수하여 각 개별 계측기에 맞게 조정할 수 있습니다.
- dextran 플루오로포레(FITC/TMR) 및 DAPI의 파장 채널에서 40배 의 공기 목표를 사용하여 이미지를 획득하는 자동화 프로토콜을 만듭니다.
참고: 일반적으로 사용되는 거시화증 억제제 EIPA는 FITC 채널에서 자동 불발성을 나타내며, 특히 이전에 DAPI 채널에서 흥분한 경우. 시험중인 다른 화합물은 또한 자동 형광을 표시할 수 있습니다. 이 문제를 우회하려면 이미지 수집이 가장 높은 흥분 파장(FITC/TMR)과 DAPI 채널에서 두 번째로 발생하는 채널에서 먼저 발생하도록 설정하면 이러한 발생을 방지하는 데 도움이 됩니다. - 과다 노출을 피하기 위해 최고 수준의 대시피노세포증을 가질 것으로 예상되는 샘플을 사용하여 노출 설정을 최적화하여 신호의 포화와 강도 데이터의 손실을 초래할 수 있습니다. 샘플을 쉽고 일관되게 찾아 고품질 이미지를 생성하는 포커스 설정을 사용합니다.
- 각 웰 또는 커버슬립에서 여러 이미지를 획득하여 샘플 가변성을 고려하고 시료를 정확하게 표현합니다.
- 이미징 설정이 결정되면 실험 내의 각 샘플에 대해 동일한 설정을 사용합니다.
- Cytation 5 및 Gen5 소프트웨어를 사용할 때 매크로 피노솜 이미지 수집을 위한 지침을 따르십시오.
- 커버슬립 포맷이 있는 24웰 플레이트
- 플레이트 판독기를 시작하고 슬라이드 홀더를 사용하여 현미경 슬라이드를 거꾸로 삽입합니다.
- 마이크로 플레이트 판독기 및 이미징 소프트웨어를 열고 프로토콜을 클릭하여 새 프로토콜 을 만들고 새 프로토콜을 만듭니다. 절차를 두 번 클릭하고 플레이트 유형을 선택합니다.
참고: 플레이트 유형을 사용할 수 없는 경우 시스템 > 플레이트 유형을 클릭하고 제조업체에서 제공하는 플레이트 치수를 사용하여 플레이트 > 유형을 소프트웨어에 추가합니다. 사용하기 쉽기 위해 실리콘 이졸기를 사용하여 세 개의 커버립이 있는 두 개의 현미경 슬라이드용 템플릿이 보충 파일 1에 제공됩니다. - 이미징 설정에 액세스하려면 이미지 > 반전된 이미지 > 동작 >을 선택하고 확인을 클릭 합니다. 와이드 FOV 및 자동 초점 비닝과 함께 40배, PL FL 단계 목표를 사용하십시오.
- 첫 번째 채널의 경우 dextran 불소 라벨(GFP 또는 RFP)에 해당하는 LED 큐브를 선택합니다. 자동 노출 을 클릭하고 현미경 아이콘 버튼을 클릭하여 노출 설정을 최적화합니다. 적절한 노출 설정이 결정되면 설정 저장을 클릭합니다.
참고: 과다 노출된 이미지를 피하기 위해 최고 수준의 대마크피노시토시스를 가질 것으로 예상되는 샘플을 사용하여 노출 설정을 조정하여 신호의 포화와 강도 데이터의 손실을 초래할 수 있습니다. - DAPI LED 큐브를 사용하여 두 번째 채널의 이전 단계를 반복합니다.
- 각 형광 채널에 대한 자동 초점 설정을 설정하고 포커스 옵션을 선택합니다. 기본 초점 방법을 선택 취소하고 dextran-플루오로포어 및 DAPI 채널에 대한 선택적 스캔 없이 선택적 스캔 및 자동 초점으로 자동 초점을 사용합니다. 설정을 저장하려면 확인을 클릭합니다.
참고: 스캔 거리를 200 μm로 줄이고 증가가 20 μm로 감소하여 자동 초점 효율을 높일 수 있습니다. 형광이 낮은 시료에 대한 적절한 자동 초점에 선택적 스캔이 필요합니다. 이는 일반적으로 거시피노세포증이 억제되거나 선천적으로 존재하지 않는 경우와 같이 낮은 대식세포증을 가진 조건을 분석할 때 발생합니다. - 비콘 정의 옵션을 사용하여 커버슬립의 여러 영역에서 이미지 수집을 자동화합니다. 현미경 아이콘을 클릭하고 이미지 창을 클릭하고 스테이지를 다음 영역으로 이동하여 비콘을 추가합니다. 적절한 수의 영역을 선택한 경우 다음 커버슬립으로 이동하여 프로세스를 반복합니다. 완료하려면 설정 저장을 클릭합니다.
참고: 샘플 전체에서 매크로피노세포증의 좋은 표현을 얻으려면 커버슬립(그림 4B)에 고르게 분포되는 약 20개의 비콘을 선택합니다. 비콘을 적게 사용할 수 있지만 이미지에 초점이 맞거나 거품이나 형광 얼룩 및 얼룩이 들어있는 경우와 같이 품질 불일치로 인해 이미지 분석에서 제외해야 할 수 있습니다. - 이미징 설정 의 조정을 완료하려면 확인을 클릭 합니다. 커버립을 이미지화하려면 새 실험 만들기를 선택하고 프로토콜 도구에서 지금 읽기를 선택합니다. 메시지가 표시되면 프로토콜과 실험을 저장합니다.
- 커버슬립 포맷이 있는 24웰 플레이트
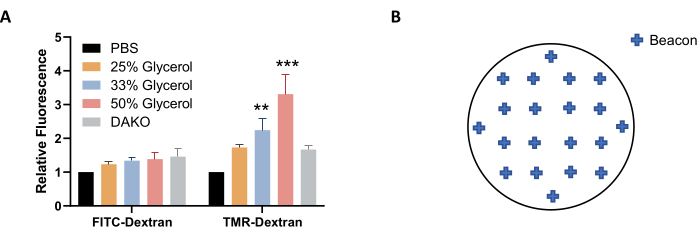
도 4: 이미지 수집을 위한 조건의 최적화. (A) 글리세롤 농도를 증가시켜 EGF로 처리된 AsPC-1 세포에서 결정된 바와 같이 TMR-dextran 형광이 증가한다. (B) 커버립 포맷이 있는 24웰 플레이트를 사용할 때 자동 이미지 수집을 위한 이미징 비콘의 예 좌표. 막대 그래프는 5개의 실험의 SEM을 가진 평균 상대형광을 보여줍니다. 통계적 유의성은 PBS에 비해 양방향 ANOVA에 의해 결정되었다. ** p < 0.01; p < 0.001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 96웰 마이크로플레이트 포맷
- 플레이트 판독기를 시작하고 마이크로 플레이트를 삽입합니다.
- 마이크로 플레이트 판독기 및 이미징 소프트웨어를 열고 프로토콜을 클릭하여 새 프로토콜 을 만들고 새 프로토콜을 만듭니다. 절차를 두 번 클릭하고 플레이트 유형을 선택합니다.
참고: 플레이트 유형을 사용할 수 없는 경우 시스템 > 플레이트 > 유형을 클릭하고 제조업체에서 제공한 플레이트 치수를 사용하여 플레이트 유형을 소프트웨어에 추가합니다. 사용 편의성을 위해 PerkinElmer의 CellCarrier-96 울트라 마이크로 플레이트템플릿은 보충 파일 2에 제공됩니다. - 이미징 설정에 액세스하려면 이미지 > 반전된 이미저에 > 작업을 선택하고 확인을 클릭 합니다. 와이드 FOV 및 자동 초점 비닝으로 40x PL FL 단계 목표를 사용하십시오.
- 첫 번째 채널의 경우 dextran 불소 라벨(GFP 또는 RFP)에 해당하는 LED 큐브를 선택합니다. 자동 노출 을 클릭하고 현미경 아이콘 버튼을 클릭하여 노출 설정을 최적화합니다. 적절한 노출 설정이 결정되면 설정 저장을 클릭합니다.
참고: 노출 설정의 최적화 중에 상당한 형광 표백이 발생할 수 있습니다. 이렇게 하면 새 필드가 이미지화될 때 과다 노출을 유발하는 설정이 발생할 수 있습니다. 따라서 아직 노출되지 않은 필드를 확인하고 선택한 설정에서 신호의 채도가 발생하지 않는다는 것을 보장하여 노출 설정을 검증합니다. 형광이 최적화 하는 동안 표백의 결과로 감소 했기 때문에, 거시적인 정량화에서 노출 설정의 최적화에 사용되는 우물을 포함 하지 마십시오. 과다 노출 된 이미지를 피하기 위해 가장 높은 수준의 대마크피노사이토시스를 가질 것으로 예상되는 샘플을 사용하여 노출 설정을 조정하여 신호의 포화와 강도 데이터의 손실을 초래할 수 있습니다. - DAPI LED 큐브를 사용하여 두 번째 채널의 이전 단계를 반복합니다.
- 각 형광 채널에 대한 자동 초점 설정을 설정하고 포커스 옵션을 선택합니다. 기본 초점 메서드를 선택 취소하고 레이저 자동 초점을 사용합니다. 거형 및 핵의 최적 시각화를 위한 초점 평면을 결정한 후 참조 스캔을 캡처합니다. 설정을 저장하려면 확인 을 클릭합니다.
참고: 스캔 거리를 400 μm로 줄이고 증가도 3 μm로 감소하여 자동 초점 효율을 높일 수 있습니다. 레이저 자동 초점 옵션이 제대로 작동하려면 플레이트 바닥을 청소하고 이미징 전에 보풀이없는 닦아 플레이트를 닦으십시오. 레이저 자동 초점은 초점 평면을 찾는 데 최소한의 시간이 필요하기 때문에 초점에 대한 우수한 방법입니다. 다른 초점 방법이 사용될 수 있지만, 유정에 페이드 방지가 첨가되지 않았기 때문에 이러한 방법은 데이터 수집에 부정적인 영향을 미칠 시료의 상당한 표백을 일으킬 수 있습니다. - 가로 및 수직 오프셋을 0으로 설정하고 단일 이미지 에서 겹치지 않는 몽타주를 선택하고 분석에 포함되기를 원하는 셀 수에 따라 3 x 3 이미지를 사용합니다.
참고: 세포의 크기와 밀도에 따라 샘플 전체에서 대식세포증의 대표적인 평가를 얻기 위해 더 많거나 적은 이미지를 촬영할 수 있습니다. 다양한 조건하에서 AsPC-1 또는 MIA PaCa-2 세포에서 거시성 세포증을 평가하며, 2 x 2 또는 4 x 4 사진 프레임 간의 데이터 해석의 차이는 관찰되지 않지만, 복제 샘플 간의 변화는 사진을 덜 찍을 때 증가할 수 있습니다(그림 5A,B). 프레임 크기를 늘리거나 줄이면 플레이트를 스캔하는 데 걸리는 시간에 영향을 미칩니다. 노출 시간에 따라 전체 96웰 마이크로 플레이트는 약 1-1.5h가 소요되어 3 x 3 프레임을 사용하여 완전히 스캔합니다. 2 x 2 및 4 x 4 프레임은 각각 해당 시간을 절반으로 줄이거나 두 배가 됩니다. - 이미징 설정 의 조정을 완료하려면 확인을 클릭 합니다.
- 플레이트를 이미지화하려면 새 실험 만들기를 선택하고 프로토콜 도구에서 지금 읽기합니다. 메시지가 표시되면 프로토콜과 실험을 저장합니다.
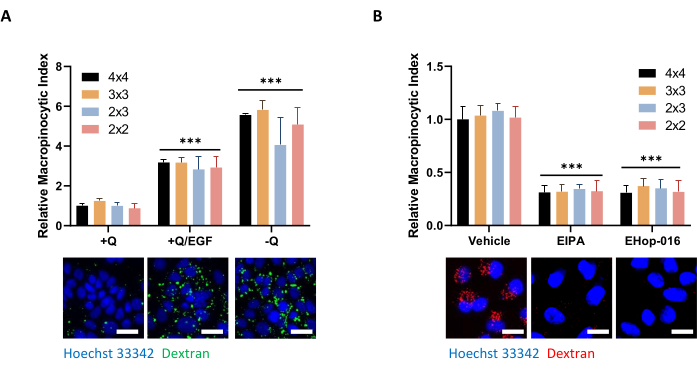
도 5: PDAC 세포에서 거시피노세포증을 평가하기 위한 제어 조건. (A) AsPC-1 세포는 24시간 동안 100 ng/mL EGF 자극에 반응하여 매크로피노시토시스를 표시한다. 이미지 수집의 경우 4 x 4, 3 x 3, 2 x 3 또는 2 x 2의 액자가 촬영되어 데이터 품질에 대한 사진 수의 영향을 결정했습니다. (B) MIA PaCa-2 세포는 75 μM EIPA 또는 10 μM EHop-016을 가진 2-h 처리로 30 분 처리에 의해 억제되는 구성적인 macropinocytosis를 보여줍니다. 사진 프레임은 A에서와 같이 촬영되었습니다. 스케일 바 = 25 μm. 막대 그래프는 4개의 복제를 가진 1개의 실험의 SD를 가진 평균 상대 적인 매크로피노사이클 인덱스를 보여줍니다. 통계적 유의성은 +Q 또는 차량 상태에 비해 양방향 ANOVA에 의해 결정되었다. p < 0.001 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 매크로피노사이클 지수 결정
'매크로피노키틱 지수'는 현미경 이미징19를 사용하여 세포당 형광 dextran 섭취량을 정량화하여 결정되는 세포 매크로 피노키토시스의 정도이다. 이를 위해, 획득된 심상은 DAPI 염색에 의해 결정된 총 형광 강도 또는 형광 양성 영역 및 총 세포 수를 측정하여 내면화된 덱스의 양을 결정하는 데 사용된다. 이러한 분석은 이전에 설명된 바와 같이 셀 프로파일러 또는 FIJI/ImageJ와 같은 오픈 소스 이미지 처리 및 분석 소프트웨어로 수행될 수 있다19,20. 그러나 다중 모드 플레이트 판독기와 함께 작업할 때 계측기와 함께 제공된 소프트웨어에는 대식세포 인덱스를 계산하기 위해 사용될 수 있는 내장 분석 응용 프로그램이 포함될 수 있다. 경우에 따라 기본 제공 소프트웨어 분석 파이프라인이 사용자에게 완전히 명확하지 않을 수 있습니다. 따라서 셀 프로파일러 또는 FIJI/ImageJ와 같은 자동화되지 않은 절차와 비교하여 초기 단계에서 소프트웨어의 유효성을 검사하는 것이 좋습니다. 이 프로토콜은 다음과 같은 일반적인 지침을 준수하여 다른 이미지 처리 및 분석 소프트웨어 도구에 맞게 조정할 수 있습니다.
- DAPI 및 해당 dextran 이미지의 경우 롤링 볼 함수라고 도포하는 적절한 함수를 적용하여 배경을 뺍니다. 배경 노이즈를 최소화하고 DAPI 및 dextran 신호에 빼기 효과가 최소화되도록 설정을 조정합니다.
- 높은 dextran 신호가 있는 필드를 사용하여, 자주 임계 함수라고 불리는 강도 신호 설정을 결정하고 핵을 선택하고 거시적 인 경우에만 선택하는 데 필요한 최소 강도 신호 설정을 결정합니다.
- dextran 이미지의 경우 생성된 매크로피노솜 선택 내에서 총 형광을 계산하거나 선택을 사용하여 dextran에 대한 총 면적 양성을 결정합니다.
- DAPI 이미지의 경우, 선택 영역을 사용하여 이미지내의 핵 수를 결정하여 존재하는 세포의 수를 반영한다.
- 거시적 색소 색인을 결정하기 위해, 총 dextran 형광 또는 면적을 DAPI에 의해 결정된 세포의 수로 나눕니다.
- 전체에서 동일한 숫자 설정을 적용하는 모든 획득된 이미지에 대해 이러한 분석 단계를 반복합니다.
- Gen5 소프트웨어를 사용할 때 매크로피노사이클 인덱스를 결정하기 위한 다음 지침을 따르십시오.
참고: 내장 분석 파이프라인이 유효성을 검사하고 피지/ImageJ에 비해 계산의 차이가 없음을 감지했습니다(그림 6A).- 이미징이 완료되면 높은 수준의 대식세포증을 가진 이미지를 선택합니다. 배경 신호를 제거하고 프로세스 (추가 그림 1A)를 클릭하고 이미지 전처리 옵션을 선택합니다.
- dextran 채널의 경우 자동 선택을 취소하고 5 μm의 롤링 볼 직경을 사용하여 미세 한 결과의 우선 순위를 지정하고 1 사이클로 이미지를 부드럽게합니다.
- DAPI 채널의 경우 자동 전처리 및 1개의 부드러운 주기를 사용합니다. 확인을 클릭하고 프로토콜에 이미지 전처리 단계를 추가합니다. 단계 추가를 클릭합니다. 다음으로 이미지 롤아웃(추가 그림 1B)에서 처리된 이미지를 선택하고 분석 버튼(추가 그림 1C)을 클릭합니다.
- 분석 설정에서 셀룰러 분석에 형식을 설정합니다. DAPI 채널을 선택하고 옵션(추가 그림 2A)을 클릭합니다.
- 1차 마스크의 경우, 처리된 DAPI 이미지를 사용하여 단일 핵을 선택하는 마스크를 만듭니다. 어두운 배경 및 자동 옵션을 사용합니다. 또한 단일 핵의 마스크 선택을 허용하는 설정을 결정하고 완료되면 적용 버튼을 클릭하여 마스크가 적절하게 적용되었는지 확인합니다.
참고: 스플릿 터치 오브젝트 를 활성화하고 마스크 옵션의 채우기 구멍은 단일 핵을 선택하는 데 가장 적합할 수 있습니다. 최소 및 최대 물체 크기는 셀라인에 따라 조정되어야 할 수 있으며 가장 일반적으로 5-40 μm 범위에서 설정됩니다. 기본 가장자리 개체 를 포함할 수 있으며 전체 이미지를 분석해야 합니다. 슬라이더를 적용하여 마스크 선택을 신호 강도로 조정할 수 있습니다. - 다음으로 보조 마스크를 적용하여 매크로피노솜 형광 펀크타를 선택하는 설정을 최적화합니다. 보조 마스크 함수 내에서 측정값을 사용하고 셀 크기에 따라 기본 마스크를 40 μm로 확장합니다.
- 마스크 메서드에서 임계값 함수 및 임계값 을 사용하여 양수 dextran 영역을 선택합니다. 적용을 클릭하여 설정이 올바르게 적용되는지 확인합니다.
참고: 임계값을 확인하려면 선 프로필 보기 도구(추가 그림 2B)를 사용하여 dextran 양성 영역(보충 도 2C)에 선을 그립니다. 측정된 강도를 사용하여 최적의 설정을 결정하여 매크로피노좀을 선택하고 배경 신호(보충 도 2D)를 제외하는 마스크를 만듭니다. - 핵및 매크로피노좀을 선택하는 적절한 마스크를 만든 후 계산된 메트릭 탭을 클릭하고 관심 있는 개체 수준 메트릭 선택 또는 만들기를 선택합니다.
- 현재 모든 메트릭을 제거하고 보조 마스크 분석을 위해 일체 및 영역 메트릭을 추가합니다. 확인 을 클릭하고 새 메트릭에 대한 계산 및 표시 를 선택합니다. 완료되면 확인 을 클릭하고 STEP 추가 를 선택하여 프로토콜에 분석 및 계산을 추가합니다.
- 나중에 사용할 수 있는 확정된 프로토콜을 저장하고 , 파일을 클릭하고 프로토콜을 저장합니다.
- 데이터 분석이 완료된 후 관심 메트릭을 선택하고 데이터를 내보내 매크로피노키틱 인덱스를 결정합니다. 다음과 같이 대식세포 인덱스를 결정합니다.
세포당 Dextran 형광 = 개체 Int_2[Dextran 형광]
셀당 Dextran 영역 = 개체 Area_2[Dextran 불소호]
참고: 커버립 형식이 있는 24웰 플레이트의 경우 메트릭은 이미지당 평균 대마크피노키틱 인덱스의 평균을 반영합니다. 또는 모든 이미지에 대해 '영역' 또는 '모성'의 합계를 총 '셀 카운트'로 나누어 전체 샘플에 대해 매크로피노키틱 인덱스를 수동으로 계산할 수 있습니다. 대부분의 설정에서 대식세포 인덱스를 계산할 때 이러한 접근 방식간의 차이는 최소화됩니다. 96웰 마이크로플레이트 형식의 경우 대식세포 인덱스는 전체 샘플의 평균으로 계산됩니다. - 이미징 및 후속 자동화 된 분석을 위한 프로토콜을 저장합니다. 동일한 형광을 사용하여 향후 실험을 위해 프로토콜을 다시 사용합니다.
참고: 레이저 자동 초점 기능을 사용하는 경우 핵및 매크로피노좀이 다른 평면으로 국한되기 때문에 다른 세포주를 분석해야 할 때 새로운 기준 검사를 수행해야 합니다. 이전에 결정된 프로토콜을 사용하여 새 실험을 수행할 때마다 해당 실험에 대한 노출 설정을 최적화해야 합니다.
6. 트리트먼트 추가
세포 치료 (소분자, 생물학적 제제, 성장 인자, 대사 산물 등)는 프로토콜의 모든 단계에서 통합 될 수 있으며 정확한 타이밍은 연구의 목표와 목표에 따라 달라집니다.
- 섹션 2에서와 같이 셀을 준비합니다.
- 관심의 치료를 추가하기 직전에 혈청이없는 미디어에서 최종 농도의 두 배로 치료와 적절한 제어를 준비하십시오. 평가되는 복제 우물의 수의 양과 동일한 볼륨으로 치료를 준비합니다.
참고: 분비 된 요인이 세포 기능을 제어할 때 재생할 수 있는 역할을 감안할 때, 조건부 미디어에 대한 관심의 치료를 희석하는 것이 바람직할 수 있습니다. 이러한 목적을 위해, 6cm 또는 10cm 세포 배양 식기와 같은 추가 플레이트를 종자하는 것이 도움이 될 수 있으며, 2항에 설명된 바와 같이 세포를 준비할 때 치료 용액의 제조를 위한 조건부 배지를 생성하는 데 도움이 될 수 있다. - 우물에서 미디어를 제거하지 않고, 각 우물에 치료 용액의 하나의 잘 볼륨을 추가합니다. 적절한 혼합을 보장하기 위해 접시를 흔들어. 원하는 시간 동안 세포를 배양합니다.
- 섹션 3을 계속합니다.
참고: dextran을 추가할 때, 신선한 매체의 사용은 추가된 처리의 제거를 일으키는 원인이 되는, 매크로 피노세포증의 수준에 영향을 미칠 수 있는. 따라서, 치료또는 대안적으로 치료를 다시 추가하거나 조절된 매체를 재사용하여 덱넨 용액을 준비하지 않고 우물에 직접 덱센을 추가하는 것이 바람직할 수 있다.
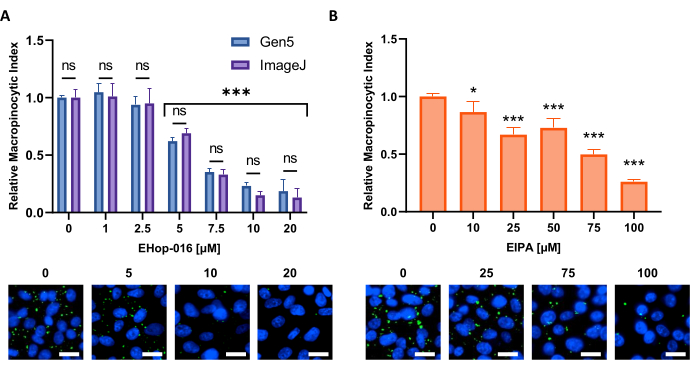
그림 6: 거시화 억제제에 대한 용량 반응 곡선을 수행. 새로운 세포주에서 알려진 매크로피노세포증 억제제를 시험할 때 얻어진 예데이터. PATU8998T 세포는 96웰 마이크로플레이트 포맷을 위해 사용되었고( A) EHop-16 및 (B) EIPA의 표시 농도로 2h 및 30분 동안 처리되었다. Gen5 소프트웨어 또는 ImageJ에 의해 이미지 분석을 통해 얻은 결과를 비교하면 ns(A)로 표시된 두 접근 방식 간에 큰 차이가 없습니다. 스케일 바 = 25 μm. 막대 그래프는 복제 4개를 가진 단일 실험의 평균 및 SD를 보여 준다. 통계적 유의성은 치료되지 않은 조건에 비해 1-또는 양방향 ANOVA에 의해 결정되었다. * p < 0.05; p < 0.001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
전술한 프로토콜의 단계 및 조정이 그에 따라 따를 때, 최종 실험 결과는 연구된 세포 배양 조건 또는 억제제가 관심 있는 세포주에서 거체피노세포증을 유도하거나 감소시키는지에 대한 정보를 제공해야 한다. 이러한 발견의 타당성을 강화하기 위해 제어 조건을 포함하면 실험이 성공적으로 완료되었는지 여부를 결정할 수 있습니다. 매크로피노세포증 유도 컨트롤은 상대적인 수준의 대시노세?...
토론
실험 및 데이터 수집의 품질은 시약의 품질, 설정 최적화 및 커버립 및 마이크로 플레이트의 청결에 따라 크게 달라집니다. 최종 결과는 복제 간에 최소한의 변형을 제공해야 합니다. 그러나 생물학적 변이는 자연적으로 발생하거나 여러 가지 요인에 의해 발생할 수 있습니다. 세포 밀도는 세포가 거시세포증 유도제 또는 억제제에 다소 반응하도록 원인이 될 수 있다. 따라서 프로토콜에서 제안된...
공개
C.C.'암 진단, 치료제 및 약물 발견'이라는 제목의 특허의 발명가입니다.' 특허 번호: 9,983,194.
감사의 말
이 작품은 NIH/NCI 보조금(R01CA207189, R21CA243701)이 C.C KMO.G.에 지원하여 TRDRP 박사 후 펠로우십 어워드(T30FT0952)의 수상자입니다. BioTek Cytation 5는 NCI 암 센터 지원 보조금 (P30 CA030199)으로부터 재정 지원을받는 샌포드 번햄 프리비스 세포 이미징 코어의 일부입니다. 그림 1-3은 BioRender를 사용하여 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
참고문헌
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유