Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Automatisierte Bildgebung und Analyse zur Quantifizierung fluoreszenzmarkierter Makropinosomen
In diesem Artikel
Zusammenfassung
Automatisierte Assays mit Multi-Well-Mikroplatten sind vorteilhafte Ansätze zur Identifizierung von Signalwegregulatoren, indem sie die Bewertung einer Vielzahl von Bedingungen in einem einzigen Experiment ermöglichen. Hier haben wir das etablierte Makropinosomen-Bildgebungs- und Quantifizierungsprotokoll an ein 96-Well-Mikroplattenformat angepasst und bieten einen umfassenden Überblick über die Automatisierung mit einem Multimode-Plattenleser.
Zusammenfassung
Makropinozytose ist ein unspezifischer Flüssigkeitsphasenaufnahmeweg, der es Zellen ermöglicht, große extrazelluläre Fracht wie Proteine, Krankheitserreger und Zelltrümmer durch Bulk-Endozytose zu internalisieren. Dieser Signalweg spielt eine wesentliche Rolle bei einer Vielzahl von zellulären Prozessen, einschließlich der Regulierung von Immunantworten und des Stoffwechsels von Krebszellen. Angesichts dieser Bedeutung für die biologische Funktion kann die Untersuchung der Zellkulturbedingungen wertvolle Informationen liefern, indem Regulatoren dieses Signalwegs identifiziert und die Bedingungen für die Entdeckung neuartiger therapeutischer Ansätze optimiert werden. Die Studie beschreibt eine automatisierte Bildgebungs- und Analysetechnik unter Verwendung von Standardlaborgeräten und einem zellbildenden Multimode-Plattenleser zur schnellen Quantifizierung des makropinozytären Index in adhärenten Zellen. Die automatisierte Methode basiert auf der Aufnahme von hochmolekularem fluoreszierendem Dextran und kann auf 96-Well-Mikrotiterplatten angewendet werden, um die Beurteilung mehrerer Bedingungen in einem Experiment oder fester Proben auf Glasdeckgläsern zu erleichtern. Dieser Ansatz zielt darauf ab, die Reproduzierbarkeit zu maximieren und die experimentelle Variation zu reduzieren, während er gleichzeitig zeitsparend und kostengünstig ist.
Einleitung
Der unspezifische endozytäre Weg der Makropinozytose ermöglicht es Zellen, eine Vielzahl von extrazellulären Komponenten, einschließlich Nährstoffen, Proteinen, Antigenen und Krankheitserregern, durch Massenaufnahme von extrazellulärer Flüssigkeit und ihren Bestandteilen zu internalisieren1. Obwohl wichtig für die Biologie zahlreicher Zelltypen, wird zunehmend beschrieben, dass der Makropinozytoseweg eine wesentliche Rolle in der Tumorbiologie spielt, wo Tumorzellen durch makropinozytäre Aufnahme in der Lage sind, in Gegenwart einer nährstoffarmen Mikroumgebung zu überleben und sich zu vermehren2,3. Die Aufnahme extrazellulärer Makromoleküle, einschließlich Albumin und extrazellulärer Matrix, sowie nekrotischer Zelltrümmer bietet eine alternative Nährstoffquelle für die Biomasseproduktion, indem Aminosäuren, Zucker, Lipide und Nukleotide durch Makropinosomen- und Lysosomenfusions-vermittelte Frachtkatabolismus erzeugt werden4,5,6,7,8.
Die Induktion und Regulation der Makropinozytose ist komplex und kann je nach zellulärem Kontext variieren. Bisher wurden mehrere Induktoren der Makropinozytose identifiziert und umfassen Liganden wie den epidermalen Wachstumsfaktor (EGF), den von Thrombozyten abgeleiteten Wachstumsfaktor (PDGF), Galectin-3 und Wnt3A9,10,11,12,13. Darüber hinaus können Kultivierungsbedingungen, die die Tumormikroumgebung nachahmen, die Aktivierung des Signalwegs auslösen. Tumoren des duktalen Adenokarzinoms (PDAC) der Bauchspeicheldrüse sind nährstoffarm, insbesondere für die Aminosäure Glutamin, die dazu führt, dass sowohl Krebszellen als auch krebsassoziierte Fibroblasten (CAFs) auf Makropinozytose angewiesen sind7,13,14,15. Darüber hinaus können Tumorbelastungen wie Hypoxie und oxidativer Stress diesen Fressweg aktivieren16. Zusätzlich zu den zahlreichen extrinsischen Einflussfaktoren, die Makropinozytose induzieren können, steuern eine Vielzahl von intrazellulären Signalwegen die Bildung von Makropinosomen. Die onkogene Ras-vermittelte Transformation reicht aus, um die makropinozytische Maschinerie zu initiieren, und mehrere Krebsarten weisen eine onkogene Ras-gesteuerte konstitutive Makropinozytose auf4,5,9,17. Alternativ wurden Wildtyp-Ras-Aktivierung und Ras-unabhängige Signalwege identifiziert, um makropinozytose in Krebszellen und CAFs zu aktivieren10,11,15,18. Die Verwendung verschiedener In-vitro-Modelle in Kombination mit Inhibitorbehandlungen hat zur Identifizierung mehrerer Makropinozytosemodulatoren geführt, darunter Natrium-Wasserstoff-Austauscher, die kleine GTPase Rac1, die Phosphoinositid-3-Kinase (PI3K), die p21-aktivierte Kinase (Pak) und die AMP-aktivierte Proteinkinase (AMPK)4,13,15 . Angesichts der Vielzahl der beschriebenen Faktoren und Bedingungen, die die Makropinozytose regulieren, ist es jedoch denkbar, dass noch viel mehr Modulatoren und Reize unentdeckt bleiben. Die Identifizierung neuartiger Modulatoren und Stimuli kann durch die automatisierte Bewertung einer Vielzahl von Bedingungen in einem einzigen Experiment erleichtert werden. Diese Methodik kann Aufschluss über die Faktoren geben, die an der Bildung von Makropinosomen beteiligt sind, und kann die Entdeckung neuartiger kleiner Moleküle oder Biologika ermöglichen, die auf diesen Signalweg abzielen.
Hier haben wir unser bisher etabliertes Protokoll zur Bestimmung des Ausmaßes der Makropinozytose in Krebszellen in vitro auf ein 96-Well-Mikroplattenformat und automatisierte Bildgebung und Quantifizierung angepasst19,20. Dieses Protokoll basiert auf der Fluoreszenzmikroskopie, die zu einem Standard auf dem Gebiet der Bestimmung der Makropinozytose in vitro und in vivo geworden ist4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Makropinosomen können von anderen endozytären Signalwegen durch ihre Fähigkeit unterschieden werden, große Makromoleküle wie hochmolekulares Dextran (d.h. 70 kDa)2,3,4,20,21,22,23 zu internalisieren. Somit können Makropinosomen durch aufnahme von extrazellulär verabreichtem Fluorophor-markiertem 70 kDa Dextran definiert werden. Infolgedessen manifestieren sich makropinozytäre Vesikel als intrazelluläre Cluster fluoreszierender Punktika mit Größen von 0,2-5 μm. Diese Puncta können mikroskopisch abgebildet und anschließend quantifiziert werden, um das Ausmaß der Makropinozytose in der Zelle - den "makropinozytären Index" - zu bestimmen.
In diesem Protokoll werden die wesentlichen Schritte zur Visualisierung von Makropinosomen in adhärenten Zellen in vitro auf einer 96-Well-Mikroplatte und Deckgläsern mit Standardlaborgeräten beschrieben (Abbildung 1). Darüber hinaus werden die Anweisungen zur Automatisierung der Bildaufnahme und Quantifizierung des makropinozytären Index mit einem cell imaging Multimode-Plattenleser bereitgestellt. Diese Automatisierung reduziert Zeit, Kosten und Aufwand im Vergleich zu unseren zuvor beschriebenen Protokollen19,20. Darüber hinaus vermeidet es eine unbeabsichtigt verzerrte Bilderfassung und -analyse und erhöht dadurch die Reproduzierbarkeit und Zuverlässigkeit. Diese Methode kann leicht an verschiedene Zelltypen oder Plattenleser angepasst oder zur Bestimmung alternativer Makropinosomenmerkmale wie Größe, Anzahl und Position verwendet werden. Das hierin beschriebene Verfahren eignet sich insbesondere für das Screening von Zellkulturbedingungen, die makropinozytose induzieren, die Identifizierung neuartiger Modulatoren oder die Optimierung von Wirkstoffkonzentrationen bekannter Inhibitoren.
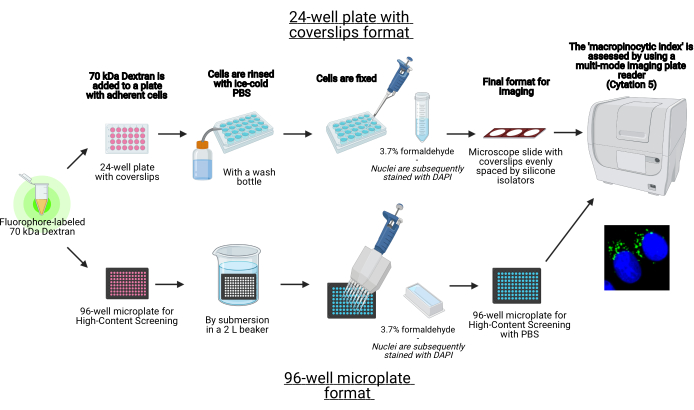
Abbildung 1: Schematische Darstellung des automatisierten Assays zur Bestimmung des "makropinozytären Index" in adhärenten Zellen. Erstellt mit BioRender. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
1. Vorbereitung der Materialien
- Lösen Sie 70 kDa Dextran, das mit FITC oder Tetramethylrhodamin (TMR) markiert ist, in PBS, um eine 20 mg/ml-Lösung zu erhalten. Lagern Sie die Aliquots bei -20 °C.
- DaPI in ddH2O auflösen, um eine 1 mg/ml Lösung zu erhalten. Lagern Sie die Aliquots bei -20 °C.
VORSICHT: DAPI ist ein potenzielles Karzinogen und sollte mit Vorsicht behandelt werden. - Bereiten Sie am Tag der Fixierung frisches 3,7% ACS-Formaldehyd in PBS zu.
VORSICHT: Formaldehyd ist ein Fixiermittel, bekanntes Karzinogen und ist giftig, wenn es eingeatmet wird. Stellen Sie die Lösung in einem chemischen Abzug her, um ein Einatmen zu vermeiden, und behandeln Sie sie mit Vorsicht. - Bereiten Sie säuregewaschene Deckelpisten vor.
- Verwenden Sie ein 500-ml-Becherglas und ein Wasserbad, um 28 g Borosilikatglas-Deckgläser mit einem Durchmesser von 12 mm und einer Dicke von # 1,5 für 24 h bei 56 ° C in 100 ml 1 M HCl zu erhitzen.
VORSICHT: HCl ist eine starke Säure, die stark korrosiv ist und daher mit Vorsicht behandelt und in einem chemischen Abzug verwendet werden sollte, um ein Einatmen zu vermeiden. - Die Deckgläser mit destilliertem Wasser waschen. Wiederholen Sie die Wäsche 4 Mal. Dann waschen Sie die Deckgläser mit 95% Ethanol. Wiederholen Sie die Wäsche 4 Mal.
- Lagern Sie die säuregewaschenen Deckgläser in einer Zellkulturschale bei Raumtemperatur für die zukünftige Verwendung, indem Sie die Sterilität durch Eintauchen in 95% Ethanol aufrechterhalten. Verschließen Sie die Schale mit Parafilm, um eine ausgedehnte Verdunstung zu vermeiden.
- Verwenden Sie ein 500-ml-Becherglas und ein Wasserbad, um 28 g Borosilikatglas-Deckgläser mit einem Durchmesser von 12 mm und einer Dicke von # 1,5 für 24 h bei 56 ° C in 100 ml 1 M HCl zu erhitzen.
2. Vorbereitung der Zellen
- Unter Verwendung einer konfluenten 10 cm Gewebekulturplatte mit den adhärenten Zellen von Interesse, aspirieren Sie die Medien und spülen Sie die Zellen mit 5 ml DPBS, vorgewärmt bei 37 ° C.
- Lösen Sie die Zellen von der Platte, indem Sie 1,5 ml vorgewärmtes 0,25% Trypsin hinzufügen und bei 37 ° C inkubieren.
HINWEIS: Die Trypsin-Inkubationszeit, die zum Lösen der interessierenden Zellen erforderlich ist, sollte empirisch bestimmt werden und kann durch Beobachtung der Ablösung unter einem herkömmlichen Lichtmikroskop bestätigt werden. - Sammeln Sie die Zellen in einem 15-ml-Zentrifugenröhrchen und fügen Sie 4,5 ml vollständiges Medium hinzu, um das Trypsin zu löschen.
- Pelletieren Sie die Zellen durch Zentrifugation für 3 min bei 200 x g und saugen Sie den Überstand ab.
- Resuspendieren Sie das Zellpellet in einem ausreichenden Volumen vorgewärmter kompletter Medien, um eine einzelne Zellsuspension für die Aussaat zu erhalten.
- Fahren Sie fort, die Zellen auf einer 24-Well-Platte mit Deckgläsern oder einem 96-Well-Mikroplattenformat zu säen (Abbildung 1).
HINWEIS: Die Anzahl der zu säenden Zellen sollte für jede Zelllinie empirisch bestimmt werden, da die Proliferationsraten und die Größe zwischen den Zelllinien variieren. Dieses Protokoll wurde für adhärente Krebszellen mit 80% Zellkonfluenz am Tag der Makropinosomenmarkierung optimiert. Die Zellkonfluenz kann die makropinozytische Kapazität beeinflussen, und dies sollte auch empirisch bestimmt werden.- 24-Well-Platte mit Deckglasformat
- Fügen Sie Deckgläser zu einer 24-Well-Gewebekulturplatte hinzu, verwenden Sie eine Pinzette, um einen einzelnen Deckglas aus dem Ethanolbad zu greifen. Klopfen Sie mit dem Deckglas auf die Innenwand der Platte, um überschüssiges Ethanol zu entfernen, und legen Sie den Deckglas flach auf den Boden eines Brunnens.
- Lassen Sie das Ethanol verdampfen und waschen Sie den Deckglas 2 mal mit DPBS.
- Säen Sie die Zellen auf dem Deckglas, indem Sie 500 μL der Zellsuspension zu jeder Vertiefung hinzufügen. Legen Sie die Zellen in einen 37 °C Zellinkubator mit 5% CO2 , bis die Zellkonfluenz am Tag vor der Makropinosomenmarkierung 60%-80% erreicht.
- Am Tag vor der Makropinosomenmarkierung die Medien aus den Vertiefungen absaugen und 500 μL vorgewärmte serumfreie Medien in jede Vertiefung geben und die Zellen für 16-24 h in einen 37 °C Zellinkubator mit 5% CO2 legen.
HINWEIS: Abhängig von den zu untersuchenden Bedingungen wird serumfreie Medien empfohlen, um die Auswirkungen von Wachstumsfaktoren zu reduzieren, die makropinozytose induzieren können und die normalerweise im Serum vorhanden sind. Es sollte jedoch berücksichtigt werden, dass Serummangel andere zelluläre Prozesse wie Proliferation und Autophagie beeinflussen kann. Da Restserum die makropinozytische Kapazität der Zellen sowie die Inhibitoraktivität beeinflussen kann, kann die Entfernung des Serums verbessert werden, indem die Zellen 1- oder 2-mal vorsichtig mit 500 μL vorgewarmtem DPBS gespült werden.
- 96-Well-Mikroplattenformat
- Übertragen Sie die Zellsuspension in ein 25 ml Reagenzreservoir. Mit einer Mehrkanalpipette (8 oder 12 Kanäle) werden 100 μL der Zellsuspension in jede Vertiefung einer schwarzen 96-Well-High-Content-Screening-Mikroplatte mit optisch klarem zyklischem Olefin oder Glasboden ausgesät.
- Legen Sie die Zellen in einen 37 °C Zellinkubator mit 5% CO2 , bis die Zellkonfluenz am Tag vor der Makropinosomenmarkierung 60%-80% erreicht.
- Am Tag vor der Makropinosomen-Beschriftung entfernen und entsorgen Sie die Medien aus jeder Vertiefung mit einer Mehrkanalpipette (8 oder 12 Kanäle) oder einem Mehrkanal-Aspirationsadapter für Standardspitzen, die an einer Vakuumpumpe befestigt sind.
- Geben Sie mit einem Reagenzreservoir und einer Mehrkanalpipette (8 oder 12 Kanäle) vorsichtig 100 μL vorgewärmte serumfreie Medien in jede Vertiefung. Legen Sie die Zellen für 16-24 h in einen 37 °C Zellinkubator mit 5% CO2 .
HINWEIS: Abhängig von den zu untersuchenden Bedingungen wird serumfreie Medien empfohlen, um die Auswirkungen von Wachstumsfaktoren zu reduzieren, die makropinozytose induzieren können und die normalerweise im Serum vorhanden sind. Es sollte jedoch berücksichtigt werden, dass Serummangel andere zelluläre Prozesse wie Proliferation und Autophagie beeinflussen kann. Da Restserum die makropinozytäre Kapazität der Zellen sowie die Inhibitoraktivität beeinflussen kann, kann die Entfernung des Serums verbessert werden, indem die Zellen 1- oder 2-mal mit 100 μL vorgewarmtem DPBS sanft gespült werden.
- 24-Well-Platte mit Deckglasformat
3. Makropinosomen-Kennzeichnung
- 24-Well-Platte mit Deckglasformat
- Aspirieren Sie die Vertiefungen und geben Sie 200 μL serumfreie Medien mit 1 mg/ml Fluorophor-markiertem Dextran mit hohem Molekulargewicht (70 kDa) zurück. Legen Sie die Zellen für 30 min in einen 37 °C Zellinkubator.
HINWEIS: Abhängig von den zu untersuchenden Bedingungen kann anstelle der Verwendung frischer Medien die Wiederverwendung des konditionierten Mediums für die Dextranbeladung bevorzugt werden, da es sezernierte oder ergänzte Faktoren wie EGF- bzw. Inhibitorverbindungen enthalten würde, die die makropinozytische Kapazität der Zellen beeinflussen können. - Saugen Sie das Medium ab und waschen Sie die Zellen vorsichtig, aber schnell 5 Mal mit eiskaltem PBS in einer vorgekühlten Waschflasche. Schütteln Sie die Platte während des Waschens fest von Hand, um das Entfernen von Dextran-Aggregaten zu unterstützen, die an den Deckgläsern haften bleiben.
- Fixieren Sie die Zellen, indem Sie 350 μL 3,7% Formaldehyd hinzufügen und für 20 min inkubieren. Dann aspirieren Sie die Fixierlösung und waschen Sie die Zellen zweimal mit PBS.
- Färben Sie die Kerne mit 350 μL 2 μg/mL DAPI in PBS. Nach 20 Min die DAPI-Lösung absaugen und die Zellen dreimal mit PBS waschen.
- Kleben Sie Silikonisolatoren nebeneinander auf einen Objektträger, um einen gleichmäßigen Abstand und eine reproduzierbare Lokalisierung der Deckgläser zu erhalten, die für die Bildgebungsautomatisierung erforderlich sind (Abbildung 2A, B).
HINWEIS: Der gesamte Objektträger kann mit insgesamt 3 Isolatoren bestückt werden. - Fügen Sie für jeden Deckglas einen Tropfen gehärtetes Fluoreszenz-Montagemedium auf dem Objektträger im offenen Raum des Isolators hinzu (Abbildung 2C). Heben Sie einen Deckglas mit einer Pinzette auf und entfernen Sie überschüssiges PBS, indem Sie vorsichtig auf die Seite der Deckgläser auf ein fusselfreies Tuch klopfen.
- Legen Sie den Deckstab kopfüber auf den Tropfen des Montagemediums (Abbildung 2D). Klopfen Sie vorsichtig mit einer geschlossenen Pinzette auf den Deckglas, um Blasen vom Montagemedium zu entfernen (Abbildung 2E).
- Lagern Sie die Dias in einer dunklen Umgebung und lassen Sie das Montagemedium bei Raumtemperatur trocknen, was typischerweise 16-24 h dauert. Dias können nun bis zu 2 Wochen bei -20 °C abgebildet oder gelagert werden.
- Entfernen Sie vor der Bildgebung die Isolatoren vom Objektträger. Lassen Sie die Objektträger auf Raumtemperatur ausgleichen und reinigen Sie die Deckgläser mit einem mit Ammoniak-freiem Glasreiniger benetzten Applikator mit Baumwollspitze. Verwenden Sie anschließend einen sauberen Applikator mit Baumwollspitze, der mit 70% Ethanol benetzt ist, um den Deckslip zu reinigen und trocken zu lassen.
- Aspirieren Sie die Vertiefungen und geben Sie 200 μL serumfreie Medien mit 1 mg/ml Fluorophor-markiertem Dextran mit hohem Molekulargewicht (70 kDa) zurück. Legen Sie die Zellen für 30 min in einen 37 °C Zellinkubator.
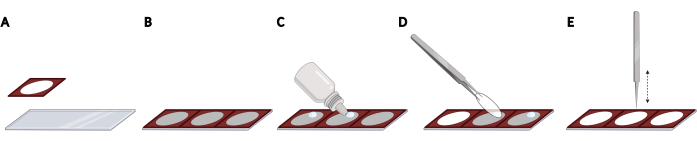
Abbildung 2: Platzieren von Deckgläsern auf einem Objektträger mit Silikonisolatoren. (A) Silikonisolatoren werden gedrückt und auf einen Objektträger geklebt. (B) Der gesamte Objektträger kann mit insgesamt 3 Isolatoren bestückt werden, was zu einem gleichmäßigen Abstand und einer reproduzierbaren Lokalisierung der Deckgläser führt. (C) Fügen Sie für jeden Deckglas einen Tropfen Fluoreszenz-Montagemedien auf dem Objektträger im offenen Raum des Isolators hinzu. (D) Nehmen Sie mit einer Pinzette einen Deckglas von der 24-Well-Platte auf und legen Sie ihn verkehrt herum auf den Tropfen des Montagemediums. (E) Wenn zwischen dem Deckglas und dem Objektträger Blasen vorhanden sind, klopfen Sie vorsichtig mit einer geschlossenen Pinzette auf den Deckglas, um Blasen zu entfernen. Erstellt mit BioRender. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- 96-Well-Mikroplattenformat
- Saugen Sie die Vertiefungen mit einem Mehrkanal-Aspirationsadapter an, der an ein Vakuum angeschlossen ist, und geben Sie 40 μL serumfreie Medien mit 1 mg/ml fluorophormarkiertem Dextran mit hohem Molekulargewicht (70 kDa) zurück in die Vertiefungen. Inkubieren Sie die Zellen in einem 37 °C Zellinkubator für 30 min.
HINWEIS: Abhängig von den zu untersuchenden Bedingungen kann anstelle der Verwendung frischer Medien die Wiederverwendung des konditionierten Mediums für die Dextranbeladung bevorzugt werden, da es sezernierte oder ergänzte Faktoren wie EGF- oder Inhibitorverbindungen enthalten würde, die die makropinozytische Kapazität der Zellen beeinflussen können. - Entsorgen Sie das Medium in der Mikrotiterplatte, indem Sie die Platte manuell auf den Kopf stellen, in ein leeres 5-Liter-Becherglas (Abbildung 3A).
- Spülen Sie die Zellen in der Mikroplatte ab, indem Sie die Platte langsam vertikal in einem leichten Winkel in ein mit eiskaltem PBS gefülltes 2-Liter-Becherglas tauchen (Abbildung 3B) und anschließend das PBS in der Mikroplatte entsorgen, indem Sie die Platte auf den Kopf stellend in das 5-l-Becherglas (Abbildung 3C). Wiederholen Sie dies 2 Mal.
HINWEIS: Zellen, die schwach an die bildgebende Mikroplatte anhaften, können sich während dieses Vorgangs lösen. Bei Bedarf können Brunnen auch mit einem Mehrkanal-Aspirationsadapter angesaugt oder mit PBS mit einer Mehrkanalpipette schonender gewaschen werden. Die Verarbeitung einer 96-Well-Mikrotiterplatte erfordert etwa 2 l eiskaltes PBS. Wenn mehr Platten analysiert werden sollen, verwenden Sie ein größeres Becherglas und fügen Sie 1 l eiskaltes PBS für jede zusätzliche Platte hinzu oder erfrischen Sie das eiskalte PBS nach Bedarf. - Nach der Entsorgung des PBS aus der letzten Spülung fixieren Sie die Zellen für 20 minuten bei Raumtemperatur, indem Sie 100 μL 3,7% Formaldehyd in PBS in jede Vertiefung mit einem 25-ml-Reagenzreservoir und einer Mehrkanalpipette geben (Abbildung 3D).
- Entfernen Sie die Fixierlösung und waschen Sie die Zellen zweimal mit PBS unter Verwendung der Tauch- und Flicking-Technik. Färben Sie die Kerne mit 100 μL 2 μg/mL DAPI in PBS pro Vertiefung.
- Nach 20 min spülen Sie die Zellen dreimal mit eiskaltem PBS mit der oben beschriebenen Tauch- und Flicktechnik ab (Schritt 3.2.3). Entfernen Sie alle PBS-Reste, indem Sie die Mikroplatte kopfüber auf ein fusselfreies Tuch klopfen und 100 μL frisches PBS mit einem 25-ml-Reagenzreservoir und einer Mehrkanalpipette in jede Vertiefung geben. Stellen Sie sich die Zellen jetzt vor oder lagern Sie sie lichtbedeckt bei 4 °C bis zu einer Woche.
HINWEIS: Alternativ kann eine Lösung von Glycerin in PBS (anstelle von PBS) für die Bildgebung und Speicherung verwendet werden, um die Fluoreszenz besser zu stabilisieren (Abbildung 4A). - Lassen Sie die Platte vor der Bildgebung auf Raumtemperatur ausgleichen. Wischen Sie die Mikrotiterplatte mit einem fusselfreien Tuch trocken.
- Saugen Sie die Vertiefungen mit einem Mehrkanal-Aspirationsadapter an, der an ein Vakuum angeschlossen ist, und geben Sie 40 μL serumfreie Medien mit 1 mg/ml fluorophormarkiertem Dextran mit hohem Molekulargewicht (70 kDa) zurück in die Vertiefungen. Inkubieren Sie die Zellen in einem 37 °C Zellinkubator für 30 min.
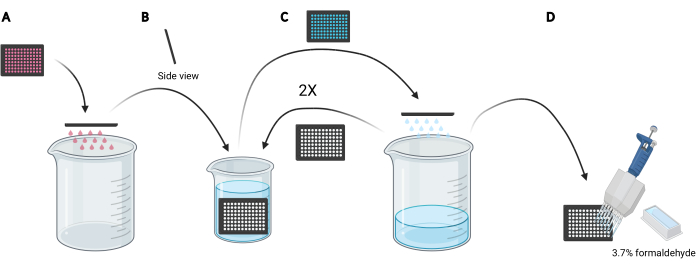
Abbildung 3: Spülen der 96-Well-Mikrotiterplatte, um die Fixierung vorzubereiten. (A) Entleeren Sie die Mikrotiterplatte des Mediums durch manuelles Streichen in ein 5-Liter-Becherglas. (B) Senkrecht und in einem leichten Winkel die Mikroplatte langsam in ein 2-Liter-Becherglas tauchen, das mit eiskaltem PBS gefüllt ist. (C) Entleeren Sie die Mikrotiterplatte von PBS durch manuelles Streichen in das 5-Liter-Becherglas. Wiederholen Sie die Waschschritte wie unter B beschrieben zweimal. (D) Nachdem Sie das PBS in der Mikroplatte zum letzten Mal entleert haben, geben Sie 100 μL 3,7% Formaldehyd in die Vertiefungen unter Verwendung einer Mehrkanalpipette. Erstellt mit BioRender. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Automatisierte Makropinosom-Bildgebung
Bilder von Makropinosomen können mit einem Standard-Fluoreszenzmikroskop aufgenommen werden, wie zuvor beschrieben19,20. Ein solches Verfahren kann jedoch durch Automatisierung in Bezug auf die Effizienz verbessert werden, insbesondere bei der Beurteilung zahlreicher verschiedener Zellkulturbedingungen. Die Automatisierung der Bilderfassung kann über einen Cell Imaging Multi-Mode-Plattenleser erfolgen, der den Aufwand durch Die Reduzierung der Handhabungsverfahren verringert und vor allem die Reproduzierbarkeit und Zuverlässigkeit der Daten erhöht, indem Bilder unvoreingenommen erfasst werden. Mehrere Bildgebungssysteme sind kommerziell erhältlich, und die Richtungen unterscheiden sich zwischen den Instrumenten. Hier wird die Aufnahme von Bildern mit einem Cytation 5 beschrieben. Das folgende Protokoll kann jedoch auf jedes einzelne Instrument zugeschnitten werden, indem die folgenden Richtlinien eingehalten werden:
- Erstellen Sie ein Automatisierungsprotokoll, um die Bilder mit einem 40-fachen Luftobjektiv im Wellenlängenkanal des Dextran-Fluorophors (FITC/TMR) und DAPI zu erfassen.
HINWEIS: Der häufig verwendete Makropinozytoseinhibitor EIPA zeigt Autofluoreszenz im FITC-Kanal, insbesondere wenn er zuvor im DAPI-Kanal angeregt wurde. Andere Zu testende Verbindungen können ebenfalls Autofluoreszenz aufweisen. Um dieses Problem zu umgehen, hilft die Einstellung der Bildaufnahme, die zuerst im Kanal mit der höchsten Anregungswellenlänge (FITC/TMR) und dann im DAPI-Kanal stattfindet, um dieses Auftreten zu vermeiden. - Optimieren Sie die Belichtungseinstellungen mit einer Probe, von der vorhergesagt wird, dass sie den höchsten Grad an Makropinozytose aufweist, um eine Überbelichtung zu vermeiden, die zu einer Sättigung des Signals und einem Verlust der Intensitätsdaten führen kann. Verwenden Sie Fokuseinstellungen, die das Sample schnell und konsistent lokalisieren, um qualitativ hochwertige Bilder zu erzeugen.
- Erfassen Sie mehrere Bilder in jedem Bohrloch oder Deckglas, um die Probenvariabilität zu berücksichtigen und eine genaue Darstellung der Probe zu erhalten.
- Sobald die Imaging-Einstellungen festgelegt wurden, verwenden Sie die gleichen Einstellungen für jede Probe innerhalb des Experiments.
- Befolgen Sie diese Anweisungen für die Makropinosomen-Bilderfassung, wenn Sie eine Cytation 5- und Gen5-Software verwenden:
- 24-Well-Platte mit Deckglasformat
- Starten Sie den Plattenleser und legen Sie die Objektträger mit dem Objektträgerhalter kopfüber ein.
- Öffnen Sie den Mikrotiterplattenleser und die Imaging-Software, erstellen Sie ein neues Protokoll, indem Sie auf Protokolle klicken, und erstellen Sie neu. Doppelklicken Sie auf Prozedur und wählen Sie den Plattentyp aus.
HINWEIS: Wenn der Plattentyp nicht verfügbar ist, fügen Sie den Plattentyp zur Software hinzu, indem Sie auf System > Plattentypen > Platte hinzufügen klicken und die vom Hersteller angegebenen Plattenabmessungen verwenden. Aus Gründen der Benutzerfreundlichkeit ist die Schablone für zwei Objektträger mit drei Deckgläsern, die mit den Silikonisolatoren angeordnet sind, in der Ergänzenden Datei 1 enthalten. - Um auf die Imaging-Einstellungen zuzugreifen, wählen Sie Actions > Image > Inverted Imager und klicken Sie auf OK. Verwenden Sie das 40-fache PL FL-Phasenobjektiv mit Wide FOV und Autofokus-Binning.
- Wählen Sie für den ersten Kanal den LED-Würfel aus, der dem Dextran-Fluorophor-Label (GFP oder RFP) entspricht. Klicken Sie auf Automatische Belichtung und klicken Sie auf die Schaltfläche mit dem Mikroskopsymbol, um die Belichtungseinstellungen zu optimieren. Wenn die entsprechenden Belichtungseinstellungen festgelegt wurden, klicken Sie auf Einstellungen speichern.
HINWEIS: Passen Sie die Belichtungseinstellungen mit einer Probe an, von der vorhergesagt wird, dass sie den höchsten Grad an Makropinozytose aufweist, um überbelichtete Bilder zu vermeiden, die zu einer Sättigung des Signals und zum Verlust von Intensitätsdaten führen können. - Wiederholen Sie den vorherigen Schritt für den zweiten Kanal mit dem DAPI-LED-Cube.
- Stellen Sie die Autofokuseinstellungen für jeden Fluoreszenzkanal ein und wählen Sie Fokusoptionen. Heben Sie die Auswahl der Standardfokusmethode auf und verwenden Sie Autofokus mit Optionalem Scan und Autofokus ohne Optionaler Scan für den Dextran-Fluorophor- bzw. DAPI-Kanal. Klicken Sie auf OK , um die Einstellungen zu speichern.
HINWEIS: Der Scanabstand kann auf 200 μm und das Inkrement auf 20 μm reduziert werden, um die Autofokuseffizienz zu erhöhen. Der optionale Scan ist für einen ausreichenden Autofokus auf Proben mit geringer Fluoreszenz erforderlich. Dies geschieht normalerweise bei der Analyse von Zuständen mit niedriger Makropinozytose, z. B. wenn die Makropinozytose gehemmt wird oder von Natur aus nicht vorhanden ist. - Verwenden Sie die Option Beacons definieren , um die Aufnahme von Bildern in verschiedenen Bereichen des Deckglases zu automatisieren. Klicken Sie auf das Mikroskopsymbol und fügen Sie Beacons hinzu, indem Sie in das Bildfenster klicken und die Bühne in die nächste Region verschieben. Wenn die entsprechende Anzahl von Regionen ausgewählt wurde, wechseln Sie zum nächsten Deckglas, und wiederholen Sie den Vorgang. Um den Vorgang abzuschließen, klicken Sie auf Einstellungen speichern.
HINWEIS: Um eine gute Darstellung der Makropinozytose in der gesamten Probe zu erhalten, wählen Sie ungefähr 20 Beacons aus, die gleichmäßig über den Deckglas verteilt sind (Abbildung 4B). Es können weniger Beacons verwendet werden, aber einige Bilder müssen möglicherweise nach der Aufnahme aufgrund von Qualitätsunterschieden von der Bildanalyse ausgeschlossen werden, z. B. wenn das Bild unscharf ist oder Blasen oder fluoreszierende Flecken und Flecken enthält. - Um die Anpassung der Imaging-Einstellungen abzuschließen, klicken Sie auf OK. Um die Deckblätter abzubilden, wählen Sie in den Protokolltools die Option Neues Experiment erstellen und Jetzt lesen aus. Speichern Sie das Protokoll und das Experiment, wenn Sie dazu aufgefordert werden.
- 24-Well-Platte mit Deckglasformat
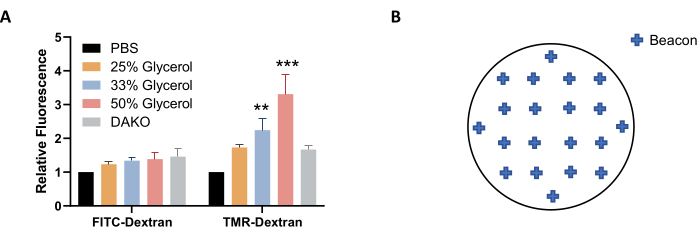
Abbildung 4: Optimierung der Bedingungen für die Bildaufnahme. (A) Erhöhung der Glycerinkonzentration erhöht die TMR-Dextran-Fluoreszenz, wie in AsPC-1-Zellen bestimmt, die mit EGF behandelt wurden. (B) Beispielkoordinaten von Bildbaken für die automatische Bilderfassung bei Verwendung der 24-Well-Platte mit Deckgläsern. Das Balkendiagramm zeigt die durchschnittliche relative Fluoreszenz mit REM von 5 Experimenten. Die statistische Signifikanz wurde durch zweiseitige ANOVA relativ zu PBS bestimmt. ** P < 0,01; P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- 96-Well-Mikroplattenformat
- Starten Sie den Plattenleser und setzen Sie die Mikrotiterplatte ein.
- Öffnen Sie den Mikrotiterplattenleser und die Imaging-Software, erstellen Sie ein neues Protokoll, indem Sie auf Protokolle klicken, und erstellen Sie neu. Doppelklicken Sie auf Prozedur und wählen Sie den Plattentyp aus.
HINWEIS: Wenn der Plattentyp nicht verfügbar ist, fügen Sie den Plattentyp zur Software hinzu, indem Sie auf System > Plattentypen > Platte hinzufügen klicken und die vom Hersteller angegebenen Plattenabmessungen verwenden. Der Einfachheit halber ist die Vorlage für die CellCarrier-96 Ultra Microplates von PerkinElmer in Supplementary File 2 enthalten. - Um auf die Imaging-Einstellungen zuzugreifen, wählen Sie Aktionen > Image > Inverted Imager und klicken Sie auf OK. Verwenden Sie das 40x PL FL Phasenobjektiv mit Wide FOV und Autofokus Binning.
- Wählen Sie für den ersten Kanal den LED-Würfel aus, der dem Dextran-Fluorophor-Label (GFP oder RFP) entspricht. Klicken Sie auf Automatische Belichtung und klicken Sie auf die Schaltfläche mit dem Mikroskopsymbol, um die Belichtungseinstellungen zu optimieren. Wenn die entsprechenden Belichtungseinstellungen festgelegt wurden, klicken Sie auf Einstellungen speichern.
HINWEIS: Bei der Optimierung der Belichtungseinstellungen kann es zu einer signifikanten Fluoreszenzbleiche kommen. Dies kann zu Einstellungen führen, die zu einer Überbelichtung führen, wenn ein neues Feld abgebildet wird. Validieren Sie daher die Belichtungseinstellungen, indem Sie ein noch nicht belichtetes Feld überprüfen und sicherstellen, dass bei den ausgewählten Einstellungen keine Sättigung des Signals auftritt. Schließen Sie die Vertiefungen, die für die Optimierung der Expositionseinstellung verwendet werden, nicht in die Makropinosomenquantifizierung ein, da die Fluoreszenz infolge der Bleiche während der Optimierung abgenommen hat. Passen Sie die Belichtungseinstellungen mit einer Probe an, von der vorhergesagt wird, dass sie den höchsten Grad an Makropinozytose aufweist, um überbelichtete Bilder zu vermeiden, die zu einer Sättigung des Signals und zum Verlust von Intensitätsdaten führen können. - Wiederholen Sie den vorherigen Schritt für den zweiten Kanal mit dem DAPI-LED-Cube.
- Stellen Sie die Autofokuseinstellungen für jeden Fluoreszenzkanal ein und wählen Sie Fokusoptionen. Deaktivieren Sie die Standardfokusmethode und verwenden Sie den Laser-Autofokus. Erfassen Sie nach der Bestimmung der Fokusebene einen Referenzscan für eine optimale Visualisierung von Makropinosomen und Kernen. Klicken Sie auf OK , um die Einstellungen zu speichern.
HINWEIS: Der Scanabstand kann auf 400 μm und die Inkrementierung auf 3 μm reduziert werden, um die Autofokuseffizienz zu erhöhen. Damit die Laser-Autofokus-Option ordnungsgemäß funktioniert, reinigen Sie den Boden der Platte, trocknen Sie sie und wischen Sie die Platte vor der Bildgebung mit einem fusselfreien Abwischen ab. Der Laser-Autofokus ist eine überlegene Methode für den Fokus, da er nur minimale Zeit benötigt, um die Brennebene zu finden. Andere Fokusmethoden können verwendet werden, aber da den Bohrlöchern kein Anti-Fade hinzugefügt wurde, können diese Methoden zu einer signifikanten Bleiche der Proben führen, die sich negativ auf die Datenerhebung auswirkt. - Stellen Sie den horizontalen und vertikalen Versatz auf Null und wählen Sie unter Einzelbild die Option Montage ohne Überlappung aus, und verwenden Sie 3 x 3 Bilder, je nachdem, wie viele Zellen in die Analyse einbezogen werden sollen.
HINWEIS: Abhängig von der Größe und Dichte der Zellen können mehr oder weniger Bilder aufgenommen werden, um eine repräsentative Beurteilung der Makropinozytose in der gesamten Probe zu erhalten. Bei der Beurteilung der Makropinozytose in AsPC-1- oder MIA PaCa-2-Zellen unter unterschiedlichen Bedingungen werden keine Unterschiede in der Dateninterpretation zwischen einem 2 x 2 oder 4 x 4-Fotorahmen beobachtet, obwohl die Variation zwischen den Wiederholungsproben zunehmen kann, wenn weniger Bilder aufgenommen werden (Abbildung 5A, B). Das Vergrößern oder Verringern der Größe des Rahmens wirkt sich auf die Zeit aus, die zum Scannen der Platte benötigt wird. Abhängig von der Belichtungszeit benötigt eine vollständige 96-Well-Mikroplatte etwa 1-1,5 Stunden, um vollständig mit einem 3 x 3-Rahmen zu scannen. Ein 2 x 2- und 4 x 4-Frame halbiert bzw. verdoppelt diese Zeit. - Um die Anpassung der Imaging-Einstellungen abzuschließen, klicken Sie auf OK.
- Um ein Bild der Platte zu erstellen, wählen Sie in den Protokollwerkzeugen die Option Neues Experiment erstellen und Jetzt lesen aus. Speichern Sie das Protokoll und das Experiment, wenn Sie dazu aufgefordert werden.
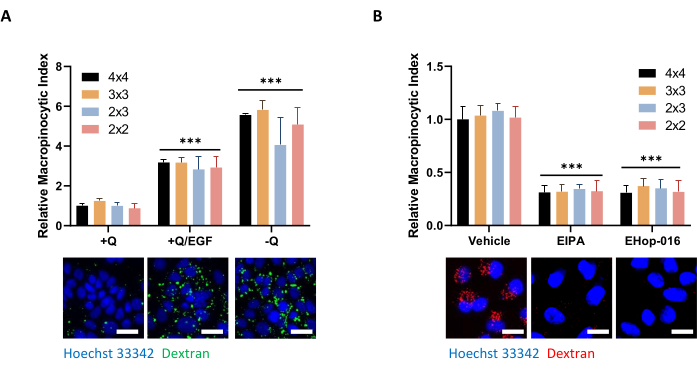
Abbildung 5: Kontrollbedingungen für die Beurteilung der Makropinozytose in PDAC-Zellen. (A) AsPC-1-Zellen zeigen Makropinozytose als Reaktion auf 100 ng/ml EGF-Stimulation für 5 min oder Glutaminentzug für 24 h. Für die Bildaufnahme wurden Bilderrahmen von 4 x 4, 3 x 3, 2 x 3 oder 2 x 2 aufgenommen, um den Einfluss der Anzahl der Fotos auf die Datenqualität zu bestimmen. (B) MIA PaCa-2-Zellen zeigen eine konstitutive Makropinozytose, die durch eine 30-minütige Behandlung mit 75 μM EIPA oder eine 2-h-Behandlung mit 10 μM EHop-016 gehemmt wird. Bilderrahmen wurden wie in A aufgenommen. Maßstabsleiste = 25 μm. Balkendiagramme zeigen den durchschnittlichen relativen makropinozytischen Index mit SD von 1 Experiment mit 4 Replikaten. Die statistische Signifikanz wurde durch eine Bidirektionale ANOVA relativ zum +Q- oder Fahrzeugzustand bestimmt. p < 0,001 Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Bestimmung des makropinozytären Index
Der "makropinozytische Index" ist das Ausmaß der zellulären Makropinozytose, das durch Quantifizierung der fluoreszierenden Dextranaufnahme pro Zelle mittels mikroskopischer Bildgebung bestimmt wird19. Zu diesem Zweck werden die aufgenommenen Bilder verwendet, um die Menge an internalisiertem Dextran zu bestimmen, indem die Gesamtfluoreszenzintensität oder fluoreszenzpositive Fläche und die Gesamtzahl der Zellen, wie durch DAPI-Färbung bestimmt, gemessen werden. Diese Analyse kann mit Open-Source-Bildverarbeitungs- und Analysesoftware wie Cell Profiler oder FIJI/ImageJ durchgeführt werden, wie zuvor beschrieben19,20. Bei der Arbeit mit einem Multimode-Plattenleser kann die mit dem Gerät gelieferte Software jedoch integrierte Analyseanwendungen enthalten, die zum Zwecke der Berechnung des makropinozytischen Index verwendet werden können. In einigen Fällen ist die integrierte Softwareanalyse-Pipeline für den Benutzer möglicherweise nicht vollständig ersichtlich. Es empfiehlt sich daher, die Software frühzeitig durch Vergleich mit einem nicht automatisierten Verfahren wie Cell Profiler oder FIJI/ImageJ zu validieren. Dieses Protokoll kann an andere Bildverarbeitungs- und Analysesoftwaretools angepasst werden, indem die folgenden allgemeinen Anweisungen eingehalten werden:
- Subtrahieren Sie für den DAPI und das entsprechende Dextran-Bild den Hintergrund, indem Sie die entsprechende Funktion anwenden, die häufig als Rolling Ball-Funktion bezeichnet wird. Passen Sie die Einstellungen so an, dass das Hintergrundrauschen minimiert wird und es einen minimalen bis gar keinen Subtraktionseffekt auf das DAPI- und Dextran-Signal gibt.
- Bestimmen Sie unter Verwendung eines Feldes mit hohem Dextransignal die Intensitätssignaleinstellungen, die häufig als Schwellenwertfunktion bezeichnet werden, um die Kerne auszuwählen und die minimale Intensitätssignaleinstellung zu bestimmen, die erforderlich ist, um nur die Makropinosomen auszuwählen.
- Berechnen Sie für das Dextranbild die Gesamtfluoreszenz innerhalb der erzeugten Makropinosomenauswahl oder verwenden Sie die Auswahl, um die für Dextran positive Gesamtfläche zu bestimmen.
- Verwenden Sie für das DAPI-Bild die Auswahl, um die Anzahl der Kerne im Bild zu bestimmen, um die Anzahl der vorhandenen Zellen widerzuspiegeln.
- Um den makropinozytären Index zu bestimmen, teilen Sie die gesamte Dextranfluoreszenz oder -fläche durch die Anzahl der Zellen, die durch DAPI bestimmt werden.
- Wiederholen Sie diese Analyseschritte für alle aufgenommenen Bilder, indem Sie die gleichen numerischen Einstellungen anwenden.
- Befolgen Sie diese Anweisungen zur Bestimmung des makropinozytischen Index bei Verwendung der Gen5-Software:
HINWEIS: Die integrierte Analysepipeline wurde validiert und es wurden keine Unterschiede in der Berechnung im Vergleich zu Fiji/ImageJ (Abbildung 6A).- Nachdem die Bildgebung abgeschlossen ist, wählen Sie ein Bild mit einem hohen Grad an Makropinozytose. Entfernen Sie das Hintergrundsignal, klicken Sie auf Verarbeiten (Ergänzende Abbildung 1A), und wählen Sie die Option Bildvorverarbeitung aus.
- Deaktivieren Sie für den Dextrankanal Auto und verwenden Sie einen Rolling-Ball-Durchmesser von 5 μm, priorisieren Sie feine Ergebnisse und glätten Sie das Bild mit 1 Zyklus.
- Verwenden Sie für den DAPI-Kanal die automatische Vorverarbeitung und 1 glatten Zyklus. Klicken Sie auf OK und fügen Sie den Bildvorverarbeitungsschritt zum Protokoll hinzu. Klicken Sie auf SCHRITT HINZUFÜGEN. Wählen Sie als Nächstes das verarbeitete Bild unter dem Bild-Rollout aus (Ergänzende Abbildung 1B) und klicken Sie auf die Schaltfläche Analysieren (Ergänzende Abbildung 1C).
- Legen Sie unter ANALYSEEINSTELLUNGEN den Typ auf Zellanalyse fest. Wählen Sie den DAPI-Kanal aus und klicken Sie auf Optionen (Ergänzende Abbildung 2A).
- Erstellen Sie für die primäre Maske mithilfe des verarbeiteten DAPI-Bildes eine Maske, um einzelne Kerne auszuwählen. Verwenden Sie den dunklen Hintergrund und die Option Auto . Bestimmen Sie außerdem, welche Einstellungen die Maskenauswahl einzelner Kerne ermöglichen, und wenn Sie fertig sind, klicken Sie auf die Schaltfläche Übernehmen , um festzustellen, ob die Maske angemessen angewendet wird.
HINWEIS: Die Aktivierung der Optionen "Berührende Objekte teilen " und " Löcher in Masken füllen " eignet sich möglicherweise am besten für die Auswahl einzelner Kerne. Minimale und maximale Objektgrößen müssen möglicherweise je nach Zelllinie angepasst werden und werden am häufigsten im Bereich von 5-40 μm eingestellt. Primäre Edge-Objekte können eingeschlossen werden, und das gesamte Bild sollte analysiert werden. Der Schieberegler kann angewendet werden, um die Maskenauswahl an die Signalintensität anzupassen. - Wenden Sie als Nächstes eine sekundäre Maske an, um die Einstellungen für die Auswahl des Makropinosom-Fluoreszenzpunkts zu optimieren. Verwenden Sie die Funktion Messen innerhalb einer Sekundärmaske und erweitern Sie die Primärmaske je nach Größe der Zellen um 40 μm.
- Verwenden Sie die Funktion Schwellenwert und die Methode Schwellenwert in Mask , um die positiven Dextran-Bereiche auszuwählen. Klicken Sie auf Übernehmen , um festzustellen, ob die Einstellungen korrekt angewendet wurden.
HINWEIS: Um den Schwellenwert zu bestimmen, verwenden Sie das Werkzeug Linienprofil anzeigen (Ergänzende Abbildung 2B) und zeichnen Sie eine Linie über einen dextran-positiven Bereich (Ergänzende Abbildung 2C). Verwenden Sie die gemessene Intensität, um die beste Einstellung zu bestimmen, um eine Maske zu erstellen, die Makropinosomen auswählt und das Hintergrundsignal ausschließt (ergänzende Abbildung 2D). - Nachdem Sie geeignete Masken zur Auswahl von Kernen und Makropinosomen erstellt haben, klicken Sie auf die Registerkarte Berechnete Metriken und wählen Sie Metriken auf Objektebene auswählen oder erstellen.
- Entfernen Sie alle vorhandenen Metriken, und fügen Sie die Metriken Integral und Area für die Analyse der sekundären Maske hinzu. Klicken Sie auf OK und wählen Sie Berechnen und Anzeigen für die neuen Metriken. Wenn Sie fertig sind, klicken Sie auf OK und wählen Sie SCHRITT HINZUFÜGEN , um die Analyse und Berechnungen zum Protokoll hinzuzufügen.
- Speichern Sie das endgültige Protokoll für die zukünftige Verwendung, klicken Sie auf Datei und Protokoll speichern unter.
- Nachdem die Datenanalyse abgeschlossen ist, wählen Sie die Metriken von Interesse aus und exportieren Sie die Daten, um den makropinozytären Index zu bestimmen. Bestimmen Sie den makropinozytischen Index wie folgt:
Dextranfluoreszenz pro Zelle = Objekt Int_2[Dextranfluorophor]
Dextran-Fläche pro Zelle = Objekt Area_2[Dextran-Fluorophor]
HINWEIS: Für die 24-Well-Platte mit Deckgläsern spiegeln die Metriken den Mittelwert des durchschnittlichen makropinozytischen Index pro Bild wider. Alternativ kann der makropinozytische Index manuell für die gesamte Probe berechnet werden, indem die Summe der "Fläche" oder des "Integrals" für alle Bilder durch die gesamte "Zellzahl" dividiert wird. Der Unterschied zwischen diesen Ansätzen bei der Berechnung des makropinozytischen Index ist in den meisten Einstellungen minimal. Für das 96-Well-Mikroplattenformat wird der makropinozytische Index als Durchschnitt für die gesamte Probe berechnet. - Speichern Sie das Protokoll für die Bildgebung und die anschließende automatisierte Analyse. Verwenden Sie das Protokoll für zukünftige Experimente mit denselben Fluorophoren wieder.
HINWEIS: Bei Verwendung der Laser-Autofokus-Funktion muss ein neuer Referenzscan gemacht werden, wenn eine andere Zelllinie analysiert werden soll, da Kerne und Makropinosomen möglicherweise auf einer anderen Ebene lokalisiert sind. Jedes Mal, wenn ein neues Experiment mit einem zuvor festgelegten Protokoll durchgeführt wird, müssen die Belichtungseinstellungen für dieses Experiment optimiert werden.
6. Zugabe von Behandlungen
Zellbehandlungen (kleine Moleküle, Biologika, Wachstumsfaktoren, Metaboliten usw.) können in jeder Phase des Protokolls integriert werden, und der genaue Zeitpunkt hängt von den Zielen und Zielen der Studie ab.
- Bereiten Sie die Zellen wie in Abschnitt 2 vor.
- Bereiten Sie kurz vor dem Hinzufügen der interessierenden Behandlungen die Behandlungen und die entsprechenden Kontrollen in doppelten Endkonzentrationen in serumfreien Medien vor. Bereiten Sie die Behandlungen in einem Volumen vor, das dem Volumen der Anzahl der zu bewertenden Replikationsbrunnen entspricht.
HINWEIS: Angesichts der Rolle, die sezernierte Faktoren bei der Kontrolle zellulärer Funktionen spielen können, kann es bevorzugt sein, die Behandlungen von Interesse in konditionierten Medien zu verdünnen. Für diese Zwecke kann es hilfreich sein, bei der Vorbereitung von Zellen wie in Abschnitt 2 beschrieben zusätzliche Platten, wie z. B. 6-cm- oder 10-cm-Zellkulturschalen, zu säen, um die konditionierten Medien für die Herstellung der Behandlungslösungen zu erzeugen. - Ohne das Medium aus dem Bohrloch zu entfernen, fügen Sie jedem Bohrloch ein Brunnenvolumen der Behandlungslösung hinzu. Schütteln Sie die Platte, um eine ordnungsgemäße Mischung zu gewährleisten. Inkubieren Sie die Zellen für die gewünschte Zeit.
- Fahren Sie mit Abschnitt 3 fort.
HINWEIS: Bei der Zugabe des Dextrans bewirkt die Verwendung von frischen Medien die Entfernung der zugesetzten Behandlungen, was das Niveau der Makropinozytose beeinflussen kann. Daher kann es bevorzugt sein, Dextran direkt in die Vertiefungen zu geben, ohne die Behandlungen zu saugen oder alternativ die Behandlungen erneut hinzuzufügen oder die konditionierten Medien wiederzuverwenden, um die Dextranlösung herzustellen.
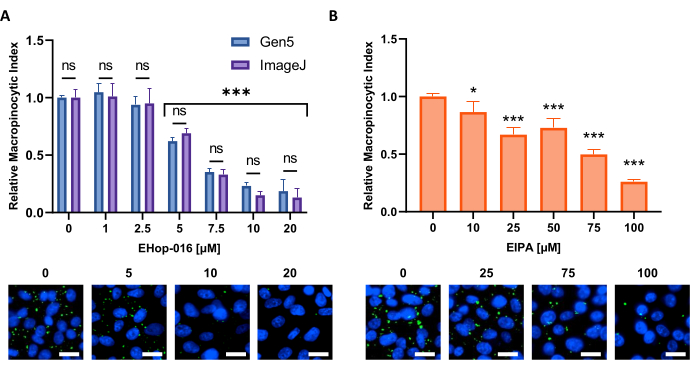
Abbildung 6: Durchführung einer Dosis-Wirkungs-Kurve für Makropinozytoseinhibitoren. Beispieldaten, die beim Testen bekannter Makropinozytoseinhibitoren in einer neuen Zelllinie erhalten wurden. PATU8998T-Zellen wurden für das 96-Well-Mikroplattenformat verwendet und für 2 h und 30 min mit den angegebenen Konzentrationen von (A) EHop-16 bzw. (B) EIPA behandelt. Der Vergleich der Ergebnisse, die durch Bildanalyse mit der Gen5-Software oder ImageJ erhalten wurden, zeigt keine signifikanten Unterschiede zwischen den beiden Ansätzen, wie durch ns in (A) angegeben. Maßstabsleiste = 25 μm. Balkendiagramme zeigen den Durchschnitt und den SD eines einzelnen Experiments mit 4 Replikaten. Die statistische Signifikanz wurde durch ein- oder zweiseitige ANOVA im Vergleich zu unbehandelten Bedingungen bestimmt. * p < 0,05; P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Wenn die Schritte und die Anpassung des oben beschriebenen Protokolls entsprechend befolgt werden, sollten die endgültigen experimentellen Ergebnisse Informationen darüber liefern, ob die untersuchten Zellkulturbedingungen oder Inhibitoren die Makropinozytose in der interessierenden Zelllinie induzieren oder reduzieren. Um die Validität dieser Ergebnisse zu stärken, ermöglicht die Einbeziehung von Kontrollbedingungen die Überprüfung der Ergebnisse, um festzustellen, ob das Experiment erfolgreich abgeschlossen wurd...
Diskussion
Die Qualität der Experimente und der Datenerfassung hängt stark von der Qualität der Reagenzien, der Optimierung der Einstellungen und der Sauberkeit der Deckgläser und der Mikrotiterplatte ab. Die Endergebnisse sollten eine minimale Variation zwischen den Replikaten ergeben; Biologische Variationen kommen jedoch natürlich vor oder können anderweitig durch eine Reihe von Faktoren verursacht werden. Die Zelldichte kann dazu führen, dass Zellen mehr oder weniger auf Makropinozytose-Induktoren oder -inhibitoren reagi...
Offenlegungen
C.C. ist Erfinder eines erteilten Patents mit dem Titel "Cancer diagnostics, therapeutics, and drug discovery associated with macropinocytosis", Patent Nr.: 9,983,194.
Danksagungen
Diese Arbeit wurde durch NIH/NCI-Zuschüsse (R01CA207189, R21CA243701) an C.C unterstützt. KMO.G. erhielt einen TRDRP Postdoctoral Fellowship Award (T30FT0952). Der BioTek Cytation 5 ist Teil des Sanford Burnham Prebys Cell Imaging Core, der finanzielle Unterstützung aus dem NCI Cancer Center Support Grant (P30 CA030199) erhält. Die Abbildungen 1-3 wurden mit BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
Referenzen
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten