Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированная визуализация и анализ для количественной оценки флуоресцентно меченых макропиносом
В этой статье
Резюме
Автоматизированные анализы с использованием микропластин с несколькими скважинами являются выгодными подходами для идентификации регуляторов путей, позволяя оценивать множество условий в одном эксперименте. Здесь мы адаптировали хорошо зарекомендовавший себя протокол визуализации и количественной оценки макропиносом к формату микропластин с 96 лунками и предоставили всестороннюю схему автоматизации с использованием многорежимного считывателя пластин.
Аннотация
Макропиноцитоз — это неспецифический путь поглощения жидкой фазы, который позволяет клеткам усваивать большие внеклеточные грузы, такие как белки, патогены и клеточный мусор, посредством объемного эндоцитоза. Этот путь играет важную роль в различных клеточных процессах, включая регуляцию иммунных реакций и метаболизма раковых клеток. Учитывая эту важность в биологической функции, изучение условий клеточной культуры может предоставить ценную информацию путем выявления регуляторов этого пути и оптимизации условий, которые будут использоваться при открытии новых терапевтических подходов. В исследовании описывается автоматизированный метод визуализации и анализа с использованием стандартного лабораторного оборудования и многомодового считывателя пластин для визуализации клеток для быстрой количественной оценки макропиноцитарного индекса в адгезивных клетках. Автоматизированный метод основан на поглощении высокомолекулярного флуоресцентного декстрана и может быть применен к 96-луночным микропластинкам для облегчения оценки нескольких условий в одном эксперименте или фиксированным образцам, установленным на стеклянных крышках. Этот подход направлен на максимизацию воспроизводимости и сокращение экспериментальных вариаций при одновременной экономии времени и рентабельности.
Введение
Неспецифический эндоцитарный путь макропиноцитоза позволяет клеткам усваивать различные внеклеточные компоненты, включая питательные вещества, белки, антигены и патогены, путем массового поглощения внеклеточной жидкости и ее составляющих1. Хотя это важно для биологии многочисленных типов клеток, все чаще описывается, что путь макропиноцитоза играет важную роль в биологии опухоли, где благодаря макропиноцитарному поглощению опухолевые клетки способны выживать и размножаться в присутствии истощенного питательными веществами микросреды2,3. Поглощение внеклеточных макромолекул, включая альбумин и внеклеточный матрикс, а также некротический клеточный мусор, обеспечивает альтернативный источник питательных веществ для производства биомассы путем создания аминокислот, сахаров, липидов и нуклеотидов через макропиносомы и лизосомы, опосредованные слиянием, катаболизм груза4,5,6,7,8.
Индукция и регуляция макропиноцитоза сложны и могут варьироваться в зависимости от клеточного контекста. До сих пор было идентифицировано несколько индукторов макропиноцитоза, которые включают лиганды, такие как эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), галектин-3 и Wnt3A9,10,11,12,13. Кроме того, условия культивирования, которые имитируют микроокружение опухоли, могут вызвать активацию пути. Опухоли аденокарциномы протоков поджелудочной железы (PDAC) лишены питательных веществ, особенно для аминокислоты глутамина, которая заставляет как раковые клетки, так и связанные с раком фибробласты (CAF) полагаться на макропиноцитоз для выживания7,13,14,15. Кроме того, опухолевые стрессы, такие как гипоксия и окислительный стресс, могут активировать этот путь очистки16. В дополнение к многочисленным внешним инфлюенсорам, которые могут индуцировать макропиноцитоз, различные внутриклеточные пути контролируют образование макропиносом. Онкогенная Ras-опосредованная трансформация достаточна для инициирования макропиноцитарного механизма, и несколько типов рака проявляют онкогенный Ras-управляемый конститутивный макропиноцитоз4,5,9,17. В качестве альтернативы, была идентифицирована активация Ras дикого типа и Ras-независимые пути для активации макропиноцитоза в раковых клетках и CAFs10,11,15,18. Использование различных моделей in vitro в сочетании с ингибиторами лечения привело к идентификации нескольких модуляторов макропиноцитоза, которые включают натриево-водородные обменники, малый GTPase Rac1, фосфоинозитид-3-киназу (PI3K), p21-активированную киназу (Pak) и AMP-активированную протеинкиназу (AMPK)4,13,15 . Однако, учитывая множество описанных факторов и условий, регулирующих макропиноцитоз, вполне возможно, что многие другие модуляторы и стимулы остаются неоткрытыми. Идентификация новых модуляторов и стимулов может быть облегчена автоматизированной оценкой множества условий в одном эксперименте. Эта методология может пролить свет на факторы, участвующие в образовании макропиносом, и может позволить обнаружить новые малые молекулы или биологические препараты, которые нацелены на этот путь.
Здесь мы адаптировали наш ранее установленный протокол для определения степени макропиноцитоза в раковых клетках in vitro к формату микропластин с 96 лунками и автоматической визуализации и количественной оценке19,20. Этот протокол основан на флуоресцентной микроскопии, которая стала стандартом в этой области для определения макропиноцитоза in vitro и in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Макропиносомы можно отличить от других эндоцитарных путей благодаря их способности усваивать крупные макромолекулы, такие как высокомолекулярный декстран (т.е. 70 кДа)2,3,4,20,21,22,23. Таким образом, макропиносомы могут быть определены путем поглощения внеклеточного вводимого флуорофором меченого декстрана 70 кДа. В результате макропиноцитарные везикулы проявляются в виде внутриклеточных скоплений флуоресцентных пункт с размерами от 0,2-5 мкм. Эти пункты могут быть микроскопически изображены и впоследствии количественно определены для определения степени макропиноцитоза в клетке - «макропиноцитарного индекса».
В этом протоколе описаны основные этапы визуализации макропиносом в адгезивных клетках in vitro на 96-луночной микропластине и крышках с использованием стандартного лабораторного оборудования (рисунок 1). Кроме того, приведены указания по автоматизации получения изображения и количественной оценки макропиноцитарного индекса с помощью многомодового пластинчатого считывателя клеточной визуализации. Эта автоматизация сокращает время, затраты и усилия по сравнению с нашими ранее описанными протоколами19,20. Кроме того, он позволяет избежать непреднамеренно предвзятого получения и анализа изображений и тем самым повышает воспроизводимость и надежность. Этот метод может быть легко адаптирован к различным типам клеток или считывателям пластин или использоваться для определения альтернативных признаков макропиносом, таких как размер, количество и местоположение. Описанный в настоящем описании способ особенно подходит для скрининга условий клеточной культуры, которые индуцируют макропиноцитоз, идентификации новых модуляторов или оптимизации концентраций лекарственного средства известных ингибиторов.
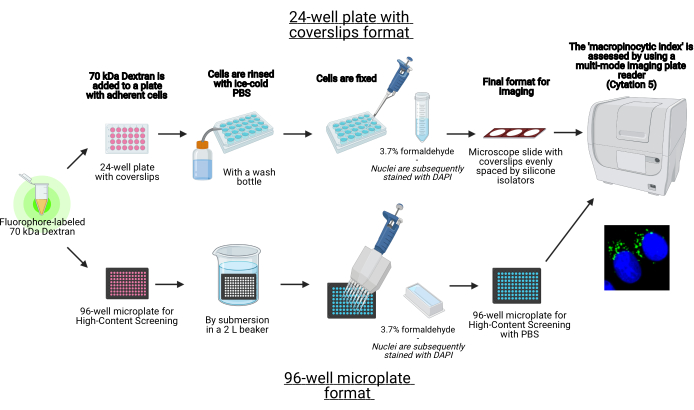
Рисунок 1: Схема автоматизированного анализа для определения «макропиноцитарного индекса» в адгезивных клетках. Создано с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Подготовка материалов
- Растворите декстран 70 кДа, меченый FITC или тетраметилродамином (TMR), в PBS для получения раствора 20 мг/мл. Храните аликвоты при -20 °C.
- Растворить DAPI в ddH2O для получения раствора 1 мг/мл. Храните аликвоты при -20 °C.
ВНИМАНИЕ: DAPI является потенциальным канцерогеном и с ним следует обращаться осторожно. - В день фиксации приготовьте свежий 3,7% формальдегид класса ACS в PBS.
ВНИМАНИЕ: Формальдегид является фиксирующим, известным канцерогеном и токсичен при вдыхании. Сделайте раствор в химическом вытяжке, чтобы избежать вдыхания и обращаться с ними с осторожностью. - Приготовьте промытые кислотой крышки.
- Используйте стакан емкостью 500 мл и водяную баню для нагрева 28 г боросиликатных стеклянных крышек диаметром 12 мм и толщиной No 1,5 в течение 24 ч при 56 °C в 100 мл 1 M HCl. Запечатайте стакан полиэтиленовой пленкой, чтобы избежать обширного испарения.
ВНИМАНИЕ: HCl является сильной кислотой, которая является очень коррозионной и, следовательно, должна обрабатываться с осторожностью и использоваться в химическом вытяжном шкафу, чтобы избежать вдыхания. - Промойте крышки дистиллированной водой. Повторите стирку 4 раза. Затем промыть крышки 95% этанолом. Повторите стирку 4 раза.
- Храните промытые кислотой крышки в чашке для клеточных культур при комнатной температуре для будущего использования, сохраняя стерильность путем погружения в 95% этанол. Запечатайте тарелку парапленкой, чтобы избежать обширного испарения.
- Используйте стакан емкостью 500 мл и водяную баню для нагрева 28 г боросиликатных стеклянных крышек диаметром 12 мм и толщиной No 1,5 в течение 24 ч при 56 °C в 100 мл 1 M HCl. Запечатайте стакан полиэтиленовой пленкой, чтобы избежать обширного испарения.
2. Подготовка клеток
- Используя сливающуюся 10 см тканевую культуральную пластину с адгезивными клетками, представляющими интерес, аспирируют среду и промывают клетки 5 мл DPBS, предварительно расплавленные при 37 °C.
- Отделите клетки от пластины, добавив 1,5 мл предварительно расплавленного 0,25% трипсина и инкубируя при 37 °C.
ПРИМЕЧАНИЕ: Время инкубации трипсина, необходимое для отделения интересующих клеток, должно быть эмпирически определено и может быть подтверждено путем наблюдения отслоения под обычным световым микроскопом. - Соберите клетки в 15 мл центрифужной трубки и добавьте 4,5 мл полной среды для гашения трипсина.
- Гранулируют клетки центрифугированием в течение 3 мин при 200 х г и аспирируют супернатант.
- Повторно суспендируйте ячейку гранулы в достаточном объеме предварительно расплавленной полной среды для получения одноклеточной суспензии для посева.
- Приступайте к посеву клеток на 24-луночную пластину с крышками или 96-луночную микропластину (рисунок 1).
ПРИМЕЧАНИЕ: Количество клеток, подлежащих посеву, должно быть эмпирически определено для каждой клеточной линии, поскольку скорость и размер пролиферации варьируются между клеточными линиями. Этот протокол был оптимизирован для адгезивных раковых клеток с 80% конфюляцией клеток в день маркировки макропиносом. Слияние клеток может влиять на макропиноцитарную емкость, и это также должно быть определено эмпирически.- 24-луночная пластина с форматом крышки
- Добавьте крышки к 24-луночной пластине для посева тканей, используйте щипцы, чтобы захватить один обшивку из этаноловой ванны. Прижмите крышку к внутренней стенке пластины, чтобы удалить избыток этанола, и поместите крышку на дно колодца.
- Дайте этанолу испариться и промыть крышку 2 раза DPBS.
- Посейте клетки поверх крышки, добавив 500 мкл клеточной суспензии в каждую лунку. Поместите клетки в клеточный инкубатор с температурой 37 °C с 5% CO2 до тех пор, пока слияние клеток не достигнет 60-80% за день до маркировки макропиносом.
- За день до маркировки макропиносом аспирируют среду из лунок и добавляют в каждую лунку по 500 мкл предварительно расплавленной среды без сыворотки и помещают клетки в клеточный инкубатор с 37 °C с 5% CO2 в течение 16-24 ч.
ПРИМЕЧАНИЕ: В зависимости от условий, подлежащих изучению, безсыворочные среды рекомендуются для уменьшения воздействия факторов роста, которые могут индуцировать макропиноцитоз и которые обычно присутствуют в сыворотке крови. Однако следует учитывать, что сывороточное голодание может влиять на другие клеточные процессы, такие как пролиферация и аутофагия. Поскольку остаточная сыворотка может влиять на макропиноцитарную емкость клеток, а также на активность ингибиторов, удаление сыворотки может быть улучшено путем осторожного промывания клеток 1 или 2 раза 500 мкл предварительно расплавленного DPBS.
- 96-луночный формат микропластины
- Переложите клеточную суспензию в резервуар реагента объемом 25 мл. Используя многоканальную пипетку (8 или 12 каналов), засовывают 100 мкл клеточной суспензии в каждую лунку черной 96-луночной экранирующей микропластинки с оптически чистым циклическим олефином или стеклянным дном.
- Поместите клетки в клеточный инкубатор с температурой 37 °C с 5% CO2 до тех пор, пока слияние клеток не достигнет 60-80% за день до маркировки макропиносом.
- За день до маркировки макропиносом удаляют и выбрасывают носители из каждой скважины с помощью многоканальной пипетки (8 или 12 каналов) или многоканального аспирационного адаптера для стандартных наконечников, прикрепленных к вакуумному насосу.
- Используя резервуар реагента и многоканальную пипетку (8 или 12 каналов), аккуратно добавьте в каждую лунку 100 мкл предварительно выровненных безымянных сред. Поместите клетки в клеточный инкубатор с температурой 37 °C с 5% CO2 в течение 16-24 ч.
ПРИМЕЧАНИЕ: В зависимости от условий, подлежащих изучению, безсыворочные среды рекомендуются для уменьшения воздействия факторов роста, которые могут индуцировать макропиноцитоз и которые обычно присутствуют в сыворотке крови. Однако следует учитывать, что сывороточное голодание может влиять на другие клеточные процессы, такие как пролиферация и аутофагия. Поскольку остаточная сыворотка может влиять на макропиноцитарную емкость клеток, а также на активность ингибиторов, удаление сыворотки может быть улучшено путем осторожного промывания клеток 1 или 2 раза 100 мкл предварительно расплавленным DPBS.
- 24-луночная пластина с форматом крышки
3. Маркировка макропиносом
- 24-луночная пластина с форматом крышки
- Аспирируйте лунки и добавьте обратно 200 мкл свободных от сыворотки среды с 1 мг/мл флуорофор-меченого высокомолекулярного декстрана (70 кДа). Поместите клетки в инкубатор с температурой 37 °C на 30 мин.
ПРИМЕЧАНИЕ: В зависимости от условий, подлежащих изучению, вместо использования свежих сред может быть предпочтительным повторное использование кондиционированной среды для загрузки декстрана, поскольку она будет содержать секретируемые или дополненные факторы, такие как EGF или ингибиторные соединения, соответственно, которые могут влиять на макропиноцитарную способность клеток. - Аспирируйте среду и аккуратно, но быстро промыть клетки 5 раз ледяным PBS, используя предварительно охлажденную бутылку для стирки. Крепко встряхивайте тарелку вручную во время стирки, чтобы помочь в смещении агрегатов декстрана, которые прилипают к чехлам.
- Зафиксируйте клетки, добавив 350 мкл 3,7% формальдегида и инкубируя в течение 20 мин. Затем аспирируйте раствор для фиксации и дважды промывайте клетки PBS.
- Окрашивают ядра 350 мкл 2 мкг/мл DAPI в PBS. Через 20 мин аспирировать раствор DAPI и трижды промыть клетки PBS.
- Прикрепите силиконовые изоляторы бок о бок на предметном стекле микроскопа для получения равномерного расстояния и воспроизводимой локализации облицовочных пластинок, необходимых для автоматизации визуализации (рисунок 2A,B).
ПРИМЕЧАНИЕ: Весь слайд микроскопа может быть заполнен в общей сложности 3 изоляторами. - Для каждой крышки добавьте каплю упрочняющего флуоресцентного монтажного носителя на предметное стекло микроскопа в открытом пространстве изолятора (рисунок 2C). Возьмите крышку с помощью щипцов и удалите лишний PBS, осторожно постукивая по боковой стороне чехлов на безворсовой салфетке.
- Поместите крышку вверх ногами на каплю монтажного носителя (рисунок 2D). Осторожно постучите по крышке закрытыми щипцами, чтобы удалить пузырьки с монтажного носителя (рисунок 2E).
- Храните слайды в темной среде и дайте монтажной среде высохнуть при комнатной температуре, обычно занимая 16-24 часа. Слайды теперь могут быть изображены или сохранены при -20 °C в течение 2 недель.
- Перед визуализацией извлеките изоляторы из слайда микроскопа. Пусть слайды уравновешиваются до комнатной температуры и очищают крышки с помощью аппликатора с хлопковым наконечником, смачиваемого очистителем стекла без аммиака. Затем используйте чистый аппликатор с хлопковым наконечником, смаченный 70% этанолом, чтобы очистить и оставить крышку сухой.
- Аспирируйте лунки и добавьте обратно 200 мкл свободных от сыворотки среды с 1 мг/мл флуорофор-меченого высокомолекулярного декстрана (70 кДа). Поместите клетки в инкубатор с температурой 37 °C на 30 мин.
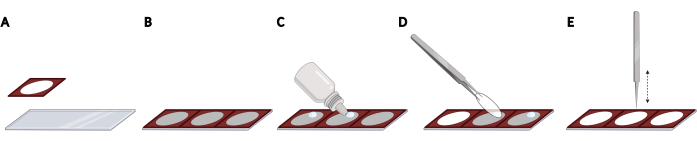
Рисунок 2: Размещение обшивки на предметном стекле микроскопа с помощью силиконовых изоляторов. (А) Силиконовые изоляторы прижимаются и приклеиваются к слайду микроскопа. (B) Весь слайд микроскопа может быть заполнен в общей сложности 3 изоляторами, что приводит к равномерному расстоянию и воспроизводимой локализации крышек. (C) Для каждого крышки добавить каплю флуоресцентной монтажной среды на предметное стекло микроскопа в открытом пространстве изолятора. (D) Используя щипцы, возьмите крышку с 24-луночной пластины и поместите ее вверх ногами на каплю монтажного носителя. (E) Когда пузырьки присутствуют между крышкой и предметным стеклом микроскопа, осторожно постучите по крышке, используя закрытые щипцы, чтобы удалить пузырьки. Создано с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- 96-луночный формат микропластины
- Аспирируйте скважины с помощью многоканального аспирационного адаптера, прикрепленного к вакууму, и добавляйте 40 мкл свободных от сыворотки среды с 1 мг/мл флуорофора меченого высокомолекулярным (70 кДа) декстраном обратно в скважины. Инкубируйте клетки в клеточном инкубаторе с температурой 37 °C в течение 30 мин.
ПРИМЕЧАНИЕ: В зависимости от условий, подлежащих изучению, вместо использования свежих сред может быть предпочтительным повторное использование кондиционированной среды для загрузки декстрана, поскольку она будет содержать секретируемые или дополненные факторы, такие как EGF или ингибиторные соединения, соответственно, которые могут влиять на макропиноцитарную способность клеток. - Утилизируйте носитель в микропластинке, вручную щелкнув пластиной вверх ногами в пустой 5-литровый стакан (рисунок 3A).
- Промойте ячейки в микропластинке, медленно погружая пластину вертикально, под небольшим углом, в 2-литровый стакан, заполненный ледяным PBS (рисунок 3B), а затем утилизируйте PBS в микропластинку, щелкнув пластиной вверх ногами в 5-литровый стакан (рисунок 3C). Повторите 2 раза.
ПРИМЕЧАНИЕ: Клетки, которые слабо прикрепляются к микропластинке визуализации, могут отсоединяться во время этого процесса. При необходимости колодцы также могут быть аспирированы с помощью многоканального аспирационного адаптера или более аккуратно промыты PBS с использованием многоканальной пипетки. Для обработки одной 96-луночной микропластины потребуется примерно 2 л ледяного PBS. Если необходимо проанализировать больше пластин, используйте больший стакан и добавьте 1 л ледяного PBS для каждой дополнительной пластины или освежите ледяную PBS по мере необходимости. - После удаления PBS от последней промывки зафиксируйте ячейки в течение 20 мин при комнатной температуре, добавив 100 мкл 3,7% формальдегида в PBS в каждую скважину с использованием резервуара реагентов 25 мл и многоканальной пипетки (рисунок 3D).
- Удалите раствор для фиксации и дважды промойте ячейки PBS, используя технику погружения и щелчка. Окрашивают ядра 100 мкл 2 мкг/мл DAPI в PBS на лунку.
- Через 20 мин трижды промыть клетки ледяным PBS, используя технику погружения и щелчка, описанную выше (шаг 3.2.3). Удалите все остатки PBS, постучав микропластинкой вверх ногами по безворсовой салфетке и добавьте 100 мкл свежего PBS в каждую скважину, используя резервуар реагента 25 мл и многоканальную пипетку. Создайте изображение клеток сейчас или храните их закрытыми от света при 4 °C в течение одной недели.
ПРИМЕЧАНИЕ: Альтернативно, раствор глицерина в PBS (вместо PBS) может быть использован для визуализации и хранения для лучшей стабилизации флуоресценции (рисунок 4A). - Перед визуализацией дайте пластине уравновеситься до комнатной температуры. Вытрите микропластинку насухо безворсовой салфеткой.
- Аспирируйте скважины с помощью многоканального аспирационного адаптера, прикрепленного к вакууму, и добавляйте 40 мкл свободных от сыворотки среды с 1 мг/мл флуорофора меченого высокомолекулярным (70 кДа) декстраном обратно в скважины. Инкубируйте клетки в клеточном инкубаторе с температурой 37 °C в течение 30 мин.
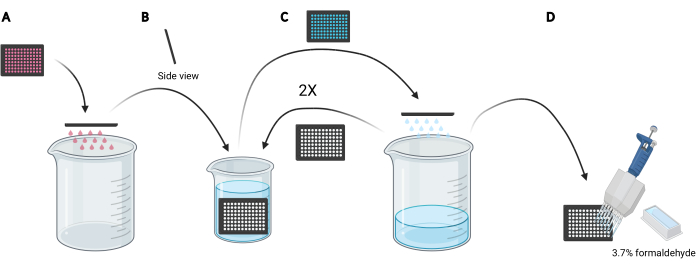
Рисунок 3: Промывка 96-луночной микропластины для подготовки к фиксации. (A) Очистите микропластину носителя в 5-литровый стакан путем ручного щелчка. (B) Вертикально и под небольшим углом медленно погружайте микропластинку в 2-литровый стакан, заполненный ледяным PBS. (C) Очистите микропластинку PBS в 5-литровый стакан вручную. Повторите шаги стирки, как описано в разделе B , два раза. (D) После опорожнения PBS в микропластине в последний раз добавьте 100 мкл 3,7% формальдегида в скважины, используя многоканальную пипетку. Создано с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Автоматизированная визуализация макропиносом
Изображения макропиносом могут быть получены с помощью стандартного флуоресцентного микроскопа, как описано ранее19,20. Однако такая процедура может быть улучшена с точки зрения эффективности за счет автоматизации, особенно при оценке многочисленных различных условий клеточной культуры. Автоматизация получения изображений может быть достигнута с помощью многорежимного считывателя пластин клеточной визуализации, что уменьшает усилия за счет сокращения процедур обработки и, что важно, повышает воспроизводимость и надежность данных за счет получения изображений непредвзятым образом. Несколько систем визуализации коммерчески доступны, и направления будут различаться между инструментами. Здесь описано получение изображений с помощью Cytation 5. Тем не менее, приведенный ниже протокол может быть адаптирован к каждому отдельному инструменту путем соблюдения следующих руководящих принципов:
- Создайте протокол автоматизации для получения изображений с 40-кратным воздушным объективом в канале длин волны флуорофора декстрана (FITC/TMR) и DAPI.
ПРИМЕЧАНИЕ: Широко используемый ингибитор макропиноцитоза EIPA проявляет аутофлуоресценцию в канале FITC, особенно при предварительном возбуждении в канале DAPI. Другие тестируемые соединения также могут проявлять автофлуоресценцию. Чтобы обойти эту проблему, настройка получения изображения сначала в канале с самой высокой длиной волны возбуждения (FITC / TMR), а вторая в канале DAPI помогает избежать этого случая. - Оптимизируйте настройки экспозиции с помощью образца, который, по прогнозам, будет иметь самый высокий уровень макропиноцитоза, чтобы избежать передержки, которая может привести к насыщению сигнала и потере данных интенсивности. Используйте настройки фокусировки, которые легко и последовательно находят образец для получения высококачественных изображений.
- Получите несколько изображений по каждой скважине или крышке, чтобы учесть изменчивость образца и получить точное представление образца.
- После определения параметров изображения используйте одинаковые параметры для каждого образца в эксперименте.
- Следуйте этим инструкциям для получения изображений макропиносом при использовании программного обеспечения Cytation 5 и Gen5:
- 24-луночная пластина с форматом крышки
- Запустите считыватель пластин и вставьте слайды микроскопа вверх ногами с помощью держателя слайдов.
- Откройте считыватель микропластин и программное обеспечение для обработки изображений, создайте новый протокол, щелкнув Протоколы, и Создайте новый. Дважды щелкните по процедуре и выберите тип пластины.
ПРИМЕЧАНИЕ: Если тип пластины недоступен, добавьте тип пластины в программное обеспечение, щелкнув Системные > Типы пластин > Добавить пластину и используя размеры пластины, указанные производителем. Для удобства использования шаблон для двух слайдов микроскопа с тремя крышками, разнесенными с помощью силиконовых изоляторов, представлен в дополнительном файле 1. - Чтобы получить доступ к настройкам образа, выберите Действия > Image > Inverted imager и нажмите кнопку OK. Используйте 40-кратный, PL FL Фазовый объектив с широким FOV и автофокусом Binning.
- Для первого канала выберите светодиодный куб, соответствующий декстрановой флуорофорной метке (GFP или RFP). Отключите автоматическую экспозицию и нажмите кнопку значка микроскопа, чтобы оптимизировать настройки экспозиции. Когда соответствующие настройки экспозиции будут определены, нажмите «Сохранить настройки».
ПРИМЕЧАНИЕ: Настройте параметры экспозиции с помощью образца, который, по прогнозам, будет иметь самый высокий уровень макропиноцитоза, чтобы избежать переэкспонирования изображений, что может привести к насыщению сигнала и потере данных интенсивности. - Повторите предыдущий шаг для второго канала с помощью светодиодного куба DAPI.
- Установите параметры автофокусировки для каждого канала флуоресценции, выберите «Параметры фокусировки». Снимите флажок с метода фокусировки по умолчанию и используйте автофокус с дополнительным сканированием и автофокус без дополнительного сканирования для декстран-флуорофора и канала DAPI соответственно. Нажмите OK , чтобы сохранить настройки.
ПРИМЕЧАНИЕ: Расстояние сканирования может быть уменьшено до 200 мкм, а приращение до 20 мкм для повышения эффективности автофокусировки. Дополнительное сканирование требуется для адекватной автофокусировки на образцах с низкой флуоресценцией. Обычно это происходит при анализе состояний с низким макропиноцитозом, например, когда макропиноцитоз ингибируется или не присутствует врожденно. - Используйте параметр «Определить маяки» для автоматизации получения изображений в разных областях обложки. Щелкните значок микроскопа и добавьте маяки, щелкнув в окне изображения и переместив сцену в следующую область. Выбрав соответствующее количество областей, перейдите к следующему облицовочному листу и повторите процесс. Чтобы завершить работу, нажмите «Сохранить настройки».
ПРИМЕЧАНИЕ: Чтобы получить хорошее представление о макропиноцитозе по всей выборке, выберите приблизительно 20 маяков, которые равномерно распределены по чехловому листу (рисунок 4B). Можно использовать меньше маяков, но некоторые изображения, возможно, придется исключить из анализа изображений после получения из-за несоответствий качества, например, когда изображение не в фокусе или содержит пузырьки или флуоресцентные пятна и пятна. - Чтобы завершить настройку параметров изображения, нажмите кнопку ОК. Чтобы создать изображение обложек, выберите Создать новый эксперимент и прочитать сейчас в средствах протокола. Сохраните протокол и эксперимент при появлении соответствующего запроса.
- 24-луночная пластина с форматом крышки
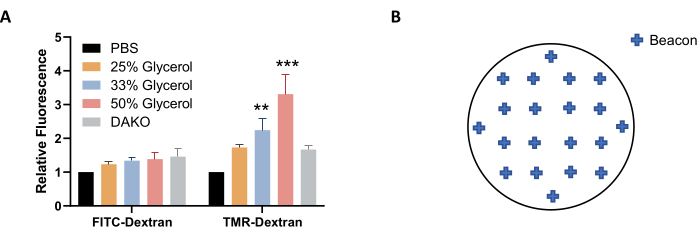
Рисунок 4: Оптимизация условий получения изображения. (A) Повышение концентрации глицерина увеличивает флуоресценцию TMR-декстрана, как это определено в клетках AsPC-1, обработанных EGF. (B) Примеры координат визуальных маяков для автоматического получения изображений при использовании 24-луночной пластины с форматом крышек. Гистограмма показывает среднюю относительную флуоресценцию с SEM из 5 экспериментов. Статистическая значимость определялась двусторонней ANOVA, относительно PBS. ** p < 0,01; p < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- 96-луночный формат микропластины
- Запустите считыватель пластин и вставьте микропластинку.
- Откройте считыватель микропластин и программное обеспечение для обработки изображений, создайте новый протокол, щелкнув Протоколы, и Создайте новый. Дважды щелкните по процедуре и выберите тип пластины.
ПРИМЕЧАНИЕ: Если тип пластины недоступен, добавьте тип пластины в программное обеспечение, щелкнув Системные > Типы пластин > Добавить пластину и используя размеры пластины, указанные производителем. Для удобства использования шаблон для микропластин CellCarrier-96 Ultra от PerkinElmer представлен в дополнительном файле 2. - Чтобы получить доступ к настройкам образа, выберите Действия > Image > Inverted Imager и нажмите кнопку ОК. Используйте 40-кратный объектив PL FL Phase с широким FOV и автофокусом Binning.
- Для первого канала выберите светодиодный куб, соответствующий декстрановой флуорофорной метке (GFP или RFP). Отключите автоматическую экспозицию и нажмите кнопку значка микроскопа, чтобы оптимизировать настройки экспозиции. Когда соответствующие настройки экспозиции будут определены, нажмите «Сохранить настройки».
ПРИМЕЧАНИЕ: Во время оптимизации настроек экспозиции может произойти значительное флуоресцентное отбеливание. Это может привести к тому, что параметры вызовут передержку при отображении нового поля. Поэтому проверьте настройки экспозиции, проверив еще не экспонированное поле и убедившись, что на выбранных настройках не происходит насыщения сигнала. Не включайте скважины, используемые для оптимизации настройки экспозиции, в количественную оценку макропиносом, так как флуоресценция уменьшилась в результате отбеливания во время оптимизации. Настройте параметры экспозиции с помощью образца, который, по прогнозам, будет иметь самый высокий уровень макропиноцитоза, чтобы избежать переэкспонирования изображений, что может привести к насыщению сигнала и потере данных интенсивности. - Повторите предыдущий шаг для второго канала с помощью светодиодного куба DAPI.
- Установите параметры автофокусировки для каждого канала флуоресценции, выберите «Параметры фокусировки». Отмените выбор метода фокусировки по умолчанию и используйте лазерную автофокусировку. Захват контрольного сканирования после определения фокальной плоскости для оптимальной визуализации макропиносом и ядер. Нажмите OK , чтобы сохранить настройки.
ПРИМЕЧАНИЕ: Расстояние сканирования может быть уменьшено до 400 мкм, а приращение до 3 мкм для повышения эффективности автофокусировки. Чтобы опция лазерной автофокусировки работала должным образом, очистите нижнюю часть пластины, высушите и протрите пластину безворсовой салфеткой перед визуализацией. Лазерная автофокусировка является превосходным методом фокусировки, поскольку для поиска фокальной плоскости требуется минимальное время. Могут использоваться и другие методы фокусировки, но, поскольку в скважины не было добавлено против затухания, эти методы могут привести к значительному обесцвечиванию образцов, что негативно скажется на сборе данных. - Установите горизонтальное и вертикальное смещение равным нулю и в разделе «Одно изображение» выберите «Монтаж без перекрытия» и используйте изображения размером 3 x 3 в зависимости от того, сколько ячеек требуется включить в анализ.
ПРИМЕЧАНИЕ: В зависимости от размера и плотности клеток можно сделать больше или меньше изображений для получения репрезентативной оценки макропиноцитоза по всему образцу. При оценке макропиноцитоза в клетках AsPC-1 или MIA PaCa-2 в различных условиях не наблюдается различий в интерпретации данных между фоторамкой 2 x 2 или 4 x 4, хотя различия между реплицируемыми образцами могут увеличиваться при съемке меньшего количества снимков (рисунок 5A, B). Увеличение или уменьшение размера кадра повлияет на время, необходимое для сканирования пластины. В зависимости от времени экспозиции, полная 96-луночная микропластинка займет около 1-1,5 ч для полного сканирования с использованием кадра 3 x 3. Кадр 2 x 2 и 4 x 4 сократит вдвое или удвоит это время соответственно. - Чтобы завершить настройку параметров изображения, нажмите кнопку ОК.
- Чтобы создать изображение пластины, выберите Создать новый эксперимент и прочитать сейчас в средствах протокола. Сохраните протокол и эксперимент при появлении соответствующего запроса.
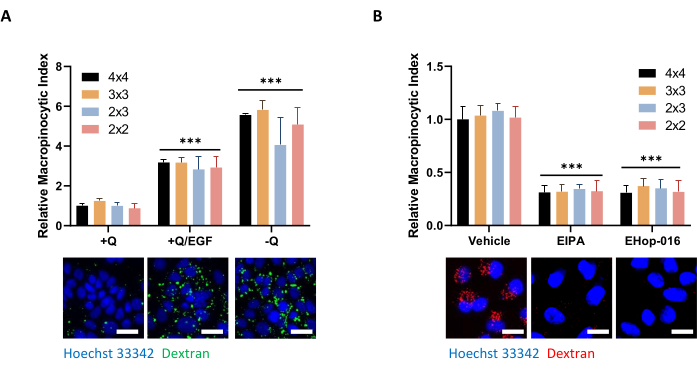
Рисунок 5: Контрольные условия оценки макропиноцитоза в клетках PDAC. (A) Клетки AsPC-1 проявляют макропиноцитоз в ответ на стимуляцию 100 нг/мл EGF в течение 5 мин или депривацию глутамина в течение 24 ч. Для получения изображения для определения влияния количества фотографий на качество данных были взяты рамки размером 4 x 4, 3 x 3, 2 x 3 или 2 x 2. (B) Клетки MIA PaCa-2 демонстрируют конститутивный макропиноцитоз, который ингибируется 30-минутным лечением 75 мкМ EIPA или 2-часовым лечением 10 мкМ EHop-016. Рамки для картин были сделаны как в А. Шкала шкалы = 25 мкм. Гистограммы показывают средний относительный макропиноцитарный индекс с SD 1 эксперимента с 4 репликами. Статистическая значимость определялась двусторонней ANOVA относительно +Q или состояния транспортного средства. p < 0.001 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Определение макропиноцитарного индекса
«Макропиноцитарный индекс» — это степень клеточного макропиноцитоза, которая определяется путем количественной оценки поглощения флуоресцентного декстрана на клетку с использованием микроскопической визуализации19. С этой целью полученные изображения используются для определения количества интернализованного декстрана путем измерения общей интенсивности флуоресценции или флуоресцентно-положительной области и общего количества клеток, определяемого окрашиванием DAPI. Этот анализ может быть выполнен с помощью программного обеспечения для обработки и анализа изображений с открытым исходным кодом, такого как Cell Profiler или FIJI/ImageJ, как описано ранее19,20. Однако при работе с многорежимным пластинчатым считывателем программное обеспечение, поставляемое с прибором, может включать в себя встроенные аналитические приложения, которые могут быть использованы для целей вычисления макропиноцитарного индекса. В некоторых случаях встроенный конвейер анализа программного обеспечения может быть не совсем очевиден для пользователя. Поэтому рекомендуется проверять программное обеспечение на ранней стадии путем сравнения с неавтоматизированной процедурой, такой как Cell Profiler или FIJI/ImageJ. Этот протокол может быть адаптирован к другим программным средствам обработки и анализа изображений, придерживаясь следующих общих инструкций:
- Для DAPI и соответствующего изображения декстрана вычтите фон, применив соответствующую функцию, часто называемую функцией катящегося шара. Отрегулируйте настройки таким образом, чтобы фоновый шум был сведен к минимуму, а эффект вычитания на сигнал DAPI и декстрана был минимальным или нулевым.
- Используя поле с высоким декстрановым сигналом, определите настройки сигнала интенсивности, часто называемые пороговой функцией, чтобы выбрать ядра и определить минимальную настройку сигнала интенсивности, необходимую для выбора только макропиносом.
- Для изображения декстрана рассчитайте общую флуоресценцию в пределах созданного макропиносомного выделения или используйте выделение для определения общей площади, положительной для декстрана.
- Для изображения DAPI используйте выделение, чтобы определить количество ядер на изображении, чтобы отразить количество присутствующих клеток.
- Чтобы определить макропиноцитарный индекс, разделите общую флуоресценцию декстрана или площадь на количество клеток, определенное DAPI.
- Повторите эти шаги анализа для всех полученных изображений, применяя одинаковые числовые настройки.
- Следуйте этим инструкциям для определения макропиноцитарного индекса при использовании программного обеспечения Gen5:
ПРИМЕЧАНИЕ: Встроенный конвейер анализа был проверен и не обнаружил различий в вычислениях относительно Fiji/ImageJ (Рисунок 6A).- После того, как визуализация будет завершена, выберите изображение с высоким уровнем макропиноцитоза. Удалите фоновый сигнал, нажмите Process (Дополнительный рисунок 1A) и выберите опцию Image Preprocessing .
- Для канала декстрана снимите флажок «Авто » и используйте катящийся шар диаметром 5 мкм, расставьте приоритеты для получения точных результатов и сгладьте изображение за 1 цикл.
- Для канала DAPI используйте автоматическую предварительную обработку и 1 плавный цикл. Нажмите OK и добавьте шаг предварительной обработки изображения в протокол; нажмите кнопку ДОБАВИТЬ ШАГ. Затем выберите обработанное изображение под развертыванием Image (Дополнительный рисунок 1B) и нажмите кнопку Analyze (Дополнительный рисунок 1C).
- В разделе ПАРАМЕТРЫ АНАЛИЗА установите для параметра Тип значение Клеточный анализ. Выберите канал DAPI и нажмите Options (Дополнительный рисунок 2A).
- Для основной маски, используя обработанное изображение DAPI, создайте маску для выбора отдельных ядер. Используйте параметры «Темный фон » и «Авто ». Кроме того, определите, какие настройки позволяют выбрать маску для отдельных ядер, и по завершении нажмите кнопку «Применить », чтобы определить, правильно ли применена маска.
ПРИМЕЧАНИЕ: Активация параметров «Разделение касающихся объектов» и «Заполнение отверстий в масках» может лучше всего работать для выбора отдельных ядер. Минимальные и максимальные размеры объектов могут нуждаться в корректировке в зависимости от линии ячеек и чаще всего устанавливаются в диапазоне 5-40 мкм. Основные объекты Edge могут быть включены, и все изображение должно быть проанализировано. Ползунок можно применять для настройки выбора маски в соответствии с интенсивностью сигнала. - Далее примените вторичную маску для оптимизации настроек выбора макропиносом флуоресцентной пункции. Используйте функцию «Измерить в дополнительной маске » и разверните первичную маску на 40 мкм в зависимости от размера ячеек.
- Используйте функции Threshold и метод Threshold in Mask для выбора положительных областей декстрана. Нажмите кнопку Применить , чтобы определить, правильно ли применены настройки.
ПРИМЕЧАНИЕ: Чтобы определить пороговое значение, используйте инструмент View Line Profile (дополнительный рисунок 2B) и проведите линию над декстран-положительной областью (дополнительный рисунок 2C). Используйте измеренную интенсивность, чтобы определить наилучшую настройку для создания маски, которая выбирает макропиносомы и исключает фоновый сигнал (дополнительный рисунок 2D). - После создания соответствующих масок для выбора ядер и макропиносом перейдите на вкладку Вычисляемые метрики и выберите Выбрать или Создать метрики на уровне объекта, представляющие интерес.
- Удалите все присутствующие метрики и добавьте метрики Интеграл и Площадь для анализа вторичной маски. Нажмите кнопку ОК и выберите Рассчитать и показать для новых метрик. По завершении нажмите OK и выберите ADD STEP , чтобы добавить анализ и вычисления в протокол.
- Сохраните готовый протокол для дальнейшего использования, нажмите кнопку Файл и Сохранить протокол как.
- После завершения анализа данных выберите интересующие метрики и экспортируйте данные для определения макропиноцитарного индекса. Определите макропиноцитарный индекс следующим образом:
Флуоресценция декстрана на клетку = объект Int_2 [флуорофор декстрана]
Площадь декстрана на ячейку = объект Area_2[флуорофор Декстрана]
ПРИМЕЧАНИЕ: Для 24-луночной пластины с форматом обложек метрики отражают среднее значение среднего макропиноцитарного индекса на изображение. Альтернативно, макропиноцитарный индекс может быть рассчитан вручную для всей выборки путем деления суммы «Площадь» или «Интеграл» для всех изображений на общее «Количество клеток». Разница между этими подходами при расчете макропиноцитарного индекса минимальна в большинстве установок. Для 96-луночного формата микропластины макропиноцитарный индекс рассчитывается как среднее значение для всей выборки. - Сохраните протокол для визуализации и последующего автоматизированного анализа. Повторно используйте протокол для будущих экспериментов с теми же флуорофорами.
ПРИМЕЧАНИЕ: При использовании функции лазерной автофокусировки необходимо провести новое эталонное сканирование при анализе другой клеточной линии, поскольку ядра и макропиносомы, возможно, локализованы в другой плоскости. Каждый раз, когда новый эксперимент выполняется с использованием ранее определенного протокола, настройки экспозиции для этого эксперимента должны быть оптимизированы.
6. Добавление процедур
Клеточные методы лечения (малые молекулы, биологические препараты, факторы роста, метаболиты и т. д.) могут быть включены на любой стадии протокола, и точное время будет зависеть от целей и задач исследования.
- Подготовьте ячейки, как показано в разделе 2.
- Непосредственно перед добавлением процедур, представляющих интерес, подготовьте процедуры и соответствующие контрольные меры с удвоенной их конечной концентрацией в средах, свободных от сыворотки. Подготовьте обработку в объеме, равном объему оцениваемого количества реплицируемых скважин.
ПРИМЕЧАНИЕ: Учитывая роль, которую секретируемые факторы могут играть в контроле клеточных функций, может быть предпочтительно разбавить интересующие методы лечения в условных средах. Для этих целей может быть полезно засеять дополнительные пластины, такие как 6-сантиметровые или 10-сантиметровые чашки для культивирования клеток, при подготовке клеток, как описано в разделе 2, для получения кондиционированной среды для приготовления лечебных растворов. - Не удаляя среду из лунки, добавьте в каждую лунку по одному объему лечебного раствора. Встряхните тарелку, чтобы обеспечить правильное перемешивание. Инкубируйте клетки в течение нужного количества времени.
- Перейдите к разделу 3.
ПРИМЕЧАНИЕ: При добавлении декстрана использование свежих сред вызывает удаление добавленных методов лечения, что может повлиять на уровень макропиноцитоза. Поэтому может быть предпочтительно добавлять декстран непосредственно в скважины без аспирации или альтернативно повторно добавлять обработки или повторно использовать кондиционированную среду для приготовления раствора декстрана.
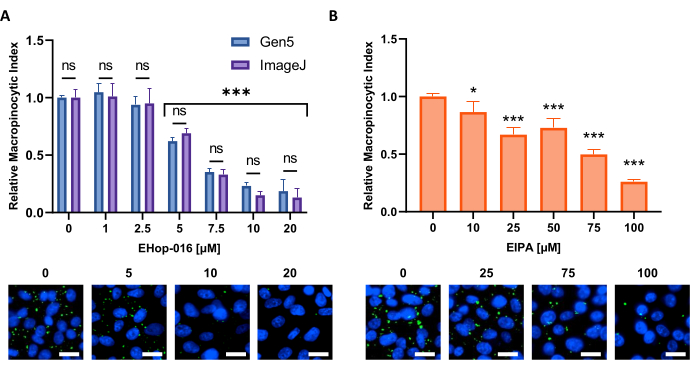
Рисунок 6: Выполнение кривой доза-реакция для ингибиторов макропиноцитоза. Пример данных, полученных при тестировании известных ингибиторов макропиноцитоза в новой клеточной линии. Клетки PATU8998T использовали для 96-луночного формата микропластины и обрабатывали в течение 2 ч и 30 мин указанными концентрациями (A) EHop-16 и (B) EIPA соответственно. Сравнение результатов, полученных с помощью анализа изображений программным обеспечением Gen5 или ImageJ, не показывает существенных различий между двумя подходами, как указано ns в (A). Шкала шкалы = 25 мкм. Гистограммы показывают среднее значение и SD одного эксперимента с 4 репликами. Статистическая значимость определялась одно- или двусторонней ANOVA по сравнению с необработанными условиями. * p < 0,05; p < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Когда этапы и корректировка вышеописанного протокола соблюдаются соответствующим образом, окончательные экспериментальные результаты должны предоставить информацию о том, индуцируют ли исследуемые условия клеточной культуры или ингибиторы индуцируют или уменьшают макропиноцитоз...
Обсуждение
Качество экспериментов и сбора данных в значительной степени зависит от качества реагентов, оптимизации настроек и чистоты крышек и микропластин. Окончательные результаты должны давать минимальные различия между репликами; однако биологические изменения происходят естественным об?...
Раскрытие информации
C.C. является изобретателем выданного патента под названием «Диагностика рака, терапия и открытие лекарств, связанных с макропиноцитозом», патент No: 9 983 194.
Благодарности
Эта работа была поддержана грантами NIH / NCI (R01CA207189, R21CA243701) C.C. KMO.G. является получателем премии TRDRP Postdoctoral Fellowship Award (T30FT0952). BioTek Cytation 5 является частью Sanford Burnham Prebys Cell Imaging Core, которое получает финансовую поддержку от гранта NCI Cancer Center Support Grant (P30 CA030199). Рисунки 1-3 были созданы с помощью BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
Ссылки
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены