Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes y análisis automatizados para la cuantificación de macropinosomas marcados fluorescentemente
En este artículo
Resumen
Los ensayos automatizados que utilizan microplacas de múltiples pocillos son enfoques ventajosos para identificar reguladores de vías al permitir la evaluación de una multitud de condiciones en un solo experimento. Aquí, hemos adaptado el protocolo de cuantificación e imágenes de macropinosomas bien establecido a un formato de microplaca de 96 pocillos y proporcionamos un esquema completo para la automatización utilizando un lector de placas multimodo.
Resumen
La macropinocitosis es una vía de captación de fase fluida no específica que permite a las células internalizar una gran carga extracelular, como proteínas, patógenos y desechos celulares, a través de la endocitosis a granel. Esta vía juega un papel esencial en una variedad de procesos celulares, incluida la regulación de las respuestas inmunes y el metabolismo de las células cancerosas. Dada esta importancia en la función biológica, el examen de las condiciones del cultivo celular puede proporcionar información valiosa mediante la identificación de reguladores de esta vía y la optimización de las condiciones que se emplearán en el descubrimiento de nuevos enfoques terapéuticos. El estudio describe una técnica automatizada de imágenes y análisis utilizando equipos de laboratorio estándar y un lector de placas multimodo de imágenes celulares para la cuantificación rápida del índice macropinocítico en células adherentes. El método automatizado se basa en la absorción de dextrano fluorescente de alto peso molecular y se puede aplicar a microplacas de 96 pocillos para facilitar las evaluaciones de múltiples condiciones en un experimento o muestras fijas montadas en cubiertas de vidrio. Este enfoque tiene como objetivo maximizar la reproducibilidad y reducir la variación experimental, al tiempo que ahorra tiempo y es rentable.
Introducción
La vía endocítica inespecífica de la macropinocitosis permite a las células internalizar una variedad de componentes extracelulares, incluidos nutrientes, proteínas, antígenos y patógenos, a través de la absorción masiva de líquido extracelular y sus constituyentes1. Aunque es importante para la biología de numerosos tipos celulares, cada vez más, se describe que la vía de la macropinocitosis desempeña un papel esencial en la biología tumoral, donde, a través de la captación macropinocítica, las células tumorales son capaces de sobrevivir y proliferar en presencia de un microambiente agotado de nutrientes2,3. La absorción de macromoléculas extracelulares, incluyendo albúmina y matriz extracelular, y restos de células necróticas, proporciona una fuente alternativa de nutrientes para la producción de biomasa mediante la creación de aminoácidos, azúcares, lípidos y nucleótidos a través del catabolismo de carga mediado por fusión de macropinosomas y lisosomas4,5,6,7,8.
La inducción y regulación de la macropinocitosis son complejas y pueden variar dependiendo del contexto celular. Hasta el momento, se han identificado varios inductores de macropinocitosis e incluyen ligandos, como el factor de crecimiento epidérmico (EGF), el factor de crecimiento derivado de plaquetas (PDGF), la galectina-3 y Wnt3A9,10,11,12,13. Además, las condiciones de cultivo que imitan el microambiente tumoral pueden desencadenar la activación de la vía. Los tumores de adenocarcinoma ductal pancreático (PDAC) carecen de nutrientes, especialmente para el aminoácido glutamina, que hace que tanto las células cancerosas como los fibroblastos asociados al cáncer (CAF) dependan de la macropinocitosis para la supervivencia7,13,14,15. Además, el estrés tumoral, como la hipoxia y el estrés oxidativo, puede activar esta vía carroñera16. Además de los numerosos influenciadores extrínsecos que pueden inducir macropinocitosis, una variedad de vías intracelulares controlan la formación de macropinosomas. La transformación oncogénica mediada por Ras es suficiente para iniciar la maquinaria macropinocítica, y múltiples tipos de cáncer exhiben macropinocitosis constitutiva oncogénica impulsada por Ras4,5,9,17. Alternativamente, se han identificado la activación de Ras de tipo salvaje y las vías independientes de Ras para activar la macropinocitosis en células cancerosas y CAF10,11,15,18. El uso de varios modelos in vitro en combinación con tratamientos con inhibidores ha dado como resultado la identificación de varios moduladores de macropinocitosis, que incluyen intercambiadores de sodio-hidrógeno, la pequeña GTPasa Rac1, fosfoinositida 3-quinasa (PI3K), quinasa activada por p21 (Pak) y proteína quinasa activada por AMP (AMPK)4,13,15 . Sin embargo, dada la multitud de factores y condiciones descritos que regulan la macropinocitosis, es concebible que muchos más moduladores y estímulos permanezcan sin descubrir. La identificación de nuevos moduladores y estímulos puede facilitarse mediante la evaluación automatizada de una multitud de condiciones en un solo experimento. Esta metodología puede arrojar luz sobre los factores involucrados en la formación de macropinosomas y puede permitir el descubrimiento de nuevas moléculas pequeñas o productos biológicos que se dirigen a esta vía.
Aquí, hemos adaptado nuestro protocolo previamente establecido para determinar el grado de macropinocitosis en células cancerosas in vitro a un formato de microplaca de 96 pocillos e imágenes y cuantificación automatizadas19,20. Este protocolo se basa en la microscopía fluorescente, que se ha convertido en un estándar en el campo para determinar la macropinocitosis in vitro e in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Los macropinosomas se pueden distinguir de otras vías endocíticas por su capacidad para internalizar macromoléculas grandes, como el dextrano de alto peso molecular (es decir, 70 kDa)2,3,4,20,21,22,23. Por lo tanto, los macropinosomas se pueden definir a través de la absorción de dextrano de 70 kDa marcado con fluoróforo administrado extracelularmente. Como resultado, las vesículas macropinocíticas se manifiestan como grupos intracelulares de puntúas fluorescentes con tamaños que oscilan entre 0,2 y 5 μm. Estos puntos pueden ser fotografiados microscópicamente y posteriormente cuantificados para determinar el alcance de la macropinocitosis en la célula- 'el índice macropinocítico'.
En este protocolo, se describen los pasos esenciales para visualizar macropinosomas en células adherentes in vitro en una microplaca de 96 pocillos y cubiertas utilizando equipos de laboratorio estándar (Figura 1). Además, se proporcionan las instrucciones para automatizar la adquisición de imágenes y la cuantificación del índice macropinocítico utilizando un lector de placas multimodo de imágenes celulares. Esta automatización reduce el tiempo, el costo y el esfuerzo en comparación con nuestros protocolos descritos anteriormente19,20. Además, evita la adquisición y el análisis de imágenes involuntariamente sesgados y, por lo tanto, mejora la reproducibilidad y la confiabilidad. Este método se puede adaptar fácilmente a diferentes tipos de células o lectores de placas o utilizarse para determinar características alternativas del macropinosoma, como el tamaño, el número y la ubicación. El método aquí descrito es especialmente adecuado para el cribado de condiciones de cultivo celular que inducen macropinocitosis, la identificación de nuevos moduladores o la optimización de las concentraciones de fármacos de inhibidores conocidos.
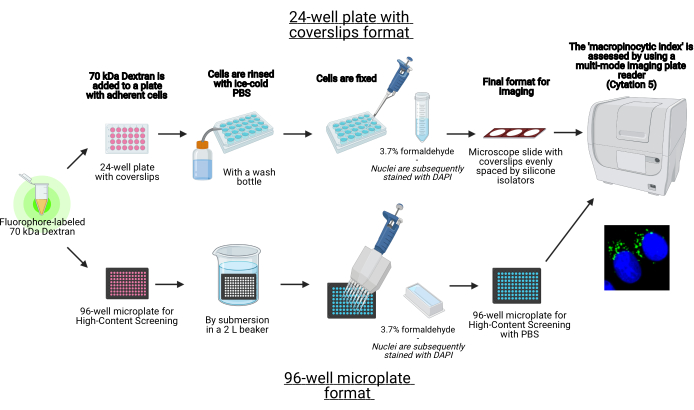
Figura 1: Esquema del ensayo automatizado para determinar el 'índice macropinocítico' en células adherentes. Creado usando BioRender. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparación de materiales
- Disolver 70 kDa dextrano marcado con FITC o tetrametilrodamina (TMR) en PBS para obtener una solución de 20 mg/ml. Conservar las alícuotas a -20 °C.
- Disolver DAPI en ddH2O para obtener una solución de 1 mg/ml. Conservar las alícuotas a -20 °C.
PRECAUCIÓN: DAPI es un carcinógeno potencial y debe manejarse con cuidado. - El día de la fijación, prepare formaldehído fresco de grado ACS al 3.7% en PBS.
PRECAUCIÓN: El formaldehído es un fijador, carcinógeno conocido y es tóxico si se inhala. Haga la solución en una campana de humos químicos para evitar la inhalación y manipule con cuidado. - Prepare fundas lavadas con ácido.
- Use un vaso de precipitados de 500 ml y un baño de agua para calentar 28 g de hojas de vidrio de borosilicato con un diámetro de 12 mm y un grosor # 1.5 durante 24 h a 56 ° C en 100 ml de 1 M HCl. Selle el vaso de precipitados con una envoltura de plástico para evitar una evaporación extensa.
PRECAUCIÓN: El HCl es un ácido fuerte que es altamente corrosivo y, por lo tanto, debe manipularse con cuidado y usarse en una campana de humos químicos para evitar la inhalación. - Lave las fundas con agua destilada. Repita el lavado 4 veces. Luego lave las fundas con etanol al 95%. Repita el lavado 4 veces.
- Almacene las cubiertas lavadas con ácido en un plato de cultivo celular a temperatura ambiente para su uso futuro manteniendo la esterilidad a través de la inmersión en etanol al 95%. Selle el plato con parafilm para evitar una evaporación extensa.
- Use un vaso de precipitados de 500 ml y un baño de agua para calentar 28 g de hojas de vidrio de borosilicato con un diámetro de 12 mm y un grosor # 1.5 durante 24 h a 56 ° C en 100 ml de 1 M HCl. Selle el vaso de precipitados con una envoltura de plástico para evitar una evaporación extensa.
2. Preparación de células
- Utilizando una placa de cultivo de tejido confluente de 10 cm con las células adherentes de interés, aspire los medios y enjuague las células con 5 ml de DPBS, precalentadas a 37 °C.
- Separe las células de la placa agregando 1.5 ml de tripsina precalentada al 0.25% e incubando a 37 ° C.
NOTA: El tiempo de incubación de tripsina requerido para separar las células de interés debe determinarse empíricamente y puede confirmarse observando el desprendimiento bajo un microscopio de luz convencional. - Recoja las células en un tubo centrífugo de 15 ml y agregue 4,5 ml de medios completos para apagar la tripsina.
- Granular las células por centrifugación durante 3 min a 200 x g y aspirar el sobrenadante.
- Resuspend el pellet celular en un volumen adecuado de medios completos precalentados para obtener una suspensión de una sola célula para la siembra.
- Proceda a sembrar las células en una placa de 24 pocillos con hojas de cubierta o un formato de microplaca de 96 pocillos (Figura 1).
NOTA: El número de células a sembrar debe determinarse empíricamente para cada línea celular, ya que las tasas de proliferación y el tamaño varían entre las líneas celulares. Este protocolo ha sido optimizado para células cancerosas adherentes con 80% de confluencia celular el día del etiquetado de macropinosomas. La confluencia celular puede afectar la capacidad macropinocítica, y esto también debe determinarse empíricamente.- Placa de 24 pocillos con formato de funda
- Agregue hojas de cubierta a una placa de cultivo de tejidos de 24 pocillos, use fórceps para agarrar una sola hoja de cubierta del baño de etanol. Golpee el cubrecolchas en la pared interior de la placa para eliminar el exceso de etanol y coloque el cubrehojas plano en el fondo de un pozo.
- Deje que el etanol se evapore y lave la funda 2 veces con DPBS.
- Sembra las células en la parte superior del deslizamiento agregando 500 μL de la suspensión celular a cada pozo. Coloque las células en una incubadora de células a 37 °C con un 5% de CO2 hasta que la confluencia celular alcance el 60%-80% el día antes del etiquetado de macropinosomas.
- El día antes del etiquetado de macropinosomas, aspire los medios de los pocillos y agregue 500 μL de medios libres de suero precalentados a cada pozo y coloque las células en una incubadora de células de 37 ° C con 5% de CO2 durante 16-24 h.
NOTA: Dependiendo de las condiciones a estudiar, se recomiendan medios libres de suero para reducir los efectos de los factores de crecimiento que pueden inducir macropinocitosis y que normalmente están presentes en el suero. Sin embargo, se debe considerar que la inanición sérica puede afectar a otros procesos celulares, como la proliferación y la autofagia. Como el suero residual puede afectar la capacidad macropinocítica de las células, así como la actividad inhibitoria, la eliminación del suero se puede mejorar enjuagando suavemente las células 1 o 2 veces con 500 μL de DPBS precalentado.
- Formato de microplaca de 96 pocillos
- Transfiera la suspensión celular a un depósito de reactivo de 25 ml. Usando una pipeta multicanal (8 o 12 canales), sembra 100 μL de la suspensión celular a cada pocillo de una microplaca negra de 96 pocillos de alto contenido con olefina cíclica ópticamente transparente o fondo de vidrio.
- Coloque las células en una incubadora de células a 37 °C con un 5% de CO2 hasta que la confluencia celular alcance el 60%-80% el día antes del etiquetado de macropinosomas.
- El día antes del etiquetado de macropinosomas, retire y deseche los medios de cada pozo utilizando una pipeta multicanal (8 o 12 canales) o un adaptador de aspiración multicanal para puntas estándar conectadas a una bomba de vacío.
- Usando un depósito de reactivo y una pipeta multicanal (8 o 12 canales), agregue suavemente 100 μL de medios sin suero precalentados a cada pozo. Coloque las células en una incubadora de células a 37 °C con un 5% de CO2 durante 16-24 h.
NOTA: Dependiendo de las condiciones a estudiar, se recomiendan medios libres de suero para reducir los efectos de los factores de crecimiento que pueden inducir macropinocitosis y que normalmente están presentes en el suero. Sin embargo, se debe considerar que la inanición sérica puede afectar a otros procesos celulares, como la proliferación y la autofagia. Como el suero residual puede afectar la capacidad macropinocítica de las células, así como la actividad inhibitoria, la eliminación del suero se puede mejorar enjuagando suavemente las células 1 o 2 veces con DPBS precalentado de 100 μL.
- Placa de 24 pocillos con formato de funda
3. Etiquetado de macropinosomas
- Placa de 24 pocillos con formato de funda
- Aspire los pocillos y vuelva a agregar 200 μL de medios libres de suero con dextrano de alto peso molecular (70 kDa) marcado con fluoróforo de 1 mg/ml. Coloque las células en una incubadora de células a 37 °C durante 30 min.
NOTA: Dependiendo de las condiciones a estudiar, en lugar de utilizar medios frescos, se puede preferir reutilizar el medio acondicionado para la carga de dextrano, ya que contendría factores secretados o suplementados, como EGF o compuestos inhibidores, respectivamente, que pueden afectar la capacidad macropinocítica de las células. - Aspire los medios y lave suave pero rápidamente las células 5 veces con PBS helado usando una botella de lavado preenfriada. Agite firmemente la placa a mano durante los lavados para ayudar a desalojar los agregados de dextrano que se adhieren a las cubiertas.
- Fije las células agregando 350 μL de formaldehído al 3,7% e incubando durante 20 min. Luego, aspire la solución de fijación y lave las células con PBS dos veces.
- Tinción de los núcleos con 350 μL de 2 μg/mL DAPI en PBS. Después de 20 min, aspire la solución dapi y lave las células con PBS tres veces.
- Adherir aisladores de silicona uno al lado del otro en un portaobjetos de microscopio para obtener un espaciado uniforme y una localización reproducible de las cubiertas, necesarias para la automatización de imágenes (Figura 2A, B).
NOTA: Todo el portaobjetos del microscopio se puede rellenar con un total de 3 aisladores. - Para cada funda, agregue una gota de soporte de montaje de fluorescencia de endurecimiento en el portaobjetos del microscopio dentro del espacio abierto del aislador (Figura 2C). Tome una funda con fórceps y elimine el exceso de PBS golpeando suavemente el lado de las fundas en una toallita sin pelusa.
- Coloque el cubrehoja boca abajo en la gota del soporte de montaje (Figura 2D). Golpee suavemente el latíbulo con pinzas cerradas para eliminar las burbujas del medio de montaje (Figura 2E).
- Guarde las diapositivas en un ambiente oscuro y permita que los medios de montaje se sequen a temperatura ambiente, lo que generalmente toma de 16 a 24 h. Las diapositivas ahora se pueden tomar imágenes o almacenar a -20 ° C durante un máximo de 2 semanas.
- Antes de tomar imágenes, retire los aisladores del portaobjetos del microscopio. Deje que las diapositivas se equilibren a temperatura ambiente y limpie las fundas con un aplicador con punta de algodón humedecido con un limpiador de vidrio sin amoníaco. Posteriormente, use un aplicador limpio con punta de algodón humedecido con etanol al 70% para limpiar y dejar el cobertor seco.
- Aspire los pocillos y vuelva a agregar 200 μL de medios libres de suero con dextrano de alto peso molecular (70 kDa) marcado con fluoróforo de 1 mg/ml. Coloque las células en una incubadora de células a 37 °C durante 30 min.
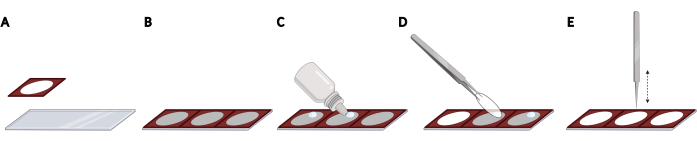
Figura 2: Colocación de latas en un portaobjetos de microscopio con aisladores de silicona. (A) Los aisladores de silicona se presionan y se adhieren a un portaobjetos de microscopio. (B) Todo el portaobjetos del microscopio se puede llenar con un total de 3 aisladores, lo que resulta en un espaciado uniforme y una localización reproducible de los cubrebocas. (C) Para cada cubierta, agregue una gota de medios de montaje de fluorescencia en el portaobjetos del microscopio dentro del espacio abierto del aislador. (D) Usando fórceps, tome un trozo de cubierta de la placa de 24 pocillos y colóquelo boca abajo en la gota del medio de montaje. (E) Cuando haya burbujas entre la lacubierta y el portaobjetos del microscopio, golpee suavemente la cubierta con fórceps cerradas para eliminar las burbujas. Creado usando BioRender. Haga clic aquí para ver una versión más grande de esta figura.
- Formato de microplaca de 96 pocillos
- Aspire los pocillos utilizando un adaptador de aspiración multicanal conectado a un vacío y agregue 40 μL de medios sin suero con dextrano de alto peso molecular (70 kDa) marcado con fluoróforo de 1 mg/ml a los pozos. Incubar las células en una incubadora de células de 37 °C durante 30 min.
NOTA: Dependiendo de las condiciones a estudiar, en lugar de utilizar medios frescos, se puede preferir reutilizar el medio acondicionado para la carga de dextrano, ya que contendría factores secretados o suplementados, como EGF o compuestos inhibidores, respectivamente, que pueden afectar la capacidad macropinocítica de las células. - Deseche el medio en la microplaca moviendo manualmente la placa boca abajo en un vaso de precipitados vacío de 5 L (Figura 3A).
- Enjuague las células de la microplaca sumergiendo lentamente la placa verticalmente, en un ligero ángulo, en un vaso de precipitados de 2 L lleno de PBS helado (Figura 3B) y posteriormente elimine el PBS en la microplaca moviendo la placa boca abajo en el vaso de precipitados de 5 L (Figura 3C). Repetir 2 veces.
NOTA: Las células que se adhieren débilmente a la microplaca de imagen pueden desprenderse durante este proceso. Si es necesario, los pocillos también se pueden aspirar con un adaptador de aspiración multicanal o lavarse más suavemente con PBS utilizando una pipeta multicanal. El procesamiento de una microplaca de 96 pocillos requerirá aproximadamente 2 L de PBS helado. Si se van a analizar más placas, use un vaso de precipitados más grande y agregue 1 L de PBS helado por cada plato adicional o refresque el PBS helado según sea necesario. - Después de la eliminación del PBS del último enjuague, fije las celdas durante 20 min a temperatura ambiente agregando 100 μL de formaldehído al 3,7% en PBS a cada pozo utilizando un depósito de reactivo de 25 ml y una pipeta multicanal (Figura 3D).
- Retire la solución de fijación y lave las células con PBS dos veces utilizando la técnica de inmersión y desplazamiento. Tinción de los núcleos con 100 μL de 2 μg/mL DAPI en PBS por pozo.
- Después de 20 min, enjuague las células tres veces con PBS helado utilizando la técnica de inmersión y desplazamiento descrita anteriormente (paso 3.2.3). Retire cualquier PBS residual tocando la microplaca boca abajo en una toallita sin pelusa y agregue 100 μL de PBS fresco a cada pozo utilizando un depósito de reactivo de 25 ml y una pipeta multicanal. Tome una imagen de las células ahora o guárdelas cubiertas de luz a 4 ° C durante un máximo de una semana.
NOTA: Alternativamente, se puede usar una solución de glicerol en PBS (en lugar de PBS) para imágenes y almacenamiento para estabilizar mejor la fluorescencia (Figura 4A). - Antes de tomar imágenes, deje que la placa se equilibre a temperatura ambiente. Seque la microplaca con una toallita sin pelusa.
- Aspire los pocillos utilizando un adaptador de aspiración multicanal conectado a un vacío y agregue 40 μL de medios sin suero con dextrano de alto peso molecular (70 kDa) marcado con fluoróforo de 1 mg/ml a los pozos. Incubar las células en una incubadora de células de 37 °C durante 30 min.
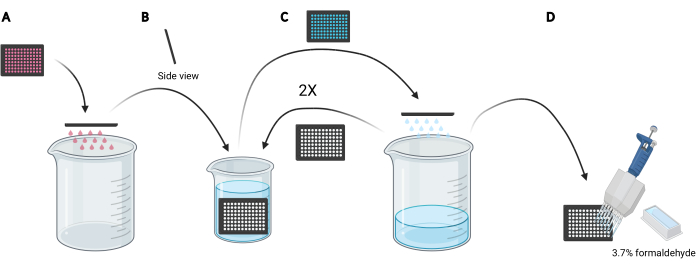
Figura 3: Enjuague de la microplaca de 96 pocillos para prepararse para la fijación. (A) Vacíe la microplaca de medios en un vaso de precipitados de 5 L moviendo manualmente. (B) Verticalmente y en un ligero ángulo, sumerja lentamente la microplaca en un vaso de precipitados de 2 L lleno de PBS helado. (C) Vacíe la microplaca de PBS en el vaso de precipitados de 5 L desplazándolo manualmente. Repita los pasos de lavado como se describe en B dos veces. (D) Después de vaciar el PBS en la microplaca por última vez, agregue 100 μL 3.7% de formaldehído a los pozos, utilizando una pipeta multicanal. Creado usando BioRender. Haga clic aquí para ver una versión más grande de esta figura.
4. Imágenes automatizadas de macropinosomas
Las imágenes de macropinosomas pueden ser capturadas utilizando un microscopio fluorescente estándar, como se describió anteriormente19,20. Sin embargo, tal procedimiento se puede mejorar en términos de eficiencia a través de la automatización, especialmente cuando se evalúan numerosas condiciones de cultivo celular diferentes. La automatización de la adquisición de imágenes se puede lograr a través de un lector de placas multimodo de imágenes celulares, lo que disminuye el esfuerzo al reducir los procedimientos de manejo y, lo que es más importante, aumenta la reproducibilidad y confiabilidad de los datos al adquirir imágenes de manera imparcial. Múltiples sistemas de imágenes están disponibles comercialmente, y las direcciones diferirán entre los instrumentos. Aquí, se describe la adquisición de imágenes utilizando una citación 5. Sin embargo, el siguiente protocolo se puede adaptar a cada instrumento individual siguiendo las siguientes pautas:
- Crear un protocolo de automatización para adquirir las imágenes con un objetivo de aire 40x en el canal de longitud de onda del fluoróforo de dextrano (FITC/TMR) y DAPI.
NOTA: El inhibidor de la macropinocitosis de uso común EIPA exhibe autofluorescencia en el canal FITC, especialmente cuando se excita previamente en el canal DAPI. Otros compuestos que se están probando también pueden mostrar autofluorescencia. Para evitar este problema, configurar la adquisición de imágenes para que ocurra primero en el canal con la longitud de onda de excitación más alta (FITC / TMR) y segundo en el canal DAPI ayuda a evitar esta ocurrencia. - Optimice la configuración de exposición utilizando una muestra que se predice que tiene el nivel más alto de macropinocitosis para evitar la sobreexposición, lo que puede provocar la saturación de la señal y la pérdida de datos de intensidad. Utilice ajustes de enfoque que localicen la muestra de forma fácil y coherente para producir imágenes de alta calidad.
- Adquiera múltiples imágenes en cada pozo o cubierta para tener en cuenta la variabilidad de la muestra y obtener una representación precisa de la muestra.
- Una vez que se hayan determinado los ajustes de imagen, utilice los mismos ajustes para cada muestra dentro del experimento.
- Siga estas instrucciones para la adquisición de imágenes de macropinosomas cuando utilice un software Cytation 5 y Gen5:
- Placa de 24 pocillos con formato de funda
- Inicie el lector de placas e inserte los portaobjetos del microscopio boca abajo con el soporte deslizante.
- Abra el lector de microplacas y el software de imágenes, cree un nuevo protocolo haciendo clic en Protocolos y Crear nuevo. Haga doble clic en Procedimiento y seleccione el tipo de placa.
NOTA: Si el tipo de placa no está disponible, agregue el tipo de placa al software haciendo clic en Sistema > Tipos de placa > Agregar placa y utilizando las dimensiones de la placa proporcionadas por el fabricante. Para facilitar su uso, la plantilla para dos portaobjetos de microscopio con tres cubiertas espaciadas con los aisladores de silicona se proporciona en el Archivo Suplementario 1. - Para acceder a la configuración de imágenes, seleccione Acciones > Imagen > imagen invertida y haga clic en Aceptar. Utilice el objetivo de fase FL PL de 40x con FOV amplio y binning de enfoque automático.
- Para el primer canal, seleccione el cubo LED correspondiente a la etiqueta del fluoróforo de dextrano (GFP o RFP). Deshaga clic en Exposición automática y haga clic en el botón del icono del microscopio para optimizar la configuración de exposición. Cuando se haya determinado la configuración de exposición adecuada, haga clic en Guardar configuración.
NOTA: Ajuste la configuración de exposición utilizando una muestra que se predice que tiene el nivel más alto de macropinocitosis para evitar imágenes sobreexpuestas, lo que puede provocar la saturación de la señal y la pérdida de datos de intensidad. - Repita el paso anterior para el segundo canal utilizando el cubo LED DAPI.
- Establezca la configuración de enfoque automático para cada canal de fluorescencia, seleccione Opciones de enfoque. Anule la selección del método de enfoque predeterminado y utilice enfoque automático con escaneo opcional y enfoque automático sin escaneo opcional para el canal dextrano-fluoróforo y DAPI, respectivamente. Haga clic en Aceptar para guardar la configuración.
NOTA: La distancia de escaneo se puede reducir a 200 μm y el incremento a 20 μm para aumentar la eficiencia del enfoque automático. Se requiere el escaneo opcional para un enfoque automático adecuado en muestras que tienen baja fluorescencia. Esto ocurre normalmente cuando se analizan condiciones con macropinocitosis baja, como cuando la macropinocitosis está inhibida o no está presente de forma innata. - Utilice la opción Definir balizas para automatizar la adquisición de imágenes en diferentes regiones del cobertor. Haga clic en el icono del microscopio y agregue balizas haciendo clic en la ventana de la imagen y moviendo el escenario a la siguiente región. Cuando se haya seleccionado el número apropiado de regiones, pase al siguiente recubierto y repita el proceso. Para finalizar, haga clic en Guardar configuración.
NOTA: Para obtener una buena representación de la macropinocitosis en toda la muestra, seleccione aproximadamente 20 balizas que se distribuyan uniformemente a través de la cubierta (Figura 4B). Se pueden usar menos balizas, pero algunas imágenes pueden tener que excluirse del análisis de imágenes después de la adquisición debido a discrepancias de calidad, como cuando la imagen está desenfocada o contiene burbujas o manchas y manchas fluorescentes. - Para completar el ajuste de la configuración de imágenes, haga clic en Aceptar. Para obtener una imagen de los cobertores, seleccione Crear un nuevo experimento y Leer ahora en las herramientas de protocolo. Guarde el protocolo y el experimento cuando se le solicite.
- Placa de 24 pocillos con formato de funda
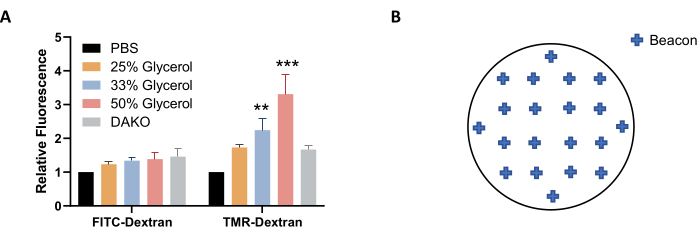
Figura 4: Optimización de las condiciones para la adquisición de imágenes. (A) El aumento de la concentración de glicerol aumenta la fluorescencia de TMR-dextrano, según lo determinado en células AsPC-1 tratadas con EGF. (B) Ejemplo de coordenadas de balizas de imagen para la adquisición automática de imágenes cuando se utiliza la placa de 24 pocillos con formato de cubiertas. El gráfico de barras muestra la fluorescencia relativa promedio con SEM de 5 experimentos. La significación estadística se determinó mediante ANOVA bidireccional, en relación con PBS. ** p < 0,01; p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
- Formato de microplaca de 96 pocillos
- Inicie el lector de placas e inserte la microplaca.
- Abra el lector de microplacas y el software de imágenes, cree un nuevo protocolo haciendo clic en Protocolos y Crear nuevo. Haga doble clic en Procedimiento y seleccione el tipo de placa.
NOTA: Si el tipo de placa no está disponible, agregue el tipo de placa al software haciendo clic en Sistema > Tipos de placa > Agregar placa y utilizando las dimensiones de la placa según lo proporcionado por el fabricante. Para facilitar su uso, la plantilla para las microplacas CellCarrier-96 Ultra de PerkinElmer se proporciona en el archivo complementario 2. - Para acceder a la configuración de imágenes, seleccione Acciones > Imagen > Imagen invertida y haga clic en Aceptar. Utilice el objetivo de fase FL de 40x PL con FOV amplio y binning de enfoque automático.
- Para el primer canal, seleccione el cubo LED correspondiente a la etiqueta del fluoróforo de dextrano (GFP o RFP). Deshaga clic en Exposición automática y haga clic en el botón del icono del microscopio para optimizar la configuración de exposición. Cuando se haya determinado la configuración de exposición adecuada, haga clic en Guardar configuración.
NOTA: Durante la optimización de los ajustes de exposición, puede producirse un blanqueamiento significativo por fluorescencia. Esto puede dar lugar a configuraciones que causan sobreexposición cuando se crea una imagen de un nuevo campo. Por lo tanto, valide la configuración de exposición comprobando un campo aún no expuesto y asegurándose de que no se produzca ninguna saturación de la señal en la configuración seleccionada. No incluya los pocillos utilizados para la optimización del ajuste de exposición en la cuantificación de macropinosomas, ya que la fluorescencia ha disminuido como resultado del blanqueo durante la optimización. Ajuste la configuración de exposición utilizando una muestra que se predice que tiene el nivel más alto de macropinocitosis para evitar imágenes sobreexpuestas, lo que puede provocar la saturación de la señal y la pérdida de datos de intensidad. - Repita el paso anterior para el segundo canal utilizando el cubo LED DAPI.
- Establezca la configuración de enfoque automático para cada canal de fluorescencia, seleccione Opciones de enfoque. Anule la selección del método de enfoque predeterminado y utilice el enfoque automático láser. Capture un escaneo de referencia después de determinar el plano focal para una visualización óptima de macropinosomas y núcleos. Haga clic en Aceptar para guardar la configuración.
NOTA: La distancia de escaneo se puede reducir a 400 μm y el incremento a 3 μm para aumentar la eficiencia del enfoque automático. Para que la opción de enfoque automático láser funcione correctamente, limpie la parte inferior de la placa, seque y limpie la placa con una toallita sin pelusa antes de obtener imágenes. El enfoque automático láser es un método superior para el enfoque, ya que requiere un tiempo mínimo para encontrar el plano focal. Se pueden utilizar otros métodos de enfoque, pero, dado que no se ha agregado antidesvaneo a los pozos, estos métodos pueden causar un blanqueamiento significativo de las muestras, lo que tendrá un impacto negativo en la recopilación de datos. - Establezca el desplazamiento horizontal y vertical en cero y, en Imagen única , seleccione Montaje sin superposición y utilice imágenes de 3 x 3, dependiendo de cuántas celdas se desee incluir en el análisis.
NOTA: Dependiendo del tamaño y la densidad de las células, se pueden tomar más o menos imágenes para obtener una evaluación representativa de la macropinocitosis en toda la muestra. Al evaluar la macropinocitosis en células AsPC-1 o MIA PaCa-2 en condiciones variables, no se observan diferencias en la interpretación de los datos entre un marco de fotos de 2 x 2 o 4 x 4, aunque la variación entre muestras replicadas puede aumentar al tomar menos imágenes (Figura 5A, B). Aumentar o disminuir el tamaño del marco afectará el tiempo que se tarda en escanear la placa. Dependiendo del tiempo de exposición, una microplaca completa de 96 pocillos tardará alrededor de 1-1.5 h en escanear completamente usando un marco de 3 x 3. Un marco de 2 x 2 y 4 x 4 reducirá a la mitad o el doble ese tiempo, respectivamente. - Para completar el ajuste de la configuración de imágenes, haga clic en Aceptar.
- Para obtener una imagen de la placa, seleccione Crear un nuevo experimento y Leer ahora en las Herramientas de protocolo. Guarde el protocolo y el experimento cuando se le solicite.
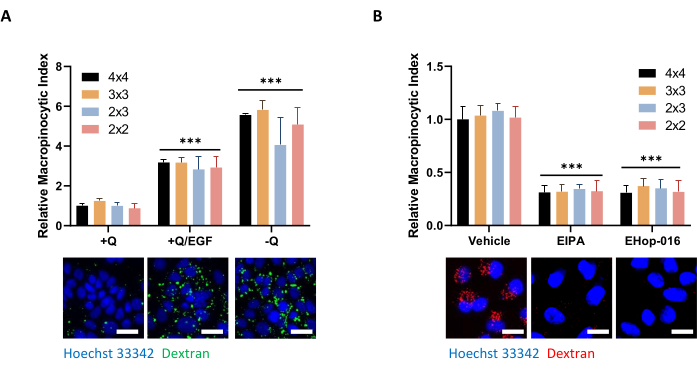
Figura 5: Condiciones de control para evaluar la macropinocitosis en células PDAC. (A) Las células AsPC-1 muestran macropinocitosis en respuesta a la estimulación de EGF de 100 ng/ml durante 5 min o a la privación de glutamina durante 24 h. Para la adquisición de imágenes, se tomaron marcos de imágenes de 4 x 4, 3 x 3, 2 x 3 o 2 x 2 para determinar la influencia del número de fotos en la calidad de los datos. (B) Las células MIA PaCa-2 muestran macropinocitosis constitutiva que se inhibe mediante un tratamiento de 30 minutos con EIPA de 75 μM o un tratamiento de 2 h con 10 μM de EHop-016. Los marcos de fotos fueron tomados como en A. Barra de escala = 25 μm. Los gráficos de barras muestran el índice macropinocítico relativo promedio con SD de 1 experimento con 4 réplicas. La significación estadística se determinó mediante ANOVA bidireccional en relación con la +Q o condición del vehículo. p < 0.001 Haga clic aquí para ver una versión más grande de esta figura.
5. Determinación del índice macropinocítico
El 'índice macropinocítico' es la extensión de la macropinocitosis celular que se determina cuantificando la captación de dextrano fluorescente por célula mediante imágenes microscópicas19. Con este fin, las imágenes adquiridas se utilizan para determinar la cantidad de dextrano internalizado midiendo la intensidad total de fluorescencia o el área positiva de fluorescencia y el número total de células según lo determinado por la tinción DAPI. Este análisis se puede realizar con software de procesamiento y análisis de imágenes de código abierto, como Cell Profiler o FIJI/ImageJ, como se describió anteriormente19,20. Sin embargo, cuando se trabaja con un lector de placas multimodo, el software proporcionado con el instrumento puede incluir aplicaciones de análisis integradas que se pueden utilizar con el fin de calcular el índice macropinocítico. En algunos casos, la canalización de análisis de software incorporada puede no ser completamente evidente para el usuario. Por lo tanto, se recomienda validar el software en una etapa temprana en comparación con un procedimiento no automatizado, como Cell Profiler o FIJI / ImageJ. Este protocolo se puede adaptar a otras herramientas de software de procesamiento y análisis de imágenes siguiendo las siguientes instrucciones generales:
- Para el DAPI y la imagen de dextrano correspondiente, reste el fondo aplicando la función apropiada, frecuentemente llamada función de bola rodante. Ajuste la configuración para que el ruido de fondo se minimice y haya un efecto de resta mínimo o nulo en la señal DAPI y dextran.
- Utilizando un campo con señal de alto dextrano, determine la configuración de la señal de intensidad, frecuentemente llamada función de umbral, para seleccionar los núcleos y determinar la configuración de señal de intensidad mínima requerida para seleccionar solo los macropinosomas.
- Para la imagen de dextrano, calcule la fluorescencia total dentro de la selección de macropinosomas creada o use la selección para determinar el área total positiva para dextrano.
- Para la imagen DAPI, utilice la selección para determinar el número de núcleos en la imagen para reflejar el número de células presentes.
- Para determinar el índice macropinocítico, divida la fluorescencia o área total de dextrano por el número de células determinadas por DAPI.
- Repita estos pasos de análisis para todas las imágenes adquiridas aplicando la misma configuración numérica en todo momento.
- Siga estas instrucciones para determinar el índice macropinocítico cuando utilice el software Gen5:
NOTA: La canalización de análisis incorporada se validó y no detectó diferencias en el cálculo en relación con Fiji/ImageJ (Figura 6A).- Una vez completada la imagen, seleccione una imagen con un alto nivel de macropinocitosis. Elimine la señal de fondo, haga clic en Proceso (Figura suplementaria 1A) y seleccione la opción Preprocesamiento de imágenes.
- Para el canal de dextrano, anule la selección de Auto y use un diámetro de bola rodante de 5 μm, priorice los resultados finos y alise la imagen con 1 ciclo.
- Para el canal DAPI, utilice el preprocesamiento automático y 1 ciclo suave. Haga clic en Aceptar y agregue el paso de preprocesamiento de imágenes al protocolo; haga clic en AGREGAR PASO. A continuación, seleccione la imagen procesada en la Implementación de la imagen (Figura suplementaria 1B) y haga clic en el botón Analizar (Figura suplementaria 1C).
- En CONFIGURACIÓN DE ANÁLISIS, establezca el Tipo en Análisis celular. Seleccione el canal DAPI y haga clic en Opciones (Figura suplementaria 2A).
- Para la máscara principal, utilizando la imagen DAPI procesada, cree una máscara para seleccionar núcleos individuales. Utilice el fondo oscuro y la opción Automático . Además, determine qué configuración permite la selección de máscaras de núcleos individuales y, cuando termine, haga clic en el botón Aplicar para determinar si la máscara se aplica correctamente.
NOTA: La activación de las opciones Dividir objetos que tocan y Rellenar agujeros en máscaras puede funcionar mejor para seleccionar núcleos individuales. Es posible que sea necesario ajustar los tamaños mínimos y máximos de los objetos en función de la línea celular y se establecen con mayor frecuencia en el rango de 5-40 μm. Se pueden incluir objetos de borde primarios y se debe analizar toda la imagen. El control deslizante se puede aplicar para ajustar la selección de máscara a la intensidad de la señal. - A continuación, aplique una máscara secundaria para optimizar la configuración para seleccionar el punto fluorescente macropinosoma. Utilice la función Medir dentro de una máscara secundaria y expanda la máscara primaria en 40 μm dependiendo del tamaño de las celdas.
- Utilice la función Umbral y el método Umbral en máscara para seleccionar las áreas de dextrano positivo. Haga clic en Aplicar para determinar si la configuración se aplica correctamente.
NOTA: Para determinar el valor umbral, utilice la herramienta Ver perfil de línea (Figura suplementaria 2B) y dibuje una línea sobre un área positiva de dextrano (Figura suplementaria 2C). Utilice la intensidad medida para determinar la mejor configuración para crear una máscara que seleccione macropinosomas y excluya la señal de fondo (Figura suplementaria 2D). - Después de crear máscaras apropiadas para seleccionar núcleos y macropinosomas, haga clic en la pestaña Métricas calculadas y seleccione Seleccionar o Crear métricas de interés a nivel de objeto.
- Elimine todas las métricas presentes y agregue las métricas Integral y de área para el análisis de la máscara secundaria. Haga clic en Aceptar y seleccione Calcular y mostrar para las nuevas métricas. Cuando haya terminado, haga clic en Aceptar y seleccione AGREGAR PASO para agregar el análisis y los cálculos al protocolo.
- Guarde el protocolo finalizado para su uso futuro, haga clic en Archivo y guardar protocolo como.
- Una vez finalizado el análisis de datos, seleccione las métricas de interés y exporte los datos para determinar el índice macropinocítico. Determine el índice macropinocítico de la siguiente manera:
Fluorescencia de dextrano por célula = Objeto Int_2[Fluoróforo de dextrano]
Área de dextrano por célula = Objeto Area_2[Fluoróforo de dextrano]
NOTA: Para la placa de 24 pocillos con formato de coverslips, las métricas reflejan la media del índice macropinocítico promedio por imagen. Alternativamente, el índice macropinocítico se puede calcular manualmente para toda la muestra dividiendo la suma del 'Área' o 'Integral' para todas las imágenes por el 'Recuento de células' total. La diferencia entre estos enfoques en el cálculo del índice macropinocítico es mínima en la mayoría de los entornos. Para el formato de microplaca de 96 pocillos, el índice macropinocítico se calcula como el promedio de toda la muestra. - Guarde el protocolo para la obtención de imágenes y el posterior análisis automatizado. Reutilizar el protocolo para futuros experimentos con los mismos fluoróforos.
NOTA: Cuando se utiliza la función de enfoque automático láser, se debe realizar un nuevo escaneo de referencia cuando se va a analizar una línea celular diferente, ya que los núcleos y los macropinosomas posiblemente se localizan en un plano diferente. Cada vez que se realiza un nuevo experimento utilizando un protocolo previamente determinado, se debe optimizar la configuración de exposición para ese experimento.
6. Adición de tratamientos
Los tratamientos celulares (moléculas pequeñas, productos biológicos, factores de crecimiento, metabolitos, etc.) se pueden incorporar en cualquier etapa del protocolo, y el momento preciso dependerá de los objetivos y metas del estudio.
- Prepare las celdas como en la sección 2.
- Justo antes de añadir los tratamientos de interés, preparar los tratamientos y los controles adecuados al doble de sus concentraciones finales en medios libres de suero. Preparar los tratamientos en un volumen igual al volumen del número de pocillos replicados que se están evaluando.
NOTA: Dado el papel que los factores secretados pueden desempeñar en el control de las funciones celulares, puede ser preferible diluir los tratamientos de interés en los medios condicionados. Para estos fines, puede ser útil sembrar placas adicionales, como placas de cultivo celular de 6 cm o 10 cm, al preparar células como se describe en la sección 2 para generar los medios acondicionados para la preparación de las soluciones de tratamiento. - Sin quitar los medios del pozo, agregue un volumen de solución de tratamiento a cada pozo. Agite el plato para asegurar una mezcla adecuada. Incubar las células durante el tiempo deseado.
- Continúe con la sección 3.
NOTA: Al agregar el dextrano, el uso de medios frescos causa la eliminación de los tratamientos agregados, lo que puede afectar el nivel de macropinocitosis. Por lo tanto, se puede preferir agregar dextrano directamente a los pozos sin aspirar o alternativamente volver a agregar los tratamientos o reutilizar los medios acondicionados para preparar la solución de dextrano.
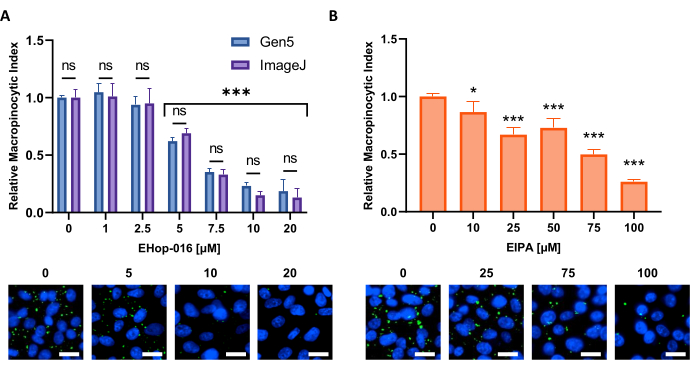
Figura 6: Realización de una curva dosis-respuesta para los inhibidores de la macropinocitosis. Datos de ejemplo obtenidos al probar inhibidores conocidos de la macropinocitosis en una nueva línea celular. Las células PATU8998T se utilizaron para el formato de microplaca de 96 pocillos y se trataron durante 2 h y 30 min con las concentraciones indicadas de (A) EHop-16 y (B) EIPA, respectivamente. La comparación de los resultados obtenidos a través del análisis de imágenes por el software Gen5 o ImageJ no muestra diferencias significativas entre los dos enfoques como lo indica ns en (A). Barra de escala = 25 μm. Los gráficos de barras muestran el promedio y el SD de un solo experimento con 4 réplicas. La significación estadística se determinó mediante ANOVA de una o dos vías, en comparación con las afecciones no tratadas. * p < 0,05; p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Cuando se siguen en consecuencia los pasos y el ajuste del protocolo descrito anteriormente, los resultados experimentales finales deben proporcionar información sobre si las condiciones de cultivo celular estudiadas o los inhibidores inducen o reducen la macropinocitosis en la línea celular de interés. Para fortalecer la validez de estos hallazgos, la inclusión de condiciones de control permitirá el escrutinio de los resultados para determinar si el experimento se ha completado con éxito. Los controles de inducci?...
Discusión
La calidad de los experimentos y la adquisición de datos depende en gran medida de la calidad de los reactivos, la optimización de la configuración y la limpieza de las cubiertas y la microplaca. Los resultados finales deben dar una variación mínima entre las réplicas; sin embargo, las variaciones biológicas ocurren naturalmente o pueden ser causadas por una serie de factores. La densidad celular puede hacer que las células respondan más o menos a los inductores o inhibidores de la macropinocitosis. Por lo tanto...
Divulgaciones
C.C. es inventor de una patente emitida titulada "Diagnóstico del cáncer, terapéutica y descubrimiento de fármacos asociados con la macropinocitosis", Patente No.: 9,983,194.
Agradecimientos
Este trabajo fue apoyado por subvenciones de nih/NCI (R01CA207189, R21CA243701) a C.C. KMO.G. ha recibido un Premio de Beca Postdoctoral TRDRP (T30FT0952). La Citación BioTek 5 es parte del Sanford Burnham Prebys Cell Imaging Core, que recibe apoyo financiero de la Subvención de Apoyo al Centro Oncológico del NCI (P30 CA030199). Las figuras 1-3 se crearon utilizando BioRender.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa - FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa - TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
Referencias
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados