A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الأحماض الدهنية β الأكسدة في تعليق خلايا الكبد الفئران المعزولة حديثا
* These authors contributed equally
In This Article
Summary
الأحماض الدهنية β الأكسدة هو مسار استقلابي أساسي مسؤول عن توليد الطاقة في العديد من أنواع الخلايا المختلفة ، بما في ذلك خلايا الكبد. هنا ، نصف طريقة لقياس أكسدة β الأحماض الدهنية في خلايا الكبد الأولية المعزولة حديثا باستخدام 14حمض بالمتيك المسمى C.
Abstract
الأحماض الدهنية β الأكسدة هو مسار استقلابي رئيسي لتلبية متطلبات الطاقة في الكبد وتوفير الركائز والعوامل المساعدة لعمليات إضافية ، مثل تكوين الكيتون وتكوين الجلوكوز ، والتي تعد ضرورية للحفاظ على توازن الجلوكوز في الجسم كله ودعم وظيفة العضو خارج الكبد في حالة الصيام. يحدث أكسدة β الأحماض الدهنية داخل الميتوكوندريا والبيروكسيزومات ويتم تنظيمها من خلال آليات متعددة ، بما في ذلك امتصاص وتنشيط الأحماض الدهنية ، ومستويات التعبير عن الإنزيم ، وتوافر العوامل المساعدة مثل الإنزيم المساعد A و NAD +. في الفحوصات التي تقيس أكسدة الأحماض الدهنية β في متجانسات الكبد ، يخفي تحلل الخلايا والإضافة الشائعة للمستويات فوق الفسيولوجية للعوامل المساعدة آثار هذه الآليات التنظيمية. علاوة على ذلك ، من الصعب التحكم في سلامة العضيات في المتجانسات ويمكن أن تختلف اختلافا كبيرا بين المستحضرات. قياس الأحماض الدهنية β الأكسدة في خلايا الكبد الأولية السليمة يتغلب على المزالق المذكورة أعلاه. يصف هذا البروتوكول طريقة لقياس أكسدة الأحماض الدهنية β في تعليق خلايا الكبد الأولية للفئران المعزولة حديثا والمحتضنة ب 14حمض بالمتيك المسمى C. من خلال تجنب ساعات إلى أيام من الثقافة ، تتمتع هذه الطريقة بميزة الحفاظ بشكل أفضل على مستويات التعبير عن البروتين ونشاط المسار الأيضي للكبد الأصلي ، بما في ذلك تنشيط الأحماض الدهنية β الأكسدة التي لوحظت في خلايا الكبد المعزولة من الفئران الصائمة مقارنة بالفئران التي تم إطعامها.
Introduction
الأحماض الدهنية β الأكسدة هي عملية أساسية في استقلاب الدهون ، مما يوفر مسارا تقويضيا لتحقيق التوازن بين تخليق الأحماض الدهنية وتناولها من النظام الغذائي. تولد هذه العملية الطاقة لأعضاء متعددة ، بما في ذلك عضلة القلب وقشرة الكلى والكبد الصائم ، وتستخدم الأحماض الدهنية التي تم الحصول عليها من النظام الغذائي ، وتحلل الدهون في الأنسجة الدهنية ، ومخازن الدهون الثلاثية الداخلية 1,2.
تؤدي أكسدة الأحماض الدهنية من خلال مسار أكسدة β إلى تقصير متسلسل لسلسلة الأسيل الدهني بواسطة كربونين في وقت واحد ، يتم إطلاقهما على شكل أسيتيل CoA ، وتحدث هذه العملية في كل من الميتوكوندريا والبيروكسيزومات. في حين أن معظم الأحماض الدهنية تخضع فقط β الأكسدة ، فإن بعضها يتأكسد عند كربونات مختلفة قبل الدخول في هذا المسار. على سبيل المثال ، تخضع الأحماض الدهنية التي يستبدلها 3 ميثيل ، مثل حمض الفيتانيك ، لإزالة كربون واحد عن طريق أكسدة α في البيروكسيزومات قبل الدخول في مسار أكسدة β. وبالمثل ، يتم تحويل بعض الأحماض الدهنية أولا إلى أحماض دهنية ثنائية الكربوكسيل عن طريق أكسدة مجموعة الميثيل الطرفية (ω-oxidation) في الشبكة الإندوبلازمية قبل أن تتأكسد بشكل تفضيلي في البيروكسيزومات عن طريق أكسدة β3.
بغض النظر عن العضية المحددة ، يجب أولا تحويل الحمض الدهني إلى ثيوستر مساعد للإنزيم A (CoA) ، أو acyl-CoA ، ليتم أكسدته من خلال مسار أكسدة β. β-أكسدة الأسيل CoAs طويل السلسلة في مصفوفة الميتوكوندريا يتطلب مكوك كارنيتين لنقلها ، حيث يحفز كارنيتين بالميتويل ترانسفيراز 1 (CPT1) تحويل acyl-CoAs إلى acylcarnitines وهو الإنزيم الذي يحد من المعدل في هذه العملية4. بمجرد نقلها إلى مصفوفة الميتوكوندريا ، يتم إعادة تشكيل acyl-CoAs وتعمل كركائز لآلية أكسدة β الميتوكوندريا. في حالة الصيام ، يتم توجيه الأسيتيل CoA الناتج عن طريق أكسدة β في الميتوكوندريا الكبدية في المقام الأول إلى تكوين الكيتون. تعمل البيروكسيزومات كموقع أساسي للأكسدة β للأحماض الدهنية طويلة السلسلة والمتفرعة السلسلة وثنائية الكربوكسيل. لا تتطلب البيروكسيزومات مكوك الكارنيتين لاستيراد ركائز الأحماض الدهنية ، وبدلا من ذلك استيراد المراسل acyl-CoAs من خلال نشاط ناقلات الكاسيت المرتبطة ب ATP (ABC) ABCD1-35. داخل البيروكسيزومات ، يتم بعد ذلك أكسدة acyl-CoAs بواسطة مجموعة مخصصة من الإنزيمات ، متميزة عن الأحماض الدهنية الميتوكوندريا β الأكسدة. تتطلب كل من الميتوكوندريا والبيروكسيزومات أيضا إمدادات من NAD+ و CoA مجانا لأكسدة سلاسل الأسيل الدهنية. وقد ثبت أن مستويات CoA في الكبد تزداد استجابة للصيام ، مما يدعم زيادة معدل أكسدة الأحماض الدهنية التي تحدث في هذه الحالة6. علاوة على ذلك ، تؤدي زيادة تدهور CoA في البيروكسيزومات إلى انخفاض انتقائي في أكسدة الأحماض الدهنية البيروكسيسومية7. لذلك ، يتم تنظيم عملية أكسدة الأحماض الدهنية داخل الخلية من خلال مستويات التعبير وأنشطة الإنزيمات المشاركة في تنشيط ونقل وأكسدة الأحماض الدهنية ، وكذلك تركيزات العوامل المساعدة والمستقلبات الأخرى في جميع أنحاء مقصورات متعددة دون الخلايا.
الإجراءات التي تستخدم متجانسات الأنسجة لقياس أكسدة الأحماض الدهنية تدمر البنية الخلوية التي تنظم وتدعم هذه العملية ، مما يؤدي إلى جمع البيانات التي لا تعكس بدقة عملية التمثيل الغذائي في الجسم الحي. في حين أن التقنيات التي تستخدم خلايا الكبد الأولية المطلية تحافظ على هذا النظام ، فإن زراعة الخلايا المعزولة لفترات طويلة من الزمن تؤدي إلى فقدان ملف التعبير الجيني في الجسم الحي الذي كان موجودا في الخلايا عندما كانت لا تزال تعيش داخل الحيوان 8,9. يصف البروتوكول التالي طريقة لعزل خلايا الكبد الأولية وفحص قدرتها على أكسدة الأحماض الدهنية مباشرة β بعد العزل وفي التعليق ، باستخدام [1-14C] حمض البالمتيك. يعتمد الفحص على قياس النشاط الإشعاعي المرتبط بمستقلبات الحمض القابلة للذوبان (ASM) أو المنتجات ، مثل الأسيتيل CoA ، التي تنتجها الأكسدة β [1-14C] حمض البالمتيك10,11.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية على الفئران (C57BL/6J ، الذكور ، 9-11 أسبوعا من العمر) من قبل اللجان المؤسسية لرعاية الحيوانات واستخدامها (IACUC) بجامعة ويست فرجينيا.
1. عزل خلايا الكبد
- اعداد
- في الأيام التي تسبق عزل خلايا الكبد، قم بإعداد المخازن المؤقتة ووسائط زراعة الخلايا المدرجة في الجدول 1. قم بإعداد حمام مائي مع ضبط درجة الحرارة على 37 درجة مئوية بالقرب من المكان الذي سيتم فيه إجراء الجراحة.
- في يوم عزل خلايا الكبد ، تحت غطاء التدفق الرقائقي ، قم بنقل 35 مل من Buffer 1 إلى أنبوب طرد مركزي معقم سعة 50 مل و 70 مل من Buffer 2 إلى كوب أو زجاجة معقمة سعة 100 مل.
- أضف المضادات الحيوية الجنتاميسين (50 ميكروغرام / مل) والبنسلين / الستربتومايسين (1x) إلى كلا المخازن المؤقتة.
- انقل 20 مل من Buffer 2 كما هو معد في الخطوة 1.1.3 إلى طبق زراعة الخلايا 100 مم وضعه على الجليد.
- انقل ال 50 مل المتبقية من Buffer 2 إلى أنبوب طرد مركزي معقم بسعة 50 مل. ضع الأنابيب سعة 50 مل التي تحتوي على المخازن المؤقتة 1 و 2 المكملة بالمضادات الحيوية في حمام مائي على درجة حرارة 37 درجة مئوية واتركها تسخن لمدة 15 دقيقة على الأقل قبل بدء التروية.
ملاحظة: في حالة إجراء عمليات عزل متعددة لخلايا الكبد في جلسة واحدة، قم بزيادة عدد الأليكوتات المكملة بالمضادات الحيوية من المخازن المؤقتة 1 و 2 للتحضير وفقا لذلك. - قم بإذابة أليكوت من محلول الكولاجيناز واحتفظ به على الجليد.
ملاحظة: إذا تم تخزينها بشكل صحيح ، فلا توجد خسارة كبيرة في نشاط الإنزيم في محاليل الكولاجيناز المجمدة والمذابة حتى 3 مرات واستخدامها في غضون 3 أسابيع من التحضير. - تحضير الأدوات الجراحية والمضخة التمعجية. تعقيم خطوط المضخة التمعجية عن طريق تدوير 15 مل من الإيثانول بنسبة 70٪ ، تليها 15 مل من الماء المعقم.
- قم بتوصيل إبرة 22 G بخط الخروج (الشكل 1A). يعمل المرشح المجوف للقسطرة بشكل جيد كموصل. املأ الخطوط باستخدام Buffer 1 وافحص الخطوط والموصل والإبرة لضمان عدم وجود فقاعات هواء محاصرة.
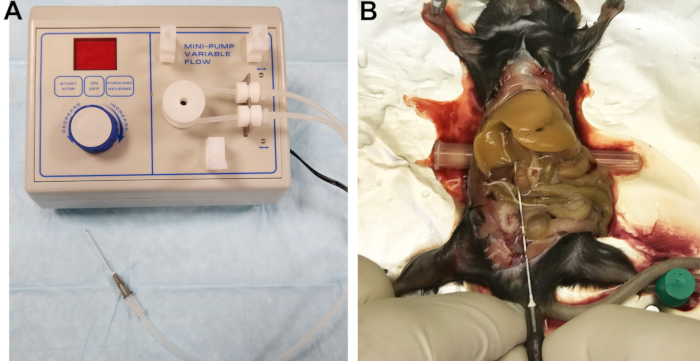
الشكل 1: جهاز التروية والكبد المنصهر . (أ) مضخة تمعجية مع خط مخرج متصل بالإبرة المستخدمة في تقليب الكبد وتطهيره. (ب) يشار إلى القنية الناجحة عن طريق ابيضاض الكبد الفوري والمتجانس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تروية الكبد وتفككه
- تخدير الفأر عن طريق استنشاق الأيزوفلوران مع الهواء الطبي كغاز ناقل ، وذلك باستخدام 4 ٪ من الأيزوفلوران للتحريض و 1.5 ٪ من الأيزوفلوران للحفاظ على التخدير. تحقق من عمق التخدير من خلال تقييم فقدان منعكس الدواسة.
- عندما لا تكون هناك استجابة لقرص إصبع القدم ، ضع الماوس في وضع ضعيف على لوحة الجراحة ، ومد الأطراف ، وثبتها على اللوحة بدبابيس.
- رش بحرية البطن والصدر من الماوس مع 70 ٪ من الإيثانول.
- باستخدام الملقط ، اسحب الجلد وجدار البطن بالقرب من قاعدة البطن وقطعه أفقيا ، على جانبي خط الوسط وحتى الحجاب الحاجز ، لفضح الأعضاء.
- كشف الوريد الأجوف السفلي (IVC) عن طريق تحريك الأمعاء إلى الجانب الأيمن وقلب فصوص الكبد بلطف لأعلى. أدخل جسما أسطوانيا صغيرا ، مثل غطاء إبرة ، تحت الجزء الخلفي من الماوس لإمالة IVC قليلا وتسهيل تعقيمها (الشكل 1B).
- ابدأ تشغيل المضخة بأقل سرعة ، ومع تدفق Buffer 1 ، أدخل الإبرة في IVC.
- قم بقطع الوريد البابي لتخفيف الضغط والسماح بتصريف الدم ومخازن التروية ، ثم قم بزيادة معدل التدفق على الفور إلى 7 مل / دقيقة. إذا تم ذلك بشكل صحيح ، فسوف يبيض الكبد بشكل موحد في غضون ثوان قليلة (الشكل 1B).
- للحصول على نتائج أكثر اتساقا ، أمسك الإبرة في موضعها باليد طوال مدة التروية.
- قم بدمج الكبد مع المخزن المؤقت الدافئ 1. لتجنب إدخال فقاعات الهواء، تأكد من أن الخط الذي تم إدخاله في الأنبوب الذي يحتوي على المخزن المؤقت 1 يظل مغمورا باستمرار.
- أثناء حدوث التروية ، أضف 130 ميكرولتر من محلول الكولاجيناز إلى Buffer 2 واخلطه عن طريق السحب لأعلى ولأسفل أو التحريك باستخدام ماصة مصلية 5 مل أو 10 مل.
- نظرا لأن الحجم الموجود في الأنبوب الذي يحتوي على Buffer 1 ينخفض إلى حوالي 5 مل ، أضف ببطء 5 مل من Buffer 2 إلى Buffer 1 عن طريق السحب على جانب الأنبوب. الهدف هو تجنب إدخال فقاعات الهواء في الخط أثناء التغيير من Buffer 1 إلى Buffer 2.
- انتظر حتى ينخفض مستوى الصوت مرة أخرى إلى 5 مل وأضف ببطء 5 مل أخرى من Buffer 2. كرر مرة أخرى. عندما يحل Buffer 2 محل Buffer 1 ويبدأ الانفصال ، سوف ينتفخ الكبد.
- أضف المخزن المؤقت 2 المتبقي إلى الأنبوب الذي يحتوي في الأصل على المخزن المؤقت 1. أوقف التروية عندما يكون هناك حوالي 5-10 مل من المخزن المؤقت 2 المتبقي في الأنبوب.
ملاحظة: بينما يقوم Buffer 2 باختراق الكبد، يمكن تثبيت الوريد البابي بشكل متقطع باستخدام ملقط لمدة 5 ثوان. هذه الخطوة اختيارية ، ولكن الزيادة الناتجة في الضغط في جميع أنحاء الكبد يمكن أن تحسن انفصاله ، وبالتالي ، العائد النهائي لخلايا الكبد. - قم باستئصال الكبد بعناية ونقله إلى طبق الاستزراع 100 مم الذي يحتوي على 20 مل من Buffer 2 المثلج البارد الموجود جانبا في الخطوة 1.1.4.
- تحت غطاء التدفق الرقائقي ، قم بتقسيم الكبد بلطف باستخدام المقص الجراحي والملقط.
- أضف حوالي 20 مل من M199 البارد إلى تعليق خلايا الكبد وقم بتصفيته من خلال مصفاة خلية 100 ميكرومتر باستخدام مكبس حقنة لتعزيز إطلاق خلايا كبدية إضافية بلطف من قطع الكبد الأكبر.
- اغسل طبق الاستزراع مقاس 100 مم ومصفاة الخلايا ب M199 إضافي حتى يمتلئ أنبوب التجميع.
- الطرد المركزي التعليق عند 50 × غرام لمدة 2 دقيقة عند 4 درجات مئوية. استنشق بعناية supernatant وأعد تعليق حبيبات خلايا الكبد بلطف في 30 مل من M199 البارد عن طريق الدوائر.
- بيليه خلايا الكبد كما هو مذكور في الخطوة 1.2.18. كرر الغسيل مرة أخرى.
- أعد تعليق خلايا الكبد في 10 مل من M199 الدافئ وحدد الجدوى والعائد باستخدام طريقة استبعاد التريبان الأزرق ومقياس الدم12.
- تمييع الخلايا في M199 تسخين إلى 37 درجة مئوية إلى تركيز نهائي من 1.0 × 106 خلايا قابلة للحياة / مل والبدء فورا في الفحص.
2. فحص الأحماض الدهنية β الأكسدة
ملاحظة: يتم إجراء الفحص في ثلاثة أضعاف ، ويحتوي كل خليط تفاعل على 750000 خلية ، و 1.35 ملغ / مل من ألبومين مصل البقر (BSA) ، و 100 ميكرومتر من حمض البالمتيك ، و 0.4 μCi [1-14C] حمض البالمتيك في حجم نهائي من 2 مل.
تنبيه: المركبات المشعة خطرة. شراء المواد المشعة ومناولتها وتخزينها والتخلص منها وفقا للوائح المؤسسية والولائية والاتحادية.
- اعداد
- في الأيام التي تسبق الفحص ، قم بإعداد محاليل حمض البالمتيك و BSA (الجدول 1) وتخزينها عند -20 درجة مئوية.
- في يوم الفحص ، أكمل الخطوات 2.1.3-2.1.9 قبل البدء في تروية الكبد.
- إذابة حمض البالمتيك وحلول BSA. قم بإعداد خليط الركيزة لتفاعلات متعددة بالإضافة إلى زيادة بنسبة 20٪ -30٪ ، مع إعداد فحص نموذجي موضح في الجدول 2.
- Aliquot 13.5 ميكرولتر من محلول BSA لكل تفاعل في أنبوب جهاز طرد مركزي دقيق ودافئ إلى 41 درجة مئوية ، ثم أضف 1 ميكرولتر من محلول حمض البالمتيك 200 mM (BSA: نسبة حمض البالمتيك المولية = 1: 5) لكل تفاعل.
ملاحظة: يفضل صرف المحاليل المحضرة باستخدام المذيبات العضوية، مثل محاليل حمض البالمتيك المشعة وغير المشعة، مع ماصة إزاحة إيجابية ونصائح مناسبة. - دوامة بقوة وحضانة عند 41 درجة مئوية لتسهيل تشكيل حمض البالمتيك القابل للذوبان: BSA المعقدة. دوامة في بعض الأحيان خلال فترة الحضانة.
- سيظهر الخليط في البداية غائما ولكنه سيتضح تماما بعد 20-30 دقيقة من الحضانة عند 41 درجة مئوية. احتفظ به عند 41 درجة مئوية حتى يصبح جاهزا لبدء التفاعلات.
- Aliquot 133 ميكرولتر من حمض البيركلوريك 1 م في أنابيب الطرد المركزي الدقيقة 1.5 مل لوقف التفاعلات.
تحذير: حمض البيركلوريك هو حمض قوي ومؤكسد قوي. مطلوب معدات الحماية المناسبة للتعامل مع هذا المركب. - Aliquot 485.5 ميكرولتر من M199 لكل تفاعل في أنبوب والاحتفاظ به عند 37 درجة مئوية لتخفيف BSA المشع: مركب حمض البالمتيك المحضر في الخطوات 2.1.4-2.1.6 قبل بدء التفاعلات.
- قم بتوزيع 750 ميكرولتر من M199 في ما يصل إلى 14 مل من الأنابيب ذات القاع الدائري مثل العينات. إذا رغبت في ذلك ، أضف مثبطات الأحماض الدهنية β الأكسدة ، مثل الإيتوموكسير والروتينون ومضادات الميسين ، بما في ذلك التحكم في السيارة (الجدول 2).
- أثناء خطوات غسل خلايا الكبد ، قبل 10-15 دقيقة من بدء التفاعلات ، انقل الأنابيب المحضرة في الخطوة 2.1.9 إلى حمام مائي مهتز مضبوط على 37 درجة مئوية ويرتجف عند 180-200 دورة في الدقيقة.
- بدء وإيقاف وتحليل تفاعلات أكسدة β الأحماض الدهنية
- إذا كانت صلاحية خلايا الكبد مقبولة (عادة ≥ 75٪ ، الشكل 2) ، لكل تفاعل ، قم بنقل 0.8 ميكرولتر من حمض البالمتيك [1-14C] (0.5 mCi / mL) إلى أنبوب الطرد المركزي الدقيق الذي يحتوي على BSA الموضح: محلول حمض البالمتيك (الخطوات 2.1.4-2.1.6). دوامة والعودة إلى الحمام المائي في 41 درجة مئوية.
- لموازنة خلايا الكبد إلى 37 درجة مئوية واحتضانها مسبقا بمثبطات (إن وجدت) ، مباشرة بعد إعادة تعليق خلايا الكبد النهائية (الخطوة 1.2.21) ، انقل 750 ميكرولتر من تعليق خلايا الكبد باستخدام ماصة 1 مل إلى كل من الأنابيب المستديرة القاع 14 مل في الحمام المائي المهتز (الخطوات 2.1.9-2.1.10) والدوامة لفترة وجيزة بسرعة منخفضة للخلط.
- قم بتصغير كل إضافة بمقدار 30 ثانية واحتضنها لمدة 15 دقيقة. لحفظ عينة لتحديد البروتين ، انقل أليكوت آخر من خلايا الكبد إلى أنبوب طرد مركزي دقيق 1.5 مل وقم بالدوران عند 3000 × g لمدة 5 دقائق.
ملاحظة: أثناء التوزيع، يجب تدوير تعليق خلايا الكبد باستمرار أو تحريكه بلطف باستخدام ماصة الاستغناء عن 1 مل لمنع الاستقرار والتباين الكبير في عدد الخلايا عبر العينات. - قم بإزالة المادة الفائقة وتخزين الكريات عند -80 درجة مئوية حتى تصبح جاهزة لقياس الكمية الإجمالية للبروتين في العينة لتطبيع النتائج (الشكل 3).
- في حين أن خلايا الكبد تحت الحضانة قبل 37 درجة مئوية ، أضف BSA المشع : مركب حمض البالمتيك إلى الوسط الدافئ في 2.1.8 ، واحتفظ به عند 37 درجة مئوية حتى يصبح جاهزا لبدء التفاعلات. هذا هو مزيج الركيزة النهائي.
- لبدء التفاعلات ، قم بإزالة خلايا الكبد من الحمام المائي وإضافة 500 ميكرولتر من مزيج الركيزة.
- دوامة بسرعة منخفضة لمدة 5 ثانية لإعادة تعليق الخلايا بالكامل والعودة إلى الحمام المائي. كرر مع جميع العينات ، مذهلة بمقدار 30 ثانية.
- احتضان لمدة 15 دقيقة. ابدأ مجموعة من التفاعلات وتوقف فورا (انظر الخطوات 2-2-10-2-2-11) لتحديد النشاط الإشعاعي في الخلفية (الجدول 2).
- انقل الأليكوتات المكررة (200-250 ميكرولتر) من مزيج الركيزة المتبقية إلى قوارير تلألؤ 6 مل واتركها جانبا للعد. استخدم هذه الأعداد لحساب النشاط الإشعاعي المقابل لإجمالي نمولات حمض البالمتيك المتاحة للأكسدة في 500 ميكرولتر من مزيج الركيزة.
- لوقف التفاعلات ، قم بإزالة خلايا الكبد من الحمام المائي ، وأعد تعليق خلايا الكبد عن طريق الدوامة بسرعة معتدلة ، ثم انقل 400 ميكرولتر من تعليق خلايا الكبد إلى أنابيب الطرد المركزي الدقيقة التي تحتوي على حمض البيركلوريك.
- على الفور غطاء الأنابيب. كرر هذا التسلسل لجميع العينات ، مذهلا بمقدار 30 ثانية.
- دوامة بقوة أنابيب أجهزة الطرد المركزي الدقيقة 1.5 مل وتدويرها أسفل أنابيب الطرد المركزي الدقيقة 1.5 مل عند 13000 × غرام لمدة 10 دقائق.
- انقل 300 ميكرولتر من السوبرنات إلى قارورة تلألؤ 6 مل ، وأضف 4 مل من سائل التلألؤ ، واحسب النشاط الإشعاعي في العينات ومزيج الركيزة aliquots (الخطوة 2.2.9) في عداد اللمعان.
تنبيه: بعد الطرد المركزي ، افتح الأنابيب تحت غطاء الدخان لتجنب تنفس 14 C-CO2 الناتج عن الأكسدة الكاملة ل 14C-acetyl-CoA الناتجة عن أكسدة الأحماض الدهنية β وإطلاقها بسبب الظروف الحمضية.
| المخازن المؤقتة/مكونات الوسائط | مبلغ | التركيز النهائي | تعليمات |
| الحل ج | |||
| كيه سي ال | 1.79 غ | 480 مللي متر | أضف الماء إلى 50 مل. يخزن على درجة حرارة 4 درجات مئوية |
| MgSO4 هيبتاهيدرات | 1.48 غ | 120 مللي متر | |
| KH2PO4 | 0.81 غ | 119 ملليمتر | |
| كريبس-هينسليت العازل (KHB)، خال من الكالسيوم | |||
| كلوريد الصوديوم | 7.0 غ | 120 مللي متر | أضف الماء إلى 900 مل ، واضبط الرقم الهيدروجيني على 7.4 ، واجلب الحجم النهائي إلى 1 لتر. |
| ناهكو3 | 2.0 غ | 24 مللي متر | |
| 1 م HEPES الرقم الهيدروجيني 7.45 | 5 مل | 5 مللي متر | |
| الجلوكوز | 1 أو 2 غ | 5.6 أو 11 ملليمتر | |
| الحل ج | 10 مل | ||
| المخزن المؤقت 1 | |||
| خ ب | 500 مل | خلط المكونات وتصفية التعقيم. يخزن على درجة حرارة 4 درجات مئوية | |
| 50 ملليمتر EGTA | 1.0 مل | 0.1 مللي متر | |
| المخزن المؤقت 2 | |||
| خ ب | 500 مل | خلط المكونات وتصفية التعقيم. يخزن على درجة حرارة 4 درجات مئوية | |
| 1 م كاكل2 ثنائي هيدرات | 686 ميكرولتر | 1.4 ملليمتر | |
| محلول الجنتاميسين | |||
| كبريتات الجنتاميسين | 0.5 غرام | 50 ملغم/مل | أضف الماء إلى 10 مل وقم بتصفية التعقيم. Aliquot وتخزينها في -20 درجة مئوية |
| محلول الكولاجيناز | |||
| مزيج الكولاجيناز الأول والثاني | 10 ملغ | 7 ملغم/مل | قم بإذابة المحتوى الكامل للقارورة في 1.43 مل من الماء. Aliquot وتخزينها في -20 درجة مئوية |
| م199 | |||
| م199 | 1 حقيبة | أضف الماء إلى 900 مل واضبط الرقم الهيدروجيني على 7.2-7.4. أحضر الحجم النهائي إلى 1 لتر وقم بتعقيم الفلتر. يخزن على درجة حرارة 4 درجات مئوية | |
| ناهكو3 | 2.2 غ | 26 مللي متر | |
| 1 M HEPES (درجة زراعة الخلايا) | 25 مل | 25 مللي متر | |
| الجلوكوز الزائد (فقط للفئران التي تتغذى) | 1 غرام | 11 مللي متر | |
| حل BSA | |||
| BSA الخالي من الأحماض الدهنية | 400 ملغ | 20٪ (ث/ت) | تذوب في 2 مل من الماء. Aliquot وتخزينها في -20 درجة مئوية |
| محلول حمض البالمتيك غير المشع | |||
| حمض البالمتيك | 103 ملغ | 200 مللي متر | يذوب في 2 مل من الإيثانول ، ويخزن في -20 درجة مئوية |
| 1 م حمض البيركلوريك | |||
| 70٪ حمض البيركلوريك | 3.5 مل | 1 م | تمييع إلى 40 مل بالماء. يخزن في درجة حرارة الغرفة |
الجدول 1: المخازن المؤقتة والوسائط والمحاليل الأخرى اللازمة لعزل خلايا الكبد وفحص أكسدة β الأحماض الدهنية
| رقم التفاعل | مثبطات ± M199 | تعليق خلايا الكبد (ميكرولتر) | مزيج الركيزة (ميكرولتر) | ||||
| الحجم (ميكرولتر) | إيتوموكسير | ||||||
| 1 | 750 | - | يسخن مسبقا عند 37 درجة مئوية | 750 | قبل الحضانة عند 37 درجة مئوية لمدة 15 دقيقة | 500 | احتضان في 37 درجة مئوية لمدة 15 دقيقة |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | توقف فورا | |||||
| 8 | |||||||
| 9 | |||||||
الجدول 2: مثال على الإعداد التجريبي لتعليق خلايا الكبد الذي تم فحصه في ثلاثة أضعاف في وجود وغياب الإيتوموكسر.
النتائج
عادة ما ينتج عن تروية الكبد الموصوفة هنا 30-40 مليون خلية / كبد بمتوسط صلاحية يبلغ 80٪ ، كما هو مقدر من خلال استبعاد التربان الأزرق (الشكل 2). التركيز النموذجي للجلوكوز في المخزن المؤقت Krebs-Henseleit (KHB) ، والذي يستخدم لإعداد المخازن المؤقتة للتروية 1 و 2 ، هو 11 mM. عند قياس أكسدة β الأحم?...
Discussion
أثناء تروية الكبد ، من الأهمية بمكان تجنب إدخال فقاعات الهواء ، لأنها تمنع الشعيرات الدموية الدقيقة في الكبد ، مما يمنع أو يقيد الدورة الدموية العازلة ويقلل بشكل عام من غلة خلايا الكبد وقابليتها للحياة20,21. يمكن للاحتياطات ، مثل فحص خط المدخل المملوء بالمخز?...
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من خلال منحة المعاهد الوطنية للصحة R35GM119528 إلى روبرتا ليوناردي.
Materials
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
References
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved