需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量新鲜分离的小鼠肝细胞悬浮液中的脂肪酸β氧化
摘要
脂肪酸β氧化是负责在许多不同细胞类型(包括肝细胞)中产生能量的重要代谢途径。在这里,我们描述了一种使用 14个C标记的棕榈酸测量新鲜分离的原代肝细胞中脂肪酸β氧化的方法。
摘要
脂肪酸β氧化是满足肝脏能量需求的关键代谢途径,并为其他过程(如生酮和糖异生)提供底物和辅助因子,这对于维持全身葡萄糖稳态和支持禁食状态下的肝外器官功能至关重要。脂肪酸β氧化发生在线粒体和过氧化物酶体内,并通过多种机制进行调节,包括脂肪酸的摄取和活化,酶表达水平以及辅酶A和NAD +等辅助因子的可用性。在测量肝脏匀浆中脂肪酸β氧化的测定中,细胞裂解和辅助因子的超生理水平的常见添加掩盖了这些调节机制的影响。此外,匀浆中细胞器的完整性难以控制,并且在制剂之间可能会有很大差异。完整原代肝细胞中脂肪酸β氧化的测量克服了上述缺陷。该协议描述了一种测量与 14个C标记棕榈酸一起孵育的新鲜分离的原代小鼠肝细胞悬浮液中脂肪酸β氧化的方法。通过避免数小时至数天的培养,该方法具有更好地保存原始肝脏的蛋白质表达水平和代谢途径活性的优点,包括与喂养小鼠相比,在从禁食小鼠分离的肝细胞中观察到的脂肪酸β氧化的活化。
引言
脂肪酸β氧化是脂质代谢的必要过程,提供分解代谢途径来平衡脂肪酸合成和饮食中的摄入量。该过程为多个器官产生能量,包括心肌,肾皮层和禁食肝脏,并利用从饮食中获得的脂肪酸,脂肪组织脂肪分解和内部甘油三酯储存1,2。
脂肪酸通过β氧化途径的氧化导致脂肪酰基链一次由两个碳连续缩短,以乙酰辅酶A的形式释放,并且该过程同时发生在线粒体和过氧化物酶体中。虽然大多数脂肪酸只经历β氧化,但有些脂肪酸在进入该途径之前在不同的碳中被氧化。例如,3-甲基取代的脂肪酸,如植烷酸,在进入β氧化途径之前,通过过氧化物酶体中的α氧化除去一个碳。类似地,一些脂肪酸首先通过氧化内质网中的末端甲基(ω-氧化)转化为二羧基脂肪酸,然后通过β氧化3在过氧化物酶体中优先氧化。
无论特定的细胞器如何,脂肪酸必须首先转化为辅酶A(CoA)硫酯或酰基辅酶A,才能通过β氧化途径被氧化。线粒体基质中长链酰基辅酶A的β氧化需要肉碱穿梭进行其易位,其中肉碱棕榈酰转移酶1(CPT1)催化酰基辅酶A向酰基肉碱的转化,并且是该过程中的限速酶4。一旦转移到线粒体基质,酰基辅酶A被重新形成并作为线粒体β氧化机制的底物。在禁食状态下,肝线粒体中通过β氧化产生的乙酰辅酶A主要引导至生酮作用。过氧化物酶体是超长链,支链和二羧酸脂肪酸β氧化的主要位点。过氧化物酶体不需要肉碱穿梭来导入脂肪酸底物,而是通过ATP结合盒(ABC)转运蛋白ABCD1-3的活性导入相应的酰基辅酶A5。在过氧化物酶体内,酰基辅酶A随后被一组专用的酶氧化,这与线粒体脂肪酸β氧化机制不同。线粒体和过氧化物酶体也需要供应NAD + 和游离辅酶A来氧化脂肪酰基链。肝脏中的CoA水平已被证明随着空腹而增加,支持在这种状态下发生的脂肪酸氧化速率的增加6。此外,过氧化物酶体中CoA降解的增加导致过氧化物酶体脂肪酸氧化7的选择性降低。因此,细胞内脂肪酸氧化的过程受到参与脂肪酸活化,运输和氧化的酶的表达水平和活性的调节,以及整个多个亚细胞区室的辅助因子和其他代谢物的浓度。
使用组织匀浆来测量脂肪酸氧化的程序破坏了调节和支持该过程的细胞结构,导致数据收集不能准确反映体内代谢。虽然使用接种的原代肝细胞的技术保留了该系统,但长时间培养分离的细胞会导致细胞中仍然存在的体内基因表达谱的丧失,当它们仍然生活在动物体内时8,9。以下方案描述了一种分离原代肝细胞的方法,并使用[1-14C]棕榈酸在分离后立即和悬浮液测定其脂肪酸β氧化的能力。该测定基于测量与酸溶性代谢物(ASM)或产物(如乙酰辅酶A)相关的放射性,由[1-14 C]棕榈酸10,11的β氧化产生。
研究方案
小鼠(C57BL / 6J,雄性,9-11周龄)的所有实验程序均已获得西弗吉尼亚大学机构动物护理和使用委员会(IACUC)的批准。
1. 肝细胞分离
- 制备
- 在肝细胞分离前几天,制备 表1中列出的缓冲液和细胞培养基。设置一个水浴,温度设置为37°C,靠近将要进行手术的地方。
- 在肝细胞分离当天,在层流罩下,将35mL缓冲液1转移到无菌的50mL离心管中,将70mL缓冲液2转移到100mL无菌烧杯或瓶子中。
- 将抗生素庆大霉素(50μg/mL)和青霉素/链霉素(1x)加入两种缓冲液中。
- 将步骤1.1.3中制备的20mL缓冲液2转移到100mm细胞培养皿中并置于冰上。
- 将剩余的50 mL缓冲液2转移到无菌的50 mL离心管中。将含有抗生素补充的缓冲液1和2的50mL管置于37°C的水浴中,并让它们预热至少15分钟,然后开始灌注。
注意:如果在一个疗程中进行多个肝细胞分离,请增加缓冲液1和2的抗生素补充等分试样的数量以进行相应的制备。 - 解冻等分试样的胶原酶溶液并保持在冰上。
注意:如果储存得当,胶原酶溶液中的酶活性不会显着损失,冷冻和解冻多达3次,并在制备后3周内使用。 - 准备手术器械和蠕动泵。通过循环15 mL 70%乙醇,然后循环15 mL无菌水对蠕动泵管路进行灭菌。
- 将22 G针连接到出纸线(图1A)。导管的空心过滤器可用作连接器。用缓冲区 1 填充线条,并检查线条、接头和针,以确保没有气泡被捕获。
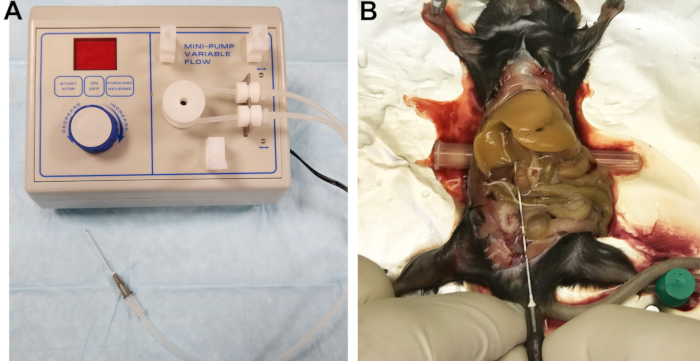
图1:灌注装置和灌注肝脏。 (A)蠕动泵,其出口管连接到用于套管和灌注肝脏的针头上。(B)成功的插管表现为肝脏立即均匀地漂白。 请点击此处查看此图的大图。
- 肝脏灌注和解离
- 通过异氟醚吸入麻醉小鼠,使用医用级空气作为载气,使用4%异氟醚诱导和1.5%异氟醚维持麻醉。通过评估踏板反射的丧失来验证麻醉的深度。
- 当对脚趾捏合没有反应时,将鼠标放在手术板上的仰卧位置,伸出四肢,并用针脚将它们固定在板上。
- 用70%乙醇自由喷洒小鼠的腹部和胸部。
- 使用镊子,拉起靠近腹部底部的皮肤和腹壁,并在中线的两侧横向切开,直到横膈膜,以暴露器官。
- 通过将肠道向右侧移动并轻轻地将肝叶向上翻转来暴露下腔静脉(IVC)。在鼠标背面下方插入一个小圆柱形物体,例如针帽,以稍微倾斜IVC并促进其插管(图1B)。
- 以最低速度启动泵,并在缓冲液 1 流动的情况下,将针插入 IVC。
- 切开门静脉以减轻压力并允许血液和灌注缓冲液引流,然后立即将流速提高到7 mL / min。如果操作正确,肝脏将在几秒钟内均匀地变白(图1B)。
- 为了获得更一致的结果,在整个灌注过程中用手将针头保持在适当的位置。
- 用温暖的缓冲液1灌注肝脏。为避免引入气泡,请确保插入含有缓冲液1的管中的管线保持连续浸没状态。
- 发生灌注时,将130μL胶原酶溶液加入缓冲液2,并通过上下移液或用5mL或10mL血清学移液器搅拌混合。
- 当含有缓冲液1的试管中的体积减小至约5mL时,通过在试管侧面移液将5mL缓冲液2缓慢加入缓冲液1。目标是避免在从缓冲区 1 更改为缓冲区 2 时在管路中引入气泡。
- 等到体积再次降至5 mL,然后缓慢再加入5 mL缓冲液2。再重复一次。当缓冲液2取代缓冲液1并开始解离时,肝脏会肿胀。
- 将剩余的缓冲液 2 加入最初包含缓冲液 1 的试管中。当管中剩余约5-10mL缓冲液2时停止灌注。
注意:当缓冲液2灌注肝脏时,门静脉可以用镊子间歇性地夹紧5秒。该步骤是可选的,但是整个肝脏中压力的增加可以改善其解离,从而改善最终的肝细胞产量。 - 小心地切除肝脏并将其转移到含有步骤1.1.4处放置的20mL冰冷缓冲液2的100mm培养皿中。
- 在层流罩下,使用手术剪刀和镊子轻轻地将肝脏分开。
- 向肝细胞悬浮液中加入约20mL冰冷的M199,并使用注射器的柱塞通过100μm细胞过滤器过滤,以轻轻促进从较大的肝块释放额外的肝细胞。
- 用额外的M199洗涤100mm培养皿和细胞过滤器,直到收集管充满。
- 在4°C下以50× g 离心悬浮液2分钟。 小心地吸出上清液,并通过旋转将肝细胞沉淀轻轻地重悬于30mL冷M199中。
- 沉淀步骤1.2.18中提到的肝细胞。再重复一次洗涤。
- 将肝细胞重悬于10mL温M199中,并使用台盼蓝排除法和血细胞计数器12测定活力和产量。
- 将M199中的细胞稀释至升温至37ºC至终浓度为1.0 x 106 活细胞/ mL,并立即开始测定。
2. 脂肪酸β氧化法
注意:该测定一式三份进行,每个反应混合物含有750,000个细胞,1.35mg / mL牛血清白蛋白(BSA),100μM棕榈酸和0.4μCi [1-14C]棕榈酸,最终体积为2mL。
注意:放射性化合物是有害的。根据机构,州和联邦法规购买,处理,存储和处置放射性物质。
- 制备
- 在测定前几天,制备棕榈酸和BSA溶液(表1)并将其储存在-20°C。
- 在测定当天,在开始肝灌注之前完成步骤2.1.3-2.1.9。
- 解冻棕榈酸和BSA溶液。制备用于多次反应的底物混合物以及过量的20%-30%,典型的测定设置如 表2所示。
- 在微量离心管中每次反应等分13.5μLBSA溶液并加热至41°C,然后加入1μL的200mM棕榈酸溶液(BSA:棕榈酸摩尔比= 1:5)。
注意:最好使用有机溶剂(例如放射性和非放射性棕榈酸溶液)分配使用正置换移液器和适当的吸头制备的溶液。 - 剧烈涡旋并在41°C孵育以促进可溶性棕榈酸的形成:BSA复合物。在潜伏期偶尔涡旋。
- 混合物最初将呈现浑浊,但在41°C下孵育20-30分钟后将完全澄清。 将其保持在41°C,直到准备开始反应。
- 在1.5mL微量离心管中等分133μL1M高氯酸以停止反应。
注意:高氯酸是一种强酸和强氧化剂。处理这种化合物需要适当的防护装备。 - 将每次反应的485.5μLM199等分试样放入管中,并将其保持在37°C以稀释在步骤2.1.4-2.1.6下制备的放射性BSA:棕榈酸复合物,然后再开始反应。
- 将 750 μL M199 分配到与样品一样多的 14 mL 圆底管中。如果需要,添加脂肪酸抑制剂β氧化,如依托莫昔、鱼藤酮和抗霉素,包括载体对照(表2)。
- 在肝细胞洗涤步骤中,在开始反应前10-15分钟,将步骤2.1.9制备的管转移到设置为37°C的振荡水浴中,并以180-200rpm振荡。
- 启动、停止和分析脂肪酸β氧化反应
- 如果肝细胞的活力可接受(通常为≥75%,图2),对于每个反应,将0.8μL[1-14 C]棕榈酸(0.5mCi / mL)转移到含有澄清的BSA:棕榈酸溶液的微量离心管中(步骤2.1.4-2.1.6)。涡旋并返回41°C的水浴。
- 为了将肝细胞平衡至37°C并用抑制剂(如果存在)预孵育它们,在最终肝细胞重悬(步骤1.2.21)之后立即用1mL移液将750μL肝细胞悬浮液转移到振荡水浴中的14mL圆底管中的每一个(步骤2.1.9-2.1.10)中,并以低速短暂涡旋以混合。
- 将每次添加错开30秒,孵育15分钟。为了保存用于蛋白质测定的样品,将另一等分试样的肝细胞转移到1.5mL微量离心管中,并以3,000×g旋转5分钟。
注意:在分配时,肝细胞悬浮液需要连续旋转或使用分配的1 mL移液管轻轻搅拌,以防止沉降和样品之间细胞数量的大变异性。 - 除去上清液并将沉淀储存在-80°C,直到准备好测量样品中的蛋白质总量以使结果正常化(图3)。
- 当肝细胞在37°C下预孵育时,将放射性BSA:棕榈酸复合物加入2.1.8的温暖培养基中,并保持在37°C,直到准备开始反应。这是最终的基材混合物。
- 要开始反应,从水浴中除去肝细胞并加入500μL底物混合物。
- 以低速涡旋5秒,以完全重悬细胞并返回水浴。对所有样品重复,错开30秒。
- 孵育15分钟。启动一组反应并立即停止(参见步骤2.2.10-2.2.11)以确定背景放射性(表2)。
- 将剩余的底物混合物的重复等分试样(200-250μL)转移到6mL闪烁小瓶中,并留出计数。使用这些计数来计算对应于500μL底物混合物中可用于氧化的棕榈酸总纳米数的放射性。
- 为了停止反应,从水浴中除去肝细胞,通过以中等速度涡旋重悬肝细胞,然后将400μL肝细胞悬浮液转移到含有高氯酸的微量离心管中。
- 立即盖上管子。对所有样品重复此序列,错开30秒。
- 大力涡旋1.5mL微量离心管,并以13,000× g 将其旋转至1.5mL微量离心管10分钟。
- 将300μL上清液转移到6mL闪烁小瓶中,加入4mL闪烁液,并在闪烁计数器中计数样品和底物混合物等分试样中的放射性(步骤2.2.9)。
注意:离心后,在通风橱下打开管子,以避免呼吸由脂肪酸β氧化产生的14C-乙酰辅酶A完全氧化产生的14C-CO2,并由酸性条件释放。
| 缓冲器/介质组件 | 量 | 最终浓度 | 指示 |
| 解决方案 C | |||
| 氯化钾 | 1.79克 | 480 毫米 | 加水至50毫升。 储存在4°C |
| MgSO4 七水合物 | 1.48克 | 120 毫米 | |
| KH2PO4 | 0.81克 | 119 毫米 | |
| 克雷布斯-亨赛莱特缓冲液(KHB),无钙 | |||
| 氯化钠 | 7.0克 | 120 毫米 | 将水加入900 mL,将pH调节至7.4,并将最终体积降至1L。 |
| NaHCO3 | 2.0克 | 24 毫米 | |
| 1 M 丙酮 pH 值 7.45 | 5 毫升 | 5 毫米 | |
| 葡萄糖 | 1 或 2 克 | 5.6 或 11 mM | |
| 解决方案 C | 10 毫升 | ||
| 缓冲区 1 | |||
| 断续器 | 500 毫升 | 混合组件并过滤灭菌。储存在4°C | |
| 50 毫微米 | 1.0 毫升 | 0.1 毫米 | |
| 缓冲区 2 | |||
| 断续器 | 500 毫升 | 混合组件并过滤灭菌。储存在4°C | |
| 1 M 氯化钙2 二水合物 | 686 微升 | 1.4 毫米 | |
| 庆大霉素溶液 | |||
| 硫酸庆大霉素 | 0.5克 | 50毫克/毫升 | 将水加入 10 mL 并过滤灭菌。等分试样并储存在-20°C |
| 胶原酶溶液 | |||
| 胶原酶I和II混合物 | 10毫克 | 7毫克/毫升 | 将小瓶的全部内容物溶解在1.43 mL水中。 等分试样并储存在-20°C |
| M199型 | |||
| M199型 | 1 袋 | 加水至900毫升,将pH值调节至7.2-7.4。将最终体积降至1 L并过滤灭菌。储存在4°C | |
| NaHCO3 | 2.2克 | 26 毫米 | |
| 1 M HEPES(细胞培养级) | 25 毫升 | 25 毫米 | |
| 额外的葡萄糖(仅适用于喂养的小鼠) | 1 克 | 11 毫米 | |
| 软件安全软件解决方案 | |||
| 无脂肪酸BSA | 400毫克 | 20% (无/ v) | 溶于2毫升水中。 等分试样并储存在-20°C |
| 无放射性棕榈酸溶液 | |||
| 棕榈酸 | 103毫克 | 200 毫米 | 溶于2mL乙醇中,储存在-20°C |
| 1 M 高氯酸 | |||
| 70%高氯酸 | 3.5 毫升 | 1 米 | 用水稀释至40毫升。在室温下储存 |
表1:肝细胞分离和脂肪酸β氧化测定所需的缓冲液,培养基和其他溶液
| 反应次数 | M199 ±抑制剂 | 肝细胞悬浮液(μL) | 底物混合物(μL) | ||||
| 体积(μL) | 艾托莫西 | ||||||
| 1 | 750 | - | 在 37 °C 预热 | 750 | 在37°C下预孵育15分钟 | 500 | 在37°C孵育15分钟 |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | 立即停止 | |||||
| 8 | |||||||
| 9 | |||||||
表2:在存在和不存在依托莫西的情况下一式三份测定肝细胞悬浮液的实验设置示例。
结果
这里描述的肝脏灌注通常产生3000-4000万个细胞/肝脏,平均活力为80%,通过台盼蓝排除估计(图2)。用于制备灌注缓冲液1和2的克雷布斯 - 亨赛莱特缓冲液(KHB)中葡萄糖的典型浓度为11 mM。当测量从禁食小鼠分离的肝细胞中的脂肪酸β氧化时,可以降低KHB中葡萄糖的浓度以更好地代表禁食状态。如图 2所示,将葡萄糖浓度降低到5.6mM对肝细胞的产量或活?...
讨论
在肝脏灌注期间,避免引入气泡至关重要,因为它们会阻塞肝脏中的微毛细血管,防止或限制缓冲液循环并总体上降低肝细胞产量和活力20,21。预防措施,例如在IVC插管之前仔细检查填充缓冲液的入口管路,并避免将入口管从含有缓冲液1的管中抬起以切换到缓冲液2,如本文所述,可以成功减少失败灌注的数量(活力<70%)。在灌注系统中使用气泡捕集?...
披露声明
作者没有利益冲突需要披露。
致谢
这项工作得到了美国国立卫生研究院(National Institutes of Health)向罗伯塔·莱昂纳迪(Roberta Leonardi)授予R35GM119528的支持。
材料
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
参考文献
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。