Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der Fettsäure-β-Oxidation in einer Suspension frisch isolierter Maus-Hepatozyten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Fettsäure-β-Oxidation ist ein essentieller Stoffwechselweg, der für die Energieerzeugung in vielen verschiedenen Zelltypen, einschließlich Hepatozyten, verantwortlich ist. Hier beschreiben wir eine Methode zur Messung der Fettsäure-β-Oxidation in frisch isolierten primären Hepatozyten unter Verwendung von 14C-markierter Palmitinsäure.
Zusammenfassung
Die Fettsäure-β-Oxidation ist ein wichtiger Stoffwechselweg, um den Energiebedarf der Leber zu decken und Substrate und Cofaktoren für zusätzliche Prozesse wie Ketogenese und Glukoneogenese bereitzustellen, die für die Aufrechterhaltung der Ganzkörper-Glukosehomöostase unerlässlich sind und die extrahepatische Organfunktion im nüchternen Zustand unterstützen. Die Fettsäure-β-Oxidation erfolgt in den Mitochondrien und Peroxisomen und wird durch mehrere Mechanismen reguliert, einschließlich der Aufnahme und Aktivierung von Fettsäuren, der Enzymexpression und der Verfügbarkeit von Cofaktoren wie Coenzym A und NAD +. In Assays, die die Fettsäure-β-Oxidation in Leberhomogenaten messen, maskieren die Zelllyse und die übliche Zugabe supraphysiologischer Cofaktorenspiegel die Auswirkungen dieser Regulationsmechanismen. Darüber hinaus ist die Integrität der Organellen in den Homogenaten schwer zu kontrollieren und kann zwischen den Präparaten erheblich variieren. Die Messung der Fettsäure- β-Oxidation in intakten primären Hepatozyten überwindet die oben genannten Fallstricke. Dieses Protokoll beschreibt ein Verfahren zur Messung der Fettsäure-β-Oxidation in einer Suspension frisch isolierter primärer Maushepatozyten, die mit 14C-markierter Palmitinsäure inkubiert wurden. Durch die Vermeidung von Stunden bis Tagen der Kultur hat diese Methode den Vorteil, dass die Proteinexpressionsniveaus und die Stoffwechselwegaktivität der ursprünglichen Leber besser erhalten bleiben, einschließlich der Aktivierung der Fettsäure-β-Oxidation, die in Hepatozyten beobachtet wird, die von nüchternen Mäusen isoliert wurden, verglichen mit gefütterten Mäusen.
Einleitung
Fettsäure-β-Oxidation ist ein essentieller Prozess im Fettstoffwechsel und bietet einen katabolen Weg, um die Fettsäuresynthese und -aufnahme aus der Nahrung auszugleichen. Dieser Prozess erzeugt Energie für mehrere Organe, einschließlich des Herzmuskels, der Nierenrinde und der nüchternen Leber, und verwendet Fettsäuren, die aus der Nahrung, der Fettgewebelipolyse und den internen Triglyceridspeicherngewonnen werden 1,2.
Die Oxidation von Fettsäuren durch den β-Oxidationsweg führt zur sequentiellen Verkürzung der Fettacylkette um zwei Kohlenstoffe gleichzeitig, die als Acetyl-CoA freigesetzt werden, und dieser Prozess findet sowohl in den Mitochondrien als auch in den Peroxisomen statt. Während die meisten Fettsäuren nur einer β-Oxidation unterzogen werden, werden einige an verschiedenen Kohlenstoffen oxidiert, bevor sie in diesen Weg eintreten. Zum Beispiel werden 3-methylsubstituierte Fettsäuren, wie Phytansäure, durch α-Oxidation in den Peroxisomen entfernt, bevor sie in den β-Oxidationsweg eintreten. Ebenso werden einige Fettsäuren zunächst durch Oxidation der terminalen Methylgruppe (ω-Oxidation) im endoplasmatischen Retikulum in Dicarbonsäuren umgewandelt, bevor sie in den Peroxisomen durch β-Oxidation bevorzugt oxidiertwerden 3.
Unabhängig von der spezifischen Organelle muss eine Fettsäure zunächst in einen Coenzym A (CoA)-Thioester oder Acyl-CoA umgewandelt werden, um über den β-Oxidationsweg oxidiert zu werden. β-Oxidation von langkettigen Acyl-CoAs in der mitochondrialen Matrix benötigt das Carnitin-Shuttle für ihre Translokation, wobei Carnitin-Palmitoyltransferase 1 (CPT1) die Umwandlung von Acyl-CoAs in Acylcarnitine katalysiert und das geschwindigkeitsbegrenzende Enzym in diesem Prozessist 4. Nach der Translokation in die mitochondriale Matrix werden die Acyl-CoAs neu geformt und dienen als Substrate für die mitochondriale β-Oxidationsmaschinerie. Im nüchternen Zustand wird das durch β-Oxidation in den hepatischen Mitochondrien erzeugte Acetyl-CoA hauptsächlich zur Ketogenese geleitet. Peroxisomen dienen als primärer Ort für die β-Oxidation von sehr langkettigen, verzweigtkettigen und dicarbonsäurehaltigen Fettsäuren. Peroxisomen benötigen das Carnitin-Shuttle nicht, um Fettsäuresubstrate zu importieren, sondern importieren die entsprechenden Acyl-CoAs durch die Aktivität der ATP-bindenden Kassettentransporter (ABC) ABCD1-35. Innerhalb der Peroxisomen werden Acyl-CoAs dann durch einen speziellen Satz von Enzymen oxidiert, die sich von der mitochondrialen Fettsäure- β-Oxidationsmaschine unterscheiden. Sowohl Mitochondrien als auch Peroxisomen benötigen auch eine Zufuhr von NAD+ und freiem CoA, um Fettacylketten zu oxidieren. Es wurde gezeigt, dass der CoA-Spiegel in der Leber als Reaktion auf das Fasten ansteigt, was die erhöhte Rate der Fettsäureoxidation unterstützt, die in diesem Zustand auftritt6. Darüber hinaus führt ein erhöhter CoA-Abbau in den Peroxisosomen zu einer selektiven Abnahme der peroxisomalen Fettsäureoxidation7. Daher wird der Prozess der Fettsäureoxidation innerhalb der Zelle durch die Expressionsniveaus und Aktivitäten von Enzymen reguliert, die an der Aktivierung, dem Transport und der Oxidation von Fettsäuren beteiligt sind, sowie durch die Konzentrationen von Cofaktoren und anderen Metaboliten in mehreren subzellulären Kompartimenten.
Verfahren, bei denen Gewebehomogenate zur Messung der Fettsäureoxidation verwendet werden, zerstören die zelluläre Architektur, die diesen Prozess reguliert und unterstützt, was zu einer Sammlung von Daten führt, die den In-vivo-Stoffwechsel nicht genau widerspiegeln. Während Techniken, die plattierte primäre Hepatozyten verwenden, dieses System erhalten, führt die Kultivierung isolierter Zellen über längere Zeiträume zu einem Verlust des In-vivo-Genexpressionsprofils, das in den Zellen vorhanden war, als sie noch im Tier lebten 8,9. Das folgende Protokoll beschreibt ein Verfahren zur Isolierung primärer Hepatozyten und zur Bestimmung ihrer Fettsäure- β-Oxidationskapazität unmittelbar nach der Isolierung und in Suspension unter Verwendung von [1-14C]Palmitinsäure. Der Assay basiert auf der Messung der Radioaktivität, die mit den säurelöslichen Metaboliten (ASM) oder Produkten wie Acetyl-CoA assoziiert ist, die durch die β-Oxidationvon [1-14 C]palmitinsäure10,11 erzeugt werden.
Protokoll
Alle experimentellen Verfahren an Mäusen (C57BL/6J, Männer, 9-11 Wochen alt) wurden von den Institutional Animal Care and Use Committees (IACUC) der West Virginia University genehmigt.
1. Hepatozyten-Isolierung
- Präparat
- Bereiten Sie in den Tagen vor der Hepatozytenisolierung die in Tabelle 1 aufgeführten Puffer und Zellkulturmedien vor. Stellen Sie ein Wasserbad mit einer Temperatur von 37 ° C in der Nähe des Ortes auf, an dem die Operation durchgeführt wird.
- Am Tag der Hepatozytenisolierung werden unter einer laminaren Durchflusshaube 35 ml Puffer 1 in ein steriles 50 ml Zentrifugenröhrchen und 70 ml Puffer 2 in ein steriles 100 ml steriles Becherglas oder eine sterile Flasche übertragen.
- Fügen Sie den beiden Puffern die Antibiotika Gentamicin (50 μg / ml) und Penicillin / Streptomycin (1x) hinzu.
- 20 ml Puffer 2, wie in Schritt 1.1.3 zubereitet, in eine 100-mm-Zellkulturschale überführen und auf Eis legen.
- Die restlichen 50 mL Puffer 2 werden in ein steriles 50 mL Zentrifugenröhrchen überführt. Legen Sie die 50 ml Röhrchen mit den antibiotikahaltigen Puffern 1 und 2 in ein Wasserbad, das auf 37 ° C eingestellt ist, und lassen Sie sie mindestens 15 Minuten aufwärmen, bevor Sie mit der Durchblutung beginnen.
HINWEIS: Wenn Sie in einer Sitzung mehrere Hepatozyten isolieren, erhöhen Sie die Anzahl der antibiotikaergänzten Aliquots der Puffer 1 und 2, um sich entsprechend vorzubereiten. - Tauen Sie ein Aliquot von Kollagenaselösung auf und halten Sie es auf Eis.
HINWEIS: Bei richtiger Lagerung gibt es keinen signifikanten Verlust der Enzymaktivität in Kollagenaselösungen, die bis zu 3 Mal eingefroren und aufgetaut und innerhalb von 3 Wochen nach der Zubereitung verwendet werden. - Bereiten Sie die chirurgischen Instrumente und die Peristaltikpumpe vor. Sterilisieren Sie die Leitungen der Peristaltikpumpe, indem Sie 15 ml 70% Ethanol umwälzen, gefolgt von 15 ml sterilem Wasser.
- Schließen Sie eine 22-G-Nadel an die Ausgangsleitung an (Abbildung 1A). Der ausgehöhlte Filter eines Katheters eignet sich gut als Stecker. Füllen Sie die Leitungen mit Puffer 1 und inspizieren Sie die Leitungen, den Stecker und die Nadel, um sicherzustellen, dass keine Luftblasen eingeschlossen werden.
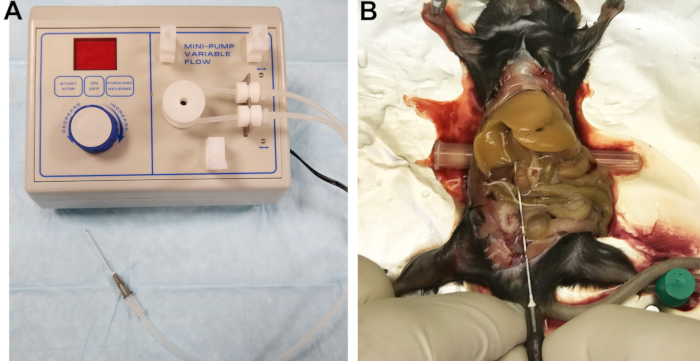
Abbildung 1: Perfusionsapparatur und perfundierte Leber. (A) Peristaltikpumpe mit Auslassleitung, die mit der Nadel verbunden ist, die zum Kanülieren und Perfusieren der Leber verwendet wird. (B) Eine erfolgreiche Kanülierung wird durch sofortiges und homogenes Blanchieren der Leber angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Leberperfusion und Dissoziation
- Anästhesieren Sie eine Maus durch Isofluran-Inhalation mit medizinischer Luft als Trägergas, wobei 4% Isofluran für die Induktion und 1,5% Isofluran zur Aufrechterhaltung der Anästhesie verwendet werden. Überprüfen Sie die Tiefe der Anästhesie, indem Sie den Verlust des Pedalreflexes beurteilen.
- Wenn es keine Reaktion auf Zehenkneifen gibt, legen Sie die Maus in Rückenlage auf ein Operationsbrett, strecken Sie die Gliedmaßen aus und befestigen Sie sie mit Stiften an der Tafel.
- Besprühen Sie den Bauch und die Brust der Maus großzügig mit 70% Ethanol.
- Ziehen Sie mit einer Pinzette die Haut und die Bauchdecke in der Nähe der Bauchbasis hoch und schneiden Sie seitlich auf beiden Seiten der Mittellinie und bis zum Zwerchfell ab, um die Organe freizulegen.
- Legen Sie die Vena cava inferior (IVC) frei, indem Sie den Darm auf die rechte Seite bewegen und die Leberlappen vorsichtig nach oben drehen. Führen Sie ein kleines zylindrisches Objekt, z. B. eine Nadelkappe, unter die Rückseite der Maus ein, um die IVC leicht zu neigen und ihre Kanülierung zu erleichtern (Abbildung 1B).
- Starten Sie die Pumpe mit der niedrigsten Drehzahl und führen Sie bei fließendem Puffer 1 die Nadel in den IVC ein.
- Schneiden Sie die Pfortader ab, um den Druck zu entlasten und die Drainage von Blut und Perfusionspuffern zu ermöglichen, und erhöhen Sie dann sofort die Durchflussrate auf 7 ml / min. Bei richtiger Anwendung wird die Leber innerhalb weniger Sekunden gleichmäßig blanchiert (Abbildung 1B).
- Für konsistentere Ergebnisse halten Sie die Nadel während der gesamten Dauer der Perfusion von Hand in Position.
- Durchbluten Sie die Leber mit warmem Puffer 1. Um das Einbringen von Luftblasen zu vermeiden, stellen Sie sicher, dass die in das Rohr mit Puffer 1 eingeführte Leitung kontinuierlich untergetaucht bleibt.
- Während die Perfusion stattfindet, fügen Sie 130 μL Kollagenaselösung zu Puffer 2 hinzu und mischen Sie durch Pipettieren auf und ab oder Rühren mit einer serologischen Pipette von 5 ml oder 10 ml.
- Da das Volumen in der Röhre, die Puffer 1 enthält, auf etwa 5 ml abnimmt, fügen Sie langsam 5 ml Puffer 2 zu Puffer 1 hinzu, indem Sie an der Seite des Rohres pipettieren. Ziel ist es, beim Wechsel von Puffer 1 zu Puffer 2 keine Luftblasen in die Leitung einzubringen.
- Warten Sie, bis das Volumen wieder auf 5 ml sinkt und fügen Sie langsam weitere 5 ml Puffer 2 hinzu. Wiederholen Sie den Vorgang noch einmal. Wenn Puffer 2 Puffer 1 ersetzt und die Dissoziation beginnt, schwillt die Leber an.
- Fügen Sie den verbleibenden Puffer 2 zu der Röhre hinzu, die ursprünglich Puffer 1 enthielt. Stoppen Sie die Perfusion, wenn sich noch etwa 5-10 ml Puffer 2 in der Röhre befinden.
HINWEIS: Während Puffer 2 die Leber durchblutet, kann die Pfortader intermittierend mit einer Pinzette für 5 s geklemmt werden. Dieser Schritt ist optional, aber der daraus resultierende Druckanstieg in der Leber kann ihre Dissoziation und damit die endgültige Hepatozytenausbeute verbessern. - Die Leber wird vorsichtig ausgeschnitten und in die 100-mm-Kulturschale mit den 20 ml eiskaltem Puffer 2 in Schritt 1.1.4 gegeben.
- Unter der Laminar-Flow-Haube die Leber mit chirurgischer Schere und Pinzette vorsichtig auseinander brechen.
- Geben Sie etwa 20 ml eiskaltes M199 in die Hepatozytensussuspension und filtern Sie es durch ein 100 μm Zellsieb mit dem Kolben einer Spritze, um die Freisetzung zusätzlicher Hepatozyten aus größeren Leberstücken sanft zu fördern.
- Waschen Sie die 100 mm Kulturschale und das Zellsieb mit zusätzlichem M199, bis das Auffangrohr voll ist.
- Zentrifen Sie die Suspension bei 50 x g für 2 min bei 4 °C. Saugen Sie den Überstand vorsichtig ab und suspendieren Sie das Hepatozytenpellet vorsichtig in 30 ml kaltem M199 durch Schwenken.
- Die Hepatozyten werden wie in Schritt 1.2.18 erwähnt pelletiert. Wiederholen Sie die Wäsche noch einmal.
- Resuspendieren Sie die Hepatozyten in 10 ml warmem M199 und bestimmen Sie die Lebensfähigkeit und Ausbeute mit der Trypan-Blue-Ausschlussmethode und einem Hämozytometer12.
- Verdünnen Sie die auf 37 ºC erwärmten Zellen in M199 auf eine Endkonzentration von 1,0 x 106 lebensfähigen Zellen/ml und beginnen Sie sofort mit dem Assay.
2. Fettsäure-β-Oxidationstest
HINWEIS: Der Assay wird dreifach durchgeführt, und jede Reaktionsmischung enthält 750.000 Zellen, 1,35 mg/ml Rinderserumalbumin (BSA), 100 μM Palmitinsäure und 0,4 μCi [1-14C]Palmitinsäure in einem Endvolumen von 2 ml.
ACHTUNG: Radioaktive Verbindungen sind gefährlich. Kauf, Handhabung, Lagerung und Entsorgung von radioaktivem Material in Übereinstimmung mit institutionellen, staatlichen und bundesstaatlichen Vorschriften.
- Präparat
- In den Tagen vor dem Assay werden die Palmitinsäure- und BSA-Lösungen (Tabelle 1) hergestellt und bei -20 °C gelagert.
- Führen Sie am Tag des Assays die Schritte 2.1.3-2.1.9 aus, bevor Sie mit der Leberdurchblutung beginnen.
- Palmitinsäure und BSA-Lösungen auftauen. Bereiten Sie die Substratmischung für mehrere Reaktionen plus einen Überschuss von 20 % bis 30 % vor, wobei ein typischer Assay-Aufbau in Tabelle 2 dargestellt ist.
- Aliquot 13,5 μL BSA-Lösung pro Reaktion in einem Mikrozentrifugenröhrchen und auf 41 °C erwärmen, dann 1 μL der 200 mM Palmitinsäurelösung (BSA: Palmitinsäuremolarverhältnis = 1:5) pro Reaktion zugeben.
HINWEIS: Es ist vorzuziehen, Lösungen, die mit organischen Lösungsmitteln hergestellt wurden, wie die radioaktiven und nicht-radioaktiven Palmitinsäurelösungen, mit einer Verdrängungspipette und geeigneten Spitzen zu dosieren. - Wirbel kräftig und inkubieren bei 41 ° C, um die Bildung der löslichen Palmitinsäure zu erleichtern: BSA-Komplex. Wirbel gelegentlich während der Inkubationszeit.
- Die Mischung erscheint zunächst trüb, klärt sich aber nach 20-30 min Inkubation bei 41 °C vollständig ab. Halten Sie es bei 41 ° C, bis Sie bereit sind, die Reaktionen zu starten.
- Aliquot 133 μL 1 M Perchlorsäure in 1,5 ml Mikrozentrifugenröhrchen, um die Reaktionen zu stoppen.
ACHTUNG: Perchlorsäure ist eine starke Säure und ein starkes Oxidationsmittel. Für den Umgang mit dieser Verbindung ist eine geeignete Schutzausrüstung erforderlich. - Aliquot 485,5 μL M199 pro Reaktion in ein Röhrchen und halten Sie es bei 37 °C, um den radioaktiven BSA: Palmitinsäurekomplex zu verdünnen, der in den Schritten 2.1.4-2.1.6 vor Beginn der Reaktionen hergestellt wurde.
- Geben Sie 750 μL M199 in so viele 14-ml-Rundbodenröhrchen wie die Proben ab. Falls gewünscht, fügen Sie Inhibitoren der Fettsäure-β-Oxidation hinzu, wie Etomoxir, Rotenon und Antimycin, einschließlich einer Vehikelkontrolle (Tabelle 2).
- Während der Hepatozytenwaschschritte werden die in Schritt 2.1.9 vorbereiteten Röhrchen 10-15 Minuten vor Beginn der Reaktionen in ein auf 37 °C eingestelltes Schüttelwasserbad überführt und bei 180-200 U/min geschüttelt.
- Starten, Stoppen und Analysieren der Fettsäure- β-Oxidationsreaktionen
- Wenn die Lebensfähigkeit der Hepatozyten akzeptabel ist (typischerweise ≥ 75%, Abbildung 2), werden für jede Reaktion 0,8 μL [1-14C]Palmitinsäure (0,5 mCi/ml) auf das Mikrozentrifugenröhrchen übertragen, das die geklärte BSA:Palmitinsäurelösung enthält (Schritte 2.1.4-2.1.6). Vortex und Rückkehr ins Wasserbad bei 41 °C.
- Um die Hepatozyten auf 37 °C auszugleichen und sie mit Inhibitoren vorzuinkubieren (falls vorhanden), werden unmittelbar nach der abschließenden Hepatozyten-Resuspension (Schritt 1.2.21) 750 μL der Hepatozytensuspension mit einer 1-ml-Pipette auf jedes der 14 ml-Rundbodenröhrchen im Schüttelwasserbad (Schritte 2.1.9-2.1.10) übertragen und bei niedriger Geschwindigkeit kurz zum Mischen vorgewirbelt.
- Jede Zugabe um 30 s taumeln und 15 min inkubieren. Um eine Probe für die Proteinbestimmung zu speichern, übertragen Sie ein weiteres Aliquot von Hepatozyten in ein 1,5 ml Mikrozentrifugenröhrchen und drehen Sie es bei 3.000 x g für 5 min.
HINWEIS: Während der Dosierung muss die Hepatozytensussuspension kontinuierlich mit der Dosierpipette 1 ml gewirbelt oder vorsichtig gerührt werden, um ein Absetzen und eine große Variabilität der Zellzahl zwischen den Proben zu verhindern. - Entfernen Sie den Überstand und lagern Sie das Pellet bei -80 °C, bis es bereit ist, die Gesamtproteinmenge in der Probe zu messen, um die Ergebnisse zu normalisieren (Abbildung 3).
- Während die Hepatozyten bei 37 °C vorinkubiert werden, wird der radioaktive BSA:Palmitinsäure-Komplex in 2.1.8 in das warme Medium gegeben und bei 37 °C gehalten, bis die Reaktionen eingeleitet werden können. Dies ist die endgültige Substratmischung.
- Um die Reaktionen zu starten, entfernen Sie die Hepatozyten aus dem Wasserbad und fügen Sie 500 μL Substratmischung hinzu.
- Wirbeln Sie mit niedriger Geschwindigkeit für 5 s vor, um die Zellen vollständig zu suspendieren und zum Wasserbad zurückzukehren. Wiederholen Sie mit allen Proben, die um 30 s staffeln.
- 15 min inkubieren Starten Sie eine Reihe von Reaktionen und stoppen Sie sofort (siehe Schritte 2.2.10-2.2.11), um die Hintergrundradioaktivität zu bestimmen (Tabelle 2).
- Doppelte Aliquots (200-250 μL) der übrig gebliebenen Substratmischung auf 6 ml Szintillationsfläschchen übertragen und zur Zählung beiseite gelegt. Verwenden Sie diese Zählungen, um die Radioaktivität zu berechnen, die den für die Oxidation verfügbaren Gesamtnmolen Palmitinsäure in 500 μL Substratmischung entspricht.
- Um die Reaktionen zu stoppen, entfernen Sie die Hepatozyten aus dem Wasserbad, resuspendieren Sie die Hepatozyten durch Vortexing mit mäßiger Geschwindigkeit und übertragen Sie dann 400 μL der Hepatozytenssuspension auf die Mikrozentrifugenröhrchen, die Perchlorsäure enthalten.
- Verschließen Sie sofort die Röhren. Wiederholen Sie diese Sequenz für alle Proben und staffeln Sie um 30 s.
- Wirbeln Sie die 1,5 ml Mikrozentrifugenröhrchen kräftig um und drehen Sie sie 10 min lang mit 13.000 x g durch die 1,5 ml Mikrozentrifugenröhrchen.
- 300 μL des Überstands werden auf eine 6 ml Szintillationsdurchstechflasche übertragen, 4 ml Szintillationsflüssigkeit zugegeben und die Radioaktivität in den Proben und die Substratmischung aliquots (Schritt 2.2.9) in einem Szintillationszähler gezählt.
ACHTUNG: Öffnen Sie nach dem Zentrifugieren die Schläuche unter einem Abzug, um das Einatmendes 14C-CO 2 zu vermeiden, das durch die vollständige Oxidation von 14C-Acetyl-CoA erzeugt wird, das durch Fettsäure-β-Oxidation erzeugt und durch die sauren Bedingungen freigesetzt wird.
| Puffer/Medienkomponenten | Menge | Endkonzentration | Anweisungen |
| Lösung C | |||
| Kcl | 1,79 g | 480 mM | Wasser zu 50 ml hinzufügen. Bei 4 °C lagern |
| MgSO4 Heptahydrat | 1,48 g | 120 mM | |
| KH2PO4 | 0,81 g | 119 mM | |
| Krebs-Henseleit-Puffer (KHB), calciumfrei | |||
| NaCl | 7,0 g | 120 mM | Wasser auf 900 ml geben, den pH-Wert auf 7,4 einstellen und das endgültige Volumen auf 1 l bringen. Bei 4 °C lagern |
| NaHCO3 | 2,0 g | 24 mM | |
| 1 m HEPES pH 7,45 | 5 ml | 5 mM | |
| Traubenzucker | 1 oder 2 g | 5,6 oder 11 mM | |
| Lösung C | 10 ml | ||
| Puffer 1 | |||
| KHB | 500 ml | Mischen Sie Komponenten und filtersterilisieren Sie. Bei 4 °C lagern | |
| 50 mM EGTA | 1,0 ml | 0,1 mM | |
| Puffer 2 | |||
| KHB | 500 ml | Mischen Sie Komponenten und filtersterilisieren Sie. Bei 4 °C lagern | |
| 1 M CaCl2 Dihydrat | 686 μL | 1,4 mM | |
| Gentamicin Lösung | |||
| Gentamicinsulfat | 0,5 g | 50 mg/ml | Wasser zu 10 ml geben und Filter sterilisieren. Aliquot und bei -20 °C lagern |
| Kollagenase-Lösung | |||
| Kollagenase I und II Mischung | 10 mg | 7 mg/ml | Lösen Sie den gesamten Inhalt der Durchstechflasche in 1,43 ml Wasser auf. Aliquot und bei -20 °C lagern |
| M199 | |||
| M199 | 1 Beutel | Wasser auf 900 ml geben und den pH-Wert auf 7,2-7,4 einstellen. Bringen Sie das endgültige Volumen auf 1 L und filtersterilisieren Sie. Bei 4 °C lagern | |
| NaHCO3 | 2,2 g | 26 mM | |
| 1 M HEPES (Zellkulturgrad) | 25 ml | 25 mM | |
| Zusätzliche Glukose (nur für gefütterte Mäuse) | 1 g | 11 mM | |
| BSA-Lösung | |||
| Fettsäurefreie BSA | 400 mg | 20% (w/v) | In 2 ml Wasser auflösen. Aliquot und bei -20 °C lagern |
| Nicht-radioaktive Palmitinsäurelösung | |||
| Palmitinsäure | 103 mg | 200 mM | In 2 ml Ethanol auflösen, bei -20 °C lagern |
| 1 M Perchlorsäure | |||
| 70% Perchlorsäure | 3,5 ml | 1 Mio. | Mit Wasser auf 40 ml verdünnen. Bei Raumtemperatur lagern |
Tabelle 1: Puffer, Medien und andere Lösungen, die für die Hepatozytenisolierung und den Fettsäure-β-Oxidationstest erforderlich sind
| Reaktionszahl | M199 ± Inhibitoren | Hepatozytensuspensionen (μL) | Substratmischung (μL) | ||||
| Volumen (μL) | Etomoxir | ||||||
| 1 | 750 | - | Vorwärmen bei 37 °C | 750 | Vorinkubation bei 37 °C für 15 min | 500 | Inkubieren bei 37 °C für 15 min |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | Sofort aufhören | |||||
| 8 | |||||||
| 9 | |||||||
Tabelle 2: Beispiel für den Versuchsaufbau einer Hepatozytensuspension, die in dreifacher Ausfertigung in Gegenwart und Abwesenheit von Etomoxir untersucht wurde.
Ergebnisse
Die hier beschriebene Leberperfusion ergibt typischerweise 30-40 Millionen Zellen / Leber mit einer durchschnittlichen Lebensfähigkeit von 80%, wie durch den Trypanblau-Ausschluss geschätzt (Abbildung 2). Die typische Konzentration von Glucose im Krebs-Henseleit-Puffer (KHB), der zur Herstellung der Perfusionspuffer 1 und 2 verwendet wird, beträgt 11 mM. Bei der Messung der Fettsäure-β-Oxidation in Hepatozyten, die von gefasteten Mäusen isoliert wurden, kann die Glukosekonzentration im...
Diskussion
Während der Leberdurchblutung ist es wichtig, die Einführung von Luftblasen zu vermeiden, da sie die Mikrokapillaren in der Leber blockieren, die Pufferzirkulation verhindern oder einschränken und insgesamt die Hepatozytenausbeute und Lebensfähigkeit verringern20,21. Vorsichtsmaßnahmen, wie die genaue Inspektion der mit Puffern gefüllten Einlassleitung vor der Kanülierung des IVC und das Vermeiden des Abhebens der Einlassleitung von dem Rohr, das Puffer 1 ...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch den Zuschuss der National Institutes of Health R35GM119528 an Roberta Leonardi unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
Referenzen
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten