É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição do ácido graxo β-oxidação em uma suspensão de hepatócitos de rato recém-isolados
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O ácido graxo β-oxidação é uma via metabólica essencial responsável pela geração de energia em muitos tipos diferentes de células, incluindo hepatócitos. Aqui, descrevemos um método para medir o ácido graxo β-oxidação em hepatócitos primários recém-isolados usando ácido palmítico de 14C.
Resumo
O ácido graxo β-oxidação é um caminho metabólico fundamental para atender às demandas energéticas do fígado e fornecer substratos e cofatores para processos adicionais, como cetogênese e gliconeogênese, que são essenciais para manter a homeostase de glicose do corpo inteiro e apoiar a função de órgãos extra-hepáticos no estado de jejum. O β-oxidação do ácido graxo ocorre dentro das mitocôndrias e peroxismos e é regulado através de múltiplos mecanismos, incluindo a absorção e ativação de ácidos graxos, níveis de expressão enzime e disponibilidade de cofatores como a coenzima A e NAD+. Em ensaios que medem o ácido graxo β-oxidação em homogeneizadores hepáticos, a lise celular e a adição comum de níveis suprafisiológicos de cofatores mascaram os efeitos desses mecanismos regulatórios. Além disso, a integridade das organelas nos homogeneizadores é difícil de controlar e pode variar significativamente entre as preparações. A medição do ácido graxo β-oxidação em hepatócitos primários intactos supera as armadilhas acima. Este protocolo descreve um método para a medição do ácido graxo β-oxidação em uma suspensão de hepatócitos de camundongos primários recém-isolados incubados com ácido palmítico de 14C. Ao evitar horas a dias de cultura, este método tem a vantagem de preservar melhor os níveis de expressão proteica e a atividade da via metabólica do fígado original, incluindo a ativação do ácido graxo β-oxidação observado em hepatócitos isolados de camundongos em jejum em comparação com camundongos alimentados.
Introdução
O ácido graxo β-oxidação é um processo essencial no metabolismo lipídico, fornecendo um caminho catabólico para equilibrar a síntese de ácidos graxos e a ingestão da dieta. Esse processo gera energia para múltiplos órgãos, incluindo o músculo cardíaco, córtex renal e fígado em jejum, e utiliza ácidos graxos obtidos da dieta, lipólise tecidual adiposa e triglicerídeos internos 1,2.
A oxidação do ácido graxo através da via β-oxidação resulta no encurtamento sequencial da cadeia de acilho gorduroso por dois carbonos de cada vez, liberados como acetil-CoA, e esse processo ocorre tanto nas mitocôndrias quanto nos peroxisomes. Enquanto a maioria dos ácidos graxos sofre apenas β-oxidação, alguns são oxidados em diferentes carbonos antes de entrar neste caminho. Por exemplo, ácidos graxos substituídos por 3 metil, como o ácido fistanico, sofrem a remoção de um carbono por α-oxidação nos perosemos antes de entrar na via β-oxidação. Da mesma forma, alguns ácidos graxos são primeiro convertidos em ácidos graxos dicarboxílicos por oxidação do grupo metil terminal (ω-oxidação) no ânticulo endoplasmático antes de serem preferencialmente oxidados nos perosários por β-oxidação3.
Independentemente da organela específica, um ácido graxo deve primeiro ser convertido em um tiaíster aconchego A (CoA), ou acyl-CoA, para ser oxidado através da via β-oxidação. β-Oxidação de Acyl-CoAs de cadeia longa na matriz mitocondrial requer o transporte carnitina para sua translocação, onde a palmitoyltransferase 1 (CPT1) catalisa a conversão de aciila-CoAs para acicarnitinas e é a enzima que limita a taxa neste processo4. Uma vez translocados à matriz mitocondrial, os aciis-CoAs são re-formados e servem como substratos para o maquinário mitocondrial β-oxidação. No estado de jejum, o acetil-CoA produzido através de β-oxidação em mitocôndrias hepáticas é canalizado principalmente para cetogênese. Peroxisomos servem como o local principal para a β-oxidação de ácidos graxos de cadeia muito longa, ramificadas e dicarboxílicos. Os peroxisários não exigem que o transporte de carnitina importe substratos de ácidos graxos, em vez de importar o correspondente acyl-CoAs através da atividade dos transportadores de de ligação ATP (ABC) ABCD1-35. Dentro dos peroxisomes, os acilico-CoAs são então oxidados por um conjunto dedicado de enzimas, distintas do ácido graxo mitocondrial β máquinas de oxidação. Tanto mitocôndrias quanto peroxisomes também requerem um fornecimento de NAD+ e CoA livre para oxidar cadeias de acicila gordurosa. Os níveis de COA no fígado têm mostrado aumento em resposta ao jejum, apoiando o aumento da taxa de oxidação de ácidos graxos que ocorre neste estado6. Além disso, o aumento da degradação do CoA nos peroxisomes resulta em uma diminuição seletiva na oxidação de ácido graxo peroxisomal7. Portanto, o processo de oxidação de ácidos graxos dentro da célula é regulado pelos níveis de expressão e atividades das enzimas envolvidas na ativação, transporte e oxidação de ácidos graxos, bem como as concentrações de cofatores e outros metabólitos em vários compartimentos subcelulares.
Procedimentos que utilizam homogeneizadores teciduais para medir a oxidação de ácidos graxos destroem a arquitetura celular que regula e apoia esse processo, levando a uma coleta de dados que não refletem com precisão o metabolismo in vivo. Enquanto as técnicas que utilizam hepatócitos primários banhados preservam esse sistema, a cultura de células isoladas por longos períodos de tempo resulta em uma perda do perfil de expressão genética in vivo que estava presente nas células quando ainda viviam dentro do animal 8,9. O protocolo a seguir descreve um método para isolar hepatócitos primários e avaliar sua capacidade de ácido graxo β-oxidação imediatamente após o isolamento e na suspensão, usando [1-14C]ácido palmítico. O ensaio baseia-se na medição da radioatividade associada aos metabólitos solúveis ácidos (ASM) ou produtos, como acetil-CoA, produzidos pela β-oxidação do ácido palmítico 10,11.
Protocolo
Todos os procedimentos experimentais em camundongos (C57BL/6J, machos, 9-11 semanas de idade) foram aprovados pelos Comitês Institucionais de Cuidados e Uso de Animais (IACUC) da West Virginia University.
1. Isolamento hepatocito
- Preparação
- Nos dias anteriores ao isolamento do hepatocito, prepare os buffers e os meios de cultura celular listados na Tabela 1. Configure um banho de água com temperatura fixada em 37 °C perto de onde a cirurgia será realizada.
- No dia do isolamento do hepatocito, sob uma capa de fluxo laminar, transfira 35 mL de Buffer 1 para um tubo de centrífuga estéril de 50 mL e 70 mL de Tampão 2 a um beaker ou garrafa estéril de 100 mL.
- Adicione antibióticos gentamicina (50 μg/mL) e penicilina/estreptomicina (1x) aos dois buffers.
- Transfira 20 mL de Buffer 2 como preparado na etapa 1.1.3 para um prato de cultura celular de 100 mm e coloque no gelo.
- Transfira os 50 mL restantes do Buffer 2 para um tubo centrífuga de 50 mL estéril. Coloque os tubos de 50 mL contendo os buffers suplementados com antibióticos 1 e 2 em um banho de água a 37 °C e deixe-os aquecer por pelo menos 15 minutos antes de iniciar a perfusão.
NOTA: Se realizar múltiplos isolamentos de hepatócitos em uma sessão, aumente o número de alíquotas complementadas por antibióticos dos Buffers 1 e 2 para se preparar em conformidade. - Descongele uma alíquota de solução de colagem e mantenha no gelo.
NOTA: Se armazenado corretamente, não há perda significativa de atividade enzimática em soluções de colagenase congeladas e descongeladas até 3 vezes e usadas dentro de 3 semanas após a preparação. - Prepare os instrumentos cirúrgicos e a bomba peristáltica. Esterilizar as linhas da bomba peristáltica circulando 15 mL de 70% de etanol, seguido por 15 mL de água estéril.
- Conecte uma agulha de 22 G à linha de saída (Figura 1A). O filtro oco de um cateter funciona bem como um conector. Encha as linhas com buffer 1 e inspecione as linhas, conector e agulha para garantir que nenhuma bolha de ar esteja presa.
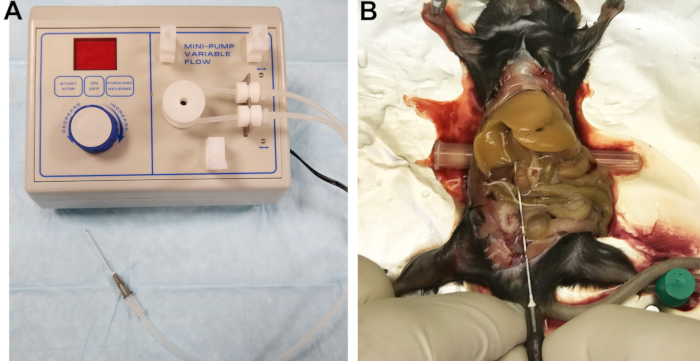
Figura 1: Aparelho de perfusão e fígado perfusado. (A) Bomba peristáltica com linha de saída conectada à agulha usada para cannulate e perfusão do fígado. (B) A canulação bem sucedida é indicada por branqueamento imediato e homogêneo do fígado. Clique aqui para ver uma versão maior desta figura.
- Perfusão hepática e dissociação
- Anestesiar um rato através da inalação de isoflurane com ar de grau médico como gás transportador, usando 4% de isoflurano para indução e 1,5% isoflurano para manter a anestesia. Verifique a profundidade da anestesia avaliando a perda do reflexo do pedal.
- Quando não houver resposta ao beliscar o dedo do pé, coloque o rato em uma posição supina em uma placa de cirurgia, estique os membros e fixe-os na placa com pinos.
- Pulverize liberalmente o abdômen e o peito do rato com 70% de etanol.
- Usando fórceps, puxe a pele e a parede abdominal perto da base do abdômen e corte lateralmente, em ambos os lados da linha média e até o diafragma, para expor os órgãos.
- Exponha a veia cava inferior (IVC) movendo os intestinos para o lado direito e gentilmente virando os lóbulos do fígado para cima. Insira um pequeno objeto cilíndrico, como uma tampa de agulha, sob a parte de trás do mouse para inclinar ligeiramente o IVC e facilitar sua cannulação (Figura 1B).
- Inicie a bomba na velocidade mais baixa e, com o Buffer 1 fluindo, insira a agulha no IVC.
- Corte a veia do portal para aliviar a pressão e permitir a drenagem de tampões sanguíneos e de perfusão, em seguida, aumente imediatamente a vazão para 7 mL/min. Se feito corretamente, o fígado ficará uniformemente branqueado dentro de alguns segundos (Figura 1B).
- Para resultados mais consistentes, mantenha a agulha na posição manual durante toda a duração da perfusão.
- Perfunda o fígado com tampão quente 1. Para evitar a introdução de bolhas de ar, certifique-se de que a linha inserida no tubo contendo Buffer 1 permaneça continuamente submersa.
- Enquanto a perfusão ocorre, adicione 130 μL de solução de colagenase ao Buffer 2 e misture por pipetar para cima e para baixo ou mexer com uma pipeta sorológica de 5 mL ou 10 mL.
- À medida que o volume no tubo contendo buffer 1 diminui para cerca de 5 mL, adicione lentamente 5 mL de Buffer 2 ao Buffer 1 por tubulação na lateral do tubo. O objetivo é evitar introduzir bolhas de ar na linha enquanto muda de Buffer 1 para Buffer 2.
- Aguarde até que o volume diminua novamente para 5 mL e adicione lentamente mais 5 mL de Buffer 2. Repita mais uma vez. À medida que o Buffer 2 substitui o Buffer 1 e a dissociação começa, o fígado inchará.
- Adicione o buffer restante 2 ao tubo que contém originalmente buffer 1. Pare a perfusão quando houver cerca de 5-10 mL de Buffer 2 deixado no tubo.
NOTA: Enquanto o Buffer 2 está perfundando o fígado, a veia portal pode ser intermitentemente presa com fórceps para 5 s. Esta etapa é opcional, mas o consequente aumento da pressão em todo o fígado pode melhorar sua dissociação e, assim, o rendimento final do hepatócito. - Extite cuidadosamente o fígado e transfira-o para o prato de cultura de 100 mm contendo os 20 mL de tampão gelado 2 reservados no passo 1.1.4.
- Sob a coifa de fluxo laminar, quebre suavemente o fígado usando tesoura cirúrgica e pinças.
- Adicione cerca de 20 mL de M199 gelado à suspensão do hepatocito e filtre-o através de um coador de células de 100 μm usando o êmbolo de uma seringa para promover suavemente a liberação de hepatócitos adicionais de pedaços maiores do fígado.
- Lave o prato de cultura de 100 mm e o coador de células com M199 adicional até que o tubo de coleta esteja cheio.
- Centrifugar a suspensão a 50 x g por 2 min a 4 °C. Aspire cuidadosamente o supernatante e resuspenque suavemente a pelota de hepatocitte em 30 mL de M199 frio girando.
- Pelota os hepatócitos mencionados na etapa 1.2.18. Repita a lavagem mais uma vez.
- Resuspend os hepatócitos em 10 mL de M199 quente e determine a viabilidade e rendimento usando o método de exclusão azul trypan e um hemócitometro12.
- Diluir as células em M199 aqueceu para 37 ºC para uma concentração final de 1,0 x 106 células viáveis/mL e imediatamente iniciar o ensaio.
2. Ensaio de β-oxidação do ácido graxo
NOTA: O ensaio é conduzido em triplicado, e cada mistura de reação contém 750.000 células, 1,35 mg/mL de colmeia bovina (BSA), 100 μM de ácido palmítico e 0,4 μCi [1-14C]ácido palmítico em um volume final de 2 mL.
ATENÇÃO: Compostos radioativos são perigosos. Comprar, manusear, armazenar e descartar material radioativo de acordo com as normas institucionais, estaduais e federais.
- Preparação
- Nos dias anteriores ao ensaio, prepare as soluções de ácido palmítico e BSA (Tabela 1) e armazene-as a -20 °C.
- No dia do ensaio, complete as etapas 2.1.3-2.1.9 antes de iniciar a perfusão hepática.
- Descongele o ácido palmítico e as soluções BSA. Prepare a mistura de substrato para múltiplas reações mais um excesso de 20%-30%, com uma configuração de ensaio típica mostrada na Tabela 2.
- Aliquot 13,5 μL de solução BSA por reação em um tubo de microcentrifuuge e quente a 41 °C, em seguida, adicione 1 μL da solução de ácido palmítico de 200 mM (BSA: molar ácido palmítico = 1:5) por reação.
NOTA: É preferível dispensar soluções preparadas com solventes orgânicos, como as soluções de ácido palmítico radioativo e não radioativo, com uma pipeta de deslocamento positiva e dicas apropriadas. - Vórtice vigorosamente e incubado a 41 °C para facilitar a formação do ácido palmítico solúvel: complexo BSA. Vórtice ocasionalmente durante o período de incubação.
- A mistura inicialmente parecerá nublada, mas esclarecerá completamente após 20-30 min de incubação a 41 °C. Mantenha-o a 41 °C até que esteja pronto para iniciar as reações.
- Alíquota 133 μL de ácido polórico de 1 M em tubos de microcentrífugo de 1,5 mL para parar as reações.
ATENÇÃO: O ácido polemóico é um ácido forte e um oxidante forte. É necessário equipamento de proteção adequado para o manuseio deste composto. - Alíquota de 485,5 μL de M199 por reação em um tubo e mantê-la a 37 °C para diluir o BSA radioativo: complexo ácido palmítico preparado nas etapas 2.1.4-2.1.6 antes de iniciar as reações.
- Dispense 750 μL de M199 em tantos tubos de fundo redondo de 14 mL quanto as amostras. Se desejar, adicione inibidores de ácido graxo β-oxidação, como etomoxir, rotenona e antimicina, incluindo um controle de veículo (Tabela 2).
- Durante as etapas de lavagem de hepatócitos, 10-15 min antes de iniciar as reações, transfira os tubos preparados na etapa 2.1.9 para um banho de água tremendo definido para 37 °C e tremendo a 180-200 rpm.
- Iniciar, parar e analisar as reações de β-oxidação do ácido graxo
- Se a viabilidade dos hepatócitos for aceitável (tipicamente ≥ 75%, Figura 2), para cada reação, transferir 0,8 μL de ácido palmítico [1-14 C](0,5 mCi/mL) para o tubo de microcentrifuuge contendo a BSA clarificada: solução de ácido palmítico (etapas 2.1.4-2.1.6). Vórtice e retorne ao banho de água a 41 °C.
- Equilibrar os hepatócitos a 37 °C e pré-incuba-los com inibidores (se presente), imediatamente após a ressuspensão hepatocitte final (etapa 1.2.21), transfira 750 μL do suspensão de hepatócito com uma pipeta de 1 mL para cada um dos tubos de fundo redondo de 14 mL no banho de água tremendo (passos 2.1.9-2.1.10) e vórtice brevemente em baixa velocidade para misturar.
- Escaler cada adição por 30 s e incubar por 15 min. Para salvar uma amostra para determinação proteica, transfira outra alíquota de hepatócitos para um tubo de microcentrifuge de 1,5 mL e gire a 3.000 x g por 5 min.
NOTA: Durante a dispensa, a suspensão do hepatócito precisa ser continuamente girada ou suavemente agitada com a pipeta de 1 mL para evitar a fixação e grande variabilidade no número de células entre as amostras. - Retire o sobrenaspeente e armazene a pelota a -80 °C até estar pronto para medir a quantidade total de proteína na amostra para normalizar os resultados (Figura 3).
- Enquanto os hepatócitos estão sob pré-incubação a 37 °C, adicione o BSA radioativo: complexo de ácido palmítico ao meio quente em 2.1.8, e mantenha-se a 37 °C até estar pronto para iniciar as reações. Esta é a última mistura de substrato.
- Para iniciar as reações, remova os hepatócitos do banho de água e adicione 500 μL de mistura de substrato.
- Vórtice em baixa velocidade para 5 s para resususpensar completamente as células e retornar ao banho de água. Repita com todas as amostras, cambaleando por 30 s.
- Incubar por 15 min. Inicie um conjunto de reações e pare imediatamente (veja as etapas 2.2.10-2.2.11) para determinar a radioatividade de fundo (Tabela 2).
- Transfira alíquotas duplicadas (200-250 μL) da mistura de substrato restante para frascos de cintilação de 6 mL e reserve para contar. Use estas contagens para calcular a radioatividade correspondente ao total de nmoles de ácido palmítico disponível para oxidação em 500 μL de mistura de substrato.
- Para parar as reações, remova os hepatócitos do banho de água, resuspenda os hepatócitos por vórtice a velocidade moderada e, em seguida, transfira 400 μL da suspensão hepatócida para os tubos de microcentrifuge contendo ácido polemóico.
- Tampe imediatamente os tubos. Repita esta sequência para todas as amostras, cambaleando por 30 s.
- Vigorosamente vórtice dos tubos de microcentrifuuge de 1,5 mL e gire-os pelos tubos de microcentrifuuge de 1,5 mL a 13.000 x g por 10 minutos.
- Transfira 300 μL do supernante para um frasco de cintilação de 6 mL, adicione 4 mL de fluido de cintilação e conte a radioatividade nas amostras e as alíquotas de mistura de substrato (passo 2.2.9) em um contador de cintilação.
ATENÇÃO: Após a centrifugação, abra os tubos sob uma coifa para evitar respirar os 14C-CO2 produzidos pela oxidação completa de 14C-acetil-CoA gerados pelo ácido graxo β-oxidação e liberados pelas condições ácidas.
| Buffers/Componentes de mídia | Quantidade | Concentração Final | Instruções |
| Solução C | |||
| Kcl | 1,79 g | 480 mM | Adicione água a 50 mL. Armazenar a 4 °C |
| Heptahydrate MgSO4 | 1,48 g | 120 mM | |
| KH2PO4 | 0,81 g | 119 mM | |
| Tampão Krebs-Henseleit (KHB), livre de cálcio | |||
| NaCl | 7,0 g | 120 mM | Adicione água a 900 mL, ajuste o pH para 7,4 e leve o volume final para 1 L. Armazene a 4 °C |
| NaHCO3 | 2,0 g | 24 mM | |
| 1 M HEPES pH 7.45 | 5 mL | 5 mM | |
| Glicose | 1 ou 2 g | 5,6 ou 11 mM | |
| Solução C | 10 mL | ||
| Buffer 1 | |||
| KHB | 500 mL | Misture componentes e esterilize o filtro. Armazenar a 4 °C | |
| 50 mM EGTA | 1,0 mL | 0,1 mM | |
| Tampão 2 | |||
| KHB | 500 mL | Misture componentes e esterilize o filtro. Armazenar a 4 °C | |
| 1 M CaCl2 dihidrato | 686 μL | 1,4 mM | |
| Solução de gentamicina | |||
| Sulfato de gentamicina | 0,5 g | 50 mg/mL | Adicione água a 10 mL e o filtro esterilizar. Aliquot e armazenar a -20 °C |
| Solução de colagenase | |||
| Mistura de colagenase I e II | 10 mgs | 7 mg/mL | Dissolva todo o conteúdo do frasco em 1,43 mL de água. Aliquot e armazenar a -20 °C |
| M199 | |||
| M199 | 1 bolsa | Adicione água a 900 mL e ajuste o pH para 7,2-7,4. Leve o volume final para 1 L e o filtro esterilizar. Armazenar a 4 °C | |
| NaHCO3 | 2,2 g | 26 mM | |
| 1 M HEPES (grau de cultura celular) | 25 mL | 25 mM | |
| Glicose extra (apenas para ratos alimentados) | 1 g | 11 mM | |
| Solução BSA | |||
| BSA livre de ácidos graxos | 400 mgs | 20% (w/v) | Dissolva-se em 2 mL de água. Aliquot e armazenar a -20 °C |
| Solução de ácido palmítico não radioativo | |||
| Ácido palmítico | 103 mgs | 200 mM | Dissolver em 2 mL de etanol, armazenar a -20 °C |
| 1 M ácido polemóico | |||
| 70% ácido polelorico | 3,5 mL | 1 M | Diluir até 40 mL com água. Armazenar à temperatura ambiente |
Tabela 1: Tampões, mídia e outras soluções necessárias para o isolamento hepatocito e o ensaio de β-oxidação do ácido graxo
| Número de reação | Inibidores de ± M199 | Suspensão de hepatócito (μL) | Mistura de substrato (μL) | ||||
| Volume (μL) | Etomoxir | ||||||
| 1 | 750 | - | Pré-quente a 37 °C | 750 | Pré-incubação a 37 °C por 15 min | 500 | Incubar a 37 °C por 15 min |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | Pare imediatamente | |||||
| 8 | |||||||
| 9 | |||||||
Tabela 2: Exemplo da configuração experimental para suspensão de hepatócitos avaliada em triplicado na presença e ausência de etomoxir.
Resultados
A perfusão hepática descrita aqui normalmente produz de 30 a 40 milhões de células/fígado com viabilidade média de 80%, como estimado pela exclusão azul trypan (Figura 2). A concentração típica de glicose no tampão Krebs-Henseleit (KHB), que é usado para preparar os Buffers de perfusão 1 e 2, é de 11 mM. Ao medir o ácido graxo β-oxidação em hepatócitos isolados de camundongos em jejum, a concentração de glicose no KHB pode ser reduzida para representar melhor o estado em...
Discussão
Durante a perfusão hepática, é fundamental evitar a introdução de bolhas de ar, pois bloqueiam os microcapilários do fígado, impedindo ou restringindo a circulação do buffer e diminuindo o rendimento e a viabilidade do hepatocito e da viabilidade20,21. Precauções, como inspecionar de perto a linha de entrada preenchida com buffer antes da cannulação do IVC e evitar tirar a linha de entrada do tubo contendo buffer 1 para mudar para Buffer 2, como desc...
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi apoiado pela concessão dos Institutos Nacionais de Saúde R35GM119528 a Roberta Leonardi.
Materiais
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
Referências
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados