JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
갓 분리된 마우스 간세포의 현탁액에서의 지방산 β산화의 측정
요약
지방산 β산화는 간세포를 포함한 다양한 세포 유형에서 에너지를 생성하는 데 필수적인 대사 경로입니다. 여기에서, 우리는 14C표지된 팔미트산을 사용하여 갓 분리된 원발성 간세포에서 지방산 β산화를 측정하는 방법을 설명한다.
초록
지방산 β산화는 간장의 에너지 요구를 충족시키고 전신 포도당 항상성을 유지하고 금식 상태에서 간 외 장기 기능을 지원하는 데 필수적인 케톤 생성 및 글루코 신 생성과 같은 추가 과정을위한 기질 및 보조 인자를 제공하는 핵심 대사 경로입니다. 지방산 β산화는 미토콘드리아와 퍼옥시좀 내에서 발생하며 지방산의 흡수 및 활성화, 효소 발현 수준 및 조효소 A 및 NAD+와 같은 보조인자의 가용성을 포함한 여러 메커니즘을 통해 조절됩니다. 간 균질물에서 지방산 β 산화를 측정하는 분석에서, 세포 용해 및 보조인자의 초생리학적 수준의 일반적인 첨가는 이러한 조절 메카니즘의 효과를 가린다. 또한, 균질물에서 소기관의 완전성은 제어하기가 어렵고 제제마다 크게 다를 수 있습니다. 온전한 원발성 간세포에서 지방산 β산화의 측정은 위의 함정을 극복합니다. 이 프로토콜은 14C표지된 팔미트산과 함께 인큐베이션된 갓 단리된 일차 마우스 간세포의 현탁액에서 지방산 β산화를 측정하는 방법을 기술한다. 배양의 시간 내지 수일을 피함으로써, 이 방법은 먹이를 먹인 마우스에 비해 금식 마우스로부터 분리된 간세포에서 관찰된 지방산 β산화의 활성화를 포함하여 본래의 간장의 단백질 발현 수준 및 대사 경로 활성을 더 잘 보존할 수 있는 장점이 있다.
서문
지방산 β산화는 지질 대사에 필수적인 과정으로식이 요법에서 지방산 합성과 섭취의 균형을 맞추는 이화 경로를 제공합니다. 이 과정은 심장 근육, 신장 피질 및 금식 간을 포함한 여러 장기에 대한 에너지를 생성하고식이 요법, 지방 조직 지방 분해 및 내부 트리글리 세라이드 저장 1,2에서 얻은 지방산을 활용합니다.
β산화 경로를 통한 지방산의 산화는 아세틸-CoA로서 방출되는 한 번에 두 개의 탄소에 의한 지방 아실 사슬의 순차적 단축을 초래하며, 이 과정은 미토콘드리아와 퍼옥시솜 모두에서 발생한다. 대부분의 지방산은 β산화만을 겪지만, 일부는 이 경로에 들어가기 전에 다른 탄소에서 산화됩니다. 예를 들어, 피탄산과 같은 3-메틸-치환 지방산은 α산화 경로에 들어가기 전에 퍼옥시솜에서 β산화에 의해 하나의 탄소의 제거를 겪는다. 유사하게, 일부 지방산은 먼저 소포체에서 말단 메틸기의 산화(ω-oxidation)에 의해 디카르복실산으로 전환되고, β산화에 의해 퍼옥시좀에서 우선적으로 산화된다(3).
특정 소기관에 관계없이, 지방산은 먼저 조효소 A(CoA) 티오에스테르 또는 아실-CoA로 전환되어야 하며, β산화 경로를 통해 산화되어야 한다. 미토콘드리아 매트릭스에서 장쇄 아실-CoAs의 β-산화는 그들의 전좌를 위해 카르니틴 셔틀을 필요로 하며, 여기서 카르니틴 팔미토일트랜스퍼라제 1(CPT1)은 아실-CoAs를 아실카르니틴으로의 전환을 촉매하고, 이 과정4에서 속도 제한 효소이다. 일단 미토콘드리아 매트릭스로 전좌되면, 아실-CoAs는 재형성되어 미토콘드리아 β산화 기계장치의 기질 역할을 한다. 금식 상태에서, 간에서 β산화를 통해 생성된 아세틸-CoA는 주로 케토제네시스로 채널링된다. 퍼옥시솜은 매우 긴 사슬, 분지쇄 및 디카르복실산의 β산화를 위한 주요 부위로서 작용한다. 페록시솜은 지방산 기질을 수입하기 위해 카르니틴 셔틀을 필요로하지 않으며, 대신 ATP 결합 카세트 (ABC) 수송체 ABCD1-35의 활성을 통해 특파원 아실-CoAs를 수입합니다. 퍼옥시좀 내에서 아실-CoAs는 미토콘드리아 지방산 β산화 기계와 구별되는 전용 효소 세트에 의해 산화됩니다. 미토콘드리아와 퍼옥시솜 모두 지방 아실 사슬을 산화시키기 위해 NAD+ 와 유리 CoA의 공급이 필요합니다. 간에서의 CoA 수준은 금식에 대한 반응에서 증가하는 것으로 나타났으며, 이 상태6에서 발생하는 지방산 산화의 증가된 속도를 지지한다. 더욱이, 퍼옥시좀에서의 증가된 CoA 분해는 퍼옥시솜 지방산 산화의 선택적 감소를 초래한다7. 따라서, 세포 내 지방산 산화의 과정은 지방산의 활성화, 수송 및 산화에 관여하는 효소의 발현 수준 및 활성뿐만 아니라 여러 세포 구획에 걸친 보조인자 및 다른 대사산물의 농도에 의해 조절된다.
지방산 산화를 측정하기 위해 조직 균질물을 사용하는 절차는 이러한 과정을 조절하고 지원하는 세포 구조를 파괴하여, 생체내 대사를 정확하게 반영하지 않는 데이터의 수집으로 이어진다. 플레이팅된 원발성 간세포를 사용하는 기술이 이 시스템을 보존하는 반면, 단리된 세포를 장기간 배양하는 것은 동물 8,9 내에 여전히 살고 있을 때 세포에 존재했던 생체내 유전자 발현 프로파일의 손실을 초래한다. 다음 프로토콜은 일차 간세포를 분리하고 [1-14C]팔미트산을 사용하여 단리 직후 및 현탁액에서 지방산 β산화에 대한 그들의 능력을 분석하는 방법을 기술한다. 상기 분석은 [1-14C]팔미트산10,11의 β산화에 의해 생성된 아세틸-CoA와 같은 산성 가용성 대사산물(ASM) 또는 생성물과 관련된 방사능의 측정에 기초한다.
프로토콜
마우스 (C57BL / 6J, 남성, 9-11 주령)에 대한 모든 실험 절차는 웨스트 버지니아 대학의 IACUC (Institutional Animal Care and Use Committees)의 승인을 받았다.
1. 간세포 분리
- 준비
- 간세포 분리 전날에, 표 1에 열거된 완충액 및 세포 배양 배지를 준비한다. 수술이 수행 될 곳 근처에서 온도를 37 ° C로 설정한 수조를 설치하십시오.
- 간세포 분리 당일에, 층류 후드 하에서, 완충액 1 35 mL를 멸균 50 mL 원심분리 튜브로 옮기고 70 mL의 완충액 2를 100 mL 멸균 비이커 또는 병으로 옮긴다.
- 항생제 젠타마이신 (50 μg / mL)과 페니실린 / 스트렙토 마이신 (1x)을 두 완충액에 첨가하십시오.
- 단계 1.1.3에서 준비된 완충액 2 20 mL를 100 mm 세포 배양 접시에 옮기고 얼음 위에 놓는다.
- 나머지 50 mL의 버퍼 2를 멸균된 50 mL 원심분리 튜브로 옮긴다. 항생제 보충 완충액 1 및 2를 함유하는 50 mL 튜브를 37°C에서 설정된 수조에 놓고 관류를 시작하기 전에 적어도 15분 동안 예열시킨다.
참고: 세션에서 여러 간세포 분리를 수행하는 경우, 그에 따라 준비하기 위해 버퍼 1과 2의 항생제 보충 분취량의 수를 늘리십시오. - 콜라게나제 용액의 분취량을 해동하고 얼음 위에 보관하십시오.
참고 : 적절하게 보관하면 콜라게나제 용액에서 효소 활성이 크게 손실되지 않으며 최대 3 회 냉동 및 해동되어 준비 후 3 주 이내에 사용됩니다. - 수술 도구와 연동 펌프를 준비하십시오. 연동 펌프의 라인을 15 mL의 70 % 에탄올을 순환시키고 15 mL의 멸균수를 순환시켜 멸균하십시오.
- 22G 바늘을 출구 라인에 연결합니다(그림 1A). 카테터의 빈 필터는 커넥터로 잘 작동합니다. 버퍼 1로 라인을 채우고 선, 커넥터 및 바늘을 검사하여 기포가 갇히지 않도록하십시오.
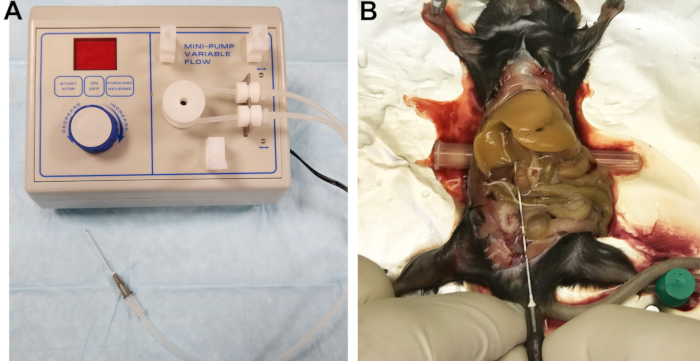
그림 1: 관류 장치 및 관류 간. (A) 간을 캐뉼레이트하고 관류하는 데 사용되는 바늘에 연결된 출구 라인이 있는 연동 펌프. (B) 성공적인 통조림은 간장의 즉각적이고 균질한 블랜칭으로 나타난다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 간 관류와 해리
- 의료용 공기를 캐리어 가스로 사용하여 이소플루란 흡입을 통해 마우스를 마취하고, 유도를 위해 4% 이소플루란을, 마취를 유지하기 위해 1.5% 이소플루란을 사용합니다. 페달 반사의 손실을 평가하여 마취의 깊이를 확인하십시오.
- 발가락 꼬집음에 반응이 없으면 마우스를 수술 보드의 수핀 위치에 놓고 팔다리를 뻗어 핀으로 보드에 고정하십시오.
- 마우스의 복부와 가슴에 70 % 에탄올을 자유롭게 뿌리십시오.
- 포셉을 사용하여 복부 바닥 근처의 피부와 복벽을 당기고 중앙선의 양쪽과 횡격막까지 옆으로 잘라 장기를 노출시킵니다.
- 창자를 오른쪽으로 움직이고 간장의 엽을 부드럽게 뒤집어 열등한 정맥 카바 (IVC)를 노출시킵니다. 바늘 뚜껑과 같은 작은 원통형 물체를 마우스 뒤쪽 아래에 삽입하여 IVC를 약간 기울이고 캐너레이션을 용이하게 합니다(그림 1B).
- 가장 낮은 속도로 펌프를 시작하고 버퍼 1이 흐르면 바늘을 IVC에 삽입하십시오.
- 압력을 완화하고 혈액 및 관류 버퍼의 배수를 허용하기 위해 포털 정맥을 절단 한 다음 즉시 유량을 7 mL / min으로 증가시킵니다. 올바르게 수행하면 간이 몇 초 내에 균일하게 붉어집니다 (그림 1B).
- 보다 일관된 결과를 얻으려면 관류의 전체 기간 동안 바늘을 손으로 잡으십시오.
- 따뜻한 버퍼로 간을 관류하십시오 1. 기포가 유입되지 않도록 하려면 버퍼 1이 포함된 튜브에 삽입된 라인이 지속적으로 침수된 상태로 유지되어야 합니다.
- 관류가 발생하는 동안, 130 μL의 콜라게나제 용액을 완충액 2에 첨가하고, 5 mL 또는 10 mL 혈청학적 피펫으로 위아래로 피펫팅하거나 교반하여 혼합한다.
- 버퍼 1을 포함하는 튜브 내의 부피가 약 5 mL로 감소함에 따라, 튜브의 측면에 피펫팅하여 버퍼 2 5 mL를 버퍼 1에 천천히 첨가한다. 목표는 버퍼 1에서 버퍼 2로 변경하는 동안 라인에 기포가 유입되지 않도록하는 것입니다.
- 부피가 다시 5mL로 줄어들 때까지 기다렸다가 버퍼 2 5mL를 천천히 더 첨가한다. 한 번 더 반복하십시오. 버퍼 2가 버퍼 1을 대체하고 해리가 시작되면 간이 부풀어 오릅니다.
- 나머지 버퍼 2를 원래 버퍼 1을 포함하는 튜브에 추가합니다. 튜브에 약 5-10 mL의 버퍼 2가 남아 있을 때 관류를 중단하십시오.
참고: 버퍼 2가 간을 관류하는 동안, 포털 정맥은 간헐적으로 5초 동안 포셉으로 클램핑될 수 있습니다. 이 단계는 선택 사항이지만 간 전체에 걸친 압력의 결과 증가는 해리를 향상시킬 수 있으며 따라서 최종 간세포 수율을 향상시킬 수 있습니다. - 간을 조심스럽게 절제하고 이를 단계 1.1.4에서 따로 떼어놓은 빙냉 버퍼 2 20 mL가 들어있는 100 mm 배양 접시로 옮긴다.
- 층류 후드 아래에서 외과 용 가위와 핀셋을 사용하여 간을 부드럽게 분리하십시오.
- 간세포 현탁액에 빙냉 M199 약 20 mL를 첨가하고 주사기의 플런저를 사용하여 100 μm 세포 스트레이너를 통해 여과하여 더 큰 간 조각으로부터 추가적인 간세포의 방출을 부드럽게 촉진한다.
- 수집 튜브가 가득 찰 때까지 100 mm 배양 접시 및 세포 스트레이너를 추가 M199로 세척하십시오.
- 현탁액을 4°C에서 2분 동안 50 x g 에서 원심분리한다. 상청액을 조심스럽게 흡인하고, 소용돌이치면서 차가운 M199 30 mL의 간세포 펠릿을 부드럽게 재현탁시킨다.
- 단계 1.2.18에서 언급된 바와 같이 간세포를 펠릿화한다. 세척을 한 번 더 반복하십시오.
- 간세포를 따뜻한 M199 10 mL에 재현탁시키고, 트리판 블루 배제 방법 및 혈구측정기(12)를 사용하여 생존능 및 수율을 결정한다.
- 세포를 37ºC로 가온하여 1.0 x 106 생존 세포/mL의 최종 농도로 가온한 M199에 세포를 희석하고 즉시 분석을 시작하십시오.
2. 지방산 β산화 분석
참고: 이 분석은 삼중으로 수행되며, 각 반응 혼합물은 2mL의 최종 부피로 750,000 세포, 1.35 mg/mL 소 혈청 알부민 (BSA), 100 μM 팔미트산 및 0.4 μCi [1-14C]팔미트산을 함유한다.
주의: 방사성 화합물은 위험합니다. 방사성 물질을 구매, 취급, 저장 및 폐기하는 것은 기관, 주 및 연방 규정에 따라 이루어집니다.
- 준비
- 분석 전날에, 팔미트산 및 BSA 용액(표 1)을 준비하고, 이를 -20°C에서 저장한다.
- 분석의 날에 간 관류를 시작하기 전에 2.1.3-2.1.9 단계를 완료하십시오.
- 팔미트산과 BSA 용액을 해동하십시오. 20%-30% 초과를 더한 다중 반응에 대해 기질 혼합물을 제조하고, 표 2에 나타낸 전형적인 분석 셋업을 갖는다.
- 반응당 BSA 용액 13.5 μL를 마이크로원심분리 튜브에서 분취량하고 41°C로 가온한 다음, 반응 당 1 μL의 200 mM 팔미트산 용액 (BSA:팔미트산 몰비 = 1:5)을 첨가하였다.
참고 : 방사성 및 비 방사성 팔미트산 용액과 같은 유기 용매를 사용하여 준비된 용액을 양의 변위 피펫과 적절한 팁으로 분배하는 것이 바람직합니다. - 소용돌이는 가용성 팔미트산:BSA 복합체의 형성을 용이하게 하기 위해 41°C에서 격렬하게 인큐베이션한다. 잠복기 동안 때때로 소용돌이.
- 혼합물은 처음에는 흐린 것처럼 보이지만 41 °C에서 20-30 분 인큐베이션 한 후에 완전히 명확해질 것입니다. 반응을 시작할 준비가 될 때까지 41°C에서 보관한다.
- 1.5 mL 마이크로원심분리 튜브에 1 M 과염소산의 133 μL를 분취하여 반응을 정지시켰다.
주의: 과염소산은 강한 산과 강한 산화제입니다. 이 화합물을 취급하기 위해서는 적절한 보호 장비가 필요합니다. - 반응 당 485.5 μL의 M199 분취량을 튜브에 넣고 37°C로 유지하여 방사성 BSA를 희석시킨다: 반응 개시 전에 단계 2.1.4-2.1.6에서 제조된 팔미트산 복합체.
- 750 μL의 M199를 샘플만큼 많은 14 mL 둥근 바닥 튜브에 분주하십시오. 원하는 경우, 비히클 조절을 포함하는 지방산 β산화의 억제제, 예컨대 에토목시르, 로테논, 및 안티마이신을 추가로 포함한다(표 2).
- 간세포 세척 단계 동안, 반응을 개시하기 10-15분 전에, 단계 2.1.9에서 제조된 튜브를 37°C로 설정된 진탕 수조로 옮기고 180-200 rpm에서 진탕시킨다.
- 지방산 β산화 반응 시작, 정지 및 분석
- 간세포의 생존력이 허용되는 경우(전형적으로 ≥ 75%, 그림 2), 각 반응에 대해 0.8 μL의 [1-14C]팔미트산(0.5 mCi/mL)을 명확히 된 BSA: 팔미트산 용액이 포함된 미세원심분리 튜브로 옮긴다(단계 2.1.4-2.1.6). 소용돌이를 일으키고 41°C에서 수조로 복귀한다.
- 간세포를 37°C로 평형화시키고 이를 억제제와 함께 예비인큐베이션하여(존재하는 경우), 최종 간세포 재현탁 직후(단계 1.2.21), 간세포 현탁액 750 μL를 1 mL 피펫으로 옮기고 진탕 수조에서 14 mL 둥근바닥 튜브 각각에 옮기고(단계 2.1.9-2.1.10) 저속으로 간단히 와류시킨다.
- 각각의 첨가물을 30 s씩 스태거링하고 15분 동안 인큐베이션한다. 단백질 결정을 위한 샘플을 저장하려면, 간세포의 또 다른 분취량을 1.5 mL 마이크로원심분리 튜브로 옮기고 3,000 x g에서 5분 동안 스핀한다.
참고: 분배하는 동안, 간세포 현탁액은 지속적으로 소용돌이치거나 분주 1 mL 피펫으로 부드럽게 교반하여 침전 및 샘플 간 세포 수의 큰 변동을 방지해야 합니다. - 상층액을 제거하고 시료 중의 단백질 총량을 측정할 준비가 될 때까지 -80°C에서 펠렛을 보관하여 결과를 정상화한다(도 3).
- 간세포가 37°C에서 예비 인큐베이션 하에 있는 동안, 방사성 BSA:팔미트산 복합체를 2.1.8의 따뜻한 배지에 첨가하고, 반응을 시작할 준비가 될 때까지 37°C에서 유지한다. 이것이 최종 기판 혼합물입니다.
- 반응을 시작하려면 수조에서 간세포를 제거하고 500μL의 기질 혼합물을 첨가하십시오.
- 5 초 동안 저속으로 소용돌이가 세포를 완전히 재현탁시키고 수조로 돌아갑니다. 모든 샘플과 함께 반복하여 30 초 간격으로 비틀 거립니다.
- 15분 동안 인큐베이션한다. 일련의 반응을 시작하고 즉시 중지(단계 2.2.10-2.2.11 참조)하여 배경 방사능을 확인합니다(표 2).
- 남은 기질 믹스의 중복 분취량(200-250 μL)을 6 mL 섬광 바이알로 옮기고 계수하도록 따로 놓는다. 이 카운트를 사용하여 500 μL의 기질 믹스에서 산화에 사용 가능한 팔미트산의 총 nmoles에 해당하는 방사능을 계산하십시오.
- 반응을 중지하려면 수조에서 간세포를 제거하고 적당한 속도로 볼텍싱하여 간세포를 재현탁 한 다음 간세포 현탁액 400 μL를 과염소산을 함유 한 마이크로 원심분리 튜브로 옮깁니다.
- 즉시 튜브를 뚜껑을 덮으십시오. 모든 샘플에 대해 이 시퀀스를 반복하여 30초씩 비틀거립니다.
- 1.5 mL 마이크로원심분리 튜브를 격렬하게 와류하고, 이를 13,000 x g 에서 10분 동안 1.5 mL 마이크로원심분리 튜브 아래로 스핀시킨다.
- 상청액 300 μL를 6 mL 섬광 바이알에 옮기고, 4 mL의 섬광 유체를 첨가하고, 섬광 계수기에서 샘플 및 기질 혼합 분취액(단계 2.2.9)에서의 방사능을 계수한다.
주의: 원심분리 후, 지방산 β산화에 의해 생성되고 산성 조건에 의해 방출되는 14C-아세틸-CoA의 완전한 산화에 의해 생성된 14C-CO2를 호흡하지 않도록 흄 후드 하에서 튜브를 개방한다.
| 버퍼/미디어 구성 요소 | 분량 | 최종 집중 | 지시 |
| 솔루션 C | |||
| 증권 시세 표시기 | 1.79 지 | 480 밀리지미터 | 50 mL에 물을 넣으십시오. 4 °C에서 보관 |
| MgSO4 헵타하이드레이트 | 1.48 지 | 120 밀리지미터 | |
| KH2PO4 | 0.81 지 | 119 밀리지미터 | |
| 크렙스-헨셀릿 버퍼(KHB), 무칼슘 | |||
| 나클 | 7.0 지 | 120 밀리지미터 | 900 mL에 물을 첨가하고, pH를 7.4로 조정하고, 최종 부피를 1 L로 가져와 4°C에서 보관한다. |
| 나HCO3 | 2.0 지 | 24 밀리지미터 | |
| 1 M 헤페스 pH 7.45 | 5 mL | 5 밀리지미터 | |
| 포도당 | 1 또는 2 g | 5.6 또는 11 mM | |
| 솔루션 C | 10 mL | ||
| 버퍼 1 | |||
| 증권 시세 표시기 | 500 mL | 구성 요소를 혼합하고 필터를 멸균하십시오. 4 °C에서 보관 | |
| 50 밀리지멘트 EGTA | 1.0 mL | 0.1 밀리지미터 | |
| 버퍼 2 | |||
| 증권 시세 표시기 | 500 mL | 구성 요소를 혼합하고 필터를 멸균하십시오. 4 °C에서 보관 | |
| 1 MCaCl2 이수화물 | 686 μL | 1.4 밀리지미터 | |
| 겐타미신 용액 | |||
| 겐타미신 황산염 | 0.5 지 | 50 밀리그램/mL | 10 mL에 물을 넣고 필터를 살균하십시오. 분취량 및 -20°C에서 저장 |
| 콜라게나제 용액 | |||
| 콜라게나제 I과 II 블렌드 | 10 밀리그램 | 7 밀리그램/mL | 바이알의 전체 내용물을 1.43 mL의 물에 녹인다. 분취량 및 -20°C에서 저장 |
| M199 | |||
| M199 | 파우치 1개 | 900 mL에 물을 첨가하고 pH를 7.2-7.4로 조정한다. 최종 부피를 1L로 가져 와서 필터를 멸균하십시오. 4 °C에서 보관 | |
| 나HCO3 | 2.2 지 | 26 밀리지미터 | |
| 1 M HEPES (세포 배양 등급) | 25 mL | 25 밀리지미터 | |
| 추가 포도당 (먹이를 먹인 마우스에만 해당) | 1 g | 11 밀리지미터 | |
| BSA 솔루션 | |||
| 무지방산 BSA | 400 밀리그램 | 20% (승 / v) | 2 mL의 물에 녹인다. 분취량 및 -20°C에서 저장 |
| 비방사성 팔미트산 용액 | |||
| 팔미트산 | 103 밀리그램 | 200 밀리미터 | 에탄올 2 mL에 녹이고 -20°C에서 보관하십시오. |
| 1 M 과염소산 | |||
| 70% 과염소산 | 3.5 mL | 1 엠 | 40 mL의 물에 희석하십시오. 실온에서 보관 |
표 1: 간세포 분리 및 지방산 β산화 분석에 필요한 완충액, 배지 및 기타 용액
| 반응 수 | M199 ± 억제제 | 간세포 현탁액 (μL) | 기판 혼합물 (μL) | ||||
| 부피 (μL) | 에토목시르 | ||||||
| 1 | 750 | - | 37°C에서 예열 | 750 | 예비-인큐베이트 37°C에서 15분 동안 | 500 | 37°C에서 15분 동안 인큐베이션 |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | 즉시 중지 | |||||
| 8 | |||||||
| 9 | |||||||
표 2: 에토목시르의 존재 및 부재 하에 삼중으로 분석된 간세포 현탁액에 대한 실험 셋업의 예.
결과
여기에 설명 된 간 관류는 일반적으로 트리판 블루 배제로 추정 된 바와 같이 평균 생존율이 80 %인 30-40 백만 세포 / 간을 산출합니다 (그림 2). 관류 완충액 1 및 2를 제조하는데 사용되는 크렙스-헨셀릿 완충액(KHB) 내의 글루코스의 전형적인 농도는 11 mM이다. 공복 마우스로부터 분리된 간세포에서 지방산 β산화를 측정할 때, KHB 내의 글루코스의 농도는 공복 상태를 더 잘 나타...
토론
간 관류 중에는 기포가 간에서 미세 모세 혈관을 차단하고 완충액 순환을 예방하거나 제한하며 간세포 수율과 생존력을 전반적으로 감소시키기 때문에 기포의 도입을 피하는 것이 중요합니다20,21. IVC의 캐뉼레이션 전에 버퍼 충전된 유입 라인을 면밀히 검사하고, 본원에 기술된 바와 같이, 버퍼 1을 포함하는 튜브로부터 유입 라인을 들어 올려 버퍼 2로...
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 연구는 Roberta Leonardi에게 국립 보건원 보조금 R35GM119528에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
참고문헌
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유