Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de la β-oxidación de ácidos grasos en una suspensión de hepatocitos de ratón recién aislados
* Estos autores han contribuido por igual
En este artículo
Resumen
La β oxidación de ácidos grasos es una vía metabólica esencial responsable de generar energía en muchos tipos de células diferentes, incluidos los hepatocitos. Aquí, describimos un método para medir la β oxidación de ácidos grasos en hepatocitos primarios recién aislados utilizando ácido palmítico marcado con 14C.
Resumen
La β oxidación de ácidos grasos es una vía metabólica clave para satisfacer las demandas de energía del hígado y proporcionar sustratos y cofactores para procesos adicionales, como la cetogénesis y la gluconeogénesis, que son esenciales para mantener la homeostasis de la glucosa de todo el cuerpo y apoyar la función de los órganos extrahepáticos en el estado de ayuno. La β oxidación de ácidos grasos ocurre dentro de las mitocondrias y los peroxisomas y se regula a través de múltiples mecanismos, incluida la absorción y activación de ácidos grasos, los niveles de expresión enzimática y la disponibilidad de cofactores como la coenzima A y NAD +. En los ensayos que miden la β oxidación de ácidos grasos en homogeneizados hepáticos, la lisis celular y la adición común de niveles suprafisiológicos de cofactores enmascaran los efectos de estos mecanismos reguladores. Además, la integridad de los orgánulos en los homogeneizados es difícil de controlar y puede variar significativamente entre preparaciones. La medición de la β oxidación de ácidos grasos en hepatocitos primarios intactos supera las trampas anteriores. Este protocolo describe un método para la medición de la β oxidación de ácidos grasos en una suspensión de hepatocitos primarios de ratón recién aislados incubados con ácido palmítico marcado con 14C. Al evitar horas o días de cultivo, este método tiene la ventaja de preservar mejor los niveles de expresión de proteínas y la actividad de la vía metabólica del hígado original, incluida la activación de la β oxidación de ácidos grasos observada en hepatocitos aislados de ratones en ayunas en comparación con ratones alimentados.
Introducción
La β-oxidación de ácidos grasos es un proceso esencial en el metabolismo de los lípidos, proporcionando una vía catabólica para equilibrar la síntesis de ácidos grasos y la ingesta de la dieta. Este proceso genera energía para múltiples órganos, incluidos el músculo cardíaco, la corteza renal y el hígado en ayunas, y utiliza ácidos grasos obtenidos de la dieta, la lipólisis del tejido adiposo y las reservas internas de triglicéridos 1,2.
La oxidación de los ácidos grasos a través de la vía de β-oxidación da como resultado el acortamiento secuencial de la cadena de acilo graso por dos carbonos a la vez, liberados como acetil-CoA, y este proceso ocurre tanto en las mitocondrias como en los peroxisomas. Mientras que la mayoría de los ácidos grasos sufren sólo β-oxidación, algunos se oxidan en diferentes carbonos antes de entrar en esta vía. Por ejemplo, los ácidos grasos sustituidos por 3-metilo, como el ácido fitánico, se someten a la eliminación de un carbono por α-oxidación en los peroxisomas antes de entrar en la vía de β-oxidación. Del mismo modo, algunos ácidos grasos se convierten primero en ácidos grasos dicarboxílicos por oxidación del grupo metilo terminal (ω-oxidación) en el retículo endoplásmico antes de ser oxidados preferentemente en los peroxisomas por β-oxidación3.
Independientemente del orgánulo específico, un ácido graso primero debe convertirse en un tioéster de coenzima A (CoA), o acil-CoA, para oxidarse a través de la vía de β oxidación. β-Oxidación de acil-CoAs de cadena larga en la matriz mitocondrial requiere el transbordador de carnitina para su translocación, donde la carnitina palmitoiltransferasa 1 (CPT1) cataliza la conversión de acil-CoAs en acilcarnitinas y es la enzima limitante de velocidad en este proceso4. Una vez translocados a la matriz mitocondrial, los acil-CoAs se vuelven a formar y sirven como sustratos para la maquinaria mitocondrial de β-oxidación. En el estado de ayuno, el acetil-CoA producido a través de la β-oxidación en las mitocondrias hepáticas se canaliza principalmente a la cetogénesis. Los peroxisomas sirven como el sitio principal para la β-oxidación de los ácidos grasos de cadena muy larga, cadena ramificada y dicarboxílicos. Los peroxisomas no requieren el transbordador de carnitina para importar sustratos de ácidos grasos, sino que importan los correspondientes acilo-CoAs a través de la actividad de los transportadores de casete de unión a ATP (ABC) ABCD1-35. Dentro de los peroxisomas, los acil-CoAs son oxidados por un conjunto dedicado de enzimas, distintas de la maquinaria de β oxidación de ácidos grasos mitocondriales. Tanto las mitocondrias como los peroxisomas también requieren un suministro de NAD + y CoA libre para oxidar las cadenas de acilo graso. Se ha demostrado que los niveles de CoA en el hígado aumentan en respuesta al ayuno, lo que respalda el aumento de la tasa de oxidación de ácidos grasos que ocurre en este estado6. Además, el aumento de la degradación de CoA en los peroxisomas resulta en una disminución selectiva de la oxidación de ácidos grasos peroxisomales7. Por lo tanto, el proceso de oxidación de ácidos grasos dentro de la célula está regulado por los niveles de expresión y las actividades de las enzimas involucradas en la activación, transporte y oxidación de los ácidos grasos, así como las concentraciones de cofactores y otros metabolitos a través de múltiples compartimentos subcelulares.
Los procedimientos que utilizan homogeneizados de tejidos para medir la oxidación de ácidos grasos destruyen la arquitectura celular que regula y apoya este proceso, lo que lleva a una recopilación de datos que no reflejan con precisión el metabolismo in vivo. Si bien las técnicas que utilizan hepatocitos primarios chapados preservan este sistema, el cultivo de células aisladas durante largos períodos de tiempo resulta en una pérdida del perfil de expresión génica in vivo que estaba presente en las células cuando todavía vivían dentro del animal 8,9. El siguiente protocolo describe un método para aislar los hepatocitos primarios y evaluar su capacidad de β-oxidación de ácidos grasos inmediatamente después del aislamiento y en suspensión, utilizando [1-14C]ácido palmítico. El ensayo se basa en la medición de la radiactividad asociada con los metabolitos solubles en ácido (MAPE) o productos, como el acetil-CoA, producidos por la β-oxidación del ácido palmítico [1-14C]10,11.
Protocolo
Todos los procedimientos experimentales en ratones (C57BL / 6J, machos, 9-11 semanas de edad) fueron aprobados por los Comités Institucionales de Cuidado y Uso de Animales (IACUC) de la Universidad de Virginia Occidental.
1. Aislamiento de hepatocitos
- Preparación
- En los días previos al aislamiento de hepatocitos, preparar los tampones y medios de cultivo celular enumerados en la Tabla 1. Configure un baño de agua con la temperatura establecida a 37 ° C cerca de donde se realizará la cirugía.
- El día del aislamiento de hepatocitos, bajo una campana de flujo laminar, transfiera 35 ml de Buffer 1 a un tubo de centrífuga estéril de 50 ml y 70 ml de tampón 2 a un vaso de precipitados o botella estéril de 100 ml.
- Añadir antibióticos gentamicina (50 μg/ml) y penicilina/estreptomicina (1x) a ambos tampones.
- Transfiera 20 ml de Buffer 2 como se preparó en el paso 1.1.3 a una placa de cultivo celular de 100 mm y colóquela en hielo.
- Transfiera los 50 ml restantes de Buffer 2 a un tubo de centrífuga estéril de 50 ml. Coloque los tubos de 50 ml que contienen los Tampones 1 y 2 suplementados con antibióticos en un baño de agua a 37 ° C y déjelos calentarse durante al menos 15 minutos antes de comenzar la perfusión.
NOTA: Si realiza múltiples aislamientos de hepatocitos en una sesión, aumente el número de alícuotas suplementadas con antibióticos de Buffers 1 y 2 para prepararse en consecuencia. - Descongele una alícuota de solución de colagenasa y manténgala en hielo.
NOTA: Si se almacena adecuadamente, no hay una pérdida significativa de la actividad enzimática en las soluciones de colagenasa congeladas y descongeladas hasta 3 veces y utilizadas dentro de las 3 semanas posteriores a la preparación. - Preparar el instrumental quirúrgico y la bomba peristáltica. Esterilizar las líneas de la bomba peristáltica haciendo circular 15 mL de etanol al 70%, seguido de 15 mL de agua estéril.
- Conecte una aguja de 22 G a la línea de salida (Figura 1A). El filtro ahuecado de un catéter funciona bien como conector. Llene las líneas con Buffer 1 e inspeccione las líneas, el conector y la aguja para asegurarse de que no queden atrapadas las burbujas de aire.
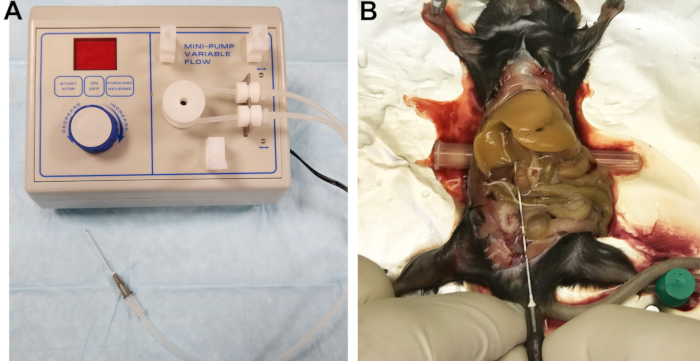
Figura 1: Aparato de perfusión e hígado perfundido. (A) Bomba peristáltica con línea de salida conectada a la aguja utilizada para cannular y perfundir el hígado. (B) La canulación exitosa está indicada por el blanqueamiento inmediato y homogéneo del hígado. Haga clic aquí para ver una versión más grande de esta figura.
- Perfusión hepática y disociación
- Anestesiar a un ratón a través de la inhalación de isoflurano con aire de grado médico como gas portador, utilizando 4% de isoflurano para la inducción y 1,5% de isoflurano para mantener la anestesia. Verificar la profundidad de la anestesia evaluando la pérdida del reflejo del pedal.
- Cuando no haya respuesta al pellizco del dedo del pie, coloque al ratón en posición supina sobre una tabla de cirugía, extienda las extremidades y asegúrelas a la tabla con alfileres.
- Rocíe generosamente el abdomen y el pecho del ratón con etanol al 70%.
- Usando fórceps, levante la piel y la pared abdominal cerca de la base del abdomen y corte lateralmente, a cada lado de la línea media y hasta el diafragma, para exponer los órganos.
- Exponga la vena cava inferior (IVC) moviendo los intestinos hacia el lado derecho y volteando suavemente los lóbulos del hígado hacia arriba. Inserte un pequeño objeto cilíndrico, como una tapa de aguja, debajo de la parte posterior del ratón para inclinar ligeramente el IVC y facilitar su canulación (Figura 1B).
- Arranque la bomba a la velocidad más baja y, con buffer 1 fluyendo, inserte la aguja en el IVC.
- Corte la vena porta para aliviar la presión y permitir el drenaje de sangre y los tampones de perfusión, luego aumente inmediatamente la tasa de flujo a 7 ml / min. Si se hace correctamente, el hígado se blanqueará uniformemente en unos pocos segundos (Figura 1B).
- Para obtener resultados más consistentes, mantenga la aguja en posición con la mano durante toda la duración de la perfusión.
- Perfundir el hígado con Tampón caliente 1. Para evitar la introducción de burbujas de aire, asegúrese de que la línea insertada en el tubo que contiene Buffer 1 permanezca continuamente sumergida.
- Mientras se produce la perfusión, agregue 130 μL de solución de colagenasa a Buffer 2 y mezcle mediante pipeteo hacia arriba y hacia abajo o revolviendo con una pipeta serológica de 5 ml o 10 ml.
- A medida que el volumen en el tubo que contiene buffer 1 disminuye a aproximadamente 5 mL, agregue lentamente 5 mL de Buffer 2 a Buffer 1 mediante pipeteo en el costado del tubo. El objetivo es evitar la introducción de burbujas de aire en la línea mientras se cambia de Buffer 1 a Buffer 2.
- Espere hasta que el volumen disminuya nuevamente a 5 ml y agregue lentamente otros 5 ml de buffer 2. Repite una vez más. A medida que el Buffer 2 reemplaza al Buffer 1 y comienza la disociación, el hígado se hinchará.
- Agregue el Buffer 2 restante al tubo que originalmente contenía el Buffer 1. Detenga la perfusión cuando queden aproximadamente 5-10 ml de Buffer 2 en el tubo.
NOTA: Mientras que Buffer 2 está perfundiendo el hígado, la vena porta se puede sujetar intermitentemente con fórceps durante 5 s. Este paso es opcional, pero el aumento resultante de la presión en todo el hígado puede mejorar su disociación y, por lo tanto, el rendimiento final de los hepatocitos. - Extirpe cuidadosamente el hígado y transfiéralo al plato de cultivo de 100 mm que contiene los 20 ml de Buffer 2 helado reservados en el paso 1.1.4.
- Debajo de la capucha de flujo laminar, rompa suavemente el hígado con tijeras quirúrgicas y pinzas.
- Agregue aproximadamente 20 ml de M199 helado a la suspensión de hepatocitos y filtre a través de un colador de células de 100 μm utilizando el émbolo de una jeringa para promover suavemente la liberación de hepatocitos adicionales de piezas hepáticas más grandes.
- Lave la placa de cultivo de 100 mm y el colador celular con M199 adicional hasta que el tubo de recolección esté lleno.
- Centrifugar la suspensión a 50 x g durante 2 min a 4 °C. Aspire cuidadosamente el sobrenadante y resuspenda suavemente el pellet de hepatocitos en 30 ml de frío M199 girando.
- Pellet los hepatocitos como se menciona en el paso 1.2.18. Repita el lavado una vez más.
- Resuspend los hepatocitos en 10 mL de M199 caliente y determinar la viabilidad y el rendimiento utilizando el método de exclusión de azul tripano y un hemocitómetro12.
- Diluir las células en M199 calentadas a 37 ºC a una concentración final de 1,0 x 106 células viables/ml e iniciar inmediatamente el ensayo.
2. Ensayo de β oxidación de ácidos grasos
NOTA: El ensayo se realiza por triplicado, y cada mezcla de reacción contiene 750.000 células, 1,35 mg/ml de albúmina sérica bovina (BSA), 100 μM de ácido palmítico y 0,4 μCi [1-14C]de ácido palmítico en un volumen final de 2 ml.
PRECAUCIÓN: Los compuestos radiactivos son peligrosos. Comprar, manipular, almacenar y desechar material radiactivo de acuerdo con las regulaciones institucionales, estatales y federales.
- Preparación
- En los días previos al ensayo, preparar las soluciones de ácido palmítico y BSA (Tabla 1) y almacenarlas a -20 °C.
- El día del ensayo, complete los pasos 2.1.3-2.1.9 antes de comenzar la perfusión hepática.
- Descongele las soluciones de ácido palmítico y BSA. Prepare la mezcla de sustrato para múltiples reacciones más un exceso del 20% al 30%, con una configuración de ensayo típica que se muestra en la Tabla 2.
- Alícuota de 13,5 μL de solución de BSA por reacción en un tubo de microcentrífuga y caliente a 41 °C, luego agregue 1 μL de la solución de ácido palmítico de 200 mM (BSA: relación molar de ácido palmítico = 1:5) por reacción.
NOTA: Es preferible dispensar soluciones preparadas con disolventes orgánicos, como las soluciones de ácido palmítico radiactivo y no radiactivo, con una pipeta de desplazamiento positivo y puntas apropiadas. - Vórtice vigorosamente e incube a 41 °C para facilitar la formación del ácido palmítico soluble: complejo BSA. Vórtice ocasionalmente durante el período de incubación.
- La mezcla aparecerá inicialmente turbia, pero se aclarará por completo después de 20-30 min de incubación a 41 °C. Manténgalo a 41 °C hasta que esté listo para iniciar las reacciones.
- Alícuota de 133 μL de ácido perclórico 1 M en tubos de microcentrífuga de 1,5 ml para detener las reacciones.
PRECAUCIÓN: El ácido perclórico es un ácido fuerte y un oxidante fuerte. Se requiere un equipo de protección adecuado para manejar este compuesto. - Alícuota 485,5 μL de M199 por reacción en un tubo y manténgala a 37 °C para diluir el BSA radiactivo: complejo de ácido palmítico preparado en los pasos 2.1.4-2.1.6 antes de iniciar las reacciones.
- Dispensar 750 μL de M199 en tantos tubos de fondo redondo de 14 ml como las muestras. Si lo desea, agregue inhibidores de la β oxidación de ácidos grasos, como etomoxir, rotenona y antimicina, incluido un control vehicular (Tabla 2).
- Durante los pasos de lavado de hepatocitos, 10-15 min antes de comenzar las reacciones, transfiera los tubos preparados en el paso 2.1.9 a un baño de agua agitado a 37 ° C y agitando a 180-200 rpm.
- Iniciar, detener y analizar las reacciones de β oxidación de ácidos grasos
- Si la viabilidad de los hepatocitos es aceptable (típicamente ≥ 75%, Figura 2), para cada reacción, transfiera 0,8 μL de [1-14 C]ácido palmítico (0,5 mCi/mL) al tubo de la microcentrífuga que contiene el BSA clarificado: solución de ácido palmítico (pasos 2.1.4-2.1.6). Vórtice y vuelva al baño de agua a 41 °C.
- Para equilibrar los hepatocitos a 37 °C y preincubarlos con inhibidores (si están presentes), inmediatamente después de la resuspensión final de hepatocitos (paso 1.2.21), transfiera 750 μL de la suspensión de hepatocitos con una pipeta de 1 ml a cada uno de los tubos de fondo redondo de 14 ml en el baño de agua agitadora (pasos 2.1.9-2.1.10) y vórtice brevemente a baja velocidad para mezclar.
- Escalona cada adición por 30 s e incuba durante 15 min. Para guardar una muestra para la determinación de proteínas, transfiera otra alícuota de hepatocitos a un tubo de microcentrífuga de 1,5 ml y gire a 3.000 x g durante 5 min.
NOTA: Durante la dispensación, la suspensión de hepatocitos debe girarse continuamente o agitarse suavemente con la pipeta dispensadora de 1 ml para evitar la sedimentación y la gran variabilidad en el número de células entre las muestras. - Retire el sobrenadante y guarde el pellet a -80 °C hasta que esté listo para medir la cantidad total de proteína en la muestra para normalizar los resultados (Figura 3).
- Mientras los hepatocitos están en preincubación a 37 °C, agregue el complejo radiactivo BSA: ácido palmítico al medio caliente en 2.1.8, y manténgase a 37 ° C hasta que esté listo para comenzar las reacciones. Esta es la mezcla final de sustrato.
- Para iniciar las reacciones, retire los hepatocitos del baño de agua y agregue 500 μL de mezcla de sustrato.
- Vórtice a baja velocidad durante 5 s para resuspendir completamente las células y volver al baño de agua. Repetir con todas las muestras, escalonando por 30 s.
- Incubar durante 15 min. Inicie un conjunto de reacciones y deténgase inmediatamente (consulte los pasos 2.2.10-2.2.11) para determinar la radiactividad de fondo (Tabla 2).
- Transfiera las alícuotas duplicadas (200-250 μL) de la mezcla de sustrato sobrante a viales de centelleo de 6 ml y reservar para contar. Utilice estos recuentos para calcular la radiactividad correspondiente al total de nmoles de ácido palmítico disponibles para la oxidación en 500 μL de mezcla de sustrato.
- Para detener las reacciones, retire los hepatocitos del baño de agua, resuspenda los hepatocitos por vórtice a velocidad moderada y luego transfiera 400 μL de la suspensión de hepatocitos a los tubos de microcentrífuga que contienen ácido perclórico.
- Tapa inmediatamente los tubos. Repita esta secuencia para todas las muestras, escalonando en 30 s.
- Vórtice vigorosamente los tubos de microcentrífuga de 1,5 ml y hágalos girar por los tubos de microcentrífuga de 1,5 ml a 13.000 x g durante 10 minutos.
- Transfiera 300 μL del sobrenadante a un vial de centelleo de 6 ml, agregue 4 ml de líquido de centelleo y cuente la radiactividad en las muestras y las alícuotas de la mezcla de sustrato (paso 2.2.9) en un contador de centelleo.
PRECAUCIÓN: Después de la centrifugación, abra los tubos bajo una campana de humos para evitar respirar los 14C-CO2 producidos por la oxidación completa de 14C-acetil-CoA generados por el ácido graso β-oxidación y liberados por las condiciones ácidas.
| Búferes/componentes multimedia | Importe | Concentración final | Instrucciones |
| Solución C | |||
| Kcl | 1,79 g | 480 metros | Añadir agua a 50 ml. Conservar a 4 °C |
| MgSO4 heptahidrato | 1,48 g | 120 metros | |
| KH2PO4 | 0,81 g | 119 metros | |
| Krebs-Henseleit Buffer (KHB), libre de calcio | |||
| NaCl | 7,0 g | 120 metros | Agregue agua a 900 ml, ajuste el pH a 7.4 y lleve el volumen final a 1 L. Almacene a 4 ° C |
| NaHCO3 | 2,0 g | 24 metros | |
| 1 M HEPES pH 7,45 | 5 ml | 5 mM | |
| Glucosa | 1 o 2 g | 5,6 o 11 mM | |
| Solución C | 10 ml | ||
| Búfer 1 | |||
| KHB | 500 ml | Mezcle los componentes y esterilice el filtro. Conservar a 4 °C | |
| EGTA de 50 mM | 1,0 ml | 0,1 mM | |
| Búfer 2 | |||
| KHB | 500 ml | Mezcle los componentes y esterilice el filtro. Conservar a 4 °C | |
| 1 M CaCl2 dihidratado | 686 μL | 1,4 mM | |
| Solución de gentamicina | |||
| Sulfato de gentamicina | 0,5 g | 50 mg/ml | Agregue agua a 10 ml y esterilice con filtro. Alícuota y conservación a -20 °C |
| Solución de colagenasa | |||
| Mezcla de colagenasa I y II | 10 mg | 7 mg/ml | Disolver todo el contenido del vial en 1,43 ml de agua. Alícuota y conservación a -20 °C |
| M199 | |||
| M199 | 1 bolsa | Agregue agua a 900 ml y ajuste el pH a 7.2-7.4. Llevar el volumen final a 1 L y esterilizar con filtro. Conservar a 4 °C | |
| NaHCO3 | 2,2 g | 26 mM | |
| 1 M HEPES (grado de cultivo celular) | 25 ml | 25 mM | |
| Glucosa extra (solo para ratones alimentados) | 1 g | 11 metros | |
| Solución BSA | |||
| BSA libre de ácidos grasos | 400 mg | 20% (p/v) | Disolver en 2 mL de agua. Alícuota y conservación a -20 °C |
| Solución de ácido palmítico no radiactivo | |||
| Ácido palmítico | 103 mg | 200 mM | Disolver en 2 ml de etanol, conservar a -20 °C |
| 1 M Ácido perclórico | |||
| 70% ácido perclórico | 3,5 ml | 1 M | Diluir a 40 ml con agua. Conservar a temperatura ambiente |
Tabla 1: Tampones, medios y otras soluciones necesarias para el aislamiento de hepatocitos y el ensayo de β oxidación de ácidos grasos
| Número de reacción | Inhibidores de la ± M199 | Suspensión de hepatocitos (μL) | Mezcla de sustrato (μL) | ||||
| Volumen (μL) | Etomoxir | ||||||
| 1 | 750 | - | Precalentamiento a 37 °C | 750 | Preincubar a 37 °C durante 15 min | 500 | Incubar a 37 °C durante 15 min |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | Deténgase inmediatamente | |||||
| 8 | |||||||
| 9 | |||||||
Tabla 2: Ejemplo de la configuración experimental para una suspensión de hepatocitos ensayada por triplicado en presencia y ausencia de etomoxir.
Resultados
La perfusión hepática descrita aquí típicamente produce 30-40 millones de células / hígado con una viabilidad promedio del 80%, según lo estimado por la exclusión del azul de tripano (Figura 2). La concentración típica de glucosa en el tampón Krebs-Henseleit (KHB), que se utiliza para preparar los tampones de perfusión 1 y 2, es de 11 mM. Al medir la β oxidación de ácidos grasos en hepatocitos aislados de ratones en ayunas, la concentración de glucosa en el KHB se puede reduc...
Discusión
Durante la perfusión hepática, es fundamental evitar la introducción de burbujas de aire, ya que bloquean los microcapilarios en el hígado, impidiendo o restringiendo la circulación tampón y disminuyendo en general el rendimiento y la viabilidad de los hepatocitos20,21. Las precauciones, como inspeccionar de cerca la línea de entrada llena de tampón antes de la canulación del IVC y evitar levantar la línea de entrada del tubo que contiene el tampón 1 p...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención R35GM119528 de los Institutos Nacionales de Salud a Roberta Leonardi.
Materiales
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
Referencias
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados