Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение β окисления жирных кислот в суспензии свежеизолированных гепатоцитов мыши
* Эти авторы внесли равный вклад
В этой статье
Резюме
Окисление жирных кислот β является важным метаболическим путем, ответственным за выработку энергии во многих различных типах клеток, включая гепатоциты. Здесь мы описываем метод измерения β окисления жирных кислот в свежевыделенных первичных гепатоцитах с использованием 14С-меченой пальмитиновой кислоты.
Аннотация
Окисление жирных кислот β является ключевым метаболическим путем для удовлетворения энергетических потребностей печени и обеспечения субстратов и кофакторов для дополнительных процессов, таких как кетогенез и глюконеогенез, которые необходимы для поддержания гомеостаза глюкозы всего тела и поддержки функции внепеченочных органов в состоянии голодания. Окисление жирных кислот β происходит в митохондриях и пероксисомах и регулируется с помощью нескольких механизмов, включая поглощение и активацию жирных кислот, уровни экспрессии ферментов и доступность кофакторов, таких как коэнзим А и NAD+. В анализах, которые измеряют β окисления жирных кислот в гомогенатах печени, лизис клеток и общее добавление супрафизиологических уровней кофакторов маскируют эффекты этих регуляторных механизмов. Кроме того, целостность органелл в гомогенатах трудно контролировать и может значительно варьироваться между препаратами. Измерение β окисления жирных кислот в интактных первичных гепатоцитах преодолевает вышеуказанные подводные камни. Этот протокол описывает метод измерения β окисления жирных кислот в суспензии свежеизолированных первичных гепатоцитов мыши, инкубированных с 14С-меченой пальмитиновой кислотой. Избегая от нескольких часов до нескольких дней культивирования, этот метод имеет преимущество в лучшем сохранении уровней экспрессии белка и активности метаболического пути исходной печени, включая активацию β окисления жирных кислот, наблюдаемого в гепатоцитах, выделенных у мышей натощак, по сравнению с кормлеными мышами.
Введение
Окисление жирных кислот β является важным процессом в липидном обмене, обеспечивая катаболический путь для балансировки синтеза и потребления жирных кислот из рациона. Этот процесс генерирует энергию для нескольких органов, включая сердечную мышцу, кору почек и печень натощак, и использует жирные кислоты, полученные из рациона, липолиза жировой ткани и внутренних запасов триглицеридов 1,2.
Окисление жирных кислот через β путь окисления приводит к последовательному укорочению жировой ациловой цепи двумя углеродами одновременно, высвобождаемыми в виде ацетил-КоА, и этот процесс происходит как в митохондриях, так и в пероксисомах. В то время как большинство жирных кислот подвергаются только β окислению, некоторые из них окисляются при различных углеродах, прежде чем войти в этот путь. Например, 3-метилзамещенные жирные кислоты, такие как фитановая кислота, подвергаются удалению одного углерода путем α-окисления в пероксисомах перед попаданием в β путь окисления. Аналогичным образом, некоторые жирные кислоты сначала превращаются в дикарбоновые жирные кислоты путем окисления концевой метильной группы (ω-окисление) в эндоплазматическом ретикулуме, прежде чем предпочтительно окисляются в пероксисомах путем β-окисления3.
Независимо от конкретной органеллы, жирная кислота должна быть сначала преобразована в тиоэстер коэнзима А (КоА), или ацил-КоА, для окисления через β путь окисления. β-окисление длинноцепочечных ацил-КоА в митохондриальном матриксе требует карнитинового челнока для их транслокации, где карнитин пальмитоилтрансфераза 1 (CPT1) катализирует превращение ацил-КоА в ацилкарнитины и является ферментом, ограничивающим скорость в этом процессе4. После перемещения в митохондриальный матрикс ацил-КоА повторно формируются и служат субстратами для митохондриального механизма β окисления. В состоянии голодания ацетил-КоА, образующийся в результате β-окисления в печеночных митохондриях, в основном направляется на кетогенез. Пероксисомы служат основным местом для β окисления очень длинноцепочечных, разветвленных и дикарбоновых жирных кислот. Пероксисомы не требуют карнитинового шаттла для импорта субстратов жирных кислот, вместо этого импортируя соответствующие ацил-КоА через активность транспортеров АТФ-связывающей кассеты (ABC) ABCD1-35. Внутри пероксисом ацил-КоА затем окисляются специальным набором ферментов, отличных от митохондриальных жирных кислот β механизма окисления. Как митохондрии, так и пероксисомы также требуют поставок NAD+ и свободного КоА для окисления жирных ацильных цепей. Было показано, что уровни CoA в печени увеличиваются в ответ на голодание, поддерживая повышенную скорость окисления жирных кислот, которое происходит в этом состоянии6. Кроме того, повышенная деградация КоА в пероксисомах приводит к селективному снижению окисления пероксисомальных жирных кислот7. Поэтому процесс окисления жирных кислот внутри клетки регулируется уровнями экспрессии и активностью ферментов, участвующих в активации, транспорте и окислении жирных кислот, а также концентрациями кофакторов и других метаболитов в нескольких субклеточных компартментах.
Процедуры с использованием тканевых гомогенатов для измерения окисления жирных кислот разрушают клеточную архитектуру, регулирующую и поддерживающую этот процесс, что приводит к сбору данных, которые не точно отражают метаболизм in vivo. В то время как методы, использующие покрытые первичные гепатоциты, сохраняют эту систему, культивирование изолированных клеток в течение длительных периодов времени приводит к потере профиля экспрессии генов in vivo, который присутствовал в клетках, когда они все еще жили в животном 8,9. Следующий протокол описывает способ выделения первичных гепатоцитов и анализа их способности к β окисления жирных кислот сразу после выделения и в суспензии с использованием [1-14С]пальмитиновой кислоты. Анализ основан на измерении радиоактивности, связанной с кислоторастворимыми метаболитами (ASM) или продуктами, такими как ацетил-КоА, полученными β окисления [1-14C]пальмитиновой кислоты10,11.
протокол
Все экспериментальные процедуры на мышах (C57BL/6J, самцы, возраст 9-11 недель) были одобрены Институциональными комитетами по уходу за животными и их использованию (IACUC) Университета Западной Вирджинии.
1. Выделение гепатоцитов
- Подготовка
- В дни, предшествующие выделению гепатоцитов, подготавливают буферы и клеточные культуральные среды, перечисленные в таблице 1. Установите водяную баню с температурой, установленной до 37 ° C, близко к месту проведения операции.
- В день выделения гепатоцитов под ламинарной проточной вытяжкой переложить 35 мл буфера 1 в стерильную центрифужную трубку объемом 50 мл и 70 мл буфера 2 в стерильный стакан или флакон объемом 100 мл.
- Добавьте антибиотики гентамицин (50 мкг/мл) и пенициллин/стрептомицин (1x) в оба буфера.
- Переложить 20 мл буфера 2, приготовленного на стадии 1.1.3, в чашку для культивирования клеток толщиной 100 мм и поместить на лед.
- Перенесите оставшиеся 50 мл буфера 2 в стерильную центрифужную трубку объемом 50 мл. Поместите 50 мл пробирок, содержащих буферы 1 и 2 с добавлением антибиотиков, на водяную баню, установленную при 37 °C, и дайте им нагреться в течение не менее 15 минут перед началом перфузии.
ПРИМЕЧАНИЕ: При проведении нескольких выделений гепатоцитов за сеанс увеличьте количество аликвот буферов 1 и 2, дополненных антибиотиками, для подготовки соответствующим образом. - Разморозить аликвоту раствора коллагеназы и держать на льду.
ПРИМЕЧАНИЕ: При правильном хранении не происходит значительной потери активности фермента в растворах коллагеназы, замороженных и размороженных до 3 раз и используемых в течение 3 недель с момента приготовления. - Подготовьте хирургические инструменты и перистальтический насос. Стерилизуют линии перистальтического насоса путем циркуляции 15 мл 70% этанола, а затем 15 мл стерильной воды.
- Подключите иглу 22 G к выходной линии (рисунок 1A). Полый фильтр катетера хорошо работает в качестве соединителя. Заполните линии буфером 1 и осмотрите линии, соединитель и иглу, чтобы убедиться, что пузырьки воздуха не задерживаются.
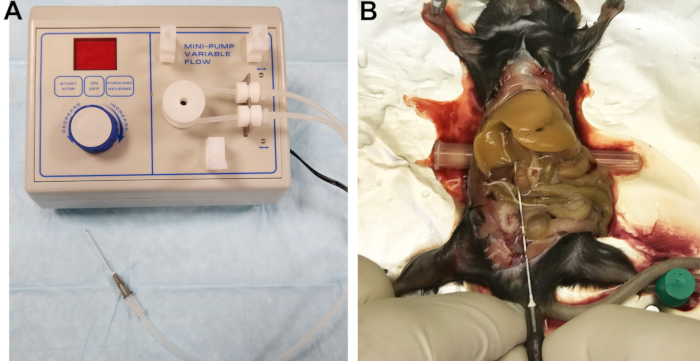
Рисунок 1: Перфузионный аппарат и перфузированная печень. (А) Перистальтический насос с выходной линией, соединенной с иглой, используемой для канюляции и перфузии печени. (B) Об успешной канюляции свидетельствует немедленное и однородное бланширование печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Перфузия и диссоциация печени
- Обезболивание мыши с помощью вдыхания изофлурана с воздухом медицинского класса в качестве газа-носителя, используя 4% изофлурана для индукции и 1,5% изофлурана для поддержания анестезии. Проверьте глубину анестезии, оценив потерю педального рефлекса.
- Когда нет реакции на защемление пальца ноги, поместите мышь в лежачее положение на операционной доске, вытяните конечности и закрепите их на доске булавками.
- Обильно опрыскивайте брюшко и грудь мыши 70% этанолом.
- Используя щипцы, подтяните кожу и брюшную стенку возле основания живота и разрезайте сбоку, по обе стороны от средней линии и до диафрагмы, чтобы обнажить органы.
- Обнажите нижнюю полую вену (IVC), переместив кишечник в правую сторону и осторожно перевернув доли печени вверх. Вставьте небольшой цилиндрический объект, такой как колпачок иглы, под заднюю часть мыши, чтобы слегка наклонить IVC и облегчить его канюляцию (рисунок 1B).
- Запустите насос на самой низкой скорости и, с буфером 1, вставьте иглу в IVC.
- Перережьте воротную вену, чтобы снять давление и обеспечить дренаж буферов крови и перфузии, затем немедленно увеличьте скорость потока до 7 мл / мин. Если все сделано правильно, печень будет равномерно побледнеть в течение нескольких секунд (рисунок 1B).
- Для получения более стабильных результатов держите иглу в положении вручную в течение всего периода перфузии.
- Перфузируйте печень теплым буфером 1. Чтобы избежать попадания пузырьков воздуха, убедитесь, что линия, вставленная в трубку, содержащую буфер 1, остается непрерывно погруженной.
- Во время перфузии добавьте 130 мкл раствора коллагеназы в буфер 2 и перемешайте путем пипетки вверх и вниз или перемешивания с серологической пипеткой 5 мл или 10 мл.
- Поскольку объем в трубке, содержащей буфер 1, уменьшается примерно до 5 мл, медленно добавляйте 5 мл буфера 2 в буфер 1 путем пипетки на боковой стороне трубки. Цель состоит в том, чтобы избежать введения пузырьков воздуха в линию при переходе от буфера 1 к буферу 2.
- Подождите, пока объем снова уменьшится до 5 мл и медленно добавьте еще 5 мл буфера 2. Повторите еще раз. Когда буфер 2 заменяет буфер 1 и начинается диссоциация, печень будет набухать.
- Добавьте оставшийся буфер 2 в трубку, первоначально содержащую буфер 1. Прекратите перфузию, когда в пробирке останется около 5-10 мл буфера 2.
ПРИМЕЧАНИЕ: В то время как буфер 2 перфузирует печень, воротная вена может быть периодически зажата щипцами в течение 5 с. Этот шаг является необязательным, но результирующее повышение давления по всей печени может улучшить ее диссоциацию и, таким образом, конечный выход гепатоцитов. - Тщательно иссечь печень и переложите ее в 100-миллиметровую культуральную чашку, содержащую 20 мл ледяного буфера 2, отведенного в сторону на этапе 1.1.4.
- Под ламинарной вытяжкой аккуратно разбейте печень на части с помощью хирургических ножниц и пинцета.
- Добавьте около 20 мл ледяного M199 в суспензию гепатоцитов и отфильтруйте его через клеточный сетчатый фильтр 100 мкм с помощью поршня шприца, чтобы мягко способствовать высвобождению дополнительных гепатоцитов из более крупных кусочков печени.
- Вымойте 100-миллиметровую чашку для культивирования и клеточный ситечко дополнительным M199 до тех пор, пока трубка для сбора не заполнится.
- Центрифугировать суспензию при 50 х г в течение 2 мин при 4 °С. Осторожно аспирировать супернатант и осторожно повторно суспендировать гранулу гепатоцитов в 30 мл холодного M199 путем закручивания.
- Гранулирование гепатоцитов, как указано в шаге 1.2.18. Повторите стирку еще раз.
- Повторно суспендируют гепатоциты в 10 мл теплого M199 и определяют жизнеспособность и выход с помощью метода исключения трипанового синего и гемоцитометра12.
- Разбавьте клетки в M199, нагретые до 37 ºC до конечной концентрации 1,0 х 106 жизнеспособных клеток/мл и немедленно начинайте анализ.
2. Анализ β окисления жирных кислот
ПРИМЕЧАНИЕ: Анализ проводят в трех экземплярах, и каждая реакционная смесь содержит 750 000 клеток, 1,35 мг/мл бычьего сывороточного альбумина (BSA), 100 мкМ пальмитиновой кислоты и 0,4 мкКи [1-14С]пальмитиновой кислоты в конечном объеме 2 мл.
ВНИМАНИЕ: Радиоактивные соединения опасны. Покупайте, обрабатывайте, храните и утилизируйте радиоактивные материалы в соответствии с институциональными, государственными и федеральными правилами.
- Подготовка
- За несколько дней до анализа готовят растворы пальмитиновой кислоты и BSA (табл. 1) и хранят при -20 °C.
- В день анализа выполните шаги 2.1.3-2.1.9 перед началом перфузии печени.
- Разморозить растворы пальмитиновой кислоты и BSA. Подготовьте субстратную смесь для нескольких реакций плюс избыток 20%-30% с типичной установкой анализа, показанной в таблице 2.
- Aliquot 13,5 мкл раствора BSA на реакцию в микроцентрифужной трубке и нагревают до 41 °C, затем добавляют 1 мкл раствора пальмитиновой кислоты 200 мМ (BSA: молярное отношение пальмитиновой кислоты = 1:5) за реакцию.
ПРИМЕЧАНИЕ: Предпочтительно дозировать растворы, приготовленные с использованием органических растворителей, таких как радиоактивные и нерадиоактивные растворы пальмитиновой кислоты, с пипеткой с положительным смещением и соответствующими наконечниками. - Вихрь энергично и инкубируют при 41 °C, чтобы облегчить образование растворимой пальмитиновой кислоты: комплекс BSA. Вихрь изредка в течение инкубационного периода.
- Смесь первоначально будет мутной, но полностью прояснится после 20-30 мин инкубации при 41 °C. Держите его при температуре 41 °C до тех пор, пока не будете готовы к началу реакций.
- Аликвот 133 мкл 1 М хлорной кислоты в микроцентрифужных пробирках объемом 1,5 мл для остановки реакций.
ВНИМАНИЕ: Соляная кислота является сильной кислотой и сильным окислителем. Для обработки этого соединения требуется соответствующее защитное снаряжение. - Аликвота 485,5 мкл M199 на реакцию попадает в пробирку и держит ее при 37 °C для разбавления радиоактивного BSA: комплекс пальмитиновой кислоты, приготовленный на стадиях 2.1.4-2.1.6 перед началом реакций.
- Дозируйте 750 мкл M199 в столько же 14 мл трубки с круглым дном, сколько образцы. При желании добавляют ингибиторы β окисления жирных кислот, такие как этомоксир, ротенон и антимицин, включая контроль транспортного средства (таблица 2).
- Во время этапов промывания гепатоцитов, за 10-15 мин до начала реакций, переложите трубки, приготовленные на шаге 2.1.9, на встряхивающую водяную баню, установленную на 37 °C и встряхивающую при 180-200 об/мин.
- Запуск, остановка и анализ реакций окисления жирных кислот β
- Если жизнеспособность гепатоцитов приемлема (обычно ≥ 75%, фиг.2), для каждой реакции переносят 0,8 мкл [1-14С]пальмитиновой кислоты (0,5 мКи/мл) в микроцентрифужную трубку, содержащую осветленный BSA: раствор пальмитиновой кислоты (этапы 2.1.4-2.1.6). Вихрь и возвращение на водяную баню при 41 °C.
- Чтобы уравновесить гепатоциты до 37 °C и предварительно инкубировать их ингибиторами (если таковые имеются), сразу после окончательной ресуспенсии гепатоцитов (стадия 1.2.21) перенести 750 мкл суспензии гепатоцитов с пипеткой 1 мл в каждую из 14 мл круглодонных трубок в трясущейся водяной бане (этапы 2.1.9-2.1.10) и кратковременно вихрь на низкой скорости перемешать.
- Разложите каждое добавление на 30 с и высиживайте в течение 15 минут. Чтобы сохранить образец для определения белка, переведите еще одну аликвоту гепатоцитов в микроцентрифужную трубку объемом 1,5 мл и вращайтесь при 3000 х г в течение 5 мин.
ПРИМЕЧАНИЕ: Во время дозирования суспензию гепатоцитов необходимо непрерывно закручивать или осторожно перемешивать с помощью дозирующей пипетки 1 мл, чтобы предотвратить оседание и большую изменчивость количества клеток в образцах. - Удалите супернатант и храните гранулу при -80 °C до тех пор, пока не будете готовы измерить общее количество белка в образце для нормализации результатов (рисунок 3).
- Пока гепатоциты находятся под предварительной инкубацией при 37 °C, добавьте радиоактивный комплекс BSA: пальмитиновой кислоты в теплую среду в 2,1,8 и держите при 37 °C до готовности к началу реакций. Это конечная субстратная смесь.
- Чтобы начать реакцию, удалите гепатоциты с водяной бани и добавьте 500 мкл субстратной смеси.
- Вихрь на низкой скорости в течение 5 с полностью суспендирует клетки и вернется на водяную баню. Повторите со всеми образцами, шатаясь на 30 с.
- Инкубировать в течение 15 мин. Запустите набор реакций и немедленно прекратите (см. шаги 2.2.10-2.2.11) для определения фоновой радиоактивности (таблица 2).
- Переложите дубликаты аликвот (200-250 мкл) оставшейся субстратной смеси в сцинтилляционные флаконы по 6 мл и отложите для подсчета. Используйте эти подсчеты для расчета радиоактивности, соответствующей общему количеству нмолей пальмитиновой кислоты, доступной для окисления в 500 мкл смеси субстрата.
- Чтобы остановить реакции, удалите гепатоциты с водяной бани, повторно суспендируйте гепатоциты путем вихрения с умеренной скоростью, а затем перенесите 400 мкл суспензии гепатоцитов в микроцентрифужные трубки, содержащие хлорную кислоту.
- Немедленно закройте трубки крышкой. Повторите эту последовательность для всех образцов, ошеломляя на 30 с.
- Энергично вращайте трубки микроцентрифуги объемом 1,5 мл и вращайте их вниз по микроцентрифужным трубкам объемом 1,5 мл при 13 000 х г в течение 10 минут.
- Перенесите 300 мкл надосадочного вещества во флакон 6 мл, добавьте 4 мл сцинтилляционной жидкости и подсчитайте радиоактивность в образцах и аликвотах смеси субстрата (стадия 2.2.9) в сцинтилляционном счетчике.
ВНИМАНИЕ: После центрифугирования откройте трубки под вытяжным капюшоном, чтобы избежать вдыхания 14C-CO2, образующихся при полном окислении 14C-ацетил-КоА, образующихся в результате β окисления жирных кислот и высвобождаемых кислотными условиями.
| Буферы/компоненты мультимедиа | Количество | Конечная концентрация | Резолюция |
| Решение C | |||
| ККл | 1,79 г | 480 мМ | Добавьте воды до 50 мл. Хранить при температуре 4 °C |
| MgSO4 гептагидрат | 1,48 г | 120 мМ | |
| KH2PO4 | 0,81 г | 119 мМ | |
| Буфер Кребса-Хенселеита (KHB), без кальция | |||
| НаКл | 7.0 г | 120 мМ | Добавьте воды до 900 мл, отрегулируйте рН до 7,4 и доведите конечный объем до 1 л. Хранить при 4 °C |
| НаХКО3 | 2.0 г | 24 мМ | |
| 1 М HEPES pH 7,45 | 5 мл | 5 мМ | |
| Глюкоза | 1 или 2 г | 5,6 или 11 мМ | |
| Решение C | 10 мл | ||
| Буфер 1 | |||
| ХБ | 500 мл | Смешайте компоненты и стерилизуйте фильтром. Хранить при температуре 4 °C | |
| 50 мМ ЭГТА | 1,0 мл | 0.1 мМ | |
| Буфер 2 | |||
| ХБ | 500 мл | Смешайте компоненты и стерилизуйте фильтром. Хранить при температуре 4 °C | |
| 1 МCaCl2 дигидрат | 686 мкл | 1,4 мМ | |
| Гентамицин раствор | |||
| Гентамицина сульфат | 0.5 г | 50 мг/мл | Добавьте воду до 10 мл и процедите стерилизуйте. Аликвота и хранение при -20 °C |
| Раствор коллагеназы | |||
| Смесь коллагеназы I и II | 10 мг | 7 мг/мл | Растворите все содержимое флакона в 1,43 мл воды. Аликвота и хранение при -20 °C |
| М199 | |||
| М199 | 1 мешочек | Добавьте воды до 900 мл и отрегулируйте рН до 7,2-7,4. Доведите конечный объем до 1 л и фильтруйте стерилизуем. Хранить при температуре 4 °C | |
| НаХКО3 | 2.2 г | 26 мМ | |
| 1 M HEPES (сорт клеточной культуры) | 25 мл | 25 мМ | |
| Дополнительная глюкоза (только для мышей, которых кормили) | 1 г | 11 мМ | |
| Решение BSA | |||
| BSA без жирных кислот | 400 мг | 20% (с об/кв) | Растворить в 2 мл воды. Аликвота и хранение при -20 °C |
| Нерадиоактивный раствор пальмитиновой кислоты | |||
| Пальмитиновая кислота | 103 мг | 200 мМ | Растворить в 2 мл этанола, хранить при -20 °C |
| 1 М Соляная кислота | |||
| 70% соляная кислота | 3,5 мл | 1 М | Разбавить водой до 40 мл. Хранить при комнатной температуре |
Таблица 1: Буферы, среды и другие растворы, необходимые для выделения гепатоцитов и анализа β окисления жирных кислот
| Номер реакции | Ингибиторы ± M199 | Гепатоцитарная суспензия (мкл) | Субстратная смесь (мкл) | ||||
| Объем (мкл) | Этомоксир | ||||||
| 1 | 750 | - | Предварительный нагрев при 37 °C | 750 | Предварительная инкубация при 37 °C в течение 15 мин | 500 | Инкубировать при 37 °C в течение 15 мин |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | Немедленно остановитесь | |||||
| 8 | |||||||
| 9 | |||||||
Таблица 2: Пример экспериментальной установки для гепатоцитарной суспензии, анализируемой в трех экземплярах в присутствии и отсутствии этомоксира.
Результаты
Перфузия печени, описанная здесь, обычно дает 30-40 миллионов клеток / печень со средней жизнеспособностью 80%, как оценивается по исключению синего трипана (рисунок 2). Типичная концентрация глюкозы в буфере Кребса-Хенселейта (KHB), который используется для приготовления пер?...
Обсуждение
Во время перфузии печени крайне важно избегать введения пузырьков воздуха, так как они блокируют микрокапилляры в печени, предотвращая или ограничивая буферную циркуляцию и в целом снижая выход гепатоцитов и жизнеспособность20,21. Меры предосторожности, ...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана грантом Национального института здравоохранения R35GM119528 Роберте Леонарди.
Материалы
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
Ссылки
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены