A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التقييم الحركي لنموذج مرض باركنسون القائم على أسماك الزرد البالغة الذي يسببه 6-هيدروكسي دوبامين
In This Article
Summary
يصف هذا البروتوكول الحقن داخل البطين (ICV) لأسماك الزرد البالغة مع السمية العصبية 6-hydroxydopamine (6-OHDA) في الدماغ البطني (Dn) وتقييم الضعف والتعافي اللاحق لآفة سلوك السباحة باستخدام اختبار الخزان المفتوح ، الذي يصاحبه تحليل باستخدام برنامج تتبع الفيديو.
Abstract
القيود المفروضة على العلاجات الحالية في تأخير فقدان الخلايا العصبية الدوبامين في مرض باركنسون (PD) تثير الحاجة إلى العلاجات البديلة التي يمكن أن تستعيد هذه الخلايا العصبية. يتم توجيه الكثير من الجهد حاليا نحو فهم أفضل للتجديد العصبي باستخدام نماذج ما قبل السريرية في الجسم الحي . ومع ذلك ، فإن هذه القدرة التجديدية للإصلاح الذاتي غير فعالة في الثدييات. وهكذا برزت الحيوانات غير الثديية مثل الزرد كنموذج ممتاز للتجديد العصبي بسبب قدرتها على التجديد الذاتي المستمر ولديها تماثل دماغي وثيق مع البشر. كجزء من الجهد المبذول في توضيح الأحداث الخلوية المشاركة في التجديد العصبي في الجسم الحي ، أنشأنا نموذج PD القائم على 6-hydroxydopamine (6-OHDA) القائم على أسماك الزرد البالغة. وقد تحقق ذلك من خلال الحقن المجهري المحسن داخل البطين (ICV) من 99.96 mM 6-OHDA للقضاء على الخلايا العصبية الدوبامينية (DpN) على وجه التحديد في الدماغ البطني (Dn) من دماغ الزرد. أشار التألق المناعي إلى أكثر من 85٪ من استئصال DpN في اليوم الثالث من الآفة والاستعادة الكاملة ل DpN في الموقع المصاب بعد 30 يوما من الآفة. حددت هذه الدراسة ضعف سلوك سباحة الزرد بعد الآفة وتعافيه لاحقا باستخدام اختبار المجال المفتوح الذي تم من خلاله تحديد معلمتين ، المسافة المقطوعة (cm) ومتوسط السرعة (cm/s). تم تقييم الحركة من خلال تحليل تسجيلات الأسماك الفردية لكل مجموعة (n = 6) باستخدام برنامج تتبع الفيديو. أظهرت النتائج انخفاضا معنويا (p < 0.0001) في السرعة (سم / ثانية) والمسافة المقطوعة (سم) لسمك الزرد المصاب 3 أيام بعد الآفة بالمقارنة مع الشام. أظهر الزرد المسبب للآفة تعافيا تاما من سلوك السباحة بعد 30 يوما من الآفة. تشير النتائج الحالية إلى أن أسماك الزرد البالغة المصابة ب 6-OHDA هي نموذج ممتاز بجودة قابلة للتكرار لتسهيل دراسة التجديد العصبي في PD. الدراسات المستقبلية حول الآليات الكامنة وراء التجديد العصبي وكذلك العوامل الداخلية والخارجية التي تعدل العملية قد توفر نظرة ثاقبة مهمة في استراتيجيات علاج استبدال الخلايا الجديدة ضد PD.
Introduction
مرض باركنسون (PD) ، وهو مرض يتميز بشكل مميز بصلابة العضلات ، ورعاش الراحة ، وبطء الحركة ، هو المرض العصبي الأسرع نموا في العالم1,2. يزداد خطر وانتشار مرض باركنسون بسرعة مع تقدم العمر خاصة لدى الأفراد الذين تتراوح أعمارهم بين 50 عاما وما فوق3. لا تزال مسببات مرض باركنسون وإمراضه غير مفهومة بشكل جيد. وقد ترك هذا في كثير من الأحيان بداية مبكرة من PD دون تشخيص. في الوقت الحاضر ، يرتبط نقص الدوبامين وفقدان الخلايا العصبية الدوبامينية (DpN) في مرضى PD ارتباطا وثيقا بمظهر من مظاهر الأعراض الحركية4. بالاستفادة من هذه العلاقة ، تم تصميم العديد من العلاجات إما للعمل مباشرة كبديل للدوبامين (أي ليفودوبا) أو للتعويض عن فقدان DpN (أي التحفيز العميق للدماغ). على الرغم من أن هذه العلاجات تجلب فوائد أعراض، إلا أنها لا تعدل المسار المتدهور للمرض5. في ضوء هذا الضعف الكبير ، تم اقتراح العلاج باستبدال الخلايا. ومع ذلك ، فإن فعالية هذا النهج غير متسقة بالنظر إلى تحديات إعداد الكسب غير المشروع ، والتحكم في نمو الخلايا ، وعدم استقرار النمط الظاهري. كما أن العلاج باستبدال الخلايا، الذي أثار مخاوف أخلاقية، يشكل أيضا خطر تحفيز أورام الدماغ وردود الفعل المناعية غير المرغوب فيها6,7.
أدت القيود المفروضة على الاستراتيجيات العلاجية الحالية إلى زيادة التركيز على تجديد DpN كنهج محتمل في علاج PD. وقد برز تجديد DpN أو التجديد العصبي كواحد من الاختراقات الواعدة في إدارة PD ، ليس فقط بسبب إمكاناته كطريقة علاجية جديدة ولكن أيضا كوسيلة لفهم آلية المرض 8 ، 9. يركز هذا النهج على استعادة وظيفة الخلايا العصبية من خلال التمايز والهجرة ودمج الخلايا السلفية الموجودة في الدوائر المصابة10. من أجل مواصلة استكشاف التجديد العصبي ، تم إجراء دراسات مختلفة في الجسم الحي. وجد أن الفقاريات مثل الثدييات والبرمائيات والزواحف تولد خلايا دماغية جديدة بعد الإصابة11،12. من بين الفقاريات ، يتم البحث عن الثدييات بشكل أكبر نظرا لتشابهها الجيني مع البشر. ومع ذلك، تظهر الثدييات قدرة إصلاحية محدودة وضعيفة في الجهاز العصبي المركزي (CNS) يمكن أن تستمر حتى مرحلة البلوغ بعد آفة الدماغ13. بشكل عام ، الثدييات غير مناسبة كنماذج حيوانية لفهم التجديد العصبي بالنظر إلى أن العدد المنخفض من الخلايا العصبية المنتجة لن يكون كافيا لاستعادة الدوائر العصبية التالفة التي لوحظت في PD. على هذا النحو ، فإن النموذج القائم على teleost ، وتحديدا في أسماك الزرد ، مفضل بشكل كبير لمعدل تكاثره العالي ، وقدرته على التجديد الذاتي المستمر ، وإغلاق تماثل الدماغ مع البشر14,15.
يستخدم سمك الزرد بشكل شائع لدراسة الحركة المضطربة في PD16. عادة ما يتم تحفيز نموذج PD القائم على أسماك الزرد بواسطة السموم العصبية ، والتي تشمل 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) و 6-hydroxydopamine (6-OHDA)17. على الرغم من فعاليتها في إحداث فقدان محدد ل DpN وانخفاض مستويات الدوبامين ، إلا أن النماذج القائمة على MPTP لا تحاكي عن كثب ظروف PD لأن فقدان DpN لا يقتصر فقط على CNS18. عدم قدرة 6-OHDA على عبور الحاجز الدموي الدماغي حد من آثاره على التغيرات الخلوية والوظيفية داخل الدماغ عندما يتم إعطاؤه داخل الجمجمة بدلا من العضل 19. تسبب الإعطاء المحيطي ل 6-OHDA في انخفاض عالمي في مستويات الدوبامين في جميع أنحاء الجهاز العصبي20. في حين أن إعطاء 6-OHDA في السائل الدماغي الشوكي تسبب في استئصال DpN في جميع أنحاء CNS21 ، والذي لا يحاكي الحالة كما هو موضح في PD حيث يحدث فقدان DpN على وجه التحديد في المادة السوداء من الدماغ البشري. على العكس من ذلك ، فإن إعطاء ICV ل 6-OHDA ، على وجه التحديد ، تسبب على وجه التحديد في استئصال كبير ل DpN في منطقة Dn البطنية في دماغ الزرد ، والذي يشبه إلى حد كبير المادة nigra22. ومن المثير للاهتمام ، تم الإبلاغ عن استعادة DpN بعد 30 يوما من الآفة التي يسببها 6-OHDA ونجت هذه الخلايا العصبية على مدار الحياة23,24. وقد ثبت التعافي الوظيفي ل DpN من خلال تقييم حركي للمسافة المقطوعة (cm) ومتوسط السرعة (cm/s) باستخدام نموذج PD القائم على أسماك الزرد البالغة 6-OHDA22.
Protocol
تمت الموافقة على هذه الدراسة من قبل لجنة البحوث والأخلاقيات الحيوانية (CARE) ، جامعة مارا التكنولوجية (UiTM) [رقم المرجع: UiTM CARE 346/2021 ، بتاريخ 7 مايو 2021].
ملاحظة: تم استخدام البروتوكولات المنشورة22،25،26 للتربية القياسية وصيانة نموذج PD لأسماك الزرد البالغة 6-OHDA. أجريت تجارب على ذكر الزرد البالغ (دانيو ريريو) الذي يزيد عمره عن خمسة أشهر بطول موحد يتراوح بين 3.2 و 3.7 سم.
1. صيانة الزرد والاستعدادات قبل ICV الحقن المجهري
- الحفاظ على الأسماك في خزان مياه هوائي تحت درجة حرارة يتم التحكم فيها من 28 ± 1.0 درجة مئوية. لتربية أسماك الزرد وصيانتها، استخدم الماء المقطر المعدني بملح البحر التجاري (1 جم/لتر) طوال التجربة27.
- احتضن 25 سمكة كحد أقصى لكل خزان سعة 45 لترا أو سمكة واحدة لكل 1.8 لتر ماء وتعريضها لجدول زمني من 14 ساعة من الضوء و 10 ساعات من الفترة الضوئية المظلمة. إطعام الأسماك مرتين على الأقل يوميا مع الكريات الغذائية المكملة بالديدان المجففة بالتجميد.
- تحضير محلول مخزون مركز من الميثانيسلفونات التريكاين (MS-222) عن طريق إذابة 2.5 غرام من MS-222 و 5 غرام من بيكربونات الصوديوم في 250 مل من الماء المقطر. تمييع 2 مل من محلول المخزون لإنتاج 200 مل من محلول التخدير العامل.
- تحضير 99.96 mM من 6-OHDA عن طريق إذابة 0.2 ملغ من حمض الأسكوربيك أولا في 1 مل من 0.9٪ ث / v كلوريد الصوديوم المصفى المعقم. قم بتصفية المحلول بفلتر 0.2 ميكرون قبل إضافة 25 ملغ من 6-OHDA في شكل مسحوق إلى المحلول. تحضير المحلول طازجا قبل كل حقن وتخزينه في الظلام عند 4 درجات مئوية.
تنبيه: ارتداء معدات الحماية الشخصية المناسبة (مثل القفازات ومعطف المختبر وقناع الوجه) وممارسة الممارسات المختبرية الجيدة عند التعامل مع المواد الكيميائية. وينبغي أن تتم جميع عمليات مناولة المواد الكيميائية داخل خزانة للسلامة الأحيائية.
2. التخدير وحقن القيمة المحلية المضافة لسمك الزرد
- صوم الأسماك لمدة 24 ساعة لتجنب القلس أثناء التخدير. قم بتخدير الأسماك عن طريق غمرها في حاوية تحتوي على 0.01٪ w / v من محلول MS-222 لمدة دقيقة تقريبا أو حتى تتوقف جميع الحركات العضلية المرئية.
- ضع السمكة المخدرة على إسفنجة غارقة في الماء توضع تحت المجهر المجسم ورطب الأسماك بانتظام.
- حدد موضع الحقن بناء على التقاطع بين الخيط المواضيعي (MS) والخياطة الإكليلية (CS) والخياطة السهمية (SS) التي تربط الجمجمة الأمامية والجدارية لدماغ الزرد.
- قم بعمل ثقب صغير بمساحة 1.0 مم 2 باستخدام إبرة حادة 27 جم في الجمجمة تسترشد بالوضع التشريحي المحدد على جمجمة الزرد (الشكل 1A ، B).
- اخفض الحاقن الشعري الدقيق بزاوية 60 درجة حتى يصل إلى عمق 1200 ميكرومتر من سقف الجمجمة في جمجمة الزرد (الشكل 1C). اضغط على حد Z لإصلاح الموضع.
- اضبط ضغط الحقن الأولي على 4000 هيكتوباسكال وضغط التعويض على 10 هيكتوباسكال. اضبط مدة الحقن على 0.3 ثانية. خفض شدة الحقن مع كل حقنة لاحقة.
- حقن 0.5 ميكرولتر من 99.96 mM من السموم العصبية 6-OHDA (أو 0.9٪ w/v المالحة لمجموعة التحكم الوهمية) والسماح للشعيرات الدموية الدقيقة بالراحة لمدة 20 ثانية. استمر في ترطيب الأسماك بالماء المقطر طوال عملية الحقن لمنع الجفاف.
- قم بإزالة الشعيرات الدموية الدقيقة ببطء وقم بإنعاش الأسماك تحت الماء المقطر الجاري. ضع الأسماك في خزان استرداد معزول وأزل أي مشتتات يمكن أن تزعج عملية الاسترداد.
- اغسل الشعيرات الدموية الدقيقة قبل الحقن التالي لإزالة الانسداد والتأكد من أن شدة الحقن كافية لإنتاج الحجم المطلوب من 0.5 ميكرولتر من 6-OHDA.
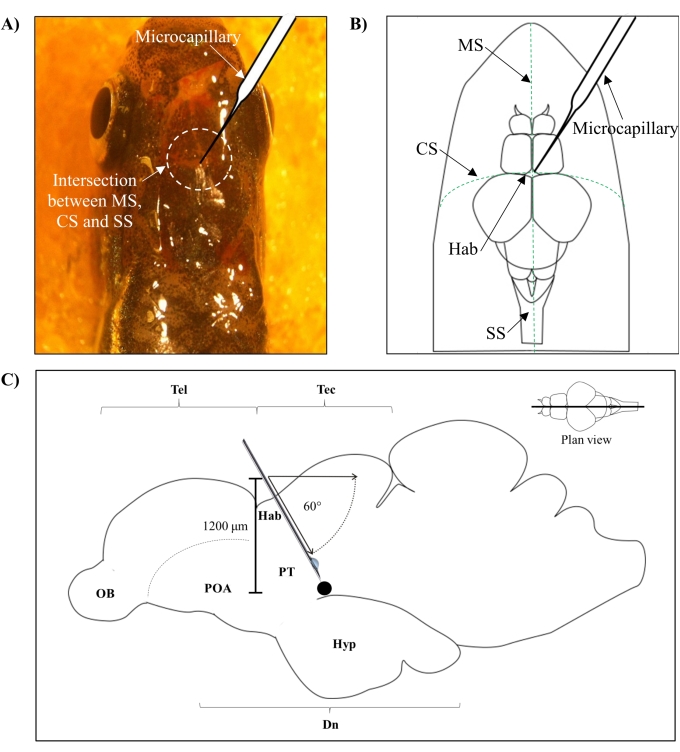
الشكل 1: موقع حقن السموم العصبية ، 6-OHDA. (أ) تسترشد نقطة دخول الشعيرات الدموية الدقيقة بالتقاطع بين الخيط المواضيعي (MS) ، والخياطة الإكليلية (CS) ، والخياطة السهمية (SS) التي تربط الجمجمة الأمامية والجدارية لدماغ الزرد (عرض الخطة). (ب) رسم تخطيطي (عرض خطة) لجمجمة ودماغ الزرد يظهر الشعيرات الدموية الدقيقة ، التي يتم إنزالها مباشرة فوق الهابينولا (Hab) ، ونقطة دخولها عند التقاطع بين نصفي الكرة الأرضية. (ج) رسم تخطيطي (قسم سهمي) لدماغ الزرد يوضح زاوية الحقن وعمق الاختراق. تمثل النقطة السوداء الموقع المسبب للآفة الذي يقع فوق المنطقة المستهدفة ، الدماغ البطني. الاختصارات: 6-OHDA: 6-هيدروكسي دوبامين ، CS: خياطة إكليلية ، DN: ثنائي الدماغ ، Hab: habenula ، Hyp: تحت المهاد ، MS: خياطة metopic ، OB: لمبة شمية ، POA: منطقة ما قبل البصريات ، PT: السل الخلفي ، SS: خياطة سهمية ، Tectum ، و Tel: telencephalon. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التقييم الحركي
ملاحظة: تم تقييم التقييم الحركي للزرد (n = ستة / مجموعة ؛ صورية مقابل آفة) بشكل فردي من خلال اختبار الخزان المفتوح باستخدام البروتوكولات المعمول بها 28,29 في اليوم الثالث واليوم 30 بعد 6-OHDA.
- تسجيل الفيديو
- ضع الخزان التجريبي (الطول 20 سم ، العرض 11.5 سم ، الارتفاع 13 سم) مع جدرانه المغطاة بالورق الأبيض على منصة مرتفعة (الشكل 2A).
- قم بإضاءة الخزان من الأسفل باستخدام مصدر ضوء. املأ الخزان بالماء المقطر (80٪ -90٪ ممتلئ) وحافظ على درجة الحرارة عند 28 ± 1.0 درجة مئوية. قياس درجة الحرارة باستخدام ميزان حرارة وتنظيمها باستخدام سخان حوض السمك التجاري.
- بعد دقيقتين على الأقل من التأقلم ، سجل سلوك سباحة الأسماك من عرض خطة على المستوى ثنائي الأبعاد (2D) للساحة التجريبية باستخدام كاميرا فيديو لمدة 5 دقائق (الشكل 2B). لتجنب عدم الاتساق في سلوك السباحة للدفعة السابقة والأخيرة من التسجيلات ، لا تتجاوز التأقلم بمقدار 10 دقائق 30.
- قم بتحليل مقاطع الفيديو باستخدام برنامج تتبع الفيديو باستخدام بروتوكول الخزان المفتوح للحصول على المسافة المقطوعة (cm) ومتوسط السرعة (cm/s) لكل موضوع.

الشكل 2: الإعداد التجريبي لاختبار خزان مفتوح لتقييم السلوك الحركي لأسماك الزرد . (أ) يتم وضع الخزان التجريبي (المنظر الأمامي) على منصة مرتفعة مضاءة من الأسفل. الجدران الأربعة للخزان مغطاة بورق أبيض ويتم التقاط التسجيلات بشكل محوري. يتم قياس درجة الحرارة باستخدام ميزان حرارة ويتم تنظيمها عند 28 ± 1.0 درجة مئوية باستخدام سخان حوض السمك التجاري. (ب) لقطة شاشة (عرض الخطة) لتسجيل الفيديو الذي تم التقاطه باستخدام الإعداد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحليل البيانات
- انقر نقرا مزدوجا فوق الرمز لفتح برنامج تتبع الفيديو. انقر فوق علامة التبويب ملف وحدد إنشاء تجربة فارغة جديدة. سيسمح ذلك للمستخدم بتخصيص معلمات التجربة وفقا لأهداف التحقيق.
- انقر فوق علامة التبويب البروتوكول ، وحدد مصادر الفيديو ، وانقر فوق إضافة مصدر فيديو جديد. انقر فوق القائمة المنسدلة المتاحة وحدد خيار ملف الفيديو . سيؤدي ذلك إلى ظهور النافذة المنبثقة لتصفح الملفات التي يمكن من خلالها تحديد تسجيلات الفيديو ذات الاهتمام.
- انقر فوق علامة التبويب الفرعية الجهاز وحدد الرمز المستطيل لإعداد الجهاز. اسحب الرمز المستطيل لتغطية الساحة التجريبية بأكملها. اضبط شريط المقياس وفقا لذلك وأدخل القيمة العددية لقياس المقياس المستخدم في طول قسم المسطرة. استخدمت التجربة الحالية مقياسا 10 مم لاختبار الخزان المفتوح.
- اضبط لون الحيوان عن طريق تحديد الحيوانات أغمق من خلفية الجهاز. اترك الخيارات الأخرى المتاحة في التتبع إلى الإعدادات الافتراضية المحددة مسبقا.
- في علامة التبويب الفرعية المناطق ، انقر فوق الجهاز المرسوم مسبقا. يتم تعيين هذه المنطقة كمنطقة قياسية يكون موضعها هو نفسه لجميع الاختبارات.
- حدد الخيارات التالية ضمن جدولة الاختبار وتقرير بيانات الاختبار: مدة الاختبار وإجمالي المسافة المقطوعة ومتوسط السرعة. الاختبارات الأخرى المتاحة في القائمة اختيارية وتعتمد على اهتمام الباحث الاستقصائي.
- في علامة التبويب تجربة، قم بتعيين الحيوانات وفقا لمجموعة الاختبار الخاصة بها عن طريق كتابة اسم المجموعة ضمن قسم الاسم وعدد الحيوانات لكل مجموعة في قسم عدد الحيوانات .
- قم بالتبديل إلى علامة التبويب اختبارات لتشغيل التجربة. انقر فوق رمز بدء الاختبار وانتظر حتى يتم تحليل جميع مقاطع الفيديو.
- في علامة التبويب النتائج ، انقر فوق أيقونة عرض التقرير لعرض البيانات الحركية في نموذج تقرير نصي.
النتائج
قيمت التجربة الحالية التغيرات في سلوك سباحة أسماك الزرد البالغة بعد الحقن المجهري ICV مع 6-OHDA. ويرجع سبب استخدام 6-OHDA كسم عصبي مفضل إلى عدم قدرته على عبور الحاجز الدموي الدماغي ، مما أدى إلى استئصال محدد ومستهدف ل DpN في منطقة الدماغ البطني (Dn)16. يحمل السكان الفرعيون DpN هنا تشابها تش...
Discussion
وقد أثبت هذا العمل بنجاح التقييم الحركي للنموذج القائم على 6-OHDA والقائم على أسماك الزرد البالغة. تضمنت التجربة بأكملها ثلاث خطوات رئيسية: المستحضرات المجهرية قبل ICV ، والحقن المجهري ICV لأسماك الزرد ، والتقييم الحركي. لضمان الانتعاش الصحي لأسماك الزرد البالغة بعد إجراء الحقن المجهري للقيمة...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل وزارة التعليم العالي الماليزية في إطار خطة منح البحوث الأساسية [600-IRMI/FRGS 5/3 (033/2019)].
Materials
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
References
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved