È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione locomotoria del modello di malattia di Parkinson a base di zebrafish adulto indotto da 6-idrossidopamina
In questo articolo
Riepilogo
Il presente protocollo descrive l'iniezione intracerebroventricolare (ICV) di zebrafish adulto con 6-idrossidopamina neurotossica (6-OHDA) al diencefalo ventrale (Dn) e la valutazione della compromissione e del successivo recupero del comportamento di nuoto postlesione utilizzando il test in vasca aperta, che è accompagnato da analisi utilizzando un software di tracciamento video.
Abstract
I limiti degli attuali trattamenti nel ritardare la perdita neuronale dopaminergica nella malattia di Parkinson (PD) aumentano la necessità di terapie alternative in grado di ripristinare questi neuroni. Molti sforzi sono attualmente diretti verso una migliore comprensione della neurorigenerazione utilizzando modelli preclinici in vivo . Questa capacità rigenerativa per l'autoriparazione è, tuttavia, inefficiente nei mammiferi. Gli animali non mammiferi come il pesce zebra sono così emersi come un eccellente modello neurorigenerativo grazie alla sua capacità di auto-rinnovarsi continuamente e di avere una stretta omologia cerebrale per gli esseri umani. Come parte dello sforzo per chiarire gli eventi cellulari coinvolti nella neurorigenerazione in vivo, abbiamo stabilito il modello pd a base di pesce zebra adulto indotto da 6-idrossidopamina (6-OHDA). Ciò è stato ottenuto attraverso la microiniezione intracerebroventricolare (ICV) ottimizzata di 99,96 mM 6-OHDA per ablare specificamente i neuroni dopaminergici (DpN) nel diencefalo ventrale (Dn) del cervello del pesce zebra. L'immunofluorescenza ha indicato oltre l'85% dell'ablazione di DpN al terzo giorno postlesion e il ripristino completo di DpN nel sito lesionato 30 giorni dopo la lesione. Il presente studio ha determinato la compromissione e il successivo recupero del comportamento di nuoto del pesce zebra a seguito della lesione utilizzando il test in campo aperto attraverso il quale sono stati quantificati due parametri, distanza percorsa (cm) e velocità media (cm / s). La locomozione è stata valutata analizzando le registrazioni dei singoli pesci di ciascun gruppo (n = 6) utilizzando un software di tracciamento video. I risultati hanno mostrato una significativa (p < 0,0001) riduzione della velocità (cm/ s) e della distanza percorsa (cm) del pesce zebra lesionato 3 giorni dopo la lesione rispetto allo sham. Il pesce zebra lesionato ha mostrato un pieno recupero del comportamento di nuoto 30 giorni dopo la lesione. I risultati attuali suggeriscono che il pesce zebra adulto lesionato 6-OHDA è un modello eccellente con qualità riproducibile per facilitare lo studio della neurorigenerazione nel PD. Studi futuri sui meccanismi alla base della neurorigenerazione e sui fattori intrinseci ed estrinseci che modulano il processo possono fornire importanti informazioni sulle nuove strategie di trattamento sostitutivo cellulare contro il PD.
Introduzione
Il morbo di Parkinson (PD), una malattia caratterizzata in modo distintivo da rigidità muscolare, tremore a riposo e bradicinesia, è la malattia neurologica in più rapida crescita al mondo1,2. Il rischio e la prevalenza di PD aumentano rapidamente con l'età, specialmente negli individui di età pari o superiore a 50 anni3. L'eziologia e la patogenesi del PD finora rimangono poco conosciute. Questo ha spesso lasciato l'insorgenza precoce del PD non diagnosticata. Allo stato attuale, la mancanza di dopamina e la perdita di neuroni dopaminergici (DpN) nei pazienti con PD sono fortemente legate alla manifestazione dei sintomi motori4. Capitalizzando su questa relazione, diversi trattamenti sono stati progettati per agire direttamente come sostituto della dopamina (cioè levodopa) o per compensare la perdita di DpN (cioè la stimolazione cerebrale profonda). Sebbene questi trattamenti portino benefici sintomatici, non modificano il decorso deteriorante della malattia5. In considerazione di questa significativa debolezza, è stata proposta la terapia sostitutiva cellulare. L'efficacia di questo approccio è, tuttavia, incoerente date le sfide della preparazione dell'innesto, del controllo della crescita cellulare e dell'instabilità del fenotipo. La terapia sostitutiva cellulare, che aveva sollevato preoccupazioni etiche, pone anche il rischio di indurre tumori cerebrali e reazioni immunitarie indesiderate6,7.
I limiti delle attuali strategie terapeutiche hanno portato a una maggiore enfasi sulla rigenerazione del DpN come potenziale approccio nel trattamento della PD. La rigenerazione del DpN o della neurorigenerazione è emersa come una delle promettenti scoperte nella gestione del PD, non solo per il suo potenziale come nuovo metodo terapeutico, ma anche come mezzo per comprendere il meccanismo della malattia8, 9. Questo approccio si concentra sul ripristino della funzione neuronale attraverso la differenziazione, la migrazione e l'integrazione delle cellule progenitrici esistenti nei circuiti lesionati10. Al fine di esplorare ulteriormente la neurorigenerazione, sono stati intrapresi vari studi in vivo. È stato scoperto che vertebrati come mammiferi, anfibi e rettili generano nuove cellule cerebrali a seguito di lesioni11,12. Tra i vertebrati, gli animali di mammifero sono più ricercati data la loro somiglianza genetica con gli esseri umani. I mammiferi, tuttavia, mostrano una limitata e scarsa capacità riparativa nel sistema nervoso centrale (SNC) che può durare fino all'età adulta a seguito di una lesione cerebrale13. In generale, i mammiferi non sono adatti come modelli animali per comprendere la neurorigenerazione dato che il basso numero di neuroni prodotti non sarà sufficiente a ripristinare i circuiti neurali danneggiati osservati nel PD. Come tale, il modello basato sul teleosteo, in particolare nel pesce zebra, è molto favorito per il suo alto tasso proliferativo, la capacità di auto-rinnovarsi continuamente e l'omologia cerebrale ravvicinata con gli esseri umani14,15.
Zebrafish è più comunemente usato per studiare il movimento disordinato in PD16. Il modello di PD a base di zebrafish è solitamente indotto da neurotossine, che includono 1-metil-4-fenil-1,2,3,6-tetraidropiridina (MPTP) e 6-idrossidopamina (6-OHDA)17. Sebbene efficaci nell'indurre la perdita specifica di DpN e la diminuzione dei livelli di dopamina, i modelli basati su MPTP non imitano da vicino le condizioni del PD poiché la perdita di DpN non è limitata esclusivamente al CNS18. L'incapacità del 6-OHDA di attraversare la barriera emato-encefalica ha limitato i suoi effetti sui cambiamenti cellulari e funzionali all'interno del cervello quando viene somministrato intracranicamente rispetto a quello intramuscolare19. La somministrazione periferica di 6-OHDA ha causato una riduzione globale dei livelli di dopamina in tutto il sistema nervoso20. Mentre la somministrazione di 6-OHDA nel liquido cerebrospinale ha causato l'ablazione di DpN in tutto il CNS21, che non imita la condizione come visto nel PD per cui la perdita di DpN si verifica specificamente alla substantia nigra del cervello umano. La somministrazione ICV di 6-OHDA, al contrario, ha specificamente indotto un'ablazione significativa di DpN nell'area del Dn ventrale nel cervello del pesce zebra, che assomigliava molto alla substantia nigra22. È interessante notare che il recupero di DpN è stato riportato 30 giorni dopo la lesione indotta da 6-OHDA e questi neuroni sono sopravvissuti nel corso della vita23,24. Il recupero funzionale di DpN è stato dimostrato attraverso una valutazione locomotoria della distanza percorsa (cm) e della velocità media (cm/s) utilizzando il modello PD adulto a base di zebrafish indotto da 6-OHDA22.
Protocollo
Il presente studio è stato approvato dal Committee on Animal Research and Ethics (CARE), Universiti Technologi MARA (UiTM) [Numero di riferimento: UiTM CARE 346/2021, datato 7 maggio 2021].
NOTA: Sono stati utilizzati i protocolli pubblicati22,25,26 per l'allevamento standard e il mantenimento del modello PD di zebrafish adulto 6-OHDA-lesionato. Gli esperimenti sono stati condotti con pesci zebra maschi adulti (Danio rerio) di età superiore ai cinque mesi con una lunghezza standardizzata di 3,2-3,7 cm.
1. Manutenzione del pesce zebra e preparazioni per la microiniezione pre-ICV
- Mantenere il pesce in un serbatoio di acqua aerata a una temperatura controllata di 28 ± 1,0 °C. Per l'allevamento e la manutenzione del pesce zebra, utilizzare acqua distillata mineralizzata con sale marino commerciale (1 g/L) durante l'esperimento27.
- Ospitare un massimo di 25 pesci per vasca da 45 L o un pesce per 1,8 L di acqua ed esporli a un programma di 14 ore di luce e 10 ore di fotoperiodo scuro. Nutrire il pesce almeno due volte al giorno con pellet alimentari integrati con vermi liofilizzati.
- Preparare una soluzione madre concentrata di tricaina metanosolfonato (MS-222) sciogliendo 2,5 g di MS-222 e 5 g di bicarbonato di sodio in 250 ml di acqua distillata. Diluire 2 mL di soluzione madre per produrre 200 mL di soluzione di anestesia di lavoro.
- Preparare 99,96 mM di 6-OHDA sciogliendo prima 0,2 mg di acido ascorbico in 1 mL di NaCl filtrato sterile allo 0,9% p/v. Filtrare la soluzione con un filtro da 0,2 micron prima di aggiungere 25 mg di 6-OHDA in polvere nella soluzione. Preparare la soluzione fresca prima di ogni iniezione e conservarla al buio a 4 °C.
ATTENZIONE: indossare dispositivi di protezione individuale appropriati (ad esempio, guanti, cappotto da laboratorio e maschera facciale) e praticare buone pratiche di laboratorio quando si maneggiano le sostanze chimiche. Tutte le manipolazioni delle sostanze chimiche devono essere effettuate all'interno di un armadio di biosicurezza.
2. Anestesizzazione e iniezione ICV di zebrafish
- Digiuna il pesce per 24 ore per evitare il rigurgito durante l'anestesia. Anestetizzare il pesce immergendolo in un contenitore contenente lo 0,01% p/v di soluzione di MS-222 per circa 1 minuto o fino a quando tutti i movimenti muscolari visibili cessano.
- Posizionare il pesce anestetizzato su una spugna imbevuta d'acqua posta sotto uno stereomicroscopio e bagnare regolarmente il pesce.
- Identificare la posizione per l'iniezione in base all'intersezione tra la sutura metopica (SM), la sutura coronale (CS) e la sutura sagittale (SS) che collega il cranio frontale e parietale del cervello del pesce zebra.
- Fai un piccolo foro di 1,0 mm2 di area usando un ago affilato da 27 G nel cranio guidato dalla posizione anatomica specifica sul cranio del pesce zebra (Figura 1A, B).
- Abbassare l'iniettore microcapillare con un angolo di 60° fino a raggiungere una profondità di 1.200 μm dal tetto cranico del cranio del pesce zebra (Figura 1C). Premere il limite Z per fissare la posizione.
- Impostare la pressione di iniezione iniziale a 4000 hPa e la pressione di compensazione a 10 hPa. Impostare la durata dell'iniezione a 0,3 s. Abbassare l'intensità dell'iniezione con ogni successiva iniezione.
- Iniettare 0,5 μL di 99,96 mM di neurotossina 6-OHDA (o 0,9% p/v di soluzione salina per il gruppo di controllo fittizio) e lasciare riposare la microcapillare per 20 s. Continuare a bagnare il pesce con acqua distillata durante tutto il processo di iniezione per evitare l'essiccazione.
- Rimuovere lentamente il microcapillare e rianimare il pesce sotto l'acqua distillata corrente. Metti il pesce in una vasca di recupero isolata e rimuovi eventuali distrazioni che possono potenzialmente disturbare il processo di recupero.
- Lavare il microcapillare prima dell'iniezione successiva per eliminare il blocco e assicurarsi che l'intensità dell'iniezione sia sufficiente per produrre il volume desiderato di 0,5 μL di 6-OHDA.
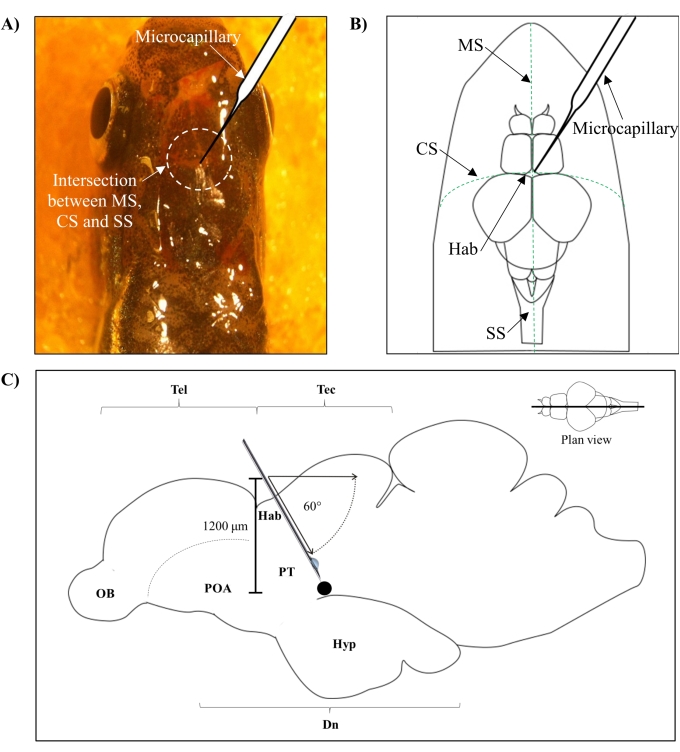
Figura 1: Sito di iniezione della neurotossina, 6-OHDA. (A) Il punto di ingresso microcapillare è guidato dall'intersezione tra la sutura metopica (SM), la sutura coronale (CS) e la sutura sagittale (SS) che collega il cranio frontale e parietale del cervello del pesce zebra (plan view). (B) Un disegno schematico (planimetria) del cranio e del cervello del pesce zebra mostra il microcapillare, che è abbassato direttamente sopra l'habenula (Hab), e il suo punto di ingresso all'intersezione tra gli emisferi. (C) Un disegno schematico (sezione sagittale) del cervello del pesce zebra mostra l'angolo di iniezione e la profondità di penetrazione. Il punto nero rappresenta il sito lesionato che si trova sopra l'area bersaglio, il diencefalo ventrale. Abbreviazioni: 6-OHDA: 6-idrossidopamina, CS: sutura coronale, Dn: diencefalo, Hab: habenula, Hyp: ipotalamo, MS: sutura metopica, OB: bulbo olfattivo, POA: area preottica, PT: tubercolo posteriore, SS: sutura sagittale, Tec: tectum e Tel: telencefalo. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Valutazione locomotoria
NOTA: La valutazione locomotoria del pesce zebra (n = sei / gruppo; sham vs lesionato) è stata valutata individualmente tramite il test in vasca aperta utilizzando protocolli stabiliti28,29 al terzo giorno e al giorno 30 della lesione post-6-OHDA.
- Registrazione video
- Posizionare il serbatoio sperimentale (lunghezza 20 cm, larghezza 11,5 cm, altezza 13 cm) con le pareti ricoperte di carta bianca su una piattaforma rialzata (Figura 2A).
- Illuminare il serbatoio dal basso usando una fonte di luce. Riempire il serbatoio con acqua distillata (80%-90% pieno) e mantenere la temperatura a 28 ± 1,0 °C. Misurare la temperatura utilizzando un termometro e regolarla utilizzando un riscaldatore per acquari commerciale.
- Dopo un minimo di 2 minuti di acclimatazione, registrare il comportamento di nuoto del pesce da una vista del piano sul piano bidimensionale (2D) dell'arena sperimentale utilizzando una videocamera per 5 minuti (Figura 2B). Per evitare incongruenze nel comportamento di nuoto del precedente e dell'ultimo lotto di registrazioni, non superare l'acclimatazione di 10 min30.
- Analizza i video utilizzando un software di video tracking con il protocollo open-tank per l'acquisizione della distanza percorsa (cm) e della velocità media (cm/s) di ciascun soggetto.

Figura 2: Configurazione sperimentale di un test in vasca aperta per la valutazione del comportamento locomotore del pesce zebra. (A) Il serbatoio sperimentale (vista frontale) è posizionato su una piattaforma rialzata illuminata dal basso. Le quattro pareti del serbatoio sono ricoperte di carta bianca e le registrazioni vengono catturate assialmente. La temperatura viene misurata utilizzando un termometro e regolata a 28 ± 1,0 °C utilizzando un riscaldatore per acquari commerciale. (B) Screenshot (vista piano) della registrazione video acquisita utilizzando la configurazione. Fare clic qui per visualizzare una versione più grande di questa figura.
- Analisi dei dati
- Fare doppio clic sull'icona per aprire il software di tracciamento video. Fare clic sulla scheda File e selezionare Crea nuovo esperimento vuoto. Ciò consentirà all'utente di personalizzare i parametri dell'esperimento in base agli obiettivi dell'indagine.
- Fare clic sulla scheda Protocollo , selezionare Sorgenti video e fare clic su Aggiungi nuova sorgente video. Fare clic sull'elenco a discesa disponibile e selezionare l'opzione File video . Ciò richiederà il pop-up di navigazione dei file da cui è possibile selezionare le registrazioni video di interesse.
- Fare clic sulla sottoscheda Apparato e selezionare l'icona Rettangolare per configurare l'apparecchio. Trascina l'icona rettangolare per coprire l'intera arena sperimentale. Impostare la barra di scala di conseguenza e immettere il valore numerico della misurazione della scala utilizzata nella lunghezza della sezione righello. Il presente esperimento ha utilizzato una scala di 10 mm per il test del serbatoio aperto.
- Imposta il colore dell'animale selezionando Gli animali sono più scuri di Lo sfondo dell'apparato. Lascia le altre opzioni disponibili in Monitoraggio alle impostazioni predefinite preimpostate.
- Nella sottoscheda Zone , fare clic sull'apparecchio disegnato in precedenza. Questa zona è impostata come zona standard la cui posizione è la stessa per tutti i test.
- Selezionare le seguenti opzioni in Pianificazione test e report dati test: Durata test, Distanza totale percorsa e Velocità media. Altri test disponibili nell'elenco sono facoltativi e dipendono dall'interesse investigativo del ricercatore.
- Nella scheda Esperimento , assegna gli animali in base al loro gruppo di test digitando il nome del gruppo nella sezione Nome e il numero di animali per gruppo nella sezione Numero di animali .
- Passare alla scheda Test per eseguire l'esperimento. Fai clic sull'icona Avvia test e attendi fino a quando tutti i video non vengono analizzati.
- Nella scheda Risultati , fare clic sull'icona Visualizza il report per visualizzare i dati locomotori nel modulo di report di testo.
Risultati
Il presente esperimento ha valutato i cambiamenti nel comportamento di nuoto del pesce zebra adulto dopo la microiniezione ICV con 6-OHDA. La ragione per l'utilizzo di 6-OHDA come neurotossina di scelta era dovuta alla sua incapacità di attraversare la barriera emato-encefalica, che produceva un'ablazione specifica e mirata di DpN nell'area di interesse-diencefalo ventrale (Dn)16. La sottopopolazione DpN qui ha una somiglianza anatomica con la sottopopolazione DpN nella substantia nigra pars comp...
Discussione
Il presente lavoro ha dimostrato con successo la valutazione locomotoria del modello di PD adulto a base di pesce zebra adulto indotto da 6-OHDA. L'intero esperimento ha coinvolto tre fasi principali: preparazioni di microiniezione pre-ICV, microiniezione ICV di zebrafish e valutazione locomotoria. Per garantire il sano recupero del pesce zebra adulto seguendo la procedura di microiniezione ICV e un buon risultato sperimentale, nel presente studio sono state raccomandate alcune buone pratiche per ogni fase.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal Ministero dell'Istruzione Superiore della Malesia nell'ambito del Fundamental Research Grant Scheme [600-IRMI/FRGS 5/3 (033/2019)].
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
Riferimenti
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon