Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Lokomotorische Bewertung des 6-Hydroxydopamin-induzierten adulten Zebrafisch-basierten Parkinson-Modells
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die intrazerebroventrikuläre (ICV) Injektion von adulten Zebrafischen mit neurotoxischem 6-Hydroxydopamin (6-OHDA) am ventralen Zwischenhirn (Dn) und die Beurteilung der Beeinträchtigung und anschließenden Wiederherstellung der Nachbehandlung des Schwimmverhaltens unter Verwendung des offenen Tanktests, der von einer Analyse mit einer Video-Tracking-Software begleitet wird.
Zusammenfassung
Die Einschränkungen der derzeitigen Behandlungen bei der Verzögerung des dopaminergen neuronalen Verlusts bei der Parkinson-Krankheit (PD) erhöhen den Bedarf an alternativen Therapien, die diese Neuronen wiederherstellen können. Derzeit werden große Anstrengungen unternommen, um die Neuroregeneration anhand präklinischer In-vivo-Modelle besser zu verstehen. Diese regenerative Fähigkeit zur Selbstreparatur ist jedoch bei Säugetieren ineffizient. Nicht-Säugetiere, wie Zebrafische, haben sich daher aufgrund ihrer Fähigkeit, sich kontinuierlich selbst zu erneuern und eine enge Gehirnhomologie zum Menschen zu haben, zu einem ausgezeichneten neuroregenerativen Modell entwickelt. Im Rahmen der Bemühungen zur Aufklärung zellulärer Ereignisse, die an der Neuroregeneration in vivo beteiligt sind, haben wir das 6-Hydroxydopamin (6-OHDA)-induzierte PD-Modell für erwachsene Zebrafische etabliert. Dies wurde durch die optimierte intrazerebroventrikuläre (ICV) Mikroinjektion von 99,96 mM 6-OHDA erreicht, um dopaminerge Neuronen (DpN) im ventralen Zwischenhirn (Dn) des Zebrafischgehirns spezifisch abzutragen. Immunfluoreszenz zeigte mehr als 85% der DpN-Ablation am dritten Tag nach der Läsion und die vollständige Wiederherstellung von DpN an der Läsionsstelle 30 Tage nach der Läsion. Die vorliegende Studie bestimmte die Beeinträchtigung und anschließende Erholung des Schwimmverhaltens von Zebrafischen nach einer Läsion unter Verwendung des Freifeldtests, durch den zwei Parameter, zurückgelegte Entfernung (cm) und mittlere Geschwindigkeit (cm / s), quantifiziert wurden. Die Fortbewegung wurde durch die Analyse der Aufzeichnungen einzelner Fische jeder Gruppe (n = 6) unter Verwendung einer Video-Tracking-Software bewertet. Die Ergebnisse zeigten eine signifikante (p < 0,0001) Verringerung der Geschwindigkeit (cm / s) und der zurückgelegten Entfernung (cm) von läsionierten Zebrafischen 3 Tage nach der Schärfe im Vergleich zu Schein. Der mit Läsionen versehene Zebrafisch zeigte 30 Tage nach der Läsion eine vollständige Erholung des Schwimmverhaltens. Die vorliegenden Ergebnisse deuten darauf hin, dass 6-OHDA-läsionierter erwachsener Zebrafisch ein ausgezeichnetes Modell mit reproduzierbarer Qualität ist, um die Untersuchung der Neuroregeneration bei Parkinson zu erleichtern. Zukünftige Studien zu den Mechanismen, die der Neuroregeneration zugrunde liegen, sowie zu intrinsischen und extrinsischen Faktoren, die den Prozess modulieren, können wichtige Einblicke in neue Zellersatzbehandlungsstrategien gegen Parkinson liefern.
Einleitung
Die Parkinson-Krankheit (PD), eine Krankheit, die durch Muskelsteifheit, Ruhetremor und Bradykinesie gekennzeichnet ist, ist die am schnellsten wachsende neurologische Erkrankung der Welt1,2. Das Risiko und die Prävalenz von Parkinson nehmen mit zunehmendem Alter rapide zu, insbesondere bei Personen im Alter von 50 Jahren und darüber3. Die Ätiologie und Pathogenese der Parkinson-Krankheit ist bisher kaum verstanden. Dies hat oft dazu geführt, dass der frühe Beginn der PD nicht diagnostiziert wurde. Gegenwärtig sind der Mangel an Dopamin und der Verlust von dopaminergen Neuronen (DpN) bei PD-Patienten stark mit der Manifestation motorischer Symptome verbunden4. Um diese Beziehung zu nutzen, wurden mehrere Behandlungen entwickelt, um entweder direkt als Dopaminersatz (dh Levodopa) zu wirken oder den Verlust von DpN (dh Tiefe Hirnstimulation) zu kompensieren. Obwohl diese Behandlungen symptomatische Vorteile mit sich bringen, verändern sie nicht den sich verschlechternden Krankheitsverlauf5. Angesichts dieser erheblichen Schwäche wurde eine Zellersatztherapie vorgeschlagen. Die Wirksamkeit dieses Ansatzes ist jedoch angesichts der Herausforderungen der Transplantatvorbereitung, der Zellwachstumskontrolle und der Phänotypinstabilität inkonsistent. Die Zellersatztherapie, die ethische Bedenken aufgeworfen hatte, birgt auch das Risiko, Hirntumore und unerwünschte Immunreaktionen auszulösen6,7.
Die Einschränkungen der derzeitigen therapeutischen Strategien haben dazu geführt, dass die Regeneration von DpN als potenzieller Ansatz bei der Behandlung von Parkinson stärker in den Vordergrund gerückt ist. Die Regeneration von DpN oder Neuroregeneration hat sich als einer der vielversprechenden Durchbrüche in der Behandlung von Parkinson herausgestellt, nicht nur aufgrund ihres Potenzials als neue therapeutische Methode, sondern auch als Mittel zum Verständnis des Mechanismus der Krankheit8. 9. Dieser Ansatz konzentriert sich auf die Wiederherstellung der neuronalen Funktion durch Differenzierung, Migration und Integration bestehender Vorläuferzellen in die läsionierten Schaltkreise10. Um die Neuroregeneration weiter zu erforschen, wurden verschiedene In-vivo-Studien durchgeführt. Es wurde festgestellt, dass Wirbeltiere wie Säugetiere, Amphibien und Reptilien nach Verletzungen neue Gehirnzellen erzeugen11,12. Unter den Wirbeltieren sind Säugetiere aufgrund ihrer genetischen Ähnlichkeit mit dem Menschen begehrter. Säugetiere weisen jedoch eine begrenzte und schlechte Reparationskapazität im zentralen Nervensystem (ZNS) auf, die nach einer Hirnläsion bis ins Erwachsenenalter andauern kann13. Im Allgemeinen sind Säugetiere als Tiermodelle für das Verständnis der Neuroregeneration ungeeignet, da die geringe Anzahl der produzierten Neuronen nicht ausreicht, um beschädigte neuronale Schaltkreise, die bei PD beobachtet werden, wiederherzustellen. Daher wird das teleostbasierte Modell, insbesondere bei Zebrafischen, aufgrund seiner hohen Proliferativrate, seiner Fähigkeit, sich kontinuierlich selbst zu erneuern, und der engen Gehirnhomologie mit dem Menschen stark bevorzugt14,15.
Zebrafisch wird am häufigsten verwendet, um Bewegungsstörungen bei PD16 zu untersuchen. Das auf Zebrafischen basierende PD-Modell wird normalerweise durch Neurotoxine induziert, zu denen 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP) und 6-Hydroxydopamin (6-OHDA)17 gehören. Obwohl MPTP-basierte Modelle den spezifischen Verlust von DpN und die Abnahme des Dopaminspiegels wirksam induzieren, ahmen sie die Bedingungen von PD nicht genau nach, da der DpN-Verlust nicht ausschließlich auf das CNS18 beschränkt ist. Die Unfähigkeit von 6-OHDA, die Blut-Hirn-Schranke zu überwinden, schränkte seine Auswirkungen auf zelluläre und funktionelle Veränderungen im Gehirn ein, wenn es intrakraniell verabreicht wird, im Gegensatz zu intramuskulär19. Die periphere Verabreichung von 6-OHDA führte zu einer globalen Senkung des Dopaminspiegels im gesamten Nervensystem20. Während die Verabreichung von 6-OHDA in die Zerebrospinalflüssigkeit eine Ablation von DpN im gesamten ZNS21 verursachte, was nicht den Zustand nachahmt, wie er bei PD beobachtet wird, wobei der Verlust von DpN speziell an der Substantia nigra des menschlichen Gehirns auftritt. Die ICV-Verabreichung von 6-OHDA hingegen induzierte spezifisch eine signifikante Ablation von DpN im Bereich des ventralen Dn im Zebrafischgehirn, die Substantia nigra22 sehr ähnlich war. Interessanterweise wurde eine Erholung von DpN 30 Tage nach der 6-OHDA-induzierten Läsion berichtet und diese Neuronen überlebten im Laufe des Lebens23,24. Die funktionelle Erholung von DpN wurde durch eine lokomotorische Bewertung der zurückgelegten Strecke (cm) und der mittleren Geschwindigkeit (cm/s) unter Verwendung des 6-OHDA-induzierten PD-Modells für erwachsene Zebrafische22 nachgewiesen.
Protokoll
Die vorliegende Studie wurde vom Committee on Animal Research and Ethics (CARE), Universiti Technologi MARA (UiTM) genehmigt [Reference No: UiTM CARE 346/2021, datiert vom 7. Mai 2021].
HINWEIS: Die veröffentlichten Protokolle22,25,26 für die Standardhaltung und Wartung des 6-OHDA-läsionierten adulten Zebrafisch-PD-Modells wurden verwendet. Die Experimente wurden mit erwachsenen männlichen Zebrafischen (Danio rerio) im Alter von mehr als fünf Monaten mit einer standardisierten Länge von 3,2-3,7 cm durchgeführt.
1. Zebrafischpflege und Prä-ICV-Mikroinjektionspräparate
- Halten Sie die Fische in einem belüfteten Wassertank unter einer kontrollierten Temperatur von 28 ± 1,0 ° C. Verwenden Sie für die Haltung und Pflege von Zebrafischen während des gesamten Experiments destilliertes Wasser, das mit kommerziellem Meersalz (1 g/L) mineralisiert ist27.
- Unterbringen Sie maximal 25 Fische pro 45 l Tank oder einen Fisch pro 1,8 l Wasser und setzen Sie sie einem Zeitplan von 14 h hellem und 10 h dunkler Photoperiode aus. Füttern Sie die Fische mindestens zweimal täglich mit Futterpellets, die mit gefriergetrockneten Würmern ergänzt werden.
- Es wird eine konzentrierte Stammlösung von Tricainmethansulfonat (MS-222) hergestellt, indem 2,5 g MS-222 und 5 g Natriumbicarbonat in 250 ml destilliertem Wasser gelöst werden. Verdünnen Sie 2 ml Stammlösung, um 200 ml Arbeitsanästhesielösung herzustellen.
- Herstellen Sie 99,96 mM 6-OHDA, indem Sie zuerst 0,2 mg Ascorbinsäure in 1 ml 0,9% w/v sterilfiltriertem NaCl auflösen. Filtern Sie die Lösung mit einem 0,2-Mikron-Filter, bevor Sie 25 mg 6-OHDA in Pulverform in die Lösung geben. Bereiten Sie die Lösung vor jeder Injektion frisch vor und lagern Sie sie bei Dunkelheit bei 4 °C.
VORSICHT: Tragen Sie geeignete persönliche Schutzausrüstung (z. B. Handschuhe, Laborkittel und Gesichtsmaske) und praktizieren Sie beim Umgang mit den Chemikalien gute Laborpraktiken. Alle Handhabungen der Chemikalien sollten innerhalb einer Biosicherheitskabine erfolgen.
2. Anästhesie und ICV-Injektion von Zebrafischen
- Fasten Sie den Fisch für 24 h, um ein Aufstoßen während der Anästhesie zu vermeiden. Betäuben Sie den Fisch, indem Sie ihn für ca. 1 min oder bis zur Einstellung aller sichtbaren Muskelbewegungen in einen Behälter mit 0,01% w/v MS-222-Lösung tauchen.
- Positionieren Sie den betäubten Fisch auf einem wassergetränkten Schwamm unter einem Stereomikroskop und befeuchten Sie den Fisch regelmäßig.
- Identifizieren Sie die Position für die Injektion basierend auf dem Schnittpunkt zwischen der metopischen Naht (MS), der koronalen Naht (CS) und der sagittalen Naht (SS), die den frontalen und parietalen Schädel des Zebrafischgehirns verbindet.
- Machen Sie ein kleines Loch mit einer Fläche von 1,0 mm2 mit einer scharfen 27-G-Nadel im Schädel, die von der spezifischen anatomischen Position auf dem Zebrafischschädel geleitet wird (Abbildung 1A, B).
- Senken Sie den Mikrokapillarinjektor in einem Winkel von 60° ab, bis er eine Tiefe von 1.200 μm vom Schädeldach des Zebrafischschädels erreicht (Abbildung 1C). Drücken Sie die Z-Grenze, um die Position zu fixieren.
- Stellen Sie den anfänglichen Einspritzdruck auf 4000 hPa und den Kompensationsdruck auf 10 hPa ein. Stellen Sie die Dauer der Injektion auf 0,3 s ein. Verringern Sie die Intensität der Injektion mit jeder nachfolgenden Injektion.
- Injizieren Sie 0,5 μL 99,96 mM Neurotoxin 6-OHDA (oder 0,9% w/v Kochsalzlösung für Scheinkontrollgruppe) und lassen Sie die Mikrokapillare für 20 s ruhen. Befeuchten Sie den Fisch während des gesamten Injektionsprozesses weiterhin mit destilliertem Wasser, um ein Austrocknen zu verhindern.
- Entfernen Sie langsam die Mikrokapillare und beleben Sie den Fisch unter fließendem destilliertem Wasser. Legen Sie den Fisch in ein isoliertes Auffangbecken und entfernen Sie alle Ablenkungen, die den Genesungsprozess stören können.
- Spülen Sie die Mikrokapillare vor der nächsten Injektion, um die Blockade zu beseitigen und sicherzustellen, dass die Intensität der Injektion ausreicht, um das gewünschte Volumen von 0,5 μL 6-OHDA zu erhalten.
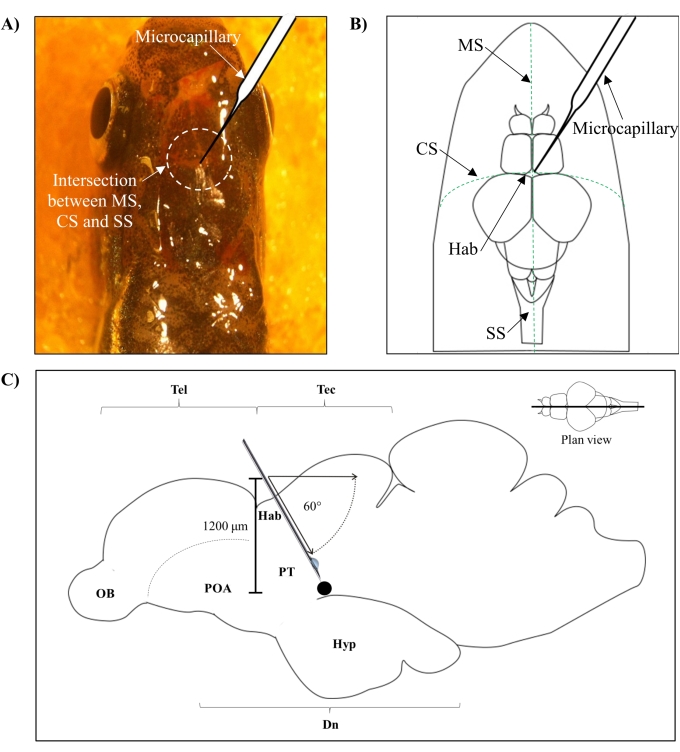
Abbildung 1: Injektionsstelle des Neurotoxins, 6-OHDA. (A) Der Punkt des mikrokapillaren Eintritts wird durch den Schnittpunkt zwischen der metopischen Naht (MS), der koronalen Naht (CS) und der sagittalen Naht (SS) geleitet, die den frontalen und parietalen Schädel des Zebrafischgehirns verbindet (Draufsicht). (B) Eine schematische Zeichnung (Draufsicht) des Zebrafischschädels und des Gehirns zeigt die Mikrokapillare, die direkt über der Habenula (Hab) abgesenkt ist, und ihren Eintrittspunkt an der Kreuzung zwischen den Hemisphären. (C) Eine schematische Zeichnung (sagittaler Schnitt) des Zebrafischgehirns zeigt den Injektionswinkel und die Eindringtiefe. Der schwarze Punkt stellt die läsionierte Stelle dar, die sich über dem Zielbereich, dem ventralen Zwischenhirn, befindet. Abkürzungen: 6-OHDA: 6-Hydroxydopamin, CS: koronale Naht, Dn: diencephalon, Hab: habenula, Hyp: hypothalamus, MS: metopische Naht, OB: Riechkolben, POA: präoptischer Bereich, PT: posteriores Tuberculum, SS: sagittale Naht, Tectum, und Tel: Telencephalon. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Beurteilung des Bewegungsapparates
HINWEIS: Die lokomotorische Beurteilung von Zebrafischen (n = sechs / Gruppe; Schein vs. Läsion) wurde individuell über den offenen Tanktest unter Verwendung der etablierten Protokolle28,29 am dritten Tag und am Tag 30 nach der 6-OHDA-Läsion beurteilt.
- Videoaufzeichnung
- Stellen Sie den Versuchstank (Länge 20 cm, Breite 11,5 cm, Höhe 13 cm) mit seinen mit weißem Papier bedeckten Wänden auf eine erhöhte Plattform (Abbildung 2A).
- Beleuchten Sie den Tank von unten mit einer Lichtquelle. Füllen Sie den Tank mit destilliertem Wasser (80% -90% voll) und halten Sie die Temperatur bei 28 ± 1,0 ° C. Messen Sie die Temperatur mit einem Thermometer und regulieren Sie sie mit einer handelsüblichen Aquarienheizung.
- Zeichnen Sie nach mindestens 2 Minuten Akklimatisierung das Schwimmverhalten der Fische aus einer Draufsicht auf der 2-dimensionalen (2D) Ebene der Versuchsarena mit einer Videokamera für 5 Minuten auf (Abbildung 2B). Um Inkonsistenzen im Schwimmverhalten der früheren und letzten Charge von Aufnahmen zu vermeiden, überschreiten Sie die Akklimatisierung nicht um 10 min30.
- Analysieren Sie die Videos mit einer Video-Tracking-Software mit dem Open-Tank-Protokoll zur Erfassung der zurückgelegten Strecke (cm) und der mittleren Geschwindigkeit (cm / s) jedes Motivs.

Abbildung 2: Versuchsaufbau eines offenen Tanktests zur Beurteilung des Bewegungsmotorverhaltens von Zebrafischen . (A) Der Versuchstank (Vorderansicht) befindet sich auf einer erhöhten Plattform, die von unten beleuchtet wird. Die vier Wände des Tanks sind mit weißem Papier bedeckt und die Aufnahmen werden axial erfasst. Die Temperatur wird mit einem Thermometer gemessen und mit einer handelsüblichen Aquarienheizung bei 28 ± 1,0 °C geregelt. (B) Screenshot (Draufsicht) der Videoaufzeichnung, die mit dem Setup aufgenommen wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Datenanalyse
- Doppelklicken Sie auf das Symbol, um die Video-Tracking-Software zu öffnen. Klicken Sie auf die Registerkarte Datei und wählen Sie Neues leeres Experiment erstellen aus. Dies ermöglicht es dem Benutzer, die Experimentparameter entsprechend den Zielen der Untersuchung anzupassen.
- Klicken Sie auf die Registerkarte Protokoll , wählen Sie Videoquellen und klicken Sie auf Neue Videoquelle hinzufügen. Klicken Sie auf die verfügbare Dropdown-Liste und wählen Sie die Option Videodatei . Dadurch wird das Popup-Fenster zum Durchsuchen der Datei angezeigt, aus dem die gewünschten Videoaufzeichnungen ausgewählt werden können.
- Klicken Sie auf die Unterregisterkarte Gerät und wählen Sie das rechteckige Symbol, um das Gerät einzurichten. Ziehen Sie das rechteckige Symbol, um die gesamte experimentelle Arena abzudecken. Stellen Sie den Maßstabsbalken entsprechend ein und geben Sie den numerischen Wert der Skalenmessung ein, die in der Länge des Linealabschnitts verwendet wird. Das vorliegende Experiment verwendete eine 10-mm-Skala für den offenen Tanktest.
- Legen Sie die Tierfarbe fest, indem Sie Die Tiere sind dunkler als der Gerätehintergrund auswählen. Behalten Sie die anderen verfügbaren Optionen in der Nachverfolgung den voreingestellten Standardeinstellungen bei.
- Klicken Sie auf der Unterregisterkarte Zonen auf das zuvor gezeichnete Gerät. Diese Zone wird als Standardzone festgelegt, deren Position für alle Tests gleich ist.
- Wählen Sie unter Testplanung und Testdatenbericht die folgenden Optionen aus: Testdauer, Gesamtzurückgelegte Strecke und Durchschnittsgeschwindigkeit. Andere verfügbare Tests auf der Liste sind optional und hängen vom Untersuchungsinteresse des Forschers ab.
- Weisen Sie auf der Registerkarte Versuch die Tiere entsprechend ihrer Testgruppe zu, indem Sie den Gruppennamen im Abschnitt Name und die Anzahl der Tiere pro Gruppe im Abschnitt Anzahl der Tiere eingeben.
- Wechseln Sie zur Registerkarte Tests , um den Test auszuführen. Klicken Sie auf das Symbol Test starten und warten Sie, bis alle Videos analysiert sind.
- Klicken Sie auf der Registerkarte Ergebnisse auf das Symbol Bericht anzeigen , um die Bewegungsdaten im Textberichtsformular anzuzeigen.
Ergebnisse
Das vorliegende Experiment untersuchte die Veränderungen des Schwimmverhaltens erwachsener Zebrafische nach ICV-Mikroinjektion mit 6-OHDA. Der Grund für die Verwendung von 6-OHDA als Neurotoxin der Wahl lag in seiner Unfähigkeit, die Blut-Hirn-Schranke zu überwinden, was zu einer spezifischen und gezielten Ablation von DpN im Bereich des interventralen Zwischenhirns (Dn)16 führte. Die DpN-Subpopulation hat hier anatomische Ähnlichkeit mit der DpN-Subpopulation in der Substantia nigra pars
Diskussion
Die vorliegende Arbeit demonstrierte erfolgreich die lokomotorische Beurteilung des etablierten 6-OHDA-induzierten, adulten Zebrafisch-basierten PD-Modells. Das gesamte Experiment umfasste drei Hauptschritte: Prä-ICV-Mikroinjektionspräparate, ICV-Mikroinjektion von Zebrafischen und lokomotorische Bewertung. Um die gesunde Erholung von erwachsenen Zebrafischen nach dem ICV-Mikroinjektionsverfahren und gute experimentelle Ergebnisse zu gewährleisten, wurden in der vorliegenden Studie einige gute Praktiken für jeden Sch...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde vom malaysischen Ministerium für Hochschulbildung im Rahmen des Fundamental Research Grant Scheme [600-IRMI/FRGS 5/3 (033/2019)] unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
Referenzen
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten