A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת לוקומוטור של מודל מחלת פרקינסון למבוגרים המושרה על ידי 6-הידרוקסידופמין
In This Article
Summary
הפרוטוקול הנוכחי מתאר את ההזרקה התוך-חדרית (ICV) של דגי זברה בוגרים עם נוירוטוקסי-הידרוקסידופאמין (6-OHDA) בדיאנספלון הגחוני (Dn) ואת הערכת הליקוי וההתאוששות שלאחר מכן של פוסטלציה של התנהגות שחייה באמצעות מבחן הטנק הפתוח, המלווה בניתוח באמצעות תוכנת מעקב וידאו.
Abstract
המגבלות של הטיפולים הנוכחיים בעיכוב אובדן עצבי דופאמין במחלת פרקינסון (PD) להעלות את הצורך טיפולים חלופיים שיכולים לשחזר נוירונים אלה. מאמץ רב מופנה כיום להבנה טובה יותר של ניוון עצבי באמצעות מודלים פרה-קליניים ב- vivo . עם זאת, יכולת רגנרטיבית זו לתיקון עצמי אינה יעילה ביונקים. בעלי חיים שאינם יונקים כמו דגי זברה התגלו כך כמודל נוירו-גנרטיבי מצוין בשל יכולתו לחדש את עצמם ללא הרף ויש להם הומולוגיית מוח קרובה לבני אדם. כחלק מהמאמץ להבהיר אירועים תאיים המעורבים בארגון עצבי ב- vivo, הקמנו את מודל PD למבוגרים המבוסס על דגי זברה למבוגרים המושרה על ידי 6-HYDROXYDopamine (6-OHDA). זה הושג באמצעות אופטימיזציה תוך שרירית (ICV) microinjection של 99.96 mM 6-OHDA כדי במיוחד ablate נוירונים דופאמין (DpN) ב diencephalon הגחוני (Dn) של המוח דגי זברה. Immunofluorescence הצביע על יותר מ 85% של אבלציה DpN ביום השלישי postlesion ושיקום מלא של DpN באתר lesioned 30 ימים postlesionion. המחקר הנוכחי קבע את הליקוי ואת ההתאוששות שלאחר מכן של התנהגות שחייה של דגי זברה בעקבות נגע באמצעות מבחן השדה הפתוח שדרכו כימתו שני פרמטרים, מרחק נסע (ס"מ) ומהירות ממוצעת (ס"מ /s), היו מכמתים. התנועה הוערכה על ידי ניתוח ההקלטות של דגים בודדים של כל קבוצה (n = 6) באמצעות תוכנת מעקב וידאו. הממצאים הראו ירידה משמעותית (p < 0.0001) במהירות (ס"מ/ים) ובמרחק נסע (ס"מ) של דגי זברה נגועים 3 ימים postlesion בהשוואה לזיוף. דגי הזברה הנגעים הפגינו התאוששות מלאה של התנהגות השחייה 30 יום לאחר מכן. הממצאים הנוכחיים מראים כי 6-OHDA נגע זברה בוגר הוא מודל מצוין עם איכות רבייה כדי להקל על המחקר של neuroregeneration ב PD. מחקרים עתידיים על המנגנונים שבבסיס neuroregeneration, כמו גם גורמים פנימיים וחיצוניים לווסת את התהליך עשוי לספק תובנה חשובה לתוך אסטרטגיות טיפול החלפת תאים חדשים נגד PD.
Introduction
מחלת פרקינסון (PD), מחלה המאופיינת באופן ייחודי על ידי קשיחות שרירים, רעד במנוחה וברדיקינזיה, היא המחלה הנוירולוגית הגדלה במהירות הגבוהה ביותר בעולם1,2. הסיכון והשכיחות של PD להגדיל במהירות עם הגיל במיוחד אצל אנשים בגילאי 50 ומעלה. האטיולוגיה והפתוגנזה של PD עד כה נשארים מובנים בצורה גרועה. זה לעתים קרובות השאיר את ההתחלה המוקדמת של PD לא מאובחנת. נכון לעכשיו, חוסר דופמין ואובדן נוירונים דופאמין (DpN) בחולי PD קשורים מאוד לביטוי של סימפטומים מוטוריים4. ניצול מערכת יחסים זו, מספר טיפולים תוכננו או לפעול ישירות כתחליף דופמין (כלומר, levodopa) או כדי לפצות על אובדן DpN (כלומר, גירוי מוחי עמוק). למרות טיפולים אלה להביא יתרונות סימפטומטיים, הם אינם משנים את מהלך הידרדרות של המחלה5. לאור חולשה משמעותית זו, הוצע טיפול בתחליפי תאים. היעילות של גישה זו, עם זאת, אינה עקבית בהתחשב באתגרים של הכנת שתל, בקרת צמיחת תאים, וחוסר יציבות פנוטיפ. טיפול בתחליפי תאים, שהעלה חששות אתיים, מהווה גם את הסיכון לגרימת גידולים במוח ותגובות חיסוניות לא רצויות6,7.
המגבלות של אסטרטגיות טיפוליות נוכחיות הובילו לדגש רב יותר על התחדשות של DpN כגישה פוטנציאלית בטיפול PD. התחדשות של DpN או neuroregeneration התפתחה כאחת מפריצות הדרך המבטיחות בניהול PD, לא רק בשל הפוטנציאל שלה כשיטה טיפולית חדשה, אלא גם כאמצעי להבין את המנגנון של המחלה8, 9. גישה זו מתמקדת בשיקום התפקוד העצבי באמצעות בידול, הגירה ושילוב של תאי אב קיימים במעגלים הנגעים10. על מנת להמשיך לחקור neuroregeneration, מחקרים שונים ב vivo בוצעו. נמצא כי בעלי חוליות כגון יונקים, דו-חיים וזוחלים מייצרים תאי מוח חדשים בעקבות פציעה של 11,12. בקרב בעלי החוליות, בעלי חיים יונקים מבוקשים יותר בהתחשב בדמיון הגנטי שלהם לבני אדם. יונקים, לעומת זאת, מפגינים יכולת תיקון מוגבלת וענייה במערכת העצבים המרכזית (CNS) שיכולה להימשך עד הבגרות בעקבות נגע במוח13. באופן כללי, יונקים אינם מתאימים כמודלים בעלי חיים להבנת neuroregeneration בהתחשב בכך מספר נמוך של נוירונים המיוצרים לא יהיה מספיק כדי לשחזר מעגלים עצביים פגומים שנצפו PD. ככזה, המודל המבוסס על טלוסט, במיוחד בדגי זברה, מועדף מאוד על קצב ההתפשטות הגבוה שלו, היכולת לחדש את עצמו ברציפות, ולסגור את ההומולוגיה המוחית עם בני אדם 14,15.
דגי זברה משמשים בדרך כלל לחקר תנועה פרועה ב- PD16. מודל PD מבוסס דגי זברה מושרה בדרך כלל על ידי רעלנים עצביים, הכוללים 1-מתיל-4-פניל-1,2,3,3,6-טטרהידרופירידין (MPTP) ו 6-הידרוקסידופאמין (6-OHDA)17. למרות יעיל גרימת אובדן ספציפי של DpN וירידה של רמות הדופאמין, מודלים מבוססי MPTP אינם מחקים מקרוב את התנאים של PD כמו אובדן DpN אינו מוגבל אך ורק CNS18. חוסר היכולת של 6-OHDA לחצות את מחסום הדם - מוח הגביל את השפעותיו על שינויים תאיים ותפקודיים בתוך המוח כאשר הוא מנוהל תוך גולגולתי לעומת תוך שרירית19. ניהול היקפי של 6-OHDA גרם לירידה גלובלית של רמות הדופאמין בכל מערכת העצבים20. בעוד מתן של 6-OHDA לתוך הנוזל השדרתי גרם אבלציה של DpN ברחבי CNS21, אשר אינו מחקה את המצב כפי שנראה PD לפיו אובדן DpN מתרחשת במיוחד בסובסטנציה ניגרה של המוח האנושי. ניהול ICV של 6-OHDA, להיפך, במיוחד גרם אבלציה משמעותית של DpN באזור של Dn הגחון במוח דג הזברה, אשר דומה מאוד סובסטנציה nigra22. מעניין, התאוששות של DpN דווחה 30 ימים לאחר נגע 6-OHDA המושרה נוירונים אלה שרדו במהלך החיים23,24. ההתאוששות הפונקציונלית של DpN הודגמה באמצעות הערכת לוקומוטור של המרחק שעבר (ס"מ) ומהירות ממוצעת (ס"מ/ים) באמצעות דגם PD למבוגרים מבוסס זברה 6-OHDA מבוססי דגי זברה22.
Protocol
המחקר הנוכחי אושר על ידי הוועדה לחקר בעלי חיים ואתיקה (CARE), האוניברסיטה טכנולוגית MARA (UiTM) [התייחסות לא: UiTM CARE 346/2021, מיום 7 במאי 2021].
הערה: הפרוטוקולים שפורסמו2,25,26 עבור גידול ותחזוקה סטנדרטיים של מודל PD דג זברה למבוגרים 6-OHDA נגע נוצלו. הניסויים נערכו עם דגי זברה זכריים בוגרים (דניו ריו) בני יותר מחמישה חודשים עם אורך סטנדרטי של 3.2-3.7 ס"מ.
1. תחזוקת דגי זברה ותכשירי מיקרו-ICV לפני ה-ICV
- לשמור על הדגים במיכל מים מאוורר תחת טמפרטורה מבוקרת של 28 ± 1.0 °C (50 °F). לגידול ותחזוקה של דגי זברה, יש להשתמש במים מזוקקים עם מלח ים מסחרי (1 גרם/ליטר) לאורך הניסוי27.
- בית מקסימום של 25 דגים לכל מיכל 45 L או דג אחד לכל מים 1.8 L ולחשוף אותם ללוח זמנים של 14 שעות אור ו 10 שעות פוטופריוד כהה. להאכיל את הדגים לפחות פעמיים ביום עם כדורי מזון בתוספת תולעים מיובשות בהקפאה.
- הכן פתרון מלאי מרוכז של טריקאין מתנסלפונט (MS-222) על ידי המסת 2.5 גרם של MS-222 ו 5 גרם של ביקרבונט נתרן ב 250 מ"ל של מים מזוקקים. לדלל 2 מ"ל של פתרון מלאי כדי לייצר 200 מ"ל של פתרון הרדמה עובד.
- הכן 99.96 מ"מ של 6-OHDA על ידי המסה ראשונה 0.2 מ"ג של חומצה אסקורבית ב 1 מ"ל של 0.9% w / v מסנן סטרילי NaCl. סנן את הפתרון עם מסנן 0.2 מיקרון לפני הוספת 25 מ"ג של 6-OHDA בצורת אבקה לתמיסה. הכן את הפתרון טרי לפני כל זריקה ולאחסן אותו בחושך ב 4 °C (60 °F).
אזהרה: יש ללבוש ציוד מגן אישי מתאים (כלומר כפפות, מעיל מעבדה ומסכת פנים) ולתרגל שיטות מעבדה טובות בעת הטיפול בכימיקלים. כל הטיפולים בכימיקלים צריכים להיעשות בתוך ארון בטיחות ביולוגית.
2. הרדמה והזרקת ICV של דגי זברה
- לצום את הדגים במשך 24 שעות כדי למנוע regurgitation במהלך הרדמה. להרדים את הדג על ידי טבילתו לתוך מיכל המכיל 0.01% w / v של פתרון MS-222 במשך כ 1 דקה או עד כל התנועה השרירית הנראית לעין מפסיק.
- מקם את הדגים המרדים על ספוג ספוג מים שהונח מתחת לסטריאומיקרוסקופ והרטיב את הדגים באופן קבוע.
- זהה את המיקום להזרקה בהתבסס על ההצטלבות בין תפר metopic (MS), תפר קורונלי (CS), ותפר קשתי (SS) המחבר את הגולגולת הקדמית והקודקודית של מוח דג הזברה.
- צור חור קטן של שטח 1.0 מ"מ2 באמצעות מחט חדה של 27 גרם בגולגולת מונחה על ידי המיקום האנטומי הספציפי על גולגולת דג הזברה (איור 1A, B).
- מנמיכים את מזרק המיקרו-קפילרי בזווית של 60° עד שהוא מגיע לעומק של 1,200 מיקרומטר מגג הגולגולת הגולגולתי של גולגולת דג הזברה (איור 1C). הקש על מגבלת Z כדי לתקן את המיקום.
- הגדר את לחץ ההזרקה הראשוני ל 4000 hPa ולחץ פיצוי ל 10 hPa. הגדר את משך ההזרקה ל-0.3 שניות. מנמיכים את עוצמת ההזרקה עם כל זריקה עוקבת.
- להזריק 0.5 μL של 99.96 mM neurotoxin 6-OHDA (או 0.9% w / v מלוחים עבור קבוצת בקרה מזויפת) ולתת microcapillary לנוח במשך 20 שניות. ממשיכים להרטיב את הדגים במים מזוקקים לאורך כל תהליך ההזרקה כדי למנוע התייבשות.
- הסירו באיטיות את המיקרו-קפרילריה והחיו את הדגים תחת מים מזוקקים זורמים. מניחים את הדגים במיכל התאוששות מבודד ומסירים כל הסחת דעת שעלולה להפריע לתהליך ההחלמה.
- לשטוף את microcapillary לפני הזריקה הבאה כדי לנקות את החסימה ולוודא כי עוצמת ההזרקה מספיק כדי להניב את הנפח הרצוי של 0.5 μL של 6-OHDA.
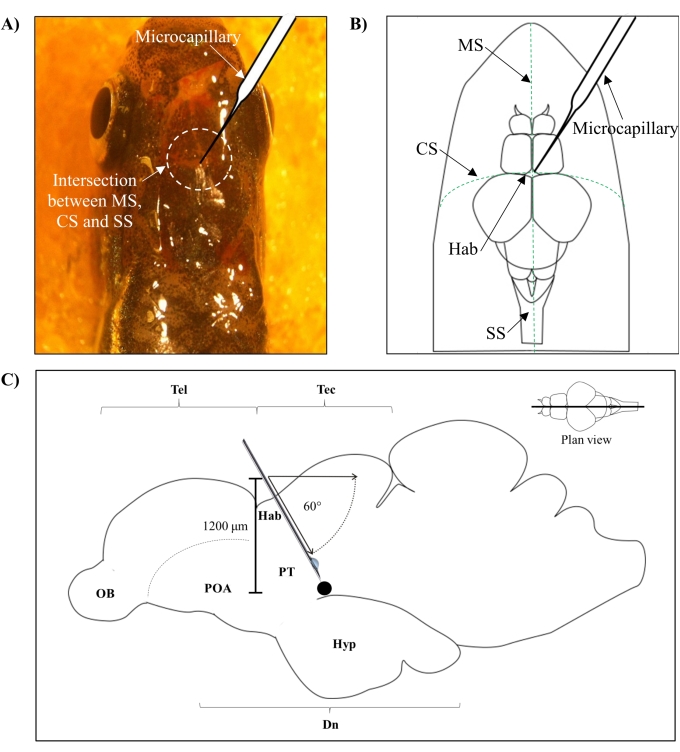
איור 1: אתר הזרקה של רעלן עצבי, 6-OHDA. (A) נקודת הכניסה המיקרו-קפילרית מונחית על ידי ההצטלבות בין התפר המטופי (טרשת נפוצה), תפר קורונלי (CS) ותפר קשתי (SS) המחבר בין הגולגולת הקדמית והקודקודית של מוח דגי הזברה (תצוגת תוכנית). (ב) שרטוט סכמטי (תצוגת תוכנית) של הגולגולת והמוח של דגי הזברה מראה את המיקרו-קפילרי, אשר מונמך ישירות מעל האבנולה (Hab), ואת נקודת הכניסה שלו בצומת שבין ההמיספרות. (C) שרטוט סכמטי (חלק קשתי) של מוח דגי הזברה מראה את זווית ההזרקה ועומק החדירה. הנקודה השחורה מייצגת את האתר הנגע הממוקם מעל האזור המיועד, הדיאנספלון הגחוני. קיצורים: 6-OHDA: 6-hydroxydopamine, CS: תפר קורונלי, Dn: diencephalon, Hab: habenula, Hyp: hypothalamus, MS: תפר metopic, OB: נורת חוש הריח, POA: אזור טרום ניתוחי, PT: שחפת אחורית, SS: תפר קשתי, טק: טק: טקטון, וטל: טלנספלון. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. הערכת לוקומוטור
הערה: הערכת Locomotor של דגי זברה (n = שישה / קבוצה; זיוף לעומת נגע) הוערך בנפרד באמצעות מבחן הטנק הפתוח באמצעות פרוטוקולים שנקבעו28,29 ביום השלישי וביום 30 לאחר נגע 6-OHDA.
- הקלטת וידאו
- הניחו את מיכל הניסוי (אורך 20 ס"מ, רוחב 11.5 ס"מ, גובה 13 ס"מ) כשקירותיו מכוסים בנייר לבן על פלטפורמה מוגבהת (איור 2A).
- להאיר את הטנק מלמטה באמצעות מקור אור. מלאו את המיכל במים מזוקקים (80%-90% מלאים) ושמרו על הטמפרטורה ב-28 ± 1.0 מעלות צלזיוס. למדוד את הטמפרטורה באמצעות מדחום ולווסת אותו באמצעות תנור אקווריום מסחרי.
- לאחר מינימום של 2 דקות של התאקלמות, תיעדו את התנהגות השחייה של הדגים מתצוגה מתוכננת במישור הדו-ממדי (דו-ממדי) של הזירה הניסיונית באמצעות מצלמת וידאו למשך 5 דקות (איור 2B). כדי למנוע חוסר עקביות בהתנהגות השחייה של הקבוצה הקודמת והאחרונה של הקלטות, אין לחרוג מההתאקלמות עד 10 דקות.
- נתח את הסרטונים באמצעות תוכנת מעקב וידאו עם פרוטוקול הטנק הפתוח לרכישת מרחק נסע (ס"מ) ומהירות ממוצעת (ס"מ/ים) של כל נושא.

איור 2: התקנה ניסיונית של מבחן טנק פתוח להערכת התנהגות לוקומוטור דגי זברה. (א) הטנק הניסיוני (מבט קדמי) ממוקם על פלטפורמה מוגבהת המוארת מלמטה. ארבעת הקירות של הטנק מכוסים בנייר לבן וההקלטות נלכדות באופן אקסיאלי. הטמפרטורה נמדדת באמצעות מדחום ומווסתת ב 28 ± 1.0 °C (50 °F) באמצעות תנור אקווריום מסחרי. (ב) צילום מסך (תצוגת תוכנית) של הקלטת וידאו שנלכדת באמצעות ההתקנה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- ניתוח נתונים
- לחץ פעמיים על הסמל כדי לפתוח את תוכנת מעקב הווידאו. לחץ על הכרטיסיה קובץ ובחר צור ניסוי ריק חדש. זה יאפשר למשתמש להתאים אישית את פרמטרי הניסוי בהתאם למטרות החקירה.
- לחץ על הכרטיסיה פרוטוקול , בחר מקורות וידאו ולחץ על הוסף מקור וידאו חדש. לחץ על הרשימה הנפתחת הזמינה ובחר באפשרות קובץ וידאו . פעולה זו תציג בקשה לקובץ המוקפץ שממנו ניתן לבחור את הקלטות הווידאו מעניינות.
- לחץ על תת הפעולה של המנגנון ובחר את הסמל המלבני כדי להגדיר את המנגנון. גרור את הסמל המלבני כדי לכסות את כל הזירה הניסיונית. הגדר את סרגל קנה המידה בהתאם והזן את הערך המספרי של מדידת קנה המידה המשמשת באורך מקטע הסרגל. הניסוי הנוכחי השתמש בקנה מידה של 10 מ"מ לניסוי הטנק הפתוח.
- הגדר את צבע החיה על-ידי בחירת החיות כהות יותר מרקע המנגנון. השאר את האפשרויות הזמינות האחרות במעקב להגדרות ברירת המחדל המוגדרות מראש.
- בכרטיסיה המשנה אזורים , לחץ על המנגנון שצויר בעבר. אזור זה מוגדר כאזור הסטנדרטי שבו המיקום זהה עבור כל הבדיקות.
- בחר את האפשרויות הבאות תחת דוח נתוני תזמון ובדיקה: משך בדיקה, מרחק כולל נסיעה ומהירות ממוצעת. בדיקות זמינות אחרות ברשימה הן אופציונליות ותלויות בעניין החקירה של החוקר.
- בכרטיסיה ניסוי , הקצה את בעלי החיים בהתאם לקבוצת הניסוי שלהם על-ידי הקלדת שם הקבוצה תחת המקטע שם ומספר בעלי החיים לקבוצה במקטע מספר בעלי חיים .
- עבור לכרטיסיה בדיקות כדי להפעיל את הניסוי. לחץ על סמל בדיקת התחל והמתן עד שכל הסרטונים ינותחו.
- בכרטיסיה תוצאות , לחץ על הסמל הצג את הדוח כדי להציג את נתוני Locomotor בטופס דוח טקסט.
תוצאות
הניסוי הנוכחי העריך את השינויים בהתנהגות השחייה של דגי זברה למבוגרים בעקבות מיקרו-ICV עם 6-OHDA. הסיבה לשימוש 6-OHDA כמו neurotoxin של בחירה נבע חוסר היכולת שלה לחצות את מחסום הדם - מוח, אשר הפיק אבלציה ספציפית וממוקדת של DpN בתחום של דיאנספלון עניין-גחון (Dn)16. אוכלוסיית המשנה של DpN כאן מחזיקה...
Discussion
העבודה הנוכחית הדגימה בהצלחה את הערכת הלוקומוטור של מודל ה-PD המבוסס על דגי זברה למבוגרים בגודל 6-OHDA. הניסוי כולו כלל שלושה שלבים עיקריים: תכשירי מיקרו-ג'ינג'ים טרום-ICV, מיקרו-ICV של דגי זברה והערכה של לוקומוטור. כדי להבטיח התאוששות בריאה של דגי זברה בוגרים בעקבות הליך microinjection ICV ותוצאה ניסיוני?...
Disclosures
המחברים מצהירים שאין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי המשרד להשכלה גבוהה מלזיה במסגרת תוכנית מענק המחקר הבסיסי [600-IRMI/FRGS 5/3 (033/2019)].
Materials
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
References
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved