Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación locomotora del modelo de enfermedad de Parkinson basado en pez cebra adulto inducido por 6-hidroxidopamina
En este artículo
Resumen
El presente protocolo describe la inyección intraerebroventricular (ICV) de pez cebra adulto con 6-hidroxidopamina neurotóxica (6-OHDA) en el diencéfalo ventral (Dn) y la evaluación del deterioro y posterior recuperación del comportamiento de natación postlesión mediante el uso de la prueba de tanque abierto, que se acompaña de análisis utilizando un software de seguimiento de video.
Resumen
Las limitaciones de los tratamientos actuales para retrasar la pérdida neuronal dopaminérgica en la enfermedad de Parkinson (EP) plantean la necesidad de terapias alternativas que puedan restaurar estas neuronas. Mucho esfuerzo se dirige actualmente hacia una mejor comprensión de la neurorregeneración utilizando modelos preclínicos in vivo . Esta capacidad regenerativa para la autorreparación es, sin embargo, ineficiente en los mamíferos. Los animales no mamíferos como el pez cebra han surgido como un excelente modelo neurorregenerativo debido a su capacidad para autorrenovarse continuamente y tener una homología cerebral cercana a los humanos. Como parte del esfuerzo para dilucidar los eventos celulares involucrados en la neuroregeneración in vivo, hemos establecido el modelo de EP basado en pez cebra adulto inducido por 6-hidroxidopamina (6-OHDA). Esto se logró a través de la microinyección intracerebroventricular (ICV) optimizada de 99.96 mM 6-OHDA para extirpar específicamente las neuronas dopaminérgicas (DpN) en el diencéfalo ventral (Dn) del cerebro del pez cebra. La inmunofluorescencia indicó más del 85% de la ablación de DpN en el tercer día después de la eclosión y la restauración completa de DpN en el sitio lesionado 30 días después de la agresión. El presente estudio determinó el deterioro y posterior recuperación del comportamiento de natación del pez cebra tras la lesión mediante el uso de la prueba de campo abierto a través de la cual se cuantificaron dos parámetros, la distancia recorrida (cm) y la velocidad media (cm/s). La locomoción se evaluó analizando las grabaciones de peces individuales de cada grupo (n = 6) utilizando un software de seguimiento de video. Los hallazgos mostraron una reducción significativa (p < 0,0001) en la velocidad (cm / s) y la distancia recorrida (cm) del pez cebra lesionado 3 días después de la muerte en comparación con la farsa. El pez cebra lesionado exhibió una recuperación completa del comportamiento de natación 30 días después de la recesión. Los presentes hallazgos sugieren que el pez cebra adulto lesionado 6-OHDA es un excelente modelo con calidad reproducible para facilitar el estudio de la neurorregeneración en la EP. Los estudios futuros sobre los mecanismos subyacentes a la neurorregeneración, así como los factores intrínsecos y extrínsecos que modulan el proceso pueden proporcionar información importante sobre las nuevas estrategias de tratamiento de reemplazo celular contra la EP.
Introducción
La enfermedad de Parkinson (EP), una enfermedad caracterizada distintivamente por rigidez muscular, temblor en reposo y bradicinesia, es la enfermedad neurológica de más rápido crecimiento en el mundo1,2. El riesgo y la prevalencia de EP aumentan rápidamente con la edad, especialmente en individuos de 50 años o más3. La etiología y la patogénesis de la EP hasta ahora siguen siendo poco conocidas. Esto a menudo ha dejado el inicio temprano de la EP sin diagnosticar. En la actualidad, la falta de dopamina y la pérdida de neuronas dopaminérgicas (DpN) en pacientes con EP están fuertemente ligadas a la manifestación de síntomas motores4. Aprovechando esta relación, se han diseñado varios tratamientos para actuar directamente como reemplazo de dopamina (es decir, levodopa) o para compensar la pérdida de DpN (es decir, estimulación cerebral profunda). Aunque estos tratamientos producen beneficios sintomáticos, no modifican el curso deteriorado de la enfermedad5. En vista de esta debilidad significativa, se ha propuesto la terapia de reemplazo celular. Sin embargo, la eficacia de este enfoque es inconsistente dados los desafíos de la preparación del injerto, el control del crecimiento celular y la inestabilidad del fenotipo. La terapia de reemplazo celular, que había planteado preocupaciones éticas, también plantea el riesgo de inducir tumores cerebrales y reacciones inmunes no deseadas6,7.
Las limitaciones de las estrategias terapéuticas actuales han llevado a un mayor énfasis en la regeneración de DpN como un enfoque potencial en el tratamiento de la EP. La regeneración de DpN o neuroregeneración se ha convertido en uno de los avances prometedores en el manejo de la EP, no solo debido a su potencial como nuevo método terapéutico sino también como medio para comprender el mecanismo de la enfermedad8, 9. Este enfoque se centra en la restauración de la función neuronal a través de la diferenciación, la migración y la integración de las células progenitoras existentes en los circuitos lesionados10. Con el fin de explorar más a fondo la neurorregeneración, se han llevado a cabo varios estudios in vivo. Se encontró que vertebrados como mamíferos, anfibios y reptiles generan nuevas células cerebrales después de una lesión11,12. Entre los vertebrados, los animales mamíferos son más buscados dado su parecido genético con los seres humanos. Los mamíferos, sin embargo, exhiben una capacidad reparadora limitada y pobre en el sistema nervioso central (SNC) que puede durar hasta la edad adulta después de una lesión cerebral13. En general, los mamíferos no son adecuados como modelos animales para comprender la neurorregeneración, dado que el bajo número de neuronas producidas no será suficiente para restaurar los circuitos neuronales dañados observados en la EP. Como tal, el modelo basado en teleósteos, específicamente en el pez cebra, es muy favorecido por su alta tasa proliferativa, capacidad de autorrenovación continua y estrecha homología cerebral con humanos14,15.
El pez cebra se usa más comúnmente para estudiar el movimiento desordenado en PD16. El modelo de EP basado en pez cebra generalmente es inducido por neurotoxinas, que incluyen 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP) y 6-hidroxidopamina (6-OHDA)17. Aunque son efectivos para inducir la pérdida específica de DpN y la disminución de los niveles de dopamina, los modelos basados en MPTP no imitan de cerca las condiciones de la EP, ya que la pérdida de DpN no se limita únicamente al SNC18. La incapacidad del 6-OHDA para atravesar la barrera hematoencefálica restringió sus efectos sobre los cambios celulares y funcionales dentro del cerebro cuando se administra intracranealmente en lugar de intramuscular19. La administración periférica de 6-OHDA provocó una reducción global de los niveles de dopamina en todo el sistema nervioso20. Mientras que la administración de 6-OHDA en el líquido cefalorraquídeo causó la ablación de DpN en todo el SNC21, que no imita la condición como se ve en la EP por la cual la pérdida de DpN ocurre específicamente en la sustancia negra del cerebro humano. La administración de ICV de 6-OHDA, por el contrario, indujo específicamente una ablación significativa de DpN en el área de Dn ventral en el cerebro del pez cebra, que se parecía mucho a la sustancia negra22. Curiosamente, la recuperación de DpN se reportó 30 días después de la lesión inducida por 6-OHDA y estas neuronas sobrevivieron a lo largo de la vida23,24. La recuperación funcional de DpN se demostró a través de una evaluación locomotora de la distancia recorrida (cm) y la velocidad media (cm/s) utilizando el modelo PD adulto basado en pez cebra inducido por 6-OHDA22.
Protocolo
El presente estudio ha sido aprobado por el Comité de Investigación y Ética Animal (CARE), Universiti Technologi MARA (UiTM) [Referencia No: UiTM CARE 346/2021, de fecha 7 de mayo de 2021].
NOTA: Se utilizaron los protocolos publicados22,25,26 para la cría y el mantenimiento estándar del modelo de DP de pez cebra adulto con lesiones 6-OHDA. Se realizaron experimentos con peces cebra machos adultos (Danio rerio) de más de cinco meses de edad con una longitud estandarizada de 3.2-3.7 cm.
1. Mantenimiento del pez cebra y preparaciones de microinyección pre-ICV
- Mantenga a los peces en un tanque de agua aireada a una temperatura controlada de 28 ± 1.0 ° C. Para la cría y el mantenimiento del pez cebra, utilice agua destilada mineralizada con sal marina comercial (1 g/L) durante todo el experimento27.
- Alberga un máximo de 25 peces por tanque de 45 L o un pez por cada 1.8 L de agua y expóndelos a un horario de 14 h de luz y 10 h de fotoperiodo oscuro. Alimente a los peces al menos dos veces al día con gránulos de alimentos complementados con gusanos liofilizados.
- Preparar una solución madre concentrada de metanosulfonato de tricaína (MS-222) disolviendo 2,5 g de MS-222 y 5 g de bicarbonato de sodio en 250 ml de agua destilada. Diluya 2 ml de solución madre para producir 200 ml de solución de anestesia de trabajo.
- Preparar 99.96 mM de 6-OHDA disolviendo primero 0.2 mg de ácido ascórbico en 1 mL de NaCl filtrado estéril al 0.9% p/v. Filtre la solución con un filtro de 0,2 micras antes de agregar 25 mg de 6-OHDA en forma de polvo a la solución. Prepare la solución fresca antes de cada inyección y guárdela en la oscuridad a 4 °C.
PRECAUCIÓN: Use el equipo de protección personal apropiado (es decir, guantes, bata de laboratorio y máscara facial) y practique buenas prácticas de laboratorio al manipular los productos químicos. Todos los manejos de los productos químicos deben hacerse dentro de un gabinete de bioseguridad.
2. Anestesia e inyección ICV de pez cebra
- Ayunar el pescado durante 24 h para evitar la regurgitación durante la anestesia. Anestesiar el pescado sumergiéndolo en un recipiente que contenga 0,01% p/v de solución de MS-222 durante aproximadamente 1 min o hasta que cese todo movimiento muscular visible.
- Coloque el pez anestesiado en una esponja empapada en agua colocada debajo de un estereomicroscopio y humedezca el pez regularmente.
- Identifique la posición para la inyección en función de la intersección entre la sutura metópica (EM), la sutura coronal (CS) y la sutura sagital (SS) que conecta el cráneo frontal y parietal del cerebro del pez cebra.
- Haga un pequeño orificio de área de 1.0 mm2 usando una aguja afilada de 27 G en el cráneo guiada por la posición anatómica específica en el cráneo del pez cebra (Figura 1A, B).
- Baje el inyector microcapilar en un ángulo de 60° hasta que alcance una profundidad de 1.200 μm desde el techo craneal del cráneo del pez cebra (Figura 1C). Presione el límite Z para fijar la posición.
- Ajuste la presión de inyección inicial a 4000 hPa y la presión de compensación a 10 hPa. Establezca la duración de la inyección en 0,3 s. Reduzca la intensidad de la inyección con cada inyección posterior.
- Inyecte 0,5 μL de neurotoxina 6-OHDA de 99,96 mM (o solución salina al 0,9% p/v para el grupo de control simulado) y deje reposar el microcapilar durante 20 s. Continúe humedeciendo el pescado con agua destilada durante todo el proceso de inyección para evitar que se seque.
- Retire lentamente el microcapilar y resucite los peces con agua destilada corriente. Coloque a los peces en un tanque de recuperación aislado y elimine cualquier distracción que pueda perturbar el proceso de recuperación.
- Enjuague el microcapilar antes de la siguiente inyección para eliminar la obstrucción y asegúrese de que la intensidad de la inyección sea suficiente para producir el volumen deseado de 0,5 μL de 6-OHDA.
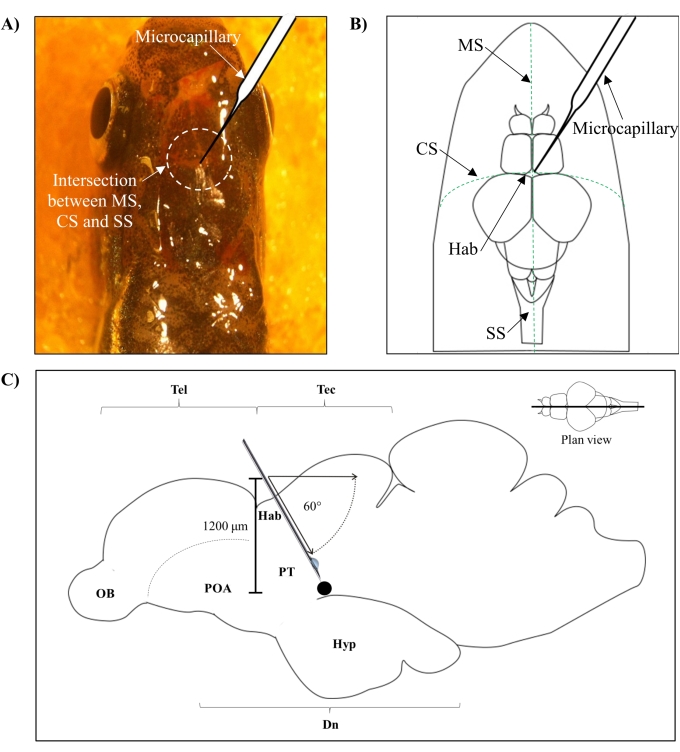
Figura 1: Sitio de inyección de neurotoxina, 6-OHDA. (A) El punto de entrada microcapilar está guiado por la intersección entre la sutura metópica (EM), la sutura coronal (CS) y la sutura sagital (SS) que conecta el cráneo frontal y parietal del cerebro del pez cebra (vista de plan). (B) Un dibujo esquemático (vista de plano) del cráneo y el cerebro del pez cebra muestra el microcapilar, que se baja directamente sobre la habénula (Hab), y su punto de entrada en la intersección entre hemisferios. (C) Un dibujo esquemático (sección sagital) del cerebro del pez cebra muestra el ángulo de inyección y la profundidad de penetración. El punto negro representa el sitio lesionado que se encuentra por encima del área objetivo, el diencéfalo ventral. Abreviaturas: 6-OHDA: 6-hidroxidopamina, CS: sutura coronal, Dn: diencéfalo, Hab: habénula, Hyp: hipotálamo, MS: sutura metópica, OB: bulbo olfatorio, POA: área preóptica, PT: tuberculum posterior, SS: sutura sagital, Tec: tectum y Tel: tel: telencéfalo. Haga clic aquí para ver una versión más grande de esta figura.
3. Evaluación locomotora
NOTA: La evaluación locomotora del pez cebra (n = seis / grupo; simulada vs lesionada) se evaluó individualmente a través de la prueba de tanque abierto utilizando protocolos establecidos28,29 en el día tres y el día 30 después de la lesión 6-OHDA.
- Grabación de vídeo
- Coloque el tanque experimental (largo 20 cm, ancho 11.5 cm, altura 13 cm) con sus paredes cubiertas con papel blanco en una plataforma elevada (Figura 2A).
- Ilumine el tanque desde el fondo usando una fuente de luz. Llene el tanque con agua destilada (80% -90% lleno) y mantenga la temperatura a 28 ± 1.0 ° C. Mida la temperatura con un termómetro y regule con un calentador de acuario comercial.
- Después de un mínimo de 2 minutos de aclimatación, registre el comportamiento de natación de los peces desde una vista de plano en el plano bidimensional (2D) de la arena experimental utilizando una cámara de video durante 5 minutos (Figura 2B). Para evitar inconsistencias en el comportamiento de natación del lote anterior y el último de grabaciones, no exceda la aclimatación por 10 min30.
- Analizar los vídeos utilizando un software de seguimiento de vídeo con el protocolo de tanque abierto para la adquisición de la distancia recorrida (cm) y la velocidad media (cm/s) de cada sujeto.

Figura 2: Configuración experimental de una prueba de tanque abierto para la evaluación del comportamiento locomotor del pez cebra. (A) El tanque experimental (vista frontal) se coloca en una plataforma elevada que se ilumina desde abajo. Las cuatro paredes del tanque están cubiertas con papel blanco y las grabaciones se capturan axialmente. La temperatura se mide con un termómetro y se regula a 28 ± 1.0 ° C utilizando un calentador de acuario comercial. (B) Captura de pantalla (vista de plan) de la grabación de video que se captura utilizando la configuración. Haga clic aquí para ver una versión más grande de esta figura.
- Análisis de datos
- Haga doble clic en el icono para abrir el software de seguimiento de video. Haga clic en la pestaña Archivo y seleccione Crear nuevo experimento vacío. Esto permitirá al usuario personalizar los parámetros del experimento de acuerdo con los objetivos de la investigación.
- Haga clic en la pestaña Protocolo , seleccione Fuentes de video y haga clic en Agregar nueva fuente de video. Haga clic en la lista desplegable disponible y seleccione la opción Archivo de video . Esto mostrará la ventana emergente de navegación de archivos desde la que se pueden seleccionar las grabaciones de video de interés.
- Haga clic en la subpestaña Aparato y seleccione el icono Rectangular para configurar el aparato. Arrastre el icono rectangular para cubrir toda la arena experimental. Establezca la barra de escala en consecuencia e introduzca el valor numérico de la medida de escala utilizada en la longitud de la sección de regla. El presente experimento utilizó una escala de 10 mm para la prueba de tanque abierto.
- Establezca el color del animal seleccionando Los animales son más oscuros que el fondo del aparato. Deje las otras opciones disponibles en Seguimiento a la configuración predeterminada preestablecida.
- En la subpestaña Zonas , haga clic en el aparato dibujado anteriormente. Esta zona se establece como la zona estándar de la que la posición es la misma para todas las pruebas.
- Seleccione las siguientes opciones en Programación de pruebas e informe de datos de prueba: Duración de la prueba, Distancia total recorrida y Velocidad promedio. Otras pruebas disponibles en la lista son opcionales y dependen del interés investigativo del investigador.
- En la pestaña Experimento , asigne los animales de acuerdo con su grupo de prueba escribiendo el nombre del grupo en la sección Nombre y el número de animales por grupo en la sección Número de animales .
- Cambie a la pestaña Pruebas para ejecutar el experimento. Haga clic en el icono Iniciar prueba y espere hasta que se analicen todos los videos.
- En la pestaña Resultados , haga clic en el icono Ver el informe para ver los datos locomotores en forma de informe de texto.
Resultados
El presente experimento evaluó los cambios en el comportamiento de natación del pez cebra adulto después de la microinyección de ICV con 6-OHDA. La razón para utilizar 6-OHDA como neurotoxina de elección se debió a su incapacidad para cruzar la barrera hematoencefálica, lo que produjo una ablación específica y dirigida de DpN en el área de interés-diencéfalo ventral (Dn)16. La subpoblación dpn aquí tiene semejanza anatómica con la subpoblación DpN en la sustancia negra pars compac...
Discusión
El presente trabajo demostró con éxito la evaluación locomotora del modelo de EP adulto basado en pez cebra adulto inducido por 6-OHDA. Todo el experimento involucró tres pasos principales: preparaciones de microinyección pre-ICV, microinyección ICV de pez cebra y evaluación locomotora. Para garantizar la recuperación saludable del pez cebra adulto después del procedimiento de microinyección de ICV y un buen resultado experimental, se han recomendado algunas buenas prácticas para cada paso en el presente estud...
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por el Ministerio de Educación Superior de Malasia bajo el Programa de Becas de Investigación Fundamental [600-IRMI / FRGS 5/3 (033/2019)].
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
Referencias
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados