Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Локомоторная оценка 6-гидроксидофамин-индуцированной модели болезни Паркинсона у взрослых рыбок данио
В этой статье
Резюме
Настоящий протокол описывает интрацеребровентрикулярную (ICV) инъекцию взрослым рыбкам данио нейротоксического 6-гидроксидофамина (6-OHDA) в вентральный диэнцефалон (Dn) и оценку нарушения и последующее восстановление плавательного поведения после этого с использованием теста в открытом резервуаре, который сопровождается анализом с использованием программного обеспечения для отслеживания видео.
Аннотация
Ограничения современных методов лечения в задержке дофаминергической потери нейронов при болезни Паркинсона (БП) повышают потребность в альтернативных методах лечения, которые могут восстановить эти нейроны. В настоящее время много усилий направлено на лучшее понимание нейрорегенерации с использованием доклинических моделей in vivo . Однако эта регенеративная способность к самовосстановлению неэффективна у млекопитающих. Таким образом, животные, не являющиеся млекопитающими, такие как рыбки данио, стали отличной нейрорегенеративной моделью из-за ее способности постоянно самообновляться и иметь близкую гомологию мозга к людям. В рамках усилий по выяснению клеточных событий, участвующих в нейрорегенерации in vivo, мы создали модель БП взрослых рыбок данио, индуцированную 6-гидроксидотамином (6-OHDA). Это было достигнуто за счет оптимизированной интрацеребровентрикулярной (ICV) микроинъекции 99,96 мМ 6-OHDA для специфического абляции дофаминергических нейронов (DpN) в вентральном диэнцефалоне (Dn) мозга рыбок данио. Иммунофлуоресценция показала более 85% абляции DpN на третий день после поражения и полное восстановление DpN на участке поражения через 30 дней после поражения. Настоящее исследование определило ухудшение и последующее восстановление плавательного поведения рыбок данио после поражения с помощью теста в открытом поле, с помощью которого были количественно определены два параметра, пройденное расстояние (см) и средняя скорость (см/с). Локомоцию оценивали путем анализа записей отдельных рыб каждой группы (n = 6) с использованием программного обеспечения для отслеживания видео. Результаты показали значительное (p < 0,0001) снижение скорости (см / с) и пройденного расстояния (см) пораженных рыбок данио через 3 дня по сравнению с фикцией. Пораженная рыбка данио продемонстрировала полное восстановление плавательного поведения через 30 дней после высадки. Представленные результаты показывают, что 6-OHDA пораженная взрослая рыбка данио является отличной моделью с воспроизводимым качеством для облегчения изучения нейрорегенерации при БП. Будущие исследования механизмов, лежащих в основе нейрорегенерации, а также внутренних и внешних факторов, которые модулируют процесс, могут дать важное представление о новых стратегиях клеточной заместительной терапии против БП.
Введение
Болезнь Паркинсона (БП), заболевание, характеризующееся мышечной ригидностью, тремором покоя и брадикинезией, является самым быстрорастущим неврологическим заболеванием в мире1,2. Риск и распространенность БП быстро увеличиваются с возрастом, особенно у лиц в возрасте 50 лет и старше3. Этиология и патогенез БП до сих пор остаются малоизученными. Это часто оставляло раннее начало БП недиагностированным. В настоящее время недостаток дофамина и потеря дофаминергических нейронов (DpN) у пациентов с БП тесно связаны с проявлением двигательной симптоматики4. Используя эту связь, несколько методов лечения были разработаны либо для того, чтобы действовать непосредственно как замена дофамина (то есть леводопа), либо для компенсации потери DpN (то есть глубокой стимуляции мозга). Хотя эти методы лечения приносят симптоматические преимущества, они не изменяют ухудшающееся течение заболевания5. Ввиду этой значительной слабости была предложена клеточная заместительная терапия. Эффективность этого подхода, однако, непоследовательна, учитывая проблемы подготовки трансплантата, контроля роста клеток и нестабильности фенотипа. Клеточная заместительная терапия, которая вызвала этические проблемы, также представляет риск индуцирования опухолей головного мозга и нежелательных иммунных реакций6,7.
Ограничения современных терапевтических стратегий привели к большему акценту на регенерацию DpN как потенциальный подход в лечении БП. Регенерация DpN или нейрорегенерация стала одним из многообещающих прорывов в лечении БП не только из-за ее потенциала в качестве нового терапевтического метода, но и как средства для понимания механизма заболевания8, См. 9. Этот подход фокусируется на восстановлении функции нейронов путем дифференцировки, миграции и интеграции существующих клеток-предшественников в поврежденную схему10. В целях дальнейшего изучения нейрорегенерации были проведены различные исследования in vivo. Было обнаружено, что позвоночные, такие как млекопитающие, амфибии и рептилии, генерируют новые клетки мозга после травмы11,12. Среди позвоночных млекопитающие животные более востребованы, учитывая их генетическое сходство с людьми. Млекопитающие, однако, демонстрируют ограниченную и плохую репаративную способность в центральной нервной системе (ЦНС), которая может длиться до взрослой жизни после поражения мозга13. В целом, млекопитающие не подходят в качестве животных моделей для понимания нейрорегенерации, учитывая, что низкое количество производимых нейронов будет недостаточным для восстановления поврежденных нейронных цепей, наблюдаемых при БП. Таким образом, модель на основе телеоста, особенно у рыбок данио, пользуется большим преимуществом из-за ее высокой пролиферативной скорости, способности к непрерывному самообновлению и закрытию гомологии мозга с людьми14,15.
Рыбки данио чаще всего используются для изучения беспорядочного движения при PD16. Модель БП на основе рыбок данио обычно индуцируется нейротоксинами, которые включают 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) и 6-гидроксидофамин (6-OHDA)17. Несмотря на эффективность в индуцировании удельной потери DpN и снижения уровня дофамина, модели на основе MPTP не точно имитируют условия PD, поскольку потеря DpN не ограничивается исключительно CNS18. Неспособность 6-OHDA пересекать гематоэнцефалический барьер ограничивала его влияние на клеточные и функциональные изменения в мозге, когда он вводится интракраниально, а не внутримышечно19. Периферическое введение 6-OHDA вызвало глобальное снижение уровня дофамина во всей нервной системе20. В то время как введение 6-OHDA в спинномозговую жидкость вызывало абляцию DpN по всему ЦНС21, что не имитирует состояние, наблюдаемое при БП, при котором потеря DpN происходит конкретно в черной субстанции человеческого мозга. Введение ICV 6-OHDA, напротив, специфически индуцировало значительную абляцию DpN в области вентрального Dn в мозге рыбок данио, которая очень напоминала substantia nigra22. Интересно, что восстановление DpN было зарегистрировано через 30 дней после 6-OHDA-индуцированного поражения, и эти нейроны выжили в течение жизни23,24. Функциональное восстановление DpN было продемонстрировано с помощью локомоторной оценки пройденного расстояния (см) и средней скорости (см/с) с использованием модели PD на основе 6-OHDA-индуцированной взрослой рыбки данио22.
протокол
Настоящее исследование было одобрено Комитетом по исследованиям и этике животных (CARE), Universiti Technologi MARA (UiTM) [Ссылка No: UiTM CARE 346/2021 от 7 мая 2021 года].
ПРИМЕЧАНИЕ: Были использованы опубликованные протоколы22,25,26 для стандартного разведения и поддержания модели 6-OHDA-пораженных взрослых рыбок данио. Эксперименты проводились со взрослым самцом рыбки данио (Danio rerio) в возрасте более пяти месяцев со стандартизированной длиной 3,2-3,7 см.
1. Препараты для содержания рыбок данио и микроинъекции перед ICV
- Поддерживайте рыбу в аквариуме с газированной водой при контролируемой температуре 28 ± 1,0 °C. Для выращивания и содержания рыбок данио используйте дистиллированную воду, минерализованную коммерческой морской солью (1 г/л) на протяжении всего эксперимента27.
- Разместите максимум 25 рыб на 45 л аквариума или одну рыбу на 1,8 л воды и подвергайте их графику 14-часового света и 10-часового темного фотопериода. Кормите рыбу не реже двух раз в день пищевыми гранулами, дополненными сублимированными червями.
- Готовят концентрированный раствор трикаина метансульфоната (MS-222) путем растворения 2,5 г MS-222 и 5 г бикарбоната натрия в 250 мл дистиллированной воды. Развести 2 мл исходного раствора для получения 200 мл рабочего раствора для анестезии.
- Готовят 99,96 мМ 6-OHDA, сначала растворяя 0,2 мг аскорбиновой кислоты в 1 мл 0,9% мас./v стерильно-фильтрованного NaCl. Процедите раствор 0,2-микронным фильтром перед добавлением в раствор 25 мг 6-OHDA в виде порошка. Готовьте раствор свежим перед каждой инъекцией и храните его в темноте при температуре 4 °C.
ВНИМАНИЕ: Носите соответствующие средства индивидуальной защиты (например, перчатки, лабораторное пальто и маску для лица) и практикуйте надлежащую лабораторную практику при обращении с химическими веществами. Все обращения с химическими веществами должны выполняться в шкафу биобезопасности.
2. Обезболивание и инъекции ICV рыбок данио
- Голодайте с рыбой в течение 24 ч, чтобы избежать срыгивания во время анестезии. Обезболивают рыбу, погружая ее в емкость, содержащую 0,01% мас./v раствора MS-222 примерно на 1 мин или до тех пор, пока не прекратятся все видимые мышечные движения.
- Поместите обезболенную рыбу на пропитанную водой губку, помещенную под стереомикроскоп, и регулярно смачивайте рыбу.
- Определите положение для инъекции на основе пересечения между метопическим швом (MS), корональным швом (CS) и сагиттальным швом (SS), который соединяет лобный и теменный череп мозга рыбок данио.
- Сделайте небольшое отверстие площадью 1,0 мм2 с помощью острой иглы 27 G в черепе, ориентируясь на конкретное анатомическое положение на черепе рыбки данио (рисунок 1A,B).
- Опустите микрокапиллярный инжектор под углом 60°, пока он не достигнет глубины 1 200 мкм от черепной крыши черепа рыбки данио (рисунок 1C). Нажмите Z-предел, чтобы зафиксировать положение.
- Установите начальное давление впрыска на уровне 4000 гПа и давление компенсации на 10 гПа. Установите продолжительность инъекции на 0,3 с. Снижайте интенсивность инъекции с каждой последующей инъекцией.
- Вводят 0,5 мкл 99,96 мМ нейротоксина 6-OHDA (или 0,9% мас./об.физиологического раствора для фиктивной контрольной группы) и дайте микрокапилляру отдохнуть в течение 20 с. Продолжайте смачивать рыбу дистиллированной водой на протяжении всего процесса инъекции, чтобы предотвратить высыхание.
- Медленно удалите микрокапилляр и реанимируйте рыбу под проточной дистиллированной водой. Поместите рыбу в изолированный резервуар для восстановления и удалите любые отвлекающие факторы, которые могут потенциально нарушить процесс восстановления.
- Промывайте микрокапилляр перед следующей инъекцией, чтобы очистить закупорку и убедиться, что интенсивность инъекции достаточна для получения желаемого объема 0,5 мкл 6-OHDA.
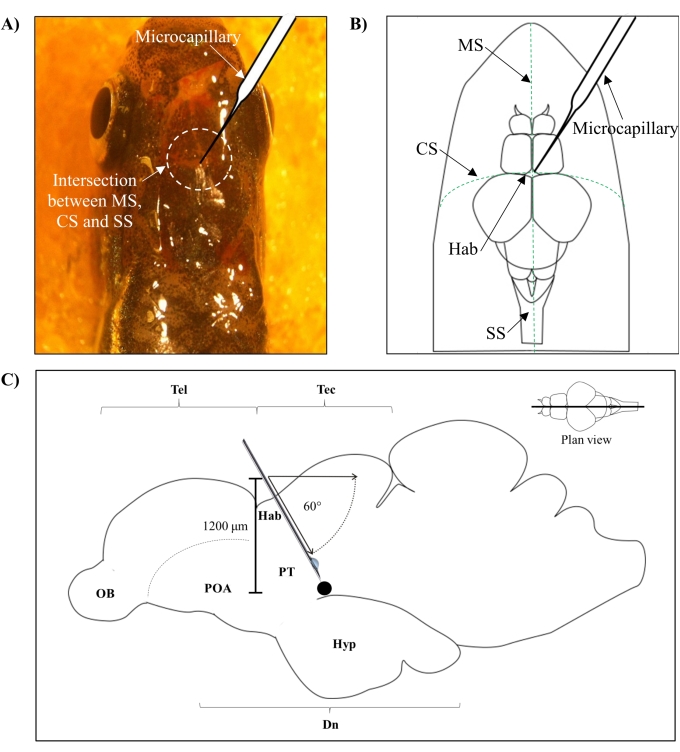
Рисунок 1: Место инъекции нейротоксина, 6-OHDA. (A) Точка микрокапиллярного входа направляется пересечением между метопическим швом (MS), корональным швом (CS) и сагиттальным швом (SS), который соединяет лобный и теменной череп мозга рыбок данио (вид плана). (B) На схематическом рисунке (виде плана) черепа и мозга рыбки данио показан микрокапилляр, который опущен непосредственно над хабенулой (Hab), и его точка входа на пересечении между полушариями. (C) Схематический рисунок (сагиттальный срез) мозга рыбки данио показывает угол инъекции и глубину проникновения. Черная точка представляет собой поврежденный участок, который расположен над целевой областью, вентральным диэнцефалоном. Сокращения: 6-OHDA: 6-гидроксидофамин, CS: корональный шов, Dn: diencephalon, Hab: habenula, Hyp: гипоталамус, MS: метопический шов, OB: обонятельная луковица, POA: преоптическая область, PT: задний туберкулез, SS: сагиттальный шов, Tec: tectum и Tel: telencephalon. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Оценка состояния опорно-двигательного аппарата
ПРИМЕЧАНИЕ: Локомоторная оценка рыбок данио (n = шесть / группа; фиктивная против пораженной) оценивалась индивидуально с помощью теста в открытом резервуаре с использованием установленных протоколов28,29 на третий день и на 30-м дне после поражения 6-OHDA.
- Видеозаписи
- Поместите экспериментальный резервуар (длина 20 см, ширина 11,5 см, высота 13 см) с его стенками, покрытыми белой бумагой, на приподнятой платформе (рисунок 2А).
- Освещайте бак снизу с помощью источника света. Наполните бак дистиллированной водой (заполненной на 80%-90%) и поддерживайте температуру 28 ± 1,0 °C. Измерьте температуру с помощью термометра и регулируйте ее с помощью коммерческого аквариумного обогревателя.
- После минимум 2 мин акклиматизации запишите поведение рыбы при плавании с плана на 2-мерной (2D) плоскости экспериментальной арены с помощью видеокамеры в течение 5 мин (рисунок 2В). Чтобы избежать непоследовательности в плавательном поведении более ранней и последней партии записей, не превышайте акклиматизацию на 10 мин30.
- Анализируйте видео с помощью программного обеспечения для отслеживания видео с протоколом открытого резервуара для получения пройденного расстояния (см) и средней скорости (см / с) каждого объекта.

Рисунок 2: Экспериментальная установка теста в открытом резервуаре для оценки локомоторного поведения рыбок данио. (А) Экспериментальный резервуар (вид спереди) размещен на приподнятой платформе, которая освещается снизу. Четыре стенки резервуара покрыты белой бумагой, а записи захватываются в осевом направлении. Температура измеряется с помощью термометра и регулируется при 28 ± 1,0 °C с помощью коммерческого аквариумного обогревателя. (B) Снимок экрана (вид плана) видеозаписи, снятой с помощью установки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Анализ данных
- Дважды щелкните значок, чтобы открыть программное обеспечение для отслеживания видео. Перейдите на вкладку Файл и выберите Создать новый пустой эксперимент. Это позволит пользователю настроить параметры эксперимента в соответствии с целями исследования.
- Перейдите на вкладку «Протокол », выберите «Источники видео» и нажмите « Добавить новый источник видео». Нажмите на доступный выпадающий список и выберите опцию Видеофайл . Это вызовет всплывающее окно просмотра файлов, из которого можно выбрать интересующие видеозаписи.
- Нажмите на подвкладку Устройство и выберите прямоугольный значок, чтобы настроить устройство. Перетащите прямоугольный значок, чтобы охватить всю экспериментальную арену. Установите шкалу шкалы соответствующим образом и введите числовое значение измерения шкалы, используемого в длине секции линейки. В настоящем эксперименте для испытания открытого резервуара использовалась шкала толщиной 10 мм.
- Установите цвет животного, выбрав Животные темнее, чем Фон аппарата. Оставьте другие доступные параметры в отслеживании для предустановленных настроек по умолчанию.
- На подвкладке Зоны нажмите на ранее нарисованное устройство. Эта зона устанавливается в качестве стандартной зоны, положение которой одинаково для всех тестов.
- Выберите следующие параметры в разделе Планирование тестирования и отчет о тестовых данных: Продолжительность теста, Общее пройденное расстояние и Средняя скорость. Другие доступные тесты в списке являются необязательными и зависят от исследовательского интереса исследователя.
- На вкладке Эксперимент назначьте животных в соответствии с их тестовой группой, введя название группы в разделе Имя и количество животных в группе в разделе Количество животных .
- Перейдите на вкладку Тесты , чтобы запустить эксперимент. Нажмите на значок Начать тест и подождите, пока все видео не будут проанализированы.
- На вкладке Результаты щелкните значок Просмотреть отчет , чтобы просмотреть данные локомотора в текстовой форме отчета.
Результаты
В настоящем эксперименте оценивались изменения в плавательном поведении взрослых рыбок данио после микроинъекции ICV с 6-OHDA. Причина использования 6-OHDA в качестве нейротоксина выбора была связана с его неспособностью пересекать гематоэнцефалический барьер, который производил специфич...
Обсуждение
Настоящая работа успешно продемонстрировала локомоторную оценку установленной 6-OHDA-индуцированной, взрослой модели PD на основе рыбок данио. Весь эксперимент включал в себя три основных этапа: подготовка микроинъекции до ICV, микроинъекция ICV рыбок данио и оценка локомоторов. Чтобы обес?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Министерством высшего образования Малайзии в рамках Схемы грантов на фундаментальные исследования [600-IRMI/FRGS 5/3 (033/2019)].
Материалы
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
Ссылки
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены