É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação locomotor de 6-Hidroxidopamina-induzido Modelo de Doença de Parkinson baseado em Zebrafish
Neste Artigo
Resumo
O presente protocolo descreve a injeção intracerebroventricular (ICV) de zebrafish adulto com neurotóxifo 6-hidroxydopamina (6-OHDA) no diencephalon ventral (Dn) e a avaliação do prejuízo e posterior recuperação da pós-colisão do comportamento de natação usando o teste do tanque aberto, que é acompanhado pela análise usando um software de rastreamento de vídeo.
Resumo
As limitações dos tratamentos atuais para retardar a perda neuronal dopaminérgica na doença de Parkinson (DP) aumentam a necessidade de terapias alternativas que possam restaurar esses neurônios. Atualmente, muito esforço é direcionado para uma melhor compreensão da neuroregeneração usando modelos in vivo pré-clínicos. Esta capacidade regenerativa para auto-reparação é, no entanto, ineficiente em mamíferos. Animais não mamíferos como o zebrafish emergiram como um excelente modelo neuroregenerativo devido à sua capacidade de se auto-renovar continuamente e ter uma homologia cerebral próxima aos humanos. Como parte do esforço para elucidar eventos celulares envolvidos na neuroregeneração in vivo, estabelecemos o modelo de DP baseado em zebrafish adulto induzido por 6-OHDA (6-OHDA). Isso foi conseguido através da microinjeção intracerebroventricular otimizada (ICV) de 99,96 mM 6-OHDA para especificamente ablate neurônios dopaminérgicos (DpN) no diencephalon ventral (Dn) do cérebro de zebrafish. A imunofluorescência indicou mais de 85% da ablação da DPN no terceiro dia de pós-seção e restauração total da DPN no local lesionado 30 dias de pós-estação. O presente estudo determinou o comprometimento e posterior recuperação do comportamento de natação de zebrafish após a lesão, utilizando-se o teste de campo aberto através do qual foram quantificados dois parâmetros, distância percorrida (cm) e velocidade média (cm/s). A locomoção foi avaliada pela análise das gravações de peixes individuais de cada grupo (n = 6) utilizando software de rastreamento de vídeo. Os achados mostraram uma redução significativa (p < 0,0001) na velocidade (cm/s) e distância percorrida (cm) de zebrafish lesionado 3 dias após a pós-lesão quando comparado com sham. O zebrafish lesionado apresentou recuperação completa do comportamento de natação 30 dias após a pós-seção. Os presentes achados sugerem que o zebrafish adulto lesado 6-OHDA é um excelente modelo com qualidade reprodutível para facilitar o estudo da neuroregeneração em PD. Estudos futuros sobre os mecanismos subjacentes à neuroregeneração, bem como fatores intrínsecos e extrínsecos que modulam o processo podem fornecer informações importantes sobre novas estratégias de tratamento de substituição celular contra a DP.
Introdução
A doença de Parkinson (DP), doença caracterizada pela rigidez muscular, tremor de repouso e bradiquinia, é a doença neurológica que mais cresce no mundo1,2. O risco e a prevalência da DP aumentam rapidamente com a idade, especialmente em indivíduos com 50 anos ou mais de 3 anos. A etiologia e a patogênese da DP até agora permanecem mal compreendidas. Isso muitas vezes deixou o início precoce do PD sem diagnóstico. Atualmente, a falta de dopamina e a perda de neurônios dopaminérgicos (DP) em pacientes com DP estão fortemente ligados à manifestação dos sintomas motores4. Capitalizando essa relação, vários tratamentos foram projetados para atuar diretamente como substituição de dopamina (ou seja, levodopa) ou para compensar a perda de DPN (ou seja, estimulação cerebral profunda). Embora esses tratamentos tragam benefícios sintomáticos, eles não modificam o curso deteriorado da doença5. Diante dessa fraqueza significativa, a terapia de reposição celular foi proposta. A eficácia dessa abordagem é, no entanto, inconsistente, dado os desafios da preparação do enxerto, controle do crescimento celular e instabilidade do fenótipo. A terapia de reposição celular, que havia levantado preocupações éticas, também representa o risco de induzir tumores cerebrais e reações imunológicas indesejadas6,7.
As limitações das estratégias terapêuticas atuais têm levado a uma maior ênfase na regeneração da DPN como abordagem potencial no tratamento da DP. A regeneração da DPN ou neuroregeneração tem emergido como um dos avanços promissores no manejo da DPP, não apenas devido ao seu potencial como novo método terapêutico, mas também como meios de compreender o mecanismo da doença8, 9. Esta abordagem se concentra na restauração da função neuronal através da diferenciação, migração e integração das células progenitoras existentes nos circuitos lesados10. Para explorar ainda mais a neuroregeneração, vários estudos in vivo foram realizados. Verificou-se que vertebrados como mamíferos, anfíbios e répteis geram novas células cerebrais após lesões11,12. Entre os vertebrados, os animais mamíferos são mais procurados dada a sua semelhança genética com os seres humanos. Os mamíferos, no entanto, apresentam uma capacidade reparativa limitada e precária no sistema nervoso central (SNC) que pode durar até a idade adulta após uma lesão cerebral13. Em geral, os mamíferos não são adequados como modelos animais para entender a neuroregeneração, dado que o baixo número de neurônios produzidos não será suficiente para restaurar circuitos neurais danificados observados em DP. Como tal, o modelo baseado em teleemst, especificamente em zebrafish, é muito favorecido por sua alta taxa de proliferação, capacidade de se auto-renovar continuamente e fechar a homologia cerebral com humanos14,15.
O zebrafish é mais comumente usado para estudar o movimento desordenado em PD16. O modelo PD à base de zebrafish é geralmente induzido por neurotoxinas, que incluem 1-metil-4-fenil-1,2,3,6-tetrahidropyridina (MPTP) e 6-hidroxidopamina (6-OHDA)17. Embora eficaz em induzir perda específica de DPN e diminuição dos níveis de dopamina, os modelos baseados em MPTP não imitam de perto as condições da DP, uma vez que a perda de DPN não se restringe apenas ao CNS18. A incapacidade do 6-OHDA de atravessar a barreira hemencefálica restringiu seus efeitos em alterações celulares e funcionais dentro do cérebro quando é administrado intracranianamente em oposição a intramuscularmente19. A administração periférica do 6-OHDA causou uma redução global dos níveis de dopamina em todo o sistema nervoso20. Enquanto a administração do 6-OHDA no fluido cefalorraquidiano causou ablação da DPN em todo o CNS21, que não imita a condição vista em DP, pelo qual a perda de DPN ocorre especificamente na substantia nigra do cérebro humano. A administração do ICV de 6-OHDA, pelo contrário, induziu especificamente ablação significativa da DPN na área de Dn ventral no cérebro de zebrafish, que se assemelhava muito à substantia nigra22. Curiosamente, a recuperação da DPN foi relatada 30 dias após lesão induzida por 6 OHDA e esses neurônios sobreviveram ao longo da vida23,24. A recuperação funcional da DPN foi demonstrada por meio de uma avaliação locomotora de distância percorrida (cm) e velocidade média (cm/s) utilizando o modelo PD adulto induzido por zebrafish 6-OHDA, modelo22.
Protocolo
O presente estudo foi aprovado pela Comissão de Pesquisa e Ética Animal (CARE), Universidade Technologi MARA (UiTM) [Referência nº: UiTM CARE 346/2021, com data de 7 de maio de 2021].
NOTA: Foram utilizados os protocolos publicados22,25,26 para a criação padrão e a manutenção do modelo de PD de zebrafish adulto de 6-OHDA. Foram realizados experimentos com zebrafish macho adulto (Danio rerio) com mais de cinco meses de idade com comprimento padronizado de 3,2-3,7 cm.
1. Manutenção de zebrafish e preparações de microinjeção pré-ICV
- Mantenha o peixe em um reservatório de água aerado sob uma temperatura controlada de 28 ± 1,0 °C. Para a criação e manutenção de zebrafish, utilize água destilada mineralizada com sal marinho comercial (1 g/L) durante todo o experimento27.
- Abriga um máximo de 25 peixes por tanque de 45 L ou um peixe por 1,8 L de água e expõe-os a um cronograma de 14h de luz e 10h de fotoperíodo escuro. Alimente os peixes pelo menos duas vezes por dia com pelotas de alimentos complementadas com vermes congelados.
- Prepare uma solução concentrada de estoque de metanosefonato tricaine (MS-222) dissolvendo 2,5 g de MS-222 e 5 g de bicarbonato de sódio em 250 mL de água destilada. Diluir 2 mL de solução de estoque para produzir 200 mL de solução de anestesia de trabalho.
- Prepare 99,96 mM de 6-OHDA dissolvendo primeiro 0,2 mg de ácido ascórbico em 1 mL de 0,9% c/v nacl filtrado estéril. Filtre a solução com filtro de 0,2 mícrons antes de adicionar 25 mg de 6-OHDA em forma de pó na solução. Prepare a solução fresca antes de cada injeção e armazene-a no escuro a 4 °C.
ATENÇÃO: Use equipamentos de proteção individual adequados (ou seja, luvas, casaco de laboratório e máscara facial) e pratique boas práticas laboratoriais ao manusear os produtos químicos. Todos os manuseios dos produtos químicos devem ser feitos dentro de um armário de biossegurança.
2. Anestesização e injeção de ICV de zebrafish
- Acelere o peixe por 24 horas para evitar a regurgitação durante a anestesia. Anestesiar o peixe imergindo-o em um recipiente contendo 0,01% c/v de solução MS-222 por aproximadamente 1 min ou até que todo o movimento muscular visível cesse.
- Posicione o peixe anestesiado em uma esponja encharcada de água colocada sob um estereoscópio e molhe o peixe regularmente.
- Identifique a posição para injeção com base na intersecção entre a sutura metopic (MS), a sutura coronal (SC) e a sutura sagital (SS) que conecta o crânio frontal e parietal do cérebro de zebrafish.
- Faça um pequeno orifício de 1,0 mm2 de área usando uma agulha afiada de 27 G no crânio guiada pela posição anatômica específica no crânio do zebrafish (Figura 1A,B).
- Abaixe o injetor microcapilar em um ângulo de 60° até atingir uma profundidade de 1.200 μm do teto craniano do crânio do zebrafish (Figura 1C). Pressione o limite Z para fixar a posição.
- Defina a pressão inicial de injeção para 4000 hPa e pressão de compensação para 10 hPa. Defina a duração da injeção para 0,3 s. Abaixe a intensidade da injeção a cada injeção subsequente.
- Injete 0,5 μL de neurotoxina 6-OHDA de 99,96 mM (ou 0,9% c/v soro fisiológico para o grupo de controle falso) e deixe o microcapilar descansar por 20 s. Continue molhando o peixe com água destilada durante todo o processo de injeção para evitar a secagem.
- Remova lentamente o microcapilar e ressuscite o peixe sob água destilada. Coloque o peixe em um tanque de recuperação isolado e remova quaisquer distrações que possam potencialmente perturbar o processo de recuperação.
- Lave o microcapilário antes da próxima injeção para limpar o bloqueio e certifique-se de que a intensidade da injeção é suficiente para produzir o volume desejado de 0,5 μL de 6-OHDA.
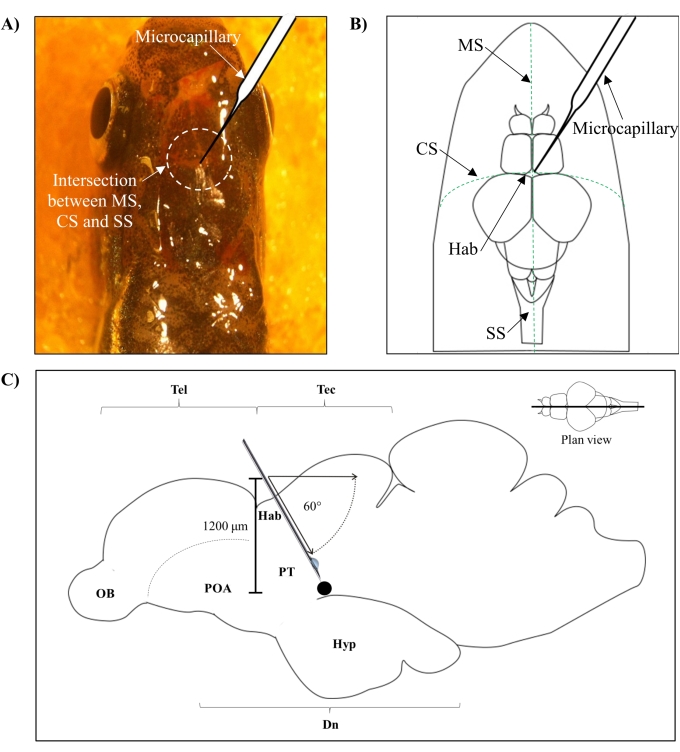
Figura 1: Local de injeção de neurotoxina, 6-OHDA. (A) O ponto de entrada microcaparar é guiado pela intersecção entre a sutura metopic (MS), a sutura coronal (SC) e a sutura sagital (SS) que conecta o crânio frontal e parietal do cérebro de zebrafish (vista do plano). (B) Um desenho esquemático (visão do plano) do crânio e cérebro de zebrafish mostra o microcapilário, que é baixado diretamente acima da habenula (Hab), e seu ponto de entrada na intersecção entre hemisférios. (C) Um desenho esquemático (seção sagital) do cérebro de zebrafish mostra o ângulo de injeção e profundidade de penetração. O ponto preto representa o local lesionado que está situado acima da área alvo, o diencephalon ventral. Abreviaturas: 6-OHDA: 6-hidroxidopamina, CS: sutura coronal, Dn: diencephalon, Hab: habenula, Hyp: hypothalamus, MS: metopic suture, OB: bulbo olfativo, POA: área preóptica, PT: tuberculum posterior, SS: sutura sagitaral, Tec: tectum, e Tel: teleencefalon. Clique aqui para ver uma versão maior desta figura.
3. Avaliação locomotor
NOTA: A avaliação locomotor de zebrafish (n = seis / grupo; sham vs lesioned) foi avaliada individualmente através do teste do tanque aberto utilizando protocolos estabelecidos28,29 no terceiro dia e dia 30 lesão pós-6-OHDA.
- Gravação de vídeo
- Coloque o tanque experimental (comprimento de 20 cm, largura 11,5 cm, altura de 13 cm) com suas paredes cobertas com papel branco em uma plataforma elevada (Figura 2A).
- Ilumine o tanque de baixo usando uma fonte de luz. Encha o tanque com água destilada (80%-90% cheia) e mantenha a temperatura em 28 ± 1,0 °C. Meça a temperatura usando um termômetro e regular-a usando um aquecedor de aquário comercial.
- Após um mínimo de 2 minutos de aclimatação, registre o comportamento de natação de peixes a partir de uma visão de plano no plano bidimensional (2D) da arena experimental usando uma câmera de vídeo por 5 min (Figura 2B). Para evitar inconsistência no comportamento de natação do anterior e último lote de gravações, não exceda a aclimatação em 10 min30.
- Analise os vídeos usando software de rastreamento de vídeo com o protocolo open-tank para aquisição de distância percorrida (cm) e velocidade média (cm/s) de cada assunto.

Figura 2: Configuração experimental de um teste de tanque aberto para avaliação do comportamento locomotor de zebrafish. (A) O tanque experimental (visão frontal) é colocado em uma plataforma elevada que é iluminada a partir de baixo. As quatro paredes do tanque estão cobertas com papel branco e as gravações são capturadas axialmente. A temperatura é medida por meio de um termômetro e regulada a 28 ± 1,0 °C usando um aquecedor de aquário comercial. (B) Captura de tela (exibição do plano) da gravação de vídeo capturada usando a configuração. Clique aqui para ver uma versão maior desta figura.
- Análise de dados
- Clique duas vezes no ícone para abrir o software de rastreamento de vídeo. Clique na guia Arquivo e selecione Criar novo experimento vazio. Isso permitirá que o usuário personalize os parâmetros do experimento de acordo com os objetivos da investigação.
- Clique na guia Protocolo , selecione Fontes de vídeo e clique em Adicionar nova fonte de vídeo. Clique na lista desistências disponíveis e selecione a opção Arquivo de vídeo . Isso solicitará o pop-up de navegação de arquivos a partir do qual as gravações de vídeo de interesse podem ser selecionadas.
- Clique no subtabto do aparelho e selecione o ícone Retangular para configurar o aparelho. Arraste o ícone retangular para cobrir toda a arena experimental. Defina a barra de escala em conformidade e insira o valor numérico da medição da escala utilizada no comprimento da seção régua. O presente experimento utilizou uma escala de 10 mm para o teste do tanque aberto.
- Defina a cor animal selecionando Os animais são mais escuros que o fundo do aparelho. Deixe as outras opções disponíveis no Rastreamento para as configurações padrão predefinidas.
- No subtabelecimento de Zonas , clique no aparelho desenhado anteriormente. Esta zona é definida como a zona padrão da qual a posição é a mesma para todos os testes.
- Selecione as seguintes opções em agendamento de testes e relatório de dados de teste: Duração do teste, distância total percorrida e velocidade média. Outros testes disponíveis na lista são opcionais e dependem do interesse investigativo do pesquisador.
- Na guia Experimentar , atribua os animais de acordo com seu grupo de teste digitando o nome do grupo na seção Nome e o número de animais por grupo na seção Número de Animais .
- Mude para guia Testes para executar o experimento. Clique no ícone Iniciar teste e aguarde até que todos os vídeos sejam analisados.
- Na guia Resultados , clique no ícone Exibir o ícone Exibir os dados locomotor no formulário de relatório de texto.
Resultados
O presente experimento avaliou as mudanças no comportamento adulto de natação de zebrafish após a microinjeção do ICV com 6-OHDA. A razão para o uso do 6-OHDA como a neurotoxina escolhida foi devido à sua incapacidade de atravessar a barreira hematoencefálica, que produziu ablação específica e direcionada de DPN na área de diencephalon de interesse-ventral (Dn)16. A subpopulação do DPN aqui tem semelhança anatômica com a subpopulação dpn na substantia nigra pars
Discussão
O presente trabalho demonstrou com sucesso a avaliação locomotor do modelo de DP baseado em zebrafish adulto induzido por 6 OHDA. Todo o experimento envolveu três passos principais: preparações de microinjeção pré-ICV, microinjeção de ICV de zebrafish e avaliação locomotor. Para garantir a recuperação saudável dos zebrafish adultos após o procedimento de microinjeção do ICV e o bom resultado experimental, algumas boas práticas para cada etapa foram recomendadas no presente estudo.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pelo Ministério da Educação Superior da Malásia no âmbito do Regime de Bolsas de Pesquisa Fundamental [600-IRMI/FRGS 5/3 (033/2019)].
Materiais
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
Referências
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados