需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
6-羟基多巴胺诱导的基于斑马鱼的成人帕金森病模型的运动评估
摘要
本方案描述了在腹侧间脑(Dn)处用神经毒性6-羟基多巴胺(6-OHDA)向成年斑马鱼注射脑室(ICV)以及通过使用开放水箱测试评估损伤和随后恢复的游泳行为,并伴有使用视频跟踪软件进行分析。
摘要
目前治疗在延缓帕金森病(PD)中多巴胺能神经元损失方面的局限性增加了对可以恢复这些神经元的替代疗法的需求。目前,人们正在努力使用临床前 体内 模型更好地了解神经再生。然而,这种自我修复的再生能力在哺乳动物中效率低下。因此,像斑马鱼这样的非哺乳动物动物因其不断自我更新的能力以及与人类具有密切的大脑同源性而成为一种极好的神经再生模型。作为阐明 体内神经再生中涉及的细胞事件的一部分,我们已经建立了6-羟基多巴胺(6-OHDA)诱导的基于斑马鱼的成年PD模型。这是通过优化的99.96 mM 6-OHDA的脑室内(ICV)显微注射来实现的,以特异性消融斑马鱼大脑腹侧间脑(Dn)中的多巴胺能神经元(DpN)。免疫荧光显示,DpN 消融在病灶后第 3 天超过 85%,病灶部位 DpN 在病灶后 30 天完全恢复。本研究通过使用开放野外测试确定了斑马鱼在病变后游泳行为的损伤和随后的恢复,通过该测试对行进距离(cm)和平均速度(cm / s)两个参数进行了量化。通过使用视频跟踪软件分析每组(n = 6)的单个鱼的记录来评估运动。研究结果显示,与假斑马鱼相比,病变斑马鱼在病后3天的速度(cm / s)和行进距离(cm)显着降低(p <0.0001)。病变斑马鱼在出生后30 d表现出完全恢复的游泳行为。目前的研究结果表明,6-OHDA病变的成年斑马鱼是一种具有可重复质量的优秀模型,有助于PD中神经再生的研究.未来对神经再生机制以及调节该过程的内在和外在因素的研究可能为针对PD的新细胞替代治疗策略提供重要见解。
引言
帕金森病 (PD) 是一种以肌肉强直、静止性震颤和运动迟缓为特征的疾病,是世界上增长最快的神经系统疾病1,2。PD的风险和患病率随着年龄的增长而迅速增加,特别是在50岁及以上的个体中3。迄今为止,帕金森病的病因和发病机制仍然知之甚少。这往往使PD的早期发作未被诊断出来。目前,PD患者中多巴胺的缺乏和多巴胺能神经元(DpN)的丧失与运动症状的表现密切相关4。利用这种关系,已经设计了几种治疗方法,以直接作为多巴胺替代(即左旋多巴)或补偿DpN的损失(即深部脑刺激)。虽然这些治疗会带来症状益处,但它们不会改变疾病恶化的过程5。鉴于这一显著的弱点,已经提出了细胞替代疗法。然而,考虑到移植物制备、细胞生长控制和表型不稳定性的挑战,这种方法的功效并不一致。细胞替代疗法引起了伦理问题,也存在诱发脑肿瘤和不必要的免疫反应的风险6,7。
当前治疗策略的局限性导致人们更加重视DpN的再生作为治疗PD的潜在方法.DpN的再生或神经再生已成为PD管理的有希望的突破之一,不仅因为它具有作为一种新的治疗方法的潜力,而且还作为了解疾病机制的手段8,9.这种方法侧重于通过分化,迁移和将现有祖细胞整合到病变回路中来恢复神经元功能10。为了进一步探索神经再生,已经进行了各种 体内 研究。研究发现,哺乳动物、两栖动物和爬行动物等脊椎动物在受伤后会产生新的脑细胞11,12。在脊椎动物中,哺乳动物因其与人类的遗传相似性而受到更多追捧。然而,哺乳动物在中枢神经系统(CNS)中表现出有限且较差的修复能力,这种能力可以在脑部病变后持续到成年期13。一般来说,哺乳动物不适合作为理解神经再生的动物模型,因为产生的神经元数量少不足以恢复在PD中观察到的受损神经回路。因此,基于硬骨的模型,特别是在斑马鱼中,因其高增殖率,不断自我更新的能力以及与人类的紧密大脑同源性而受到极大的青睐14,15。
斑马鱼最常用于研究PD16的运动紊乱。基于斑马鱼的PD模型通常由神经毒素诱导,其中包括1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)和6-羟基多巴胺(6-OHDA)17。虽然基于MPTP的模型可有效诱导DpN的特定损失和多巴胺水平的降低,但不能密切模拟PD的条件,因为DpN损失不仅限于CNS18。6-OHDA无法穿过血脑屏障,限制了其在颅内而不是肌肉内给药时对大脑内细胞和功能变化的影响19。6-OHDA的外周给药导致整个神经系统的多巴胺水平全面降低20。虽然将6-OHDA施用到脑脊液中导致整个CNS21的DpN消融,这与PD中看到的情况不同,即DpN的丧失特别发生在人脑的黑质处。相反,6-OHDA的ICV给药特异性诱导斑马鱼大脑腹侧Dn区域DpN显着消融,这与黑质非常相似22。有趣的是,DpN的恢复是在6-OHDA诱导的病变后30天报告的,这些神经元在生命过程中存活23,24。通过使用6-OHDA诱导的基于斑马鱼的成年PD模型22的运动评估行进距离(cm)和平均速度(cm / s)来证明DpN的功能恢复。
研究方案
本研究已获得动物研究与伦理委员会(CARE),Universiti Technologi MARA(UiTM)的批准[参考编号:UiTM CARE 346/2021,日期为2021年5月7日]。
注:已公布的6-OHDA病变成年斑马鱼PD模型标准饲养和维护方案22,25,26被使用。对年龄超过5个月大的成年雄性斑马鱼(Danio rerio)进行了实验,其标准化长度为3.2-3.7厘米。
1. 斑马鱼保养及ICV前显微注射制剂
- 将鱼保持在充气水箱中,控制温度为28±1.0°C。 对于斑马鱼的饲养和维护,在整个实验过程中使用用商业海盐(1克/升)矿化的蒸馏水27。
- 每45升水箱最多容纳25条鱼或每1.8升水最多容纳一条鱼,并将它们暴露在14小时的光线和10小时的黑暗光周期内。每天至少用补充冻干蠕虫的食物颗粒喂鱼两次。
- 通过将2.5g MS-222和5g碳酸氢钠溶解在250mL蒸馏水中来制备三卡因甲磺酸盐(MS-222)的浓缩储备溶液。稀释2 mL储备溶液以产生200 mL工作麻醉溶液。
- 通过将0.2mg抗坏血酸溶解在1 mL 0.9%w / v无菌过滤的NaCl中,制备99.96mM的6-OHDA。用0.2微米过滤器过滤溶液,然后将25mg粉末形式的6-OHDA加入溶液中。在每次注射前准备新鲜的溶液,并将其储存在4°C的黑暗中。
注意:在处理化学品时,请穿戴适当的个人防护装备(即手套、实验室外套和口罩),并遵循良好的实验室规范。化学品的所有处理都应在生物安全柜内进行。
2. 斑马鱼麻醉和ICV注射
- 将鱼禁食24小时,以避免麻醉期间反流。将鱼浸入含有0.01%w / v MS-222溶液的容器中约1分钟或直到所有可见的肌肉运动停止,麻醉鱼。
- 将麻醉的鱼放在放置在立体显微镜下的浸水海绵上,并定期弄湿鱼。
- 根据连接斑马鱼大脑额叶和顶骨的介位缝合线 (MS)、冠状缝合线 (CS) 和矢状缝合线 (SS) 之间的交点确定注射位置。
- 在斑马鱼头骨的特定解剖位置的指导下,在颅骨中使用锋利的27 G针头制作一个1.0 mm2 面积的小孔(图1A,B)。
- 以60°角降低微毛细管注射器,直到其从斑马鱼头骨的颅顶达到1,200μm的深度(图1C)。按 Z 限制以固定位置。
- 将初始注入压力设置为4000 hPa,将补偿压力设置为10 hPa。将注入持续时间设置为 0.3 秒。每次后续注射时降低注射强度。
- 注射0.5μL99.96mM神经毒素6-OHDA(或0.9%w / v盐水用于假对照组),让微毛细血管休息20秒。在整个注射过程中继续用蒸馏水润湿鱼,以防止变干。
- 慢慢取出微毛细血管,在流动的蒸馏水中复苏鱼。将鱼放在一个隔离的回收池中,并清除任何可能干扰恢复过程的干扰。
- 在下一次注射之前冲洗微毛细管以清除堵塞,并确保注射强度足以产生所需的0.5μL 6-OHDA体积。
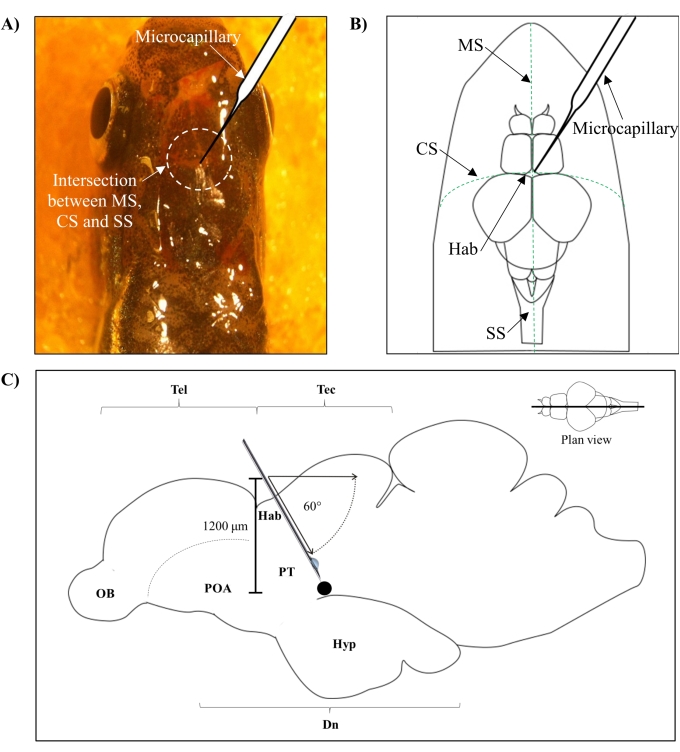
图1:神经毒素的注射部位,6-OHDA. (A)微毛细血管进入点由连接斑马鱼大脑额叶和顶骨头骨的介位缝合线(MS),冠状缝合线(CS)和猕骨缝合线(SS)之间的交集引导(平面图)。(B)斑马鱼头骨和大脑的示意图(平面图)显示了微毛细血管,其直接位于habenula(Hab)上方,及其在半球交叉处的入口点。(C)斑马鱼大脑的示意图(矢状面)显示了注射的角度和穿透深度。黑点代表位于目标区域上方的病变部位,即腹侧间脑。缩写:6-OHDA:6-羟基多巴胺,CS:冠状缝合线,Dn:间脑,Hab:habenula,Hyp:下丘脑,MS:介位缝合,OB:嗅球,POA:视前区,PT:后结核,SS:矢状缝合,Tec:构造,和电话:端脑。 请点击此处查看此图的放大版本。
3. 运动评估
注意:斑马鱼的运动评估(n = 6 /组;假与病变) 在第 三天和第30天使用既定协议28,29 在6-OHDA病变后使用既定协议单独评估。
- 录像
- 将实验罐(长20厘米,宽11.5厘米,高13厘米)放在凸起的平台上,其墙壁上覆盖着白纸(图2A)。
- 使用光源从底部照亮水箱。用蒸馏水(80%-90%满)填充罐,并将温度保持在28±1.0°C。 使用温度计测量温度,并使用商用水族箱加热器进行调节。
- 经过至少2分钟的适应后,使用摄像机从实验竞技场的2D(2D)平面上的平面图记录鱼的游泳行为5分钟(图2B)。为避免较早和最后一批录音的游泳行为不一致,请勿超过10分钟30的适应时间。
- 使用具有开放式坦克协议的视频跟踪软件分析视频,以获取每个受试者的行进距离(cm)和平均速度(cm / s)。

图2:用于评估斑马鱼运动行为的开放式水箱测试的实验设置。 (A)实验水箱(前视图)放置在从下方照亮的凸起平台上。坦克的四面墙覆盖着白纸,记录是轴向捕获的。使用温度计测量温度,并使用商用水族箱加热器调节在28±1.0°C。(B) 使用设置捕获的视频录制的屏幕截图(平面视图)。 请点击此处查看此图的放大版本。
- 数据分析
- 双击图标以打开视频跟踪软件。单击" 文件 "选项卡,然后选择" 创建新的空试验"。这将允许用户根据调查目的自定义实验参数。
- 单击" 协议 "选项卡,选择" 视频源", 然后单击" 添加新视频源"。单击可用的下拉列表,然后选择" 视频文件" 选项。这将提示文件浏览弹出窗口,从中可以选择感兴趣的视频录制。
- 单击 "设备" 子选项卡,然后选择" 矩形 "图标以设置设备。拖动矩形图标以覆盖整个实验竞技场。相应地设置比例尺,并输入标尺部分长度中使用的比例测量值的数值。本实验使用10毫米刻度进行开罐试验。
- 通过选择" 动物比设备背景更暗"来设置动物颜色。将"跟踪"中的其他可用选项保留为预设的默认设置。
- 在 "区域" 子选项卡中,单击先前绘制的设备。此区域设置为标准区域,其位置对于所有测试都是相同的。
- 在"测试计划和测试数据报告"下选择以下选项:" 测试持续时间"、"总行驶距离"和" 平均速度"。列表中的其他可用测试是可选的,取决于研究人员的调查兴趣。
- 在" 实验 "选项卡中,通过在 "名称 "部分下键入组名称和"动物数"部分中键入每个组的动物数,根据测试组分配 动物 。
- 切换到" 测试 "选项卡以运行实验。单击" 开始测试" 图标,然后等待分析所有视频。
- 在" 结果 "选项卡中,单击" 查看报告 "图标以在文本报告窗体中查看运动数据。
结果
本实验评估了6-OHDA静脉导热病毒显微注射后成年斑马鱼游泳行为的变化。使用6-OHDA作为首选神经毒素的原因是由于其无法穿过血脑屏障,血脑屏障在感兴趣腹侧间脑(Dn)区域产生特异性和靶向消融DpN16。这里的DpN亚群在解剖学上与人类黑质中的DpN亚群相似31。
根据我们之前的工作22,通过DpN标志物 - 酪氨酸羟化酶(TH)的?...
讨论
本工作成功地证明了对已建立的6-OHDA诱导的基于斑马鱼的成年PD模型的运动评估。整个实验涉及三个主要步骤:ICV前显微注射制剂,斑马鱼的ICV显微注射和运动评估。为确保成年斑马鱼在ICV显微注射手术后健康恢复并取得良好的实验结果,本研究建议对每一步采取一些良好做法。
ICV前显微注射准备:动物选择最好在实验前一天进行。确定了性别,并测量了鱼的长度。将标准化长?...
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了马来西亚高等教育部在基础研究资助计划[600-IRMI/FRGS 5/3 (033/2019)]下的支持。
材料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
参考文献
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。