このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
6-ヒドロキシドーパミン誘発成体ゼブラフィッシュベースのパーキンソン病モデルの自発運動評価
要約
本プロトコールは、腹側間脳(Dn)における神経毒性6-ヒドロキシドーパミン(6-OHDA)による成体ゼブラフィッシュの脳室内(ICV)注射、およびビデオ追跡ソフトウェアを用いた分析を伴うオープンタンク試験を用いた病変後の遊泳行動の障害およびその後の回復の評価を記載する。
要約
パーキンソン病(PD)におけるドーパミン作動性ニューロン喪失を遅らせる現在の治療法の限界は、これらのニューロンを回復させることができる代替療法の必要性を提起する。現在、前臨床in vivoモデルを用いた神経再生の理解を深めるために多くの努力 が払われている 。しかし、自己修復のためのこの再生能力は、哺乳類では非効率的である。したがって、ゼブラフィッシュのような哺乳類以外の動物は、継続的に自己再生する能力と人間との密接な脳相同性を有するため、優れた神経再生モデルとして浮上してきた。 生体内の神経再生に関与する細胞事象の解明の一環として、6-ヒドロキシドーパミン(6-OHDA)誘導成体ゼブラフィッシュ由来PDモデルを確立しました。これは、ゼブラフィッシュ脳の腹側間脳(Dn)内のドーパミン作動性ニューロン(DpN)を特異的に遮断するために、99.96mM 6-OHDAの最適化された脳室内脳室(ICV)マイクロインジェクションによって達成された。免疫蛍光は、病変後3日目におけるDpNアブレーションの85%以上を示し、病変後30日目におけるDpNの完全な回復を示した。本研究では、移動距離(cm)と平均速度(cm/s)の2つのパラメータを定量化したオープンフィールドテストを用いて、病変後のゼブラフィッシュの遊泳行動の障害とその後の回復を決定した。移動運動は、ビデオ追跡ソフトウェアを用いて各群(n=6)の個々の魚の記録を分析することによって評価された。この知見は、偽物と比較して、病変後3日目の病変ゼブラフィッシュの速度(cm/s)および移動距離(cm)の有意な減少(p <0.0001)を示した。病変したゼブラフィッシュは、病変後30日目に遊泳行動の完全な回復を示した。本知見は、6-OHDA病変成体ゼブラフィッシュがPDにおける神経再生の研究を促進する再現性のある品質を有する優れたモデルであることを示唆している。
概要
パーキンソン病(PD)は、筋肉の硬直、安静時振戦、運動緩慢を特徴とする疾患で、世界で最も急速に成長している神経疾患です1,2。PDのリスクと有病率は、特に50歳以上の個人において、年齢とともに急速に増加する3。PDの病因および病因は、これまでほとんど理解されていないままである。これはしばしばPDの早期発症を未診断のままにしている。現在、PD患者におけるドーパミンの欠乏およびドーパミン作動性ニューロン(DpN)の喪失は、運動症状の発現と強く関連している4。この関係を利用して、いくつかの治療法は、ドーパミン補充(すなわち、レボドパ)として直接作用するか、またはDpNの損失を補う(すなわち、深部脳刺激)ように設計されている。これらの治療法は症候性の利益をもたらしますが、病気の悪化する経過を変更するものではありません5。この重大な弱点に鑑み、細胞補充療法が提案されている。しかしながら、このアプローチの有効性は、移植片調製、細胞増殖制御、および表現型不安定性の課題を考えると矛盾している。倫理的な懸念を提起していた細胞補充療法は、脳腫瘍や望ましくない免疫反応を誘発するリスクも引き起こします6,7。
DpNの再生または神経再生は、新しい治療法としての可能性だけでなく、疾患のメカニズムを理解する手段としても、PDの管理における有望なブレークスルーの1つとして浮上しています。9.このアプローチは、既存の前駆細胞の分化、遊走、および病変回路への統合によるニューロン機能の回復に焦点を当てています10。神経再生をさらに探求するために、様々なin vivo研究が行われている。哺乳類、両生類、爬虫類などの脊椎動物は、傷害後に新しい脳細胞を生成することが判明しました11,12。脊椎動物の間では、哺乳類動物は人間との遺伝的類似性を考えると、より求められています。しかし、哺乳類は中枢神経系(CNS)において限定的で貧弱な修復能力を示し、脳病変後の成人期まで持続する可能性があります13。一般に、哺乳類は、産生されるニューロンの数が少ないとPDで観察された損傷した神経回路を回復させるのに十分ではないことを考えると、神経再生を理解するための動物モデルとしては不向きである。そのため、テレオストベースのモデル、特にゼブラフィッシュでは、その高い増殖速度、継続的に自己再生する能力、および人間との脳の相同性を閉じることで非常に好まれています14,15。
ゼブラフィッシュは、PD16の運動障害を研究するために最も一般的に使用されています。ゼブラフィッシュベースのPDモデルは、通常、1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)および6-ヒドロキシドーパミン(6-OHDA)を含む神経毒によって誘導される17。DpNの特異的損失およびドーパミンレベルの低下を誘導するのに有効であるが、MPTPベースのモデルは、DpN損失がCNS18のみに限定されないため、PDの状態を厳密に模倣しない。6-OHDAが血液脳関門を通過することができないため、筋肉内投与ではなく頭蓋内投与時の脳内の細胞的および機能的変化への影響が制限されていました19。6-OHDAの末梢投与は、神経系全体のドーパミンレベルの世界的な低下を引き起こした20。脳脊髄液への6-OHDAの投与はCNS21全体にわたってDpNのアブレーションを引き起こしたが、これはPDに見られるような状態を模倣せず、それによってDpNの喪失はヒト脳の黒質で特異的に起こる。それどころか、6-OHDAのICV投与は、ゼブラフィッシュ脳における腹側Dnの領域におけるDpNの有意なアブレーションを特異的に誘導し、これは実体nigra22によく似ていた。興味深いことに、DpNの回復は6-OHDA誘発病変の30日後に報告され、これらのニューロンは生涯にわたって生存した23,24。DpNの機能回復は、6-OHDA誘導成体ゼブラフィッシュベースのPDモデルを用いて、移動距離(cm)および平均速度(cm/s)の自発運動評価によって実証された22。
プロトコル
本研究は、マラ大学(UiTM)動物研究倫理委員会(CARE)によって承認されている[参考文献番号:UiTM CARE 346/2021、2021年5月7日付]。
注:6-OHDA病変成体ゼブラフィッシュPDモデルの標準的な飼育および維持のための公開されたプロトコル22,25,26が利用された。実験は、3.2〜3.7cmの標準化された長さを有する生後5ヶ月以上の成体雄ゼブラフィッシュ(Danio rerio)を用いて実施された。
1.ゼブラフィッシュのメンテナンスとICV前のマイクロインジェクション製剤
- 魚を通気水槽に28〜1.0°Cの制御された温度±維持する。 ゼブラフィッシュの飼育と維持管理のために、実験全体を通して市販の海塩(1 g/L)でミネラル化した蒸留水を使用してください27。
- 45 Lタンクあたり最大25匹の魚、または1.8 Lの水あたり1匹の魚を収容し、14時間の光と10時間の暗光周期のスケジュールにさらします。フリーズドライワームを補充した食物ペレットで少なくとも1日2回魚に餌をやる。
- 250mLの蒸留水にMS-22222gおよび炭酸水素ナトリウム5gを溶解して、メタンスルホン酸トリカイン(MS-222)の濃縮原液を調製する。2 mLの原液を希釈して、200 mLの作業麻酔溶液を生成する。
- まず0.2mgのアスコルビン酸を1mLの0.9%w/v滅菌ろ過NaClに溶解して99.96mMの6-OHDAを調製する。溶液に粉末形態の6-OHDA25mgを加える前に、0.2ミクロンフィルターで溶液をろ過する。各注射前に溶液を新鮮に調製し、4°Cで暗所に保存する。
警告: 化学物質を取り扱う際には、適切な個人用保護具(手袋、実験用コート、フェイスマスクなど)を着用し、検査室での適切な練習を実践してください。化学物質のすべての取り扱いは、バイオセーフティキャビネット内で行う必要があります。
2. ゼブラフィッシュの麻酔とICV注射
- 麻酔中の逆流を避けるために、魚を24時間速くします。MS-222溶液の0.01% w/vを含む容器に約1分間、または目に見えるすべての筋肉の動きが止まるまで魚を麻酔します。
- 麻酔をかけた魚を実体顕微鏡下に置いた水浸しのスポンジの上に置き、定期的に魚を濡らします。
- ゼブラフィッシュ脳の前頭頭蓋骨と頭頂頭蓋骨をつなぐメトピー縫合糸(MS)、冠状縫合糸(CS)、矢状縫合糸(SS)の交点に基づいて注射位置を特定する。
- ゼブラフィッシュの頭蓋骨上の特定の解剖学的位置によって導かれる頭蓋骨に鋭い27G針を使用して、1.0mm2領域の小さな穴を開ける(図1A、B)。
- マイクロキャピラリーインジェクタを60°の角度で下げ、ゼブラフィッシュの頭蓋骨の頭蓋屋根から1,200μmの深さに達するまで下げます(図1C)。Z リミットを押して位置を固定します。
- 初期射出圧力を4000hPa、補償圧力を10hPaに設定してください。注入時間を 0.3 秒に設定します。後続の各注入で注入の強度を下げます。
- 0.5 μLの99.96 mM神経毒6-OHDA(または偽対照群の場合は0.9% w/v生理食塩水)を注入し、微小毛細血管を20秒間休ませます。乾燥を防ぐために、注入プロセス全体を通して蒸留水で魚を濡らし続けます。
- ゆっくりとマイクロキャピラリーを取り除き、実行中の蒸留水の下で魚を蘇生させます。魚を隔離された回収タンクに入れ、回復プロセスを妨害する可能性のある気を散らすものを取り除きます。
- 次の注射の前にマイクロキャピラリーをフラッシュして閉塞を解消し、注射の強度が所望の容量の6-OHDAを0.5μL得るのに十分であることを確認する。
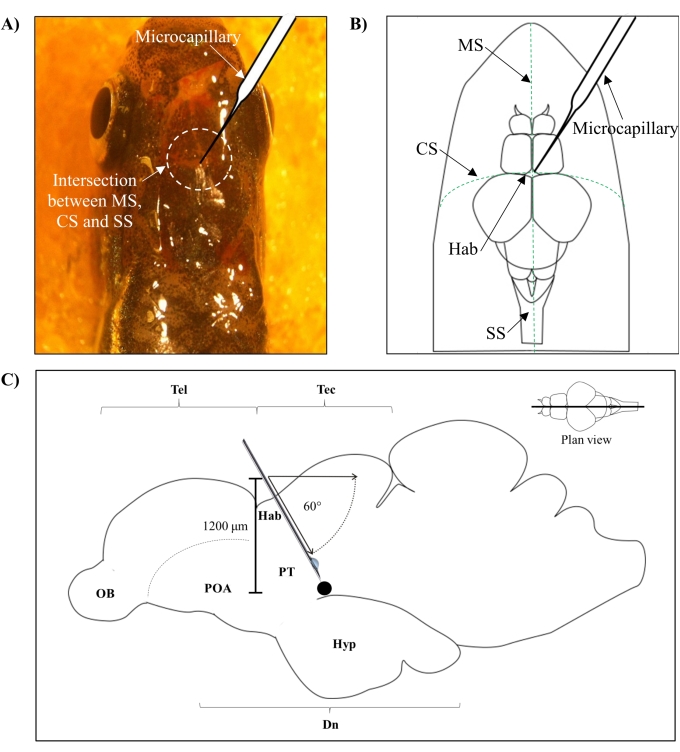
図1:神経毒の注射部位、6-OHDA.(A)微小毛細血管進入点は、ゼブラフィッシュ脳の前頭蓋骨と頭頂頭蓋骨をつなぐメトピー縫合糸(MS)、冠状縫合糸(CS)、矢状縫合糸(SS)との交点によって導かれる(平面図)。(b)ゼブラフィッシュの頭蓋骨と脳の模式図(平面図)は、ハベヌラ(Hab)の真上に下降した微小毛細血管と、半球の交点におけるその進入点を示している。(c)ゼブラフィッシュ脳の模式図(矢状部)は、注入角度と浸透深さを示す。黒い点は、標的領域、腹側間脳の上に位置する病変部位を表す。略語:6-OHDA:6-ヒドロキシドーパミン、CS:冠状縫合糸、Dn:間脳、Hab:ハベヌラ、Hyp:視床下部、MS:メトピア縫合糸、OB:嗅球、POA:前視領域、PT:後結核、SS:矢状縫合糸、Tec:tectum、およびTel:テレシンファロン。この図の拡大版を表示するには、ここをクリックしてください。
3. 自発運動評価
注:ゼブラフィッシュの自発運動評価(n=6個/群;偽物対病変)は、6-OHDA病変後の3日目および30日目に確立されたプロトコール28、29を用いたオープンタンク試験を介して個別に評価した。
- ビデオ録画
- 壁を白い紙で覆った実験槽(長さ20cm、幅11.5cm、高さ13cm)を、隆起した台の上に置きます(図2A)。
- 光源を使用してタンクを下から照らします。タンクに蒸留水(80%〜90%満杯)を満たし、温度を28±1.0°Cに維持します。 温度計を使用して温度を測定し、市販の水槽ヒーターを使用して温度を調整します。
- 最低2分間の順応後、ビデオカメラを用いて実験場の2次元(2D)平面上の平面図から魚の遊泳行動を5分間記録する(図2B)。記録の前のバッチと最後のバッチの水泳動作の不一致を避けるために、順応を10分30超過しないでください。
- オープンタンクプロトコルを備えたビデオトラッキングソフトウェアを使用してビデオを分析し、各被験者の移動距離(cm)と平均速度(cm/s)を取得します。

図2:ゼブラフィッシュの自発運動挙動を評価するためのオープンタンクテストの実験セットアップ 。 (A)実験タンク(正面図)は、下から照らされた隆起したプラットフォーム上に置かれる。タンクの4つの壁は白い紙で覆われており、録音は軸方向にキャプチャされています。温度は温度計を使用して測定され、市販の水槽ヒーターを使用して28±1.0°Cで調整されます。(B) セットアップを使用してキャプチャされたビデオ録画のスクリーンショット (平面図)。 この図の拡大版を表示するには、ここをクリックしてください。
- データ解析
- アイコンをダブルクリックしてビデオトラッキングソフトウェアを開きます。[ ファイル ] タブをクリックし、[ 新しい空の実験を作成] を選択します。これにより、ユーザーは調査の目的に応じて実験パラメータをカスタマイズできます。
- [プロトコル]タブをクリックし、[ビデオソース]を選択して、[新しいビデオソースの追加]をクリックします。利用可能なドロップダウンリストをクリックし、[ビデオファイル]オプションを選択します。これにより、目的のビデオ録画を選択できるファイルブラウジングポップアップが表示されます。
- 装置サブタブをクリックし、長方形アイコンを選択して装置を設定します。長方形のアイコンをドラッグして、実験アリーナ全体を覆います。それに応じてスケールバーを設定し、定規セクションの長さで使用されるスケール測定の数値を入力します。本実験では、開放槽試験に10mmスケールを用いた。
- 動物の色を設定する には、「動物は装置の背景よりも暗い」を選択します。トラッキングで使用可能なその他のオプションは、あらかじめ設定されたデフォルト設定のままにします。
- ゾーンサブタブで、以前に描画した装置をクリックします。このゾーンは、すべてのテストで位置が同じである標準ゾーンとして設定されます。
- テストのスケジュールとテスト データ レポートで、[テスト期間]、[合計移動距離]、[平均速度] のオプションを選択します。リスト上の他の利用可能なテストはオプションであり、研究者の調査の関心に依存します。
- [実験] タブで、[名前] セクションにグループ名を入力し、[動物の数] セクションにグループごとの動物数を入力して、テスト グループに従って動物を割り当てます。
- [ テスト] タブに切り替えて、実験を実行します。[ テストの開始] アイコンをクリックし、すべてのビデオが分析されるまで待ちます。
- [ 結果 ]タブで、[レポート の表示] アイコンをクリックして、自発運動データをテキストレポート形式で表示します。
結果
本実験は、6-OHDAによるICVマイクロインジェクション後の成体のゼブラフィッシュ遊泳行動の変化を評価した。6-OHDAを神経毒として選択した理由は、血液脳関門を通過することができず、関心のある腹側間脳(Dn)の領域でDpNの特異的かつ標的遮断を生じさせたためであった16。ここでのDpN亜集団は、ヒトの黒質パースコンパクト31におけるDpN亜集団と解剖学的?...
ディスカッション
本研究は、確立された6-OHDA誘導成体ゼブラフィッシュベースのPDモデルの自発運動評価を首尾よく実証した。実験全体は、ICV前のマイクロインジェクション調製物、ゼブラフィッシュのICVマイクロインジェクション、および自発運動評価の3つの主要なステップを含む。ICVマイクロインジェクション手順と良好な実験結果に続く成体ゼブラフィッシュの健全な回復を確実にするために、本研究?...
開示事項
著者らは利益相反がないと宣言しています。
謝辞
この研究は、マレーシア高等教育省の基盤研究助成スキーム[600-IRMI/FRGS 5/3 (033/2019)]の支援を受けたものです。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
参考文献
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved