JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
6-하이드록시도파민 유발 성인 제브라피쉬계 파킨슨병 모델의 운동성 평가
요약
본 프로토콜은 복부 이뇌팔론(Dn)에서 신경독성 6-히드록시도파민(6-OHDA)을 갖는 성인 제브라피쉬의 뇌심실(ICV) 주사 및 개방 탱크 테스트를 사용하여 수영 거동 후 후유증의 장애 및 후속 회복에 대한 평가를 설명하며, 이는 비디오 추적 소프트웨어를 이용한 분석을 수반한다.
초록
파킨슨 병 (PD)에서 도파민성 뉴런 손실을 지연시키는 현재의 치료법의 한계는 이러한 뉴런을 복원 할 수있는 대체 요법의 필요성을 제기합니다. 많은 노력은 현재 전임상 생체 내 모델을 사용하여 신경 재생에 대한 더 나은 이해를 지향하고 있습니다. 그러나 자기 복구를위한 이러한 재생 능력은 포유류에서는 비효율적입니다. 따라서 제브라피쉬와 같은 비포유류 동물은 지속적으로 자기 갱신하고 인간과 가까운 뇌 상동성을 가질 수있는 능력으로 인해 우수한 신경 재생 모델로 부상했습니다. 생체 내에서 신경 재생에 관여하는 세포 사건을 밝히기 위한 노력의 일환으로, 우리는 6-하이드록시도파민(6-OHDA)-유도성인 제브라피쉬 기반 PD 모델을 확립하였다. 이는 제브라피쉬 뇌의 복부 디뇌팔론(Dn)에서 도파민성 뉴런(DpN)을 특이적으로 제거하기 위해 99.96 mM 6-OHDA의 최적화된 뇌심실(ICV) 미세주입을 통해 달성되었다. 면역형광은 병변 후 3일째에 DpN 절제의 85% 이상을 나타내었고, 병변 후 30일 후 병변 부위에서 DpN의 완전한 회복을 나타내었다. 본 연구는 이동 거리 (cm)와 평균 속도 (cm / s)의 두 가지 매개 변수가 정량화 된 개방 필드 테스트를 사용하여 병변 후 제브라 피쉬 수영 행동의 손상과 후속 회복을 결정했습니다. 이동은 비디오 추적 소프트웨어를 사용하여 각 그룹의 개별 물고기 기록 (n = 6)을 분석하여 평가되었습니다. 연구 결과는 sham과 비교했을 때 병변 제브라 피쉬의 속도 (cm / s) 및 이동 거리 (cm)의 유의 감소 (p < 0.0001)를 보여주었습니다. 병변 된 제브라 피쉬는 30 일 후 수영 행동의 완전한 회복을 나타냈다. 본 연구 결과는 6-OHDA 병변 성인 제브라피쉬가 PD의 신경 재생 연구를 용이하게하는 재현 가능한 품질을 갖춘 우수한 모델임을 시사합니다. 신경 재생의 기초가되는 메커니즘뿐만 아니라 과정을 조절하는 내재적 및 외인성 요인에 대한 향후 연구는 PD에 대한 새로운 세포 대체 치료 전략에 대한 중요한 통찰력을 제공 할 수 있습니다.
서문
파킨슨 병 (PD)은 근육 경직, 휴식 떨림 및 서맥을 특징으로하는 질병으로 세계에서 가장 빠르게 성장하는 신경 질환입니다1,2. PD의 위험과 유병률은 특히 50 세 이상의 개인에서 나이가 들수록 빠르게 증가합니다3. PD의 병인과 병인은 지금까지 잘 이해되지 않고 있다. 이것은 종종 PD의 조기 발병을 진단되지 않은 채로 남겨 두었습니다. 현재, PD 환자에서 도파민의 부족과 도파민성 뉴런 (DpN)의 손실은 운동 증상의 징후와 강하게 관련이있다4. 이 관계를 활용하여, 도파민 대체 (즉, 레보도파)로 직접 작용하거나 DpN의 손실 (즉, 심부 뇌 자극)을 보상하기 위해 여러 가지 치료법이 설계되었습니다. 이러한 치료법은 증상 적 이점을 가져 오지만 질병의 악화 과정을 수정하지는 않습니다5. 이러한 중요한 약점을 고려하여 세포 대체 요법이 제안되었습니다. 그러나 이러한 접근법의 효능은 이식편 제제, 세포 성장 조절 및 표현형 불안정성의 도전을 고려할 때 일관성이 없다. 윤리적 문제를 제기했던 세포 대체 요법은 또한 뇌종양과 원치 않는 면역 반응을 유발할 위험을 제기한다6,7.
현재의 치료 전략의 한계는 PD 치료의 잠재적 인 접근법으로서 DpN의 재생에 더 중점을 두게했다. DpN의 재생 또는 신경 재생은 PD의 관리에서 유망한 돌파구 중 하나로 부상했으며, 이는 새로운 치료 방법으로서의 잠재력뿐만 아니라 질병의 메커니즘을 이해하는 수단으로 인해8, 9. 이 접근법은 기존의 전구 세포를 병변 회로로 분화, 이동 및 통합을 통해 신경 기능의 회복에 중점을 둡니다10. 신경 재생을 더 탐구하기 위해 다양한 생체 내 연구가 수행되었습니다. 포유류, 양서류 및 파충류와 같은 척추 동물이 손상 후 새로운 뇌 세포를 생성하는 것으로 나타났습니다11,12. 척추 동물 중에서 포유류 동물은 인간과 유전 적으로 닮았을 때 더 많이 추구됩니다. 그러나 포유류는 뇌 병변 후 성인기까지 지속될 수 있는 중추신경계(CNS)에서 제한적이고 열악한 회복 능력을 나타낸다13. 일반적으로, 포유동물은 낮은 수의 뉴런 생성이 PD에서 관찰된 손상된 신경 회로를 복원하기에 충분하지 않을 것이라는 점을 감안할 때 신경재생을 이해하기 위한 동물 모델로서 부적합하다. 따라서, 텔레오스트 기반 모델, 특히 제브라피쉬에서는 높은 증식 속도, 지속적으로 자기 갱신 능력, 인간과의 뇌 상동성을 닫는 능력 때문에 크게 선호된다14,15.
제브라피쉬는 PD16에서 무질서한 움직임을 연구하는 데 가장 일반적으로 사용됩니다. 제브라피쉬-기반 PD 모델은 일반적으로 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘(MPTP) 및 6-하이드록시도파민(6-OHDA)17을 포함하는 신경독소에 의해 유도된다. DpN의 특이적 손실 및 도파민 수준의 감소를 유도하는데 효과적이지만, MPTP 기반 모델은 DpN 손실이 CNS18에만 국한되지 않기 때문에 PD의 조건을 밀접하게 모방하지 않는다. 6-OHDA가 혈액-뇌 장벽을 넘을 수 없기 때문에 근육내와 반대로 두개내로 투여될 때 뇌 내의 세포 및 기능 변화에 미치는 영향이 제한되었다19. 6-OHDA의 말초 투여는 신경계 전반에 걸쳐 도파민 수준의 세계적인 감소를 일으켰다20. 뇌척수액에 6-OHDA를 투여하는 동안 CNS21 전체에 걸쳐 DpN의 절제가 발생했으며, 이는 PD에서 볼 수 있는 바와 같은 상태를 모방하지 못함으로써 DpN의 손실이 인간 뇌의 흑질에서 특이적으로 발생한다. 반대로 6-OHDA의 ICV 투여는 특히 제브라피쉬 뇌의 복부 Dn 영역에서 DpN의 현저한 절제를 유도했으며, 이는 실질적 nigra22와 매우 유사했다. 흥미롭게도, DpN의 회복은 6-OHDA-유도된 병변 후 30일 후에 보고되었고, 이들 뉴런은 수명 동안 생존하였다23,24. DpN의 기능적 회복은 6-OHDA 유도 성인 제브라피쉬 기반 PD 모델(22)을 사용하여 이동 거리(cm) 및 평균 속도(cm/s)의 운동 평가를 통해 입증되었습니다.
프로토콜
본 연구는 동물 연구 및 윤리위원회 (CARE), Universiti Technologi MARA (UiTM) [참조 번호 : UiTM CARE 346/2021, 2021 년 5 월 7 일자]의 승인을 받았습니다.
참고: 6-OHDA-병변 성인 제브라피쉬 PD 모델의 표준 축산 및 유지를 위해 공개된 프로토콜22,25,26이 활용되었다. 실험은 표준화된 길이 3.2-3.7 cm의 5개월 이상 된 성인 남성 제브라피쉬(Danio rerio)를 대상으로 수행되었다.
1. 제브라피쉬 유지 보수 및 ICV 전 미세 주사 준비
- 물고기를 폭기 된 물 탱크에서 28 ± 1.0 °C의 통제 된 온도 하에서 유지하십시오. 제브라피쉬 축산 및 유지 보수를 위해 실험 전반에 걸쳐 상업용 바다 소금 (1 g / L)으로 미네랄 화 된 증류수를 사용하십시오.27.
- 45L 탱크 당 최대 25 마리의 물고기 또는 1.8 L 물 당 1 마리의 물고기를 수용하고 14 시간 빛과 10 시간의 어두운 광주기의 일정에 노출시킵니다. 동결 건조 된 웜으로 보충 된 음식 펠릿으로 하루에 적어도 두 번 물고기에게 먹이를주십시오.
- 2.5 g의 MS-222 및 5 g의 중탄산나트륨을 증류수 250 mL에 용해시켜 트리카인 메탄설포네이트(MS-222)의 농축 원액을 제조하였다. 원액 2 mL를 희석하여 작업 마취 용액 200 mL를 생성합니다.
- 먼저 0.9% w/v 멸균 여과된 NaCl 1 mL에 0.2 mg의 아스코르브산을 용해시켜 99.96 mM의 6-OHDA를 제조하였다. 분말 형태의 6-OHDA 25mg을 용액에 첨가하기 전에 용액을 0.2-미크론 필터로 여과하십시오. 각 주입 전에 신선한 용액을 준비하고 4°C에서 어둠 속에 보관한다.
주의: 적절한 개인 보호 장비(예: 장갑, 실험실 코트 및 안면 마스크)를 착용하고 화학 물질을 취급할 때 좋은 실험실 관행을 실천하십시오. 화학 물질의 모든 취급은 생물 안전 캐비닛 내에서 수행되어야합니다.
2. 제브라피쉬의 마취 및 ICV 주사
- 마취 중 역류를 피하기 위해 물고기를 24 시간 동안 빠르게하십시오. 약 1분 동안 또는 모든 가시적인 근육 운동이 멈출 때까지 MS-222 용액의 0.01% w/v가 들어있는 용기에 담그어 물고기를 마취하십시오.
- 마취 된 물고기를 입체 현미경으로 놓은 물에 젖은 스폰지에 놓고 물고기를 정기적으로 적시십시오.
- 제브라피쉬 뇌의 전두엽 및 정수리 두개골을 연결하는 메토픽 봉합사 (MS), 코로나 봉합사 (CS) 및 시상 봉합사 (SS) 사이의 교차점을 기반으로 주사 위치를 확인합니다.
- 제브라피쉬 두개골의 특정 해부학적 위치에 따라 안내되는 두개골에 날카로운 27G 바늘을 사용하여 1.0mm2 영역의 작은 구멍을 만듭니다(그림 1A,B).
- 미세모세관 주입기를 제브라피쉬 두개골의 두개골 지붕으로부터 1,200μm 깊이에 도달할 때까지 60° 각도로 낮춥니다(그림 1C). Z 한계를 눌러 위치를 수정합니다.
- 초기 사출 압력을 4000hPa로 설정하고 보상 압력을 10hPa로 설정합니다. 주입 기간을 0.3초로 설정합니다. 각 후속 주사로 주사의 강도를 낮 춥니 다.
- 99.96 mM 신경독소 6-OHDA (또는 가짜 대조군의 경우 0.9 % w / v 식염수) 0.5 μL를 주입하고 미세 모세 혈관을 20 초 동안 쉬게하십시오. 건조를 방지하기 위해 주입 과정 전반에 걸쳐 증류수로 물고기를 계속 적시십시오.
- 천천히 미세 모세 혈관을 제거하고 흐르는 증류수에서 물고기를 소생시킵니다. 물고기를 격리 된 복구 탱크에 넣고 복구 과정을 방해 할 수있는 산만 함을 제거하십시오.
- 다음 주입 전에 미세모세관을 플러시하여 막힘을 제거하고 주입의 강도가 0.5 μL의 6-OHDA의 원하는 부피를 산출하기에 충분한지 확인하십시오.
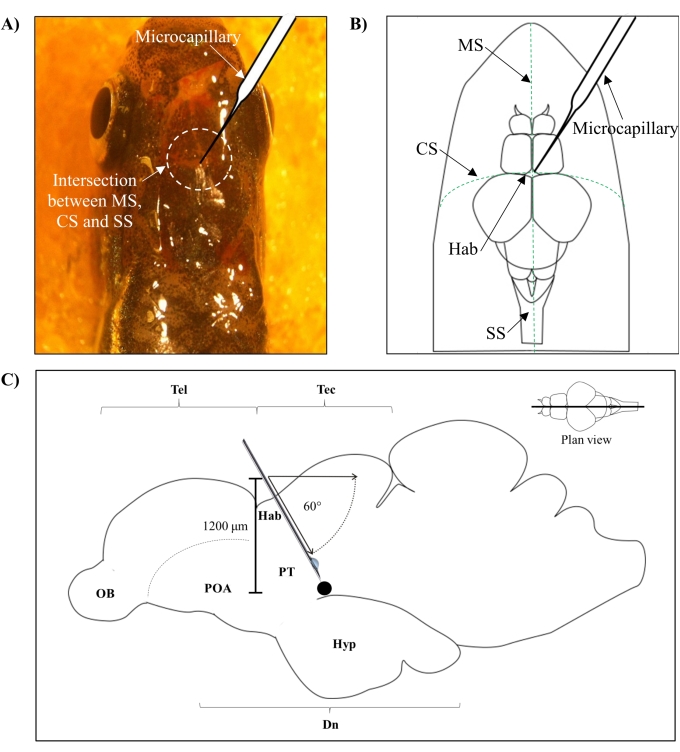
도 1: 신경독소, 6-OHDA의 주사 부위. (A) 미세모세관 진입 지점은 제브라피쉬 뇌의 전두엽 및 정수리 두개골을 연결하는 메토픽 봉합사(MS), 관상 봉합사(CS) 및 시상 봉합사(SS) 사이의 교차점에 의해 유도된다(평면도). (B) 제브라피쉬 두개골과 뇌의 개략도(평면도)는 하베눌라(Hab) 바로 위에 하강되는 미세모세관과 반구 사이의 교차점에서의 진입점을 보여준다. (C) 제브라피쉬 뇌의 개략도(sagittal section)는 주입각과 침투 깊이를 보여준다. 검은 점은 표적 부위 인 복부 diencephalon 위에 위치한 병변 부위를 나타냅니다. 약어 : 6-OHDA : 6- 히드 록시 도파민, CS : 코로나 봉합사, Dn : diencephalon, Hab : habenula, Hyp : 시상 하부, MS : metopic 봉합사, OB : 후각 전구, POA : 시신경 영역, PT : 후부 결핵, SS : 시상 봉합사, Tectum : tectum 및 Tel : telencephalon. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 운동 평가
참고: 제브라피쉬의 기관모성 평가(n=6/군; 가짜 대 병변)는 6-OHDA 병변 후 3일째 및 30일째에 확립된 프로토콜28,29를 사용하여 개방 탱크 테스트를 통해 개별적으로 평가되었다.
- 비디오 녹화
- 벽이 흰 종이로 덮인 실험 탱크(길이 20cm, 너비 11.5cm, 높이 13cm)를 올린 플랫폼 위에 놓습니다(그림 2A).
- 광원을 사용하여 탱크를 바닥에서 비추십시오. 탱크를 증류수 (80 % -90 % 전체)로 채우고 온도를 28 ± 1.0 °C로 유지하십시오. 온도계를 사용하여 온도를 측정하고 상업용 수족관 히터를 사용하여 온도를 조절하십시오.
- 최소 2분의 순응 후, 5분 동안 비디오 카메라를 사용하여 실험 경기장의 2차원(2D) 평면상의 평면도에서 물고기 수영 거동을 기록한다(도 2B). 이전 및 마지막 녹음 배치의 수영 동작의 불일치를 피하려면 순응도를 10 min30까지 초과하지 마십시오.
- 각 피사체의 이동 거리 (cm) 및 평균 속도 (cm / s)를 획득하기위한 오픈 탱크 프로토콜과 비디오 추적 소프트웨어를 사용하여 비디오를 분석하십시오.

그림 2 : 제브라 피쉬 운동 거동 평가를위한 개방형 탱크 테스트의 실험 설정. (A) 실험 탱크 (정면도)는 아래에서 조명되는 상승 된 플랫폼에 배치됩니다. 탱크의 네 벽은 흰 종이로 덮여 있으며 녹음은 축 방향으로 캡처됩니다. 온도는 온도계를 사용하여 측정되고 상업용 수족관 히터를 사용하여 28 ± 1.0 °C에서 조절됩니다. (B) 설정을 사용하여 캡처된 비디오 녹화의 스크린샷(평면도). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 데이터 분석
- 아이콘을 두 번 클릭하여 비디오 추적 소프트웨어를 엽니 다. 파일 탭을 클릭하고 새 빈 실험 만들기를 선택합니다. 이를 통해 사용자는 조사 목적에 따라 실험 매개 변수를 사용자 정의 할 수 있습니다.
- 프로토콜 탭을 클릭하고 비디오 소스를 선택한 다음 새 비디오 소스 추가를 클릭하십시오. 사용 가능한 드롭 다운 목록을 클릭하고 비디오 파일 옵션을 선택하십시오. 그러면 관심있는 비디오 녹화를 선택할 수있는 파일 탐색 팝업이 표시됩니다.
- 장치 하위 탭을 클릭하고 직사각형 아이콘을 선택하여 장치를 설정합니다. 직사각형 아이콘을 드래그하여 전체 실험 영역을 덮습니다. 그에 따라 배율 막대를 설정하고 눈금자 섹션의 길이에 사용되는 스케일 측정의 숫자 값을 입력합니다. 본 실험은 개방 탱크 시험을 위해 10 mm 스케일을 사용하였다.
- 동물 색상은 장치 배경보다 어둡습니다(The Animals are Darker than The Apparatus Background)를 선택하여 설정합니다. 추적에서 사용 가능한 다른 옵션은 사전 설정된 기본 설정으로 둡니다.
- Zones 하위 탭에서 이전에 그린 장치를 클릭합니다. 이 영역은 모든 테스트에서 위치가 동일한 표준 영역으로 설정됩니다.
- 테스트 일정 및 테스트 데이터 보고서에서 테스트 기간, 총 이동 거리 및 평균 속도라는 옵션을 선택합니다. 목록에서 사용 가능한 다른 테스트는 선택 사항이며 연구자의 조사 관심에 따라 다릅니다.
- 실험 탭에서 이름 섹션 아래에 그룹 이름을 입력하고 동물 수 섹션에서 그룹당 동물 수를 입력하여 실험군에 따라 동물을 할당합니다.
- 테스트 탭으로 전환하여 실험을 실행합니다. 테스트 시작 아이콘을 클릭하고 모든 비디오가 분석 될 때까지 기다리십시오.
- 결과 탭에서 보고서 보기 아이콘을 클릭하여 텍스트 보고서 양식에서 운동 데이터를 봅니다.
결과
본 실험은 6-OHDA를 사용한 ICV 미세주사 후 성인 제브라피쉬 수영 행동의 변화를 평가하였다. 선택의 신경 독소로서 6-OHDA를 사용하는 이유는 관심 영역에서 DpN의 특이적이고 표적화 된 절제를 생성 한 혈액 뇌 장벽을 통과 할 수 없기 때문입니다 - 복부 디뇌팔론 (Dn)16. 여기서 DpN 하위 집단은 인간의 흑질적 nigra pars compacta31에서 DpN 하위 집단과 해부학적으로 유사?...
토론
본 연구는 확립 된 6-OHDA 유도 성인 제브라 피쉬 기반 PD 모델의 운동 평가를 성공적으로 시연했습니다. 전체 실험에는 ICV 미세 주사 전 준비, 제브라 피쉬의 ICV 미세 주사 및 운동 평가의 세 가지 주요 단계가 포함되었습니다. ICV 미세 주사 절차와 좋은 실험 결과에 따라 성인 제브라 피쉬의 건강한 회복을 보장하기 위해 본 연구에서 각 단계에 대한 몇 가지 좋은 관행이 권장되었습니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 작업은 말레이시아 고등 교육부가 기본 연구 보조금 제도 [600-IRMI / FRGS 5/3 (033/2019)]에 따라 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 6-Hydroxydopamine (6-OHDA) | Sigma-Aldrich, Missouri, USA | 162957 | |
| Ascorbic acid | Thermo Fisher Scientific, California, USA | FKC#A/8882/53 | |
| Disposable pasteur pipette, 3 mL | Thermo Fisher Scientific, California, USA | FB55348 | |
| Microcentrifuge tube, 0.2 mL | Eppendorf, Hamburg, Germany | 30124332 | |
| Nice conical flask, 100 mL | Evergreen Engineering & Resources, Semenyih, Malaysia | SumYau0200 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Missouri, USA | P4417 | |
| Sodium bicarbonate | Sigma-Aldrich, Missouri, USA | S5761 | |
| Sodium chloride | Merck, Darmstadt, Germany | 106404 | |
| Stereomicroscope | Nikon, Tokyo, Japan | SMZ745 | |
| Tricaine methanesulfonate (MS-222) | Sigma-Aldrich, Missouri, USA | E10521 | |
| Equipment | |||
| ANY-maze software | Stoelting Co., Illinois, USA | - | version 7.0; video tracking software |
| Cubis II Micro Lab Balance | Sartorius, Göttingen, Germany | SE 2 | |
| FemtoJet IV microinjector | Eppendorf, Hamburg, Germany | 5192000035 | |
| Femtotip II, sterile injection capillary | Eppendorf, Hamburg, Germany | 5242957000 | |
| InjectMan 4 micromanipulator | Eppendorf, Hamburg, Germany | 5192000027 | |
| LED Portable Lamp | MR. DIY, Selangor, Malaysia | 9023251 | 20 mAh |
| PELCO Pro Superalloy, offset, fine tips | Ted Pella, California, USA | 5367-12NM | |
| Shanda aquarium heater | Yek Fong Aquarium, Selangor, Malaysia | SDH-228 | |
| Thermometer | Sera Precision, Heinsberg, Germany | 52525 | |
| Video camera | Nikon, Tokyo, Japan | D3100 |
참고문헌
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 939-953 (2018).
- Maserejian, N., Vinikoor-Imler, L., Dilley, L. Estimation of the 2020 global population of Parkinson's Disease (PD). Movement Disorder Council. 35 (1), 198 (2020).
- Hirsch, L., Jette, N., Frolkis, A., Steeves, T., Pringsheim, T. The Incidence of Parkinson's Disease: A Systematic Review and Meta-Analysis. Neuroepidemiology. 46 (4), 292-300 (2016).
- Przedborski, S. The two-century journey of Parkinson disease research. Nature Review Neuroscience. 18 (4), 251-259 (2017).
- Cookson, M. R. . Disease-Modifying Targets in Neurodegenerative Disorders. , 157-174 (2017).
- Jamebozorgi, K., et al. Cellular and molecular aspects of Parkinson treatment: Future therapeutic perspectives. Molecular Neurobiology. 56 (7), 1-13 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Review Neuroscience. 21 (1), 1-13 (2020).
- Foltynie, T. Can Parkinson's disease be cured by stimulating neurogenesis. Journal of Clinical Investigation. 125 (3), 978-980 (2015).
- Winner, B., Winkler, J. Adult neurogenesis in neurodegenerative diseases. Cold Spring Harbour Perspect Biology. 7 (4), 021287 (2015).
- Huang, C., et al. Nerve guidance conduits from aligned nanofibers: improvement of nerve regeneration through longitudinal nanogrooves on a fiber surface. ACS Applied Materials & Interfaces. 7 (13), 7189-7196 (2015).
- Alunni, A., Bally-Cuif, L. A comparative view of regenerative neurogenesis in vertebrates. Development. 143 (5), 741-753 (2016).
- Dietz, V., Schwab, M. E. From the rodent spinal cord injury model to human application: promises and challenges. Journal of Neurotrauma. 34 (9), 1826-1830 (2017).
- La Rosa, C., Bonfanti, L. Brain plasticity in mammals: An example for the role of comparative medicine in the neurosciences. Frontiers in Veterinary Science. 5 (274), 1-8 (2018).
- Ferretti, P., Prasongchean, W. . Neural Stem Cells in Development, Adulthood and Disease. , 1-21 (2015).
- Vijayanathan, Y., et al. Adult endogenous dopaminergic neuroregeneration against Parkinson's Disease: Ideal animal models. Neurotoxicity Research. 39 (2), 504-532 (2021).
- Vaz, R. L., Outeiro, T. F., Ferreira, J. J. Zebrafish as an animal model for drug discovery in Parkinson's disease and other movement disorders: a systematic review. Frontier Neuroscience. 9, 347 (2018).
- Nie, S., et al. Small molecule TrkB agonist deoxygedunin protects nigrostriatal dopaminergic neurons from 6-OHDA and MPTP induced neurotoxicity in rodents. Neuropharmacology. 99, 448-458 (2015).
- Schober, A. Classic toxin-induced animal models of Parkinson's disease: 6-OHDA and MPTP. Cell Tissue Research. 318 (1), 215-224 (2004).
- Betarbet, R., Sherer, T. B., Greenamyre, J. T. Animal models of Parkinson's disease. Bioessays. 24 (4), 308-318 (2002).
- Anichtchik, O. V., Kaslin, J., Peitsaro, N., Scheinin, M., Panula, P. Neurochemical and behavioural changes in zebrafish Danio rerio after systemic administration of 6-hydroxydopamine and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Journal of Neurochemistry. 88 (2), 443-453 (2004).
- Fiametti, L. O., Correa, C. N., Castro, L. M. d. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Vijayanathan, Y., et al. 6-OHDA-lesioned adult zebrafish as a useful Parkinson's disease model for dopaminergic neuroregeneration. Neurotoxicity Research. 32 (3), 496-508 (2017).
- Caldwell, L. J., et al. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations. Journal of Neuroscience. 39 (24), 4694-4713 (2019).
- Zupanc, G. K., Hinsch, K., Gage, F. H. Proliferation, migration, neuronal differentiation, and long-term survival of new cells in the adult zebrafish brain. Journal of Comparative Neurology. 488 (3), 290-319 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture Research. 269 (1-4), 1-20 (2007).
- Reed, B., Jennings, M. Guidance on the Housing and Care of Zebrafish Danio rerio. Royal Society for the Prevention of Cruelty to Animals (RSPCA). , 7-53 (2011).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments: JoVE. (69), e4196 (2012).
- Altenhofen, S., et al. Tebuconazole alters morphological, behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio). Chemosphere. 180, 483-490 (2017).
- Bridi, D., Altenhofen, S., Gonzalez, J. B., Reolon, G. K., Bonan, C. D. Glyphosate and Roundup alter morphology and behavior in zebrafish. Toxicology. 392, 32-39 (2017).
- Wright, D., Krause, J. Repeated measures of shoaling tendency in zebrafish (Danio rerio) and other small teleost fishes. Nature Protocols. 1 (4), 1828-1831 (2006).
- Pienaar, I. S., Götz, J., Feany, M. B. Parkinson's disease: insights from non-traditional model organisms. Progress in Neurobiology. 92 (4), 558-571 (2010).
- Becker, T., Becker, C. G. Axonal regeneration in zebrafish. Current Opinion in Neurobiology. 27, 186-191 (2014).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Katz, E. M., et al. The stability and efficacy of tricaine methanesulfonate (MS222) solution after long-term storage. Journal of the American Association for Laboratory Animal Science. 59 (4), 393-400 (2020).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments: JoVE. (60), e3234 (2012).
- Neiffer, D. L., Stamper, M. A. Fish sedation, analgesia, anesthesia, and euthanasia: considerations, methods, and types of drugs. Institute for Laboratory Animal Research. 50 (4), 343-360 (2009).
- Barbosa Júnior, A., et al. . Zebrafish Protocols for Neurobehavioral Research. 66, 323-330 (2012).
- Cocchiaro, J. L., Rawls, J. F. Microgavage of zebrafish larvae. Journal of Visualized Experiments: JoVE. (72), e4434 (2013).
- Stewart, A., et al. Modeling anxiety using adult zebrafish: a conceptual review. Neuropharmacology. 62 (1), 135-143 (2012).
- Sykes, D. J., Suriyampola, P. S., Martins, E. P. Recent experience impacts social behavior in a novel context by adult zebrafish (Danio rerio). PLOS ONE. 13 (10), 0204994 (2018).
- Collymore, C., Tolwani, R. J., Rasmussen, S. The behavioral effects of single housing and environmental enrichment on adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 54 (3), 280-285 (2015).
- Grossman, L., et al. Characterization of behavioral and endocrine effects of LSD on zebrafish. Behavioural Brain Research. 214 (2), 277-284 (2010).
- Stewart, A., et al. Homebase behavior of zebrafish in novelty-based paradigms. Behavioural Processes. 85 (2), 198-203 (2010).
- Abozaid, A., Tsang, B., Gerlai, R. The effects of small but abrupt change in temperature on the behavior of larval zebrafish. Physiology and Behavior. 227, 113169 (2020).
- Sekhar, M., Singh, R., Bhat, A., Jain, M. Feeding in murky waters: acclimatization and landmarks improve foraging efficiency of zebrafish (Danio rerio) in turbid waters. Biology Letters. 15 (7), 1-5 (2019).
- Valcarce, D. G., Martínez-Vázquez, J. M., Riesco, M. F., Robles, V. Probiotics reduce anxiety-related behavior in zebrafish. Heliyon. 6 (5), 03973 (2020).
- Tunbak, H., Vazquez-Prada, M., Ryan, T. M., Kampff, A. R., Dreosti, E. Whole-brain mapping of socially isolated zebrafish reveals that lonely fish are not loners. eLife. 9, 55863 (2020).
- Shams, S., Seguin, D., Facciol, A., Chatterjee, D., Gerlai, R. Effect of social isolation on anxiety-related behaviors, cortisol, and monoamines in adult zebrafish. Behavioral Neuroscience. 131 (6), 492-504 (2017).
- Burghardt, G. M., et al. Perspectives - Minimizing observer bias in behavioral studies: A review and recommendations. Ethology. 118 (6), 511-517 (2012).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Franco-Restrepo, J. E., Forero, D. A., Vargas, R. A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish. Zebrafish. 16 (3), 223-232 (2019).
- Beal, M. F. Parkinson's disease: a model dilemma. Nature. 466 (7310), 8-10 (2010).
- Jha, U., Thirumalai, V. Neuromodulatory selection of motor neuron recruitment patterns in a visuomotor behavior increases speed. Current Biology. 30 (5), 788-801 (2020).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Developmental Cell. 25 (5), 478-491 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유