A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصور المتزامن لديناميكيات الأنابيب الدقيقة المتقاطعة والمفردة في المختبر بواسطة مجهر TIRF
In This Article
Summary
هنا ، يتم تقديم فحص إعادة تشكيل مجهري TIRF قائم على المختبر لتحديد ومقارنة ديناميكيات مجموعتين من الأنابيب الدقيقة في وقت واحد. يتم وصف طريقة لعرض النشاط الجماعي للبروتينات المتعددة المرتبطة بالأنابيب الدقيقة في وقت واحد على حزم الأنابيب الدقيقة المتقاطعة والأنابيب الدقيقة المفردة.
Abstract
الأنابيب الدقيقة هي بوليمرات من αβ-tubulin heterodimers التي تنظم في هياكل متميزة في الخلايا. غالبا ما تحتوي المعماريات والشبكات القائمة على الأنابيب الدقيقة على مجموعات فرعية من صفائف الأنابيب الدقيقة التي تختلف في خصائصها الديناميكية. على سبيل المثال ، في تقسيم الخلايا ، تتعايش حزم مستقرة من الأنابيب الدقيقة المتقاطعة على مقربة من الأنابيب الدقيقة الديناميكية غير المترابطة. تمكن دراسات إعادة التشكيل في المختبر القائمة على TIRF المجهري من التصور المتزامن لديناميكيات هذه المصفوفات المختلفة من الأنابيب الدقيقة. في هذا الفحص ، يتم تجميع غرفة التصوير باستخدام الأنابيب الدقيقة المجمدة على السطح ، والتي إما موجودة كخيوط مفردة أو منظمة في حزم متقاطعة. يسمح إدخال التوبولين والنيوكليوتيدات ومنظمات البروتين بالتصور المباشر للبروتينات المرتبطة والخصائص الديناميكية للأنابيب الدقيقة المفردة والمتشابكة. علاوة على ذلك ، يمكن مراقبة التغييرات التي تحدث عندما يتم تنظيم الأنابيب الدقيقة المفردة الديناميكية في حزم في الوقت الفعلي. تسمح الطريقة الموصوفة هنا بإجراء تقييم منهجي لنشاط البروتينات الفردية وتوطينها ، بالإضافة إلى التأثيرات التآزرية لمنظمات البروتين على مجموعتين فرعيتين مختلفتين من الأنابيب الدقيقة في ظل ظروف تجريبية متطابقة ، وبالتالي توفير رؤى ميكانيكية لا يمكن الوصول إليها بطرق أخرى.
Introduction
الأنابيب الدقيقة هي بوليمرات حيوية تشكل سقالات هيكلية ضرورية لعمليات خلوية متعددة ، تتراوح من النقل داخل الخلايا وتحديد مواقع العضيات إلى انقسام الخلايا واستطالتها. لتنفيذ هذه الوظائف المتنوعة ، يتم تنظيم الأنابيب الدقيقة الفردية في صفائف بحجم ميكرون ، مثل المغزل الانقسامي ، والمحاور الهدبية ، والحزم العصبية ، والمصفوفات بين الأطوار ، والمصفوفات القشرية النباتية. ومن الزخارف المعمارية المنتشرة في كل مكان الموجودة في هذه الهياكل مجموعة من الأنابيب الدقيقة المتشابكة على طول أطوالها1. ومن السمات المثيرة للاهتمام للعديد من الهياكل القائمة على الأنابيب الدقيقة التعايش بين الأنابيب الدقيقة المجمعة والأنابيب الدقيقة المفردة غير المتقاطعة في مكان قريب. يمكن لهذه المجموعات الفرعية من الأنابيب الدقيقة أن تعرض ديناميكيات بلمرة مختلفة بشكل صارخ عن بعضها البعض ، حسب الحاجة لوظيفتها المناسبة2،3،4،5. على سبيل المثال، داخل المغزل الانقسامي، توجد حزم متقاطعة مستقرة وأنابيب دقيقة مفردة ديناميكية داخل منطقة على نطاق ميكرون في مركز الخلية6. وبالتالي ، فإن دراسة كيفية تحديد الخصائص الديناميكية لمجموعات الأنابيب الدقيقة المتعايشة أمر أساسي لفهم تجميع ووظيفة الهياكل القائمة على الأنابيب الدقيقة.
الأنابيب الدقيقة هي بوليمرات ديناميكية تدور بين مراحل البلمرة وإزالة البلمرة ، وتنتقل بين المرحلتين في الأحداث المعروفة باسم الكارثة والإنقاذ7. يتم تنظيم ديناميكيات الأنابيب الدقيقة الخلوية من خلال عدد لا يحصى من البروتينات المرتبطة بالأنابيب الدقيقة (MAPs) التي تعدل معدلات بلمرة الأنابيب الدقيقة وإزالة البلمرة وترددات أحداث الكوارث والإنقاذ. ومن الصعب التحقيق في نشاط MAPs على المصفوفات القريبة مكانيا في الخلايا، بسبب محدودية الاستبانة المكانية في الفحص المجهري الضوئي، وخاصة في المناطق ذات الكثافة العالية للأنابيب الدقيقة. علاوة على ذلك ، فإن وجود MAPs متعددة في نفس المنطقة الخلوية يعيق تفسيرات الدراسات البيولوجية الخلوية. تعمل فحوصات إعادة التشكيل في المختبر ، التي يتم إجراؤها بالاقتران مع الفحص المجهري الكلي للانعكاس الداخلي (TIRF) ، على التحايل على تحديات فحص الآليات التي تنظم من خلالها مجموعات فرعية محددة من MAPs ديناميكيات صفائف الأنابيب الدقيقة الخلوية القريبة. هنا ، يتم فحص ديناميكيات الأنابيب الدقيقة التي يتم تجميعها في المختبر في وجود واحد أو أكثر من MAPs المؤتلفة في ظل ظروف خاضعة للرقابة8،9،10. ومع ذلك ، يتم إجراء اختبارات إعادة التشكيل التقليدية عادة على الأنابيب الدقيقة المفردة أو على نوع واحد من الصفيفات ، مما يحول دون تصور السكان المتعايشين.
هنا ، نقدم في المختبر اختبارات إعادة التشكيل التي تمكن من التصور المتزامن لمجموعتين من الأنابيب الدقيقة تحت نفس ظروف الحل 11. نحن نصف طريقة لعرض النشاط الجماعي ل MAPs متعددة في وقت واحد على الأنابيب الدقيقة المفردة وعلى حزم الأنابيب الدقيقة المترابطة بواسطة البروتين المرتبط بالمغزل الانقسامي PRC1. يرتبط البروتين PRC1 بشكل تفضيلي عند التداخل بين الأنابيب الدقيقة المضادة للتوازي ، ويربطها معا9. باختصار ، يتكون هذا البروتوكول من الخطوات التالية: (i) إعداد محاليل المخزون والكواشف ، (ii) تنظيف ومعالجة السطح للأغطية المستخدمة لإنشاء غرفة التصوير لتجارب الفحص المجهري ، (iii) إعداد "بذور" microtubule مستقرة والتي تبدأ منها البلمرة أثناء التجربة ، (iv) مواصفات إعدادات المجهر TIRF لتصور ديناميكيات microtubule ، (v) تجميد بذور microtubule وتوليد حزم microtubule المتشابكة في غرفة التصوير ، و (vi) تصور ديناميكيات الأنابيب الدقيقة في غرفة التصوير من خلال المجهر TIRF ، عند إضافة توبولين قابل للذوبان ، MAPs ، والنيوكليوتيدات. تمكن هذه الفحوصات من التقييم النوعي والفحص الكمي لتوطين MAP وتأثيرها على ديناميكيات مجموعتين من الأنابيب الدقيقة. بالإضافة إلى ذلك ، فإنها تسهل تقييم الآثار التآزرية ل MAPs المتعددة على مجموعات الأنابيب الدقيقة هذه ، عبر مجموعة واسعة من الظروف التجريبية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد الكواشف
- إعداد المخازن المؤقتة والكواشف على النحو المبين في الجدول 1 والجدول 2. أثناء التجربة ، احتفظ بجميع الحلول على الجليد ، ما لم يذكر خلاف ذلك.
| حل | مكونات | مدة التخزين الموصى بها | تلاحظ | ||
| 5X BRB80 | 400 مللي متر K-الأنابيب، 5 ملليمتر MgCl2، 5 ملليمتر EGTA، الرقم الهيدروجيني 6.8 مع KOH، تصفية التعقيم | ما يصل إلى 2 سنوات | يخزن على درجة حرارة 4 درجات مئوية | ||
| 1X BRB80 | 80 مللي متر K-الأنابيب، 1 ملليمتر MgCl2، 1 ملليمتر EGTA، الرقم الهيدروجيني 6.8 | ما يصل إلى 2 سنوات | يخزن على درجة حرارة 4 درجات مئوية | ||
| BRB80-DTT | 1X BRB80، 1 ملليمتر DTT | ما يصل إلى 2 أيام | |||
| فحص المخزن المؤقت | 80 مللي متر K-الأنابيب، 3 ملم MgCl2، 1 ملليمتر EGTA، الرقم الهيدروجيني 6.8، 5٪ السكروز (أو 1X BRB80، 5٪ السكروز، 2 ملليمتر MgCl2) | ما يصل إلى 1 سنة | يخزن على درجة حرارة 4 درجات مئوية | ||
| المخزن المؤقت الرئيسي (MB) | فحص المخزن المؤقت، 5mM TCEP | 1 أسبوع | التحضير في يوم التجربة ؛ افصل إلى أنبوبين: MB-warm في درجة حرارة الغرفة و MB-cold على الجليد ؛ تضمين 1 mM DTT إذا كنت تستخدم أصباغ الفلورسنت | ||
| المخزن المؤقت الرئيسي مع ميثيل السليلوز (MBMC) | 1X BRB80 ، 0.8٪ ميثيل سليلوز ، 5 mM TCEP ، 5 mM MgCl2 | 1 أسبوع | التحضير في يوم التجربة ؛ تضمين 1 mM DTT إذا كنت تستخدم أصباغ الفلورسنت | ||
| المخزن المؤقت لتخفيف البروتين (DB) | MB, 1 ملغم/مل ألبومين مصل البقر (BSA), 1 ميكرومتر ATP | 1 يوم، على الجليد | التحضير في يوم التجربة ؛ تضمين 1 mM DTT إذا كنت تستخدم أصباغ الفلورسنت | ||
| مزيج كسح الأكسجين (OSM) | MB, 389 ميكروغرام/مل كاتالاز، 4.44 ملغم/مل أوكسيديز الجلوكوز، 15.9 مللي متر 2-ميركابتوإيثانول (BME) | 1 يوم، على الجليد | التحضير في يوم التجربة | ||
| نهائي كسح الأكسجين (OSF) | MB، 350 ميكروغرام/مل كاتالاز، 4 ملغم/مل أوكسيديز الجلوكوز، 14.3 مللي مل BME، 15 ملغم/مل جلوكوز | يستخدم في غضون 30 دقيقة | تحضير مباشرة قبل الاستخدام عن طريق إضافة 1 ميكرولتر من الجلوكوز إلى 9 ميكرولتر من OSM | ||
الجدول 1: قائمة المخازن المؤقتة المستخدمة في هذا البروتوكول ومكوناتها. راجع عمود "مدة التخزين الموصى بها" للحصول على إرشادات حول مدى إمكانية إعداد كل مخزن مؤقت مسبقا.
| الكاشف | تركيز التخزين | مذيب التخزين | درجة حرارة التخزين | تركيز العمل | التركيز النهائي | مدة التخزين الموصى بها | تلاحظ | |||||||||
| نيوترافيدين (NA) | 5 ملغم/مل | 1X BRB80 | -80 درجة مئوية | 0.2 ملغم/مل | 0.2 ملغم/مل | ما يصل إلى 1 سنة | تستخدم لشل حركة الأنابيب الدقيقة عن طريق ربط البيوتين-نيوترافيدين-البيوتين؛ تخزين في أليكوتس صغيرة | |||||||||
| كابا كازين (KC) | 5 ملغم/مل | 1X BRB80 | -80 درجة مئوية | 0.5 ملغم/مل | 0.5 ملغم/مل | ما يصل إلى 2 سنوات | تستخدم لمنع سطح غرفة التصوير. تخزينها في أليكوتس صغيرة. في يوم التجربة، ضع حجرا صغيرا جانبا في درجة حرارة الغرفة | |||||||||
| ألبومين مصل البقر (BSA) | 50 ملغم/مل | 1X BRB80 | -20 درجة مئوية | 1 ملغم/مل (بالديسيبل) | غير متوفر | ما يصل إلى 2 سنوات | تخزين في أليكوتس صغيرة | |||||||||
| كاتالاز | 3.5 ملغم/مل | 1X BRB80 | -80 درجة مئوية | 350 ميكروغرام/مل (في OSF) | 35 ميكروغرام/مل | ما يصل إلى 2 سنوات | مكون من مزيج كسح الأكسجين. تخزين في أليكوتس صغيرة | |||||||||
| أوكسيديز الجلوكوز | 40 ملغم/مل | 1X BRB80 | -80 درجة مئوية | 4 ملغم/مل (في OSF) | 0.4 ملغم/مل | ما يصل إلى 2 سنوات | مكون من مزيج كسح الأكسجين. تخزين في أليكوتس صغيرة | |||||||||
| توبولين | مجفف بالتجميد | غير متوفر | 4 درجات مئوية | 10 ملغم/مل | 2.12 ملغم/مل (في مزيج توبولين) | ما يصل إلى 1 سنة | بمجرد أن يصبح التوبولين في المحلول ، اجعله باردا لتجنب البلمرة. | |||||||||
| أدينوسين ثلاثي الفوسفات (ATP) | 100 مللي متر | مياه فائقة النقاء | -20 درجة مئوية | 10 مللي متر | 1 مللي متر | 6 أشهر | تحضير محلول في الماء المعقم بالترشيح ، وضبط درجة الحموضة إلى ~ 7.0 ، وتجميد في aliquots الصغيرة. | |||||||||
| جوانوزين ثلاثي الفوسفات (GTP) | 100 مللي متر | مياه فائقة النقاء | -20 درجة مئوية | 10 مللي متر | 1.29 مللي متر (في مزيج توبولين) | 6 أشهر | تحضير محلول في الماء المعقم بالترشيح ، وضبط درجة الحموضة إلى ~ 7.0 ، وتجميد في aliquots الصغيرة. | |||||||||
| غوانوزين-5'-[(α,β)-ميثيلينو] ثلاثي الفوسفات (GMPCPP) | 10 مللي متر | مياه فائقة النقاء | -20 درجة مئوية | 10 ميكرومتر | 0.5 ميكرومتر | 6 أشهر | ||||||||||
| ديثيوثريتول (DTT) | 1 م | مياه معقمة | -20 درجة مئوية | 1 مللي متر | غير متوفر | ما يصل إلى 2 سنوات | ||||||||||
| تريس (2-كربوكسي إيثيل) فوسفين (TCEP) | 0.5 م | المياه المعقمة بالفلتر | درجة حرارة الغرفة | 5 مللي متر | غير متوفر | ما يصل إلى 2 سنوات | ||||||||||
| ميثيل سليلوز | 1% | مياه معقمة | درجة حرارة الغرفة | 0.8٪ (بالميجابايت إم إم سي) | 0.21٪ (في مزيج توبولين) | ما يصل إلى 1 سنة | يذوب ميثيل سليلوز عن طريق إضافته ببطء إلى الماء شبه المغلي. اتركيه ليبرد مع التحريك المستمر. | |||||||||
| بيتا ميركابتوإيثانول (BME) | 143 مللي متر | مياه معقمة | درجة حرارة الغرفة | 14.3 ملليمتر (في OSF) | 1.43 ملليمتر | حتى 5 سنوات | 143 mM هو تخفيف 1:100 من BME الأسهم | |||||||||
| الجلوكوز | 150 ملغم/مل | 1X BRB80 | -80 درجة مئوية | 15 ملغم/مل (في OSF) | 1.5 ملغم/مل | ما يصل إلى 2 سنوات | أضف إلى OSM مباشرة قبل الاستخدام | |||||||||
| (±)-6-هيدروكسي-2،5،7،8-رباعي ميثيل كرومان-2-حمض الكربوكسيل (ترولوكس) | 10 مللي متر | 1X BRB80 | -80 درجة مئوية | 10 مللي متر | 1 مللي متر | ما يصل إلى 1 سنة | لا يذوب تماما. أضف بعض NaOH ، وحرك لمدة 4 ساعات تقريبا ، وقم بتصفية التعقيم قبل الاستخدام | |||||||||
| mPEG-Succinimidyl فاليرات، MW 5,000 | ذرور | غير متوفر | -20 درجة مئوية | 333 ملغم/مل (في 0.1 مليون بيكربونات الصوديوم) | 324 ملغم/مل (في 0.1 مليون بيكربونات الصوديوم) | 6 أشهر | إعداد ~ 34 ملغ aliquots ، ووضع علامة على كل أنبوب مع الوزن الدقيق للمسحوق. مرر غاز النيتروجين فوق الأنابيب الصلبة المغلقة باستخدام البارافيلم ، وخزنه عند -20 درجة مئوية في حاوية مع مجفف. | |||||||||
| البيوتين-PEG-SVA, MW 5,000 | ذرور | غير متوفر | -20 درجة مئوية | 111 ملغم/مل (في 0.1 مليون بيكربونات الصوديوم) | 3.24 ملغم/مل (في 0.1 مليون بيكربونات الصوديوم) | 6 أشهر | إعداد ~ 3 ملغ aliquots ، ووضع علامة على كل أنبوب مع الوزن الدقيق للمسحوق. مرر غاز النيتروجين فوق الأنابيب الصلبة المغلقة باستخدام البارافيلم ، وخزنه عند -20 درجة مئوية في حاوية مع مجفف. | |||||||||
الجدول 2: قائمة الكواشف المستخدمة في هذا البروتوكول. وتشمل ظروف التخزين والتركيزات الموصى بها، وتركيزات العمل من المحاليل المخزون المستخدمة أثناء التجربة، والتركيز النهائي في غرفة التصوير. وترد ملاحظات إضافية في العمود اليميني المتطرف.
2. إعداد شرائح البيوتين-PEG
ملاحظة: قم بإعداد غرف التصوير في أقرب وقت ممكن من بداية التجربة ، وليس أكثر من 2 أسابيع مقدما.
- أغطية نظيفة
- ضع عددا مساويا من 24 × 60 مم و 18 × 18 مم # 1.5 غطاء (الشكل 1F) في أوعية تلطيخ الشرائح ورفوف غسل الشرائح ، على التوالي (الشكل 1A ، B). ضع رفوف الغسيل المنزلق التي تحتوي على أغطية مقاس 18 × 18 مم في كوب سعة 100 مل.
- شطف جميع أغطية 5-6 مرات في ماء فائق النقاء (مقاومة 18.2 MΩ-cm) وإزالة السائل الزائد بعد كل شطف بطرف ماصة متصل بأنبوب فراغ (الشكل 1C).
- املأ الأكواب والجرار الملطخة بالشرائح التي تحتوي على الأغطية بالماء فائق النقاء ، وختم بالبارافيلم ، وسونيكات لمدة 10 دقائق.
- املأ دورقين سعة 150 مل بالإيثانول المقاوم ل 200 متر. باستخدام ملاقط ، اغمس كل غطاء في كوب واحد مملوء بالإيثانول ، ثم الآخر.
- باستخدام الملقط ، انقل الأغطية إلى رف تجفيف الشرائح (الشكل 1D) ، وجففها تحت تيار غاز النيتروجين واحتضنها عند 37 درجة مئوية حتى تجف تماما (~ 15 دقيقة).
- ضع الأغطية المجففة في طبقة واحدة داخل منظف البلازما. قم بتشكيل ختم فراغ ، ثم اضبط مستوى التردد اللاسلكي (RF) لمنظف البلازما على ~ 8 ميجاهرتز.
- بمجرد إنشاء البلازما ، اترك أغطية في منظف البلازما لمدة 5 دقائق. أطفئ منظف البلازما وحرر المكنسة الكهربائية ببطء.
- بمجرد تحرير ختم التفريغ ، اقلب الغطاء وكرر تنظيف البلازما لمدة 5 دقائق للجانب الآخر من الأغطية .
- بديل لتنظيف البلازما: بدلا من الخطوات 2.1.2-2.1.3 ، تنزلق أغطية السونيكات في محلول دافئ من منظف 2٪ (في ماء فائق النقاء) لمدة 10 دقائق. بعد ذلك ، اغسل الأغطية جيدا بالماء فائق النقاء وصوتنة في ماء فائق النقاء 2-3 مرات (10 دقائق لكل منهما). بعد ذلك ، اغسل الإيثانول وجففه كما في الخطوات 2.1.4-2.1.5. تخطي الخطوات 2.1.6-2.1.8.
- علاج البيوتين-PEG
- مباشرة قبل الاستخدام ، قم بإذابة 400 ميكرولتر من 3-Aminopropyltriethoxysilane في 40 مل من الأسيتون. باستخدام الملقط، حرك الأغطية النظيفة بالبلازما إلى رف غسل الشرائح والجرار الملطخة بالشرائح. يغمر الغطاء في محلول 3-Aminopropyltriethoxysilane ويحضن لمدة 5 دقائق 12,13.
- اغسل جميع الأغطية 5-6 مرات بالماء فائق النقاء.
- انقل الأغطية إلى رف تجفيف الشرائح ، وجففها تحت تيار غاز النيتروجين واحتضنها عند 37 درجة مئوية حتى تجف تماما (~ 20 دقيقة).
- ضع الأغطية المجففة على مناديل المهام الحساسة وقم بتسمية كل غطاء على زاوية واحدة، على سبيل المثال، "p" على كل شريحة غطاء مقاس 18 × 18 مم و"b" على كل شريحة غطاء مقاس 24 × 60 مم (انظر الشكل 2).
- في يوم التجربة ، قم بإعداد محلول بيكربونات الصوديوم الطازج 0.1 M عن طريق إذابة 0.84 ملغ من NaHCO3 في 10 مل من الماء فائق النقاء.
- أحضر أليكوتات من mPEG-Succinimidyl Valerate (PEG-SVA) و Biotin-PEG-SVA إلى درجة حرارة الغرفة ، مباشرة قبل الاستخدام. انظر الملاحظات المتعلقة بإعداد أليكوت البولي إيثيلين غليكول (PEG) في الجدول 2.
ملاحظة: اعمل بسرعة لأن عمر النصف للتحلل المائي ل Succinimidyl Valerate (SVA) moiety هو ~ 30 دقيقة. - أضف 102 ميكرولتر من 0.1 M NaHCO3 إلى 34 ملغ من PEG-SVA ، وقم بالدوران في جهاز طرد مركزي دقيق على الطاولة عند 2,656 × g لمدة 20 ثانية ، ثم اخلطه عن طريق السحب لأعلى ولأسفل. قم بإذابة 3 ملغ من البيوتين-PEG-SVA في 27 ميكرولتر من 0.1 M NaHCO3 عن طريق السحب لأعلى ولأسفل. اضبط أحجام التخفيف وفقا للوزن الدقيق ل PEG الملاحظ على الأنابيب (انظر الجدول 2).
- تحضير 100: 1 ث / ث PEG: خليط البيوتين-PEG عن طريق الجمع بين 75 ميكرولتر من محلول PEG-SVA و 2.25 ميكرولتر من محلول Biotin-PEG-SVA ل 20 غطاء ، 100 ميكرولتر و 3 ميكرولتر ل 30 غطاء ، أو 125 ميكرولتر و 3.75 ميكرولتر ل 40 غطاء.
- قم ببناء غرفة ترطيب عن طريق وضع مناشف ورقية مبللة أسفل رف الطرف في الجزء السفلي من صندوق طرف فارغ سعة 10 ميكرولتر (الشكل 1E). هذا سيمنع تبخر حلول PEG.
- ماصة 6 ميكرولتر من 100: 1 PEG-SVA: خليط البيوتين-PEG في وسط غطاء واحد 24 × 60 مم على الجانب الملصق. ضع غطاء آخر مقاس 24 × 60 مم فوق الغطاء الأول بحيث يشكل الزوج شكل X ، مع مواجهة الجانبين "b" لبعضهما البعض. ضعي الزوج على رف فارغ في غرفة الترطيب وكرريه للأغطية المتبقية مقاس 24 × 60 مم.
- ماصة 6 ميكرولتر من PEG-SVA في وسط غطاء واحد 18 × 18 مم على الجانب الملصق. ضع غطاء آخر مقاس 18 × 18 مم فوق الغطاء الأول ، مع وضع الجوانب المعلمة "p" في مواجهة بعضها البعض. ضعي الزوج على رف فارغ في غرفة الترطيب وكرريه مع الأغطية المتبقية مقاس 18 × 18 مم.
- أغلق غرفة الترطيب واحتضنها لمدة 3 ساعات أو طوال الليل.
- افصل أزواج الأغطية وشطفها بالماء فائق النقاء.
- يجفف الغطاء مع تيار النيتروجين ويوضع في حاضنة 37 درجة مئوية لتجف تماما.
- لبناء غرفة التصوير، قم بلصق ثلاثة شرائط من الشريط على الوجهين على غطاء مقاس 24 × 60 مم على الجانب المسمى "b". على الجانب الآخر من شرائط الشرائط، قم بتركيب غطاء 18 × 18 مم مع جانبه المسمى "p" في مواجهة الغطاء الأكبر. وهذا يشكل غرفتي تدفق لتجارب الفحص المجهري، حيث تواجه الأسطح المعالجة بعضها البعض (الشكل 2 والشكل 1G).

الشكل 1: معدات لمعالجة الانزلاق وإعداد غرفة التصوير . (أ) الجرار الملطخة بالشرائح ل 24 × 60 مم ، (ب) رفوف غسل الشرائح لقسائم الأغطية 18 × 18 مم ، (C) إعداد الفراغ ، (D) رف تجفيف الشرائح ، (E) غرفة الترطيب ، (F) أغطية الغطاء ، (G) غرفة التصوير ، (H) حامل الشرائح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
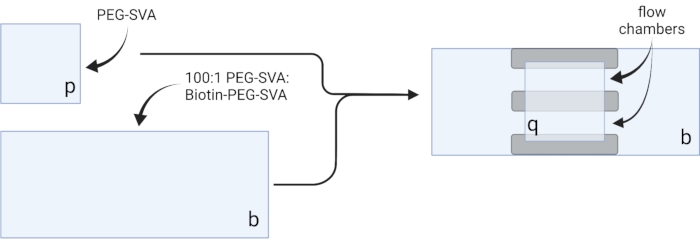
الشكل 2: مخطط لإعداد غرف التصوير باستخدام شريط على الوجهين (رمادي) وأغطية معالجة PEG/Biotin-PEG. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. بلمرة الأنابيب الدقيقة
- تحضير بذور GMPCPP
ملاحظة: قم بإعداد بذور GMPCPP في غرفة باردة ، مع الحفاظ على جميع الكواشف والنصائح والأنابيب عند 4 درجات مئوية. ضع دوار جهاز الطرد المركزي الفائق الزاوية الثابت ، الذي يحتوي على أنابيب طرد مركزي 1 مل ، في جهاز طرد مركزي فائق واضبط درجة الحرارة على 4 درجات مئوية.- أعد تعليق التوبولين المجفف بالتجميد (الجدول 2) إلى ~ 10 ملغم / مل في 1X BRB80 ، مباشرة قبل الاستخدام.
- خلط مكونات بذور GMPCPP كما هو موضح في الجدول 3.
ملاحظة: احتفظ بجميع مكونات التوبولين على الجليد قدر الإمكان لتقليل بلمرة التوبولين القابل للذوبان. - قم بتوضيح المزيج في دوار جهاز طرد مركزي فائق الزاوية ثابت عند 352,700 × g لمدة 5 دقائق عند 4 درجات مئوية.
- افصل المادة الفائقة إلى 5 ميكرولتر أليكوتس ، ثم قم بتجميدها في النيتروجين السائل ، وخزنها عند -80 درجة مئوية.
- بلمرة البذور في يوم التجربة
- دافئ 1-2 مل من BRB80-DTT (الجدول 1) إلى 37 درجة مئوية.
- ضع 5 ميكرولتر من بذور GMPCPP (-80 درجة مئوية) من الخطوة 3.1.4 على الجليد وتذوب على الفور في 20 ميكرولتر من BRB80-DTT الدافئ. تدور بسرعة 2000 × جم لمدة 5 ثوان في درجة حرارة الغرفة وتنقر للخلط.
ملاحظة: قد يتراوح حجم التخفيف الأولي بين 13 ميكرولتر و 21 ميكرولتر ويتم تحديده تجريبيا لكل دفعة من البذور. إذا فشلت البذور في البلمرة ، فقم باستكشاف الأخطاء وإصلاحها عن طريق استكمال المخزن المؤقت الأولي للتخفيف (الخطوة 3.2.2) ب 0.5 ميكرومتر GMPCPP. - يحفظ بعيدا عن الضوء ويحضن عند 37 درجة مئوية لمدة 30-45 دقيقة.
ملاحظة: يعتمد طول الأنابيب الدقيقة على مدة الحضانة. بالنسبة للأنابيب الدقيقة القصيرة ، يمكن أن يكون وقت الحضانة قصيرا يصل إلى 15 دقيقة. بالنسبة للأنابيب الدقيقة الطويلة ، يمكن أن يصل وقت الحضانة إلى 2 ساعة. تميل الأنابيب الدقيقة البيوتينيل إلى أن تتطلب أوقات حضانة أطول من الأنابيب الدقيقة غير البيوتينيلية. - ضع دوار جهاز الطرد المركزي الفائق الزاوية ثابت الزاوية ، الذي يحتوي على أنابيب طرد مركزي سعة 500 ميكرولتر ، في جهاز طرد مركزي فائق السخونة مسبقا إلى 30 درجة مئوية.
- بعد الحضانة ، أضف 50 ميكرولتر من BRB80-DTT الدافئ (الخطوة 3.2.1) إلى بذور GMPCPP المبلمرة وانقل الخليط إلى أنبوب طرد مركزي سعة 500 ميكرولتر. اغسل الأنبوب الفارغ الذي يحتوي على بذور GMPCPP ب 50 ميكرولتر أخرى من BRB80-DTT الدافئة ، وقم بماصة لأعلى ولأسفل ، وأضف هذا المخزن المؤقت إلى أنبوب الطرد المركزي 500 ميكرولتر الذي يحتوي على الخليط.
- قبل الدوران ، ضع علامة على حافة أنبوب جهاز الطرد المركزي للإشارة إلى مكان وجود الكرية (ستكون الكرية صغيرة جدا بحيث لا يمكن رؤيتها). تدور لمدة 10 دقائق عند 244,900 × g عند 30 درجة مئوية12.
- ماصة بعناية من supernatant والتخلص منها. أعد تعليق الكريات في 100 ميكرولتر من BRB80-DTT الدافئ. انقر للمزج.
- تدور لمدة 10 دقائق عند 244,900 × g عند 30 درجة مئوية ، مع محاذاة العلامة مع الدوار للحبيبات في نفس المكان.
- قم بإزالة السوبرناتانت وأعد تعليق الكريات في 16 ميكرولتر من BRB80-DTT الدافئ. انقل محلول الأنابيب الدقيقة إلى أنبوب طرد مركزي دقيق نظيف سعة 0.6 مل. يحفظ بعيدا عن الضوء ويحفظ في درجة حرارة الغرفة أو فوقها.
ملاحظة: بعد البلمرة، احتفظ بالأنابيب الدقيقة في درجة حرارة الغرفة أو فوقها. إذا أصيبوا بالبرد ، فسوف يزيلون البلمرة. احتضان في 28 درجة مئوية لمزيد من الاستقرار.
- تحقق من الأنابيب الدقيقة عبر المجهر TIRF
- ماصة خليط من 4.5 ميكرولتر من BRB80-DTT و 1 ميكرولتر من محلول الأنابيب الدقيقة (الخطوة 3.2.9) على شريحة المجهر. قم بتغطيتها بغطاء 18 × 18 مم وأغلق الحواف إما بطلاء أظافر شفاف أو بمزيج 1: 1: 1 من الفازلين واللانولين والبارافين (مانع تسرب فالاب) ، وهو صلب في درجة حرارة الغرفة وسائل عند 95 درجة مئوية.
- ضع هدف TIRF أسفل الغطاء (انظر الخطوة 4 للاطلاع على إعدادات المجهر الموصى بها) وتصور الأنابيب الدقيقة المبلمرة حديثا بطول موجي مناسب للتوبولين المسمى بالفلورسنت في المزيج الساطع (الجدول 3) ، لتحديد التخفيف من الأنابيب الدقيقة لاستخدامها في التجارب القادمة.
| الكاشف | مزيج مشرق (ميكرولتر) | ترتيب الإضافة | مزيج مشرق + البيوتين (ميكرولتر) | ترتيب الإضافة |
| توبولين الفلورسنت، 10 ملغم/مل | 2 | 6 | 2 | 7 |
| البيوتين-توبولين، 10 ملغم/مل | 0 | غير متوفر | 2 | 6 |
| توبولين غير ملصق، 10 ملغم/مل | 20 | 5 | 18 | 5 |
| GMPCPP ، 10 mM | 30 | 4 | 30 | 4 |
| DTT، 0.2 م | 0.7 | 3 | 0.7 | 3 |
| 5X BRB80 | 26.4 | 2 | 26.4 | 2 |
| مياه معقمة | 52.9 | 1 | 52.9 | 1 |
| الحجم الكلي (ميكرولتر) | 132 | 132 |
الجدول 3: مزيج بذور GMPCPP. مكونات بذور الأنابيب الدقيقة GMPCPP ، بما في ذلك حجم وترتيب الإضافة. تحضير 5 ميكرولتر aliquots وتخزينها لمدة تصل إلى 1 سنة في -80 درجة مئوية.
4. إعدادات المجهر
- درجة الحرارة: اضبط درجة حرارة المجهر على 28 درجة مئوية لعرض الأنابيب الدقيقة الديناميكية.
- المرشحات: استخدم أفضل مزيج من مكعبات المرشحات ومرشحات الانبعاثات، اعتمادا على قنوات الفلورسنت المراد تصويرها. لتصور أطوال موجية 488 نانومتر و560 نانومتر و647 نانومتر في نفس التجربة، استخدم مجموعة 405/488/560/647 نانومتر رباعية النطاق، إلى جانب مرشحات الانبعاثات للأطوال الموجية المحددة.
- محاذاة الليزر: تأكد من محاذاة أشعة الليزر المستخدمة في التجربة. حدد كثافة الليزر للتجربة تجريبيا ، بحيث يمكن تصوير جميع البروتينات الفلورية بأعلى نسبة ممكنة من الإشارة إلى الضوضاء ، ولكنها لا تخضع لتبييض ضوئي كبير على مدار فترة التجربة.
- الهدف: استخدم ورق العدسة لتنظيف هدف 100x باستخدام 70٪ من الإيثانول. قبل التصوير ، أضف قطرة من زيت غمر المجهر إلى الهدف.
- إعداد تسلسل تصوير
- لإجراء تجربة مع 647 نانومتر من الأنابيب الدقيقة البيوتينيل الموسومة بالفلوروفور، والأنابيب الدقيقة غير البيوتينيل المسماة بالفلوروفور 560 نانومتر، والتوبولين القابل للذوبان، والبروتين الذي يحمل علامة GFP، صورة لمدة 20 دقيقة. صور قنوات 560 نانومتر و 488 نانومتر كل 10 ثوان ، وقناة 647 نانومتر كل 30 ثانية.
- لالتقاط صورة مرجعية للحزم قبل إضافة التوبولين القابل للذوبان و MAPs ، قم بإعداد تسلسل مع صورة واحدة لكل منها في أطوال موجية 560 نانومتر و 647 نانومتر.
5. توليد حزم الأنابيب الدقيقة المثبتة على السطح
ملاحظة: بالنسبة للخطوات التالية، قم بتدفق جميع المحاليل إلى غرفة تدفق عن طريق السحب إلى جانب واحد مفتوح، مع وضع ورقة ترشيح على الجانب الآخر. حماية غرفة التصوير من الضوء لتقليل التبييض الضوئي للبروتينات ذات العلامات الفلورية. قم بلصق غرفة التصوير المعدة بحامل شريحة (الشكل 1G ، H). اتبع الخطوات الواردة في الجدول 4، والتي تتوافق مع بروتوكولات steps 5.2-6.4.
- تحضير مزيج توبولين قابل للذوبان وفقا للجدول 5 والاحتفاظ به على الجليد.
ملاحظة: يجب دائما وضع توبولين قابل للذوبان على الجليد لمنع البلمرة. قم بإعداد مزيج توبولين طازج قابل للذوبان كل 2 ساعة تقريبا ، أو عندما تتوقف الأنابيب الدقيقة عن البلمرة. - لشل حركة الأنابيب الدقيقة عبر وصلة البيوتين-نيوترافيدين-البيوتين، التدفق الأول في محلول نيوترافيدين (NA) حتى تمتلئ الغرفة (~ 7.5 ميكرولتر) وتحضن لمدة 5 دقائق.
- يغسل مع 10 ميكرولتر من MB-الباردة.
- تدفق في 7.5 ميكرولتر من البروتين المانع κ-الكازين (KC) وحضانت لمدة 2 دقيقة.
- يغسل مع 10 ميكرولتر من MB-warm لإعداد الغرفة لإدخال microtubules.
- قم بتخفيف مخزون الأنابيب الدقيقة البيوتينيل (وفقا للملاحظات الواردة في الخطوة 3.3.2) في 1X BRB80-DTT وأضف 1 ميكرولتر من هذا التخفيف إلى 9 ميكرولتر من MB-warm. تدفق الخليط إلى الغرفة وحضانته لمدة 10 دقائق. استخدم تركيزا أعلى من الأنابيب الدقيقة لمزيد من الحزم.
- اغسل الأنابيب الدقيقة غير المثبتة بسعة 10 ميكرولتر من MB-warm.
- تدفق 7.5 ميكرولتر من KC الدافئ إلى الغرفة واحتضان لمدة 2 دقيقة.
- أثناء الحضانة ، قم بإعداد محلول 2 نانومتر من بروتين الوصلة المتقاطعة PRC1 في KC. تدفق 10 ميكرولتر من هذا المحلول إلى غرفة التدفق واحتضانه لمدة 5 دقائق.
ملاحظة: يتم التعبير عن PRC1 المؤتلف وتنقيته من الخلايا البكتيرية كما هو موضح سابقا13. - لصنع الحزم ، قم بتدفق 10 ميكرولتر من الأنابيب الدقيقة غير البيوتينيل إلى الغرفة واحتضنها لمدة 10 دقائق.
ملاحظة: راجع الخطوة 6.1 لإعداد مزيج الفحص أثناء وقت الحضانة. - اغسل الغرفة مرتين ب 10 ميكرولتر من MB-warm. الأنابيب الدقيقة المرفقة مستقرة لمدة 20 دقيقة تقريبا من هذه النقطة.
| درج | الكاشف | الحجم (ميكرولتر) | وقت الحضانة (بالدقائق) |
| 1 | نيوترافيدين | 7.5 | 5 |
| 2 | ميجابايت-بارد | 10 | - |
| 3 | κ-الكازين | 7.5 | 2 |
| 4 | MB-دافئ | 10 | - |
| 5 | الأنابيب الدقيقة البيوتينيل (المخففة في MB-warm) | 10 | 10 |
| 6 | MB-دافئ | 10 | - |
| 7 | دافئ κ-الكازين | 7.5 | 2 |
| 8 | 2 نانومتر PRC1 مخفف في الكازين κ | 10 | 5 |
| 9 | الأنابيب الدقيقة غير البيوتينيل | 10 | 10 |
| 10 | ميجابايت دافئة × 2 | 10 | - |
| 11 | مزيج الفحص | 10 | - |
| البذور المرفقة مستقرة لمدة 20 دقيقة تقريبا في هذه المرحلة | |||
الجدول 4: خطوات الفحص. قائمة الكواشف المضافة إلى غرفة التصوير ، مع الإشارة إلى وقت الغسيل (-) أو الحضانة.
| الكاشف | الحجم (ميكرولتر) |
| توبولين معاد تدويره، 10 ملغم/مل | 10 |
| ميجابايت-بارد | 10.3 |
| إم بي إم سي | 13.7 |
| BRB80-DTT | 3.4 |
| GTP ، 10 mM | 6.7 |
| ATP، 10 مللي متر (في حالة استخدام كينيسين) | 6.7 |
| توبولين المسمى بالفلورسنت ، 10 ملغم/مل | 1 (إعادة تعليق التوبولين المجفف بالتجميد في BRB80-DTT البارد) |
الجدول 5: مكونات مزيج التوبولين القابلة للذوبان. اخلطي في بداية التجربة وحافظي على الثلج.
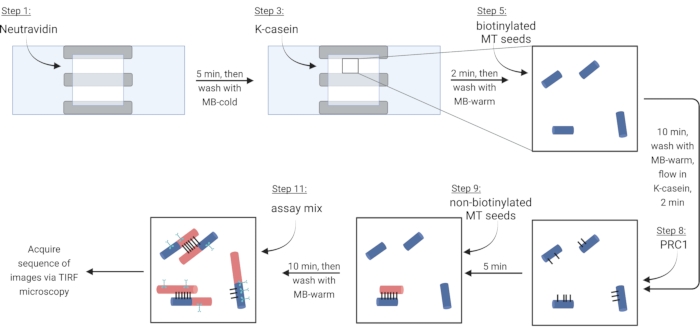
الشكل 3: مخطط لإضافة مكونات الفحص لصنع وتصوير الحزم ذات العلامات الفلورية والأنابيب الدقيقة المفردة. تظهر البذور البيوتينيل باللون الأزرق والبذور غير البيوتينيل والتوبولين القابل للذوبان باللون الأحمر و PRC1 باللون الأسود والبروتين ذي الأهمية في السماوي. وتتطابق أرقام الخطوات في الشكل مع الأرقام الواردة في الجدول 4. تعرض اللوحة المقابلة للخطوة 9 حزمة مشكلة مسبقا (أسفل اليسار) ؛ تظهر الخطوة 11 حزمة تم تشكيلها حديثا (أعلى اليسار). تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. ديناميات الأنابيب الدقيقة للصور
- خلال فترة الحضانة التي تبلغ 10 دقائق في الخطوة 5.10 ، قم بإعداد 10 ميكرولتر من مزيج الفحص الذي يحتوي على بروتينات ذات أهمية ، توبولين قابل للذوبان ، نيوكليوتيدات ، زبالين الأكسجين 14 ، ومضادات الأكسدة وفقا للجدول 6. حافظ على المزيج على الجليد.
- قم بتحميل غرفة التصوير المعدة ، المسجلة على حامل الشريحة ، على هدف TIRF 100x. استخدم قناتي 560 نانومتر و647 نانومتر للعثور على مجال رؤية يحتوي على العدد الأمثل وكثافة الأنابيب الدقيقة المفردة والحزم.
ملاحظة: إذا تم تصنيف كل من الأنابيب الدقيقة البيوتينيل وغير البيوتينيل بنفس الفلوروفور، فإن تحليلات المسح الضوئي للخطوط لشدة التألق يمكن أن تميز بين الأنابيب الدقيقة المفردة والحزم. - بمجرد تحديد مجال الرؤية، التقط صورة مرجعية.
- تدفق بعناية في مزيج الفحص دون إزعاج غرفة التصوير.
- ختم الأطراف المفتوحة للغرفة مع تسرب فالاب.
- بدء تشغيل تسلسل التصوير كما هو موضح في الخطوة 4.5.1.
| الكاشف | الحجم (ميكرولتر) |
| مزيج توبولين قابل للذوبان | 4 |
| OSF | 1 |
| Trolox (إذا كنت تستخدم الأنابيب الدقيقة الموسومة بفلوروفور التبييض الضوئي بسهولة) | 1 |
| ATP، 10 مللي متر (في حالة استخدام كينيسين) | 1 |
| PRC1 (أو رابط متقاطع من اختيارك) | 1 |
| البروتينات ذات الأهمية | X |
| ميجابايت-بارد | 2-X |
الجدول 6: فحص مكونات المزيج. امزج، واتدفق، واتدفق، وصور ديناميكيات الأنابيب الدقيقة، في غضون 30 دقيقة.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم إجراء التجربة الموصوفة أعلاه باستخدام أنابيب دقيقة بيوتينيل تحمل علامة الفلوروفور 647 نانومتر ، وأنابيب دقيقة غير بيوتينيل تحمل علامة الفلوروفور 560 نانومتر ، ومزيج توبولين قابل للذوبان يحمل علامة الفلوروفور 560 نانومتر. تم ربط الأنابيب الدقيقة بواسطة بروتين الربط المتقاطع PRC1 (المسمى GFP)....
Access restricted. Please log in or start a trial to view this content.
Discussion
توسع التجربة الموصوفة هنا بشكل كبير نطاق وتعقيد اختبارات إعادة تشكيل الأنابيب الدقيقة التقليدية ، والتي يتم إجراؤها تقليديا على الأنابيب الدقيقة المفردة أو على نوع واحد من الصفيف. يوفر الفحص الحالي طريقة لتحديد ومقارنة نشاط MAP التنظيمي في وقت واحد على مجموعتين سكانيتين ، وهما الأنابيب ا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منحة من المعاهد الوطنية للصحة (رقم 1DP2GM126894-01) ، وبأموال من صناديق بيو الخيرية ومؤسسة عائلة سميث إلى R.S. يشكر المؤلفون الدكتور شو جيانغ على مساهمته في تطوير وتحسين البروتوكولات.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma Aldrich | 238813 | |
| 1,4-piperazinediethanesulfonic acid (PIPES) | Sigma Aldrich | P6757 | |
| 18x18 mm #1.5 coverslips | Electron Microscopy Sciences | 63787 | |
| 2-Mercaptoethanol (BME) | Sigma Aldrich | M-6250 | |
| 24x60 mm #1.5 coverslips | Electron Microscopy Sciences | 63793 | |
| 405/488/560/647 nm Laser Quad Band | Chroma | TRF89901-NK | |
| Acetone | Sigma Aldrich | 320110 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sigma Aldrich | A7699-5G | |
| Avidin, NeutrAvidin® Biotin-binding Protein (Molecular Probes®) | Thermo Fischer Scientific | A2666 | |
| Bath sonicator: Branson 2800 Cleaner | Branson | CPX2800H | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 11 x 34 mm | Beckman-Coulter | 343778 | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 8 x 34 mm | Beckman-Coulter | 343776 | |
| Biotin-PEG-SVA, MW 5,000 | Laysan Bio | #Biotin-PEG-SVA-5000 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 2905 | |
| Catalase | Sigma Aldrich | C40 | |
| Corning LSE Mini Microcentrifuge, AC100-240V | Corning | 6670 | |
| Delicate Task Wipes | Kimtech | 34120 | |
| Dithiothreitol (DTT) | GoldBio | DTT10 | |
| Emission filter | Chroma | ET610/75m | |
| Ethanol (200-proof) | Decon Labs | 2705 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma Aldrich | 3777 | |
| Glucose Oxidase | Sigma Aldrich | G2133 | |
| GMPCPP | Jena Bioscience | NU-405 | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma Aldrich | G8877 | |
| Hellmanex III detergent | Sigma Aldrich | Z805939 | |
| Immersion oil, Type A | Fisher Scientific | 77010 | |
| Kappa-casein | Sigma Aldrich | C0406 | |
| Lanolin | Fisher Scientific | S25376 | |
| Lens Cleaning Tissue | ThorLabs | MC-5 | |
| Magnesium Chloride (MgCl2) | Sigma Aldrich | M9272 | |
| Methylcellulose | Sigma Aldrich | M0512 | |
| Microfuge 16 Benchtop Centrifuge | Beckman-Coulter | A46474 | |
| Microscope Slides, Diamond White Glass, 25 x 75mm, 90° Ground Edges, WHITE Frosted | Globe Scientific | 1380-50W | |
| mPEG-Succinimidyl Valerate, MW 5,000 | Laysan Bio | #NH2-PEG-VA-5K | |
| Optima™ Max-XP Tabletop Ultracentrifuge | Beckman-Coulter | 393315 | |
| Paraffin | Fisher Scientific | P31-500 | |
| PELCO Reverse (self-closing), Fine Tweezers | Ted Pella | 5377-NM | |
| Petrolatum, White | Fisher Scientific | 18-605-050 | |
| Plasma Cleaner, 115V | Harrick Plasma | PDC-001 | |
| Potassium Hydroxide (KOH) | Sigma Aldrich | 221473 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Thermal-Lok 1-Position Dry Heat Bath | USA Scientific | 2510-1101 | |
| Thermal-Lok Block for 1.5 and 2.0 mL Tubes | USA Scientific | 2520-0000 | |
| Thermo Scientific™ Pierce™ Bond-Breaker™ TCEP Solution, Neutral pH; 500mM | Thermo Fischer Scientific | PI-77720 | |
| TIRF 100X NA 1.49 Oil Objective | Nikon | CFI Apochromat TIRF 100XC Oil | |
| TIRF microscope | Nikon | Eclipse Ti | |
| TLA 120.1 rotor | Beckman-Coulter | 362224 | |
| TLA 120.2 rotor | Beckman-Coulter | 357656 | |
| Tubulin protein (>99% pure): porcine brain | Cytoskeleton | T240 | |
| Tubulin Protein (Biotin): Porcine Brain | Cytoskeleton | T333P | |
| Tubulin protein (fluorescent HiLyte 647): porcine brain | Cytoskeleton | TL670M | |
| Tubulin protein (X-rhodamine): bovine brain | Cytoskeleton | TL620M | |
| VECTABOND® Reagent, Tissue Section Adhesion | Vector Biolabs | SP-1800-7 | |
| VWR® Personal-Sized Incubator, 120V, 50/60Hz, 0.6A | VWR | 97025-630 |
References
- Subramanian, R., Kapoor, T. M. Building complexity: insights into self-organized assembly of microtubule-based architectures. Developmental Cell. 23 (5), 874-885 (2012).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Bitan, A., Rosenbaum, I., Abdu, U. Stable and dynamic microtubules coordinately determine and maintain Drosophila bristle shape. Development. 139 (11), 1987-1996 (2012).
- Foe, V. E., von Dassow, G. Stable and dynamic microtubules coordinately shape the myosin activation zone during cytokinetic furrow formation. The Journal of Cell Biology. 183 (3), 457-470 (2008).
- Pous, C., et al. Functional specialization of stable and dynamic microtubules in protein traffic in WIF-B cells. The Journal of Cell Biology. 142 (1), 153-165 (1998).
- Uehara, R., Goshima, G. Functional central spindle assembly requires de novo microtubule generation in the interchromosomal region during anaphase. The Journal of Cell Biology. 191 (2), 259-267 (2010).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bieling, P., et al. Reconstitution of a microtubule plus-end tracking system in vitro. Nature. 450 (7172), 1100-1105 (2007).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Shimamoto, Y., Forth, S., Kapoor, T. M. Measuring pushing and braking forces generated by ensembles of Kinesin-5 crosslinking two microtubules. Developmental Cell. 34 (6), 669-681 (2015).
- Mani, N., Jiang, S., Neary, A. E., Wijeratne, S. S., Subramanian, R. Differential regulation of single microtubules and bundles by a three-protein module. Nature Chemical Biology. 17 (9), 964-974 (2021).
- Hyman, A. A., Salser, S., Drechsel, D., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Subramanian, R., et al. Insights into antiparallel microtubule crosslinking by PRC1, a conserved nonmotor microtubule binding protein. Cell. 142 (3), 433-443 (2010).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Wijeratne, S., Subramanian, R. Geometry of antiparallel microtubule bundles regulates relative sliding and stalling by PRC1 and Kif4A. eLife. 7, 32595(2018).
- Mani, N., Wijeratne, S. S., Subramanian, R. Micron-scale geometrical features of microtubules as regulators of microtubule organization. eLife. 10, 63880(2021).
- Freal, A., et al. Feedback-driven assembly of the axon initial segment. Neuron. 104 (2), 305-321 (2019).
- Ledbetter, M., Porter, K. A "microtubule" in plant cell fine structure. The Journal of Cell Biology. 19 (1), 239-250 (1963).
- Wijeratne, S. S., Marchan, M. F., Tresback, J. S., Subramanian, R. Atomic force microscopy reveals distinct protofilament-scale structural dynamics in depolymerizing microtubule arrays. Proceedings of the National Academy of Sciences of the United States of America. , 119(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved