Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Çapraz Bağlı ve Tek Mikrotübüllerin Dinamiğinin In Vitro TIRF Mikroskobu ile Eşzamanlı Görselleştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, iki mikrotübül popülasyonunun dinamiklerini aynı anda ölçmek ve karşılaştırmak için TIRF mikroskopi tabanlı in vitro resusyon testi sunulmaktadır. Çapraz bağlı mikrotübül demetleri ve tek mikrotübüller üzerindeki çoklu mikrotübül ile ilişkili proteinlerin kolektif aktivitesini eşzamanlı olarak görüntülemek için bir yöntem açıklanmaktadır.
Özet
Mikrotübüller, hücrelerde farklı yapılara organize olan αβ-tübülin heterodimerlerinin polimerleridir. Mikrotübül tabanlı mimariler ve ağlar genellikle dinamik özelliklerinde farklılık gösteren mikrotübül dizilerinin alt kümelerini içerir. Örneğin, bölünen hücrelerde, çapraz bağlı mikrotübüllerin kararlı demetleri, dinamik çapraz bağlı olmayan mikrotübüllere yakın bir yerde bir arada bulunur. TIRF-mikroskopi tabanlı in vitro sulandırma çalışmaları, bu farklı mikrotübül dizilerinin dinamiklerinin eşzamanlı olarak görselleştirilmesini sağlar. Bu tahlilde, bir görüntüleme odası, tek filamentler halinde bulunan veya çapraz bağlı demetler halinde organize edilen yüzey immobilize mikrotübüllerle birleştirilir. Tübülin, nükleotitler ve protein düzenleyicilerinin tanıtılması, ilişkili proteinlerin ve tek ve çapraz bağlı mikrotübüllerin dinamik özelliklerinin doğrudan görselleştirilmesini sağlar. Ayrıca, dinamik tek mikrotübüller demetler halinde organize olurken meydana gelen değişiklikler gerçek zamanlı olarak izlenebilir. Burada açıklanan yöntem, bireysel proteinlerin aktivitesinin ve lokalizasyonunun sistematik bir değerlendirmesinin yanı sıra, protein düzenleyicilerinin aynı deneysel koşullar altında iki farklı mikrotübül alt kümesi üzerindeki sinerjik etkilerinin sistematik bir şekilde değerlendirilmesine izin verir, böylece diğer yöntemlerle erişilemeyen mekanik bilgiler sağlar.
Giriş
Mikrotübüller, hücre içi taşıma ve organel konumlandırmasından hücre bölünmesi ve uzamasına kadar çoklu hücresel süreçler için gerekli olan yapısal iskeleleri oluşturan biyopolimerlerdir. Bu çeşitli işlevleri yerine getirmek için, bireysel mikrotübüller mitotik iğler, siliyer aksonemler, nöronal demetler, interfaz dizileri ve bitki kortikal dizileri gibi mikron boyutlu diziler halinde düzenlenir. Bu yapılarda bulunan her yerde bulunan bir mimari motif, uzunlukları boyunca çapraz bağlanmış bir mikrotübül demetidir1. Birkaç mikrotübül bazlı yapının ilgi çekici bir özelliği, demetlenmiş mikrotübüllerin ve çapraz bağlı olmayan tek mikrotübüllerin yakın uzamsal yakınlıkta bir arada bulunmasıdır. Bu mikrotübül alt popülasyonları, düzgün işlevleri için gerektiği gibi, birbirlerinden çok farklı polimerizasyon dinamikleri gösterebilir2,3,4,5. Örneğin, mitotik iş mili içinde, hücre merkezindeki mikron ölçekli bir bölgede kararlı çapraz bağlı demetler ve dinamik tek mikrotübüller bulunur6. Bu nedenle, birlikte bulunan mikrotübül popülasyonlarının dinamik özelliklerinin nasıl belirlendiğinin incelenmesi, mikrotübül bazlı yapıların montajını ve işlevini anlamak için merkezidir.
Mikrotübüller, polimerizasyon ve depolimerizasyon aşamaları arasında geçiş yapan, felaket ve kurtarma olarak bilinen olaylarda iki faz arasında geçiş yapan dinamik polimerlerdir7. Hücresel mikrotübüllerin dinamikleri, mikrotübül polimerizasyonu ve depolimerizasyon oranlarını ve felaket ve kurtarma olaylarının frekanslarını modüle eden sayısız Mikrotübül İlişkili Protein (MAP'ler) tarafından düzenlenir. Işık mikroskobunda, özellikle de yüksek mikrotübül yoğunluğuna sahip bölgelerde, uzamsal çözünürlüğün sınırlamaları nedeniyle, hücrelerdeki uzamsal proksimal diziler üzerindeki MAP'lerin aktivitesini araştırmak zordur. Dahası, aynı hücresel bölgede birden fazla MAP'nin varlığı, hücre biyolojik çalışmalarının yorumlanmasını engellemektedir. Toplam İç Yansıma Floresan (TIRF) mikroskobu ile birlikte gerçekleştirilen in vitro sulandırma testleri, MAP'lerin belirli alt kümelerinin proksimal hücresel mikrotübül dizilerinin dinamiklerini düzenlediği mekanizmaları incelemenin zorluklarını aşmaktadır. Burada, in vitro olarak monte edilen mikrotübüllerin dinamikleri, kontrollü koşullar altında bir veya daha fazla rekombinant MAP'nin varlığında incelenir8,9,10. Bununla birlikte, geleneksel sulandırma testleri tipik olarak tek mikrotübüller veya bir dizi türü üzerinde gerçekleştirilir ve birlikte var olan popülasyonların görselleştirilmesini engeller.
Burada, aynı çözelti koşulları altında iki mikrotübül popülasyonunun eşzamanlı olarak görselleştirilmesini sağlayan in vitro sulandırma testleri sunuyoruz11. Tek mikrotübüller ve mitotik iğle ilişkili protein PRC1 tarafından çapraz bağlanmış mikrotübül demetleri üzerinde birden fazla MAP'nin kolektif aktivitesini aynı anda görüntülemek için bir yöntem açıklıyoruz. PRC1 proteini tercihen anti-paralel mikrotübüller arasındaki örtüşmeye bağlanır ve onları çapraz bağlar9. Kısaca, bu protokol aşağıdaki adımlardan oluşur: (i) stok çözeltilerinin ve reaktiflerin hazırlanması, (ii) mikroskopi deneyleri için görüntüleme odasını oluşturmak için kullanılan kapak fişlerinin temizlenmesi ve yüzey işlemi, (iii) deney sırasında polimerizasyonun başlatıldığı kararlı mikrotübül "tohumlarının" hazırlanması, (iv) mikrotübül dinamiklerini görselleştirmek için TIRF mikroskop ayarlarının spesifikasyonu, (v) mikrotübül tohumlarının immobilizasyonu ve çapraz bağlı mikrotübül demetlerinin üretilmesi görüntüleme odasında ve (vi) çözünür tübülin, MAP'ler ve nükleotidlerin eklenmesi üzerine TIRF mikroskobu ile görüntüleme odasındaki mikrotübül dinamiklerinin görselleştirilmesi. Bu testler, MAP lokalizasyonunun ve bunların iki mikrotübül popülasyonunun dinamikleri üzerindeki etkilerinin nitel olarak değerlendirilmesini ve nicel olarak incelenmesini sağlar. Ek olarak, çoklu MAP'lerin bu mikrotübül popülasyonları üzerindeki sinerjik etkilerinin çok çeşitli deneysel koşullarda değerlendirilmesini kolaylaştırırlar.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Reaktifleri hazırlayın
- Arabellekleri ve reaktifleri Tablo 1 ve Tablo 2'de belirtildiği gibi hazırlayın. Deney sırasında, aksi belirtilmedikçe, tüm çözeltileri buz üzerinde tutun.
| Çözüm | Bileşen | Önerilen Depolama Süresi | Notlar | ||
| 5X BRB80 Serisi | 400 mM K-BORULAR, 5 mM MgCl2, 5 mM EGTA, pH 6.8 KOH ile, filtre sterilize | 2 yıla kadar | 4 °C'de depolayın | ||
| 1X BRB80 Serisi | 80 mM K-BORULAR, 1 mM MgCl2, 1 mM EGTA, pH 6,8 | 2 yıla kadar | 4 °C'de depolayın | ||
| BRB80-DTT | 1X BRB80, 1 mM DTT | 2 güne kadar | |||
| Tahlil Arabelleği | 80 mM K-BORULAR, 3 mM MgCl2, 1 mM EGTA, pH 6.8, %5 sakkaroz (VEYA 1X BRB80, %5 sakaroz, 2 mM MgCl2) | 1 yıla kadar | 4 °C'de depolayın | ||
| Ana Arabellek (MB) | Tahlil Tamponu, 5mM TCEP | 1 hafta | Deney gününde hazırlanın; İki tüpe ayırın: Oda sıcaklığında MB-sıcak ve buz üzerinde MB-soğuk; floresan boyalar kullanılıyorsa 1 mM DTT içerir | ||
| MetilSelüloz (MBMC) ile Ana Tampon | 1X BRB80, %0,8 metilselüloz, 5 mM TCEP, 5 mM MgCl2 | 1 hafta | Deney gününde hazırlanın; floresan boyalar kullanılıyorsa 1 mM DTT içerir | ||
| Protein Seyreltme Tamponu (DB) | MB, 1 mg/mL Sığır Serumu Albümini (BSA), 1 μM ATP | 1 gün, buz üzerinde | Deney gününde hazırlanın; floresan boyalar kullanılıyorsa 1 mM DTT içerir | ||
| Oksijen Süpürme Karışımı (OSM) | MB, 389 μg/mL katalaz, 4.44 mg/mL glikoz oksidaz, 15.9 mM 2-merkaptoetanol (BME) | 1 gün, buz üzerinde | Deneme gününde hazırlanın | ||
| Oksijen Süpürme Finali (OSF) | MB, 350 μg/mL katalaz, 4mg/mL glukoz oksidaz, 14.3 mM BME, 15 mg/mL glikoz | 30 dakika içinde kullanın | 9 μL OSM'ye 1 μL glikoz ekleyerek kullanımdan hemen önce hazırlayın | ||
Tablo 1: Bu protokolde kullanılan arabelleklerin ve bileşenlerinin listesi. Her arabelleğin ne kadar önceden hazırlanabileceği konusunda rehberlik için "Önerilen Depolama Süresi" sütununa bakın.
| Reaktif | Depolama Konsantrasyonu | Depolama Solventi | Depolama Sıcaklığı | Çalışma Konsantrasyonu | Son Konsantrasyon | Önerilen Depolama Süresi | Notlar | |||||||||
| Neutravidin (NA) | 5 mg/mL | 1X BRB80 Serisi | -80°C | 0.2 mg/mL | 0.2 mg/mL | 1 yıla kadar | Mikrotübülleri biyotin-nötravidin-biyotin bağlantısı yoluyla hareketsiz hale getirmek için kullanılır; küçük aliquots içinde saklamak | |||||||||
| Kappa-kazein (KC) | 5 mg/mL | 1X BRB80 Serisi | -80°C | 0.5 mg/mL | 0.5 mg/mL | 2 yıla kadar | Görüntüleme odası yüzeyini bloke etmek için kullanılır; Küçük aliquots'larda saklayın; Deney gününde, oda sıcaklığında küçük bir hacim ayırın | |||||||||
| Sığır Serum Albümini (BSA) | 50 mg/mL | 1X BRB80 Serisi | -20°C | 1 mg/mL (DB'de) | YOK | 2 yıla kadar | küçük aliquots içinde saklamak | |||||||||
| Katalaz | 3.5 mg/mL | 1X BRB80 Serisi | -80°C | 350 μg/mL (OSF'de) | 35 μg/mL | 2 yıla kadar | oksijen süpürme karışımının bileşeni; küçük aliquots içinde saklamak | |||||||||
| Glikoz oksidaz | 40 mg/mL | 1X BRB80 Serisi | -80°C | 4 mg/mL (OSF'de) | 0.4 mg/mL | 2 yıla kadar | oksijen süpürme karışımının bileşeni; küçük aliquots içinde saklamak | |||||||||
| Tubulin | Liyofilize | YOK | 4°C | 10 mg/mL | 2.12 mg/mL (tübülin karışımında) | 1 yıla kadar | Tubulin çözeltiye girdikten sonra, polimerizasyonu önlemek için soğuk tutun. | |||||||||
| Adenozin Trifosfat (ATP) | 100 mM | ultra saf su | -20°C | 10 mM | 1 mM | 6 ay | Çözeltiyi filtreyle sterilize edilmiş suda hazırlayın, pH'ı ~ 7.0'a ayarlayın ve küçük alikotlarda dondurun. | |||||||||
| Guanozin Trifosfat (GTP) | 100 mM | ultra saf su | -20°C | 10 mM | 1.29 mM (tübülin karışımında) | 6 ay | Çözeltiyi filtreyle sterilize edilmiş suda hazırlayın, pH'ı ~ 7.0'a ayarlayın ve küçük alikotlarda dondurun. | |||||||||
| Guanosin-5'-[(α,β)-metileno] trifosfat (GMPCPP) | 10 mM | ultra saf su | -20°C | 10 μM | 0,5 μM | 6 ay | ||||||||||
| Dithiothreitol (DTT) | 1 milyon | steril su | -20°C | 1 mM | YOK | 2 yıla kadar | ||||||||||
| Tris (2-karboksiyetil) fosfin (TCEP) | 0,5 milyon | filtre sterilize edilmiş su | Oda sıcaklığı | 5 mM | YOK | 2 yıla kadar | ||||||||||
| Metilselüloz | 1% | steril su | Oda sıcaklığı | %0.8 (MBMC cinsinden) | % 0.21 (tübülin karışımında) | 1 yıla kadar | Metilselülozu kaynamaya yakın suya yavaşça ekleyerek çözün. Sürekli karıştırırken soğumaya bırakın. | |||||||||
| Beta-merkaptoetanol (BME) | 143 mM | steril su | Oda sıcaklığı | 14,3 mM (OSF'de) | 1,43 mM | 5 yıla kadar | 143 mM, stok BME'nin 1:100 seyreltilmesidir | |||||||||
| Glikoz | 150 mg/mL | 1X BRB80 Serisi | -80°C | 15 mg/mL (OSF'de) | 1.5 mg/mL | 2 yıla kadar | Kullanmadan hemen önce OSM'ye ekleyin | |||||||||
| (±)-6-Hidroksi-2,5,7,8-tetrametil kroman-2-karboksilik asit (Troloks) | 10mM | 1X BRB80 Serisi | -80°C | 10 mM | 1 mM | 1 yıla kadar | Tamamen çözünmez. Biraz NaOH ekleyin, ~ 4 saat karıştırın ve kullanmadan önce sterilize edin | |||||||||
| mPEG-Süksinimidil Valerat, MW 5.000 | toz | YOK | -20°C | 333 mg/mL (0,1 M sodyum bikarbonat içinde) | 324 mg/mL (0,1 M sodyum bikarbonat içinde) | 6 ay | Her tüpü tam bir toz ağırlığı ile işaretleyerek ~ 34 mg aliquots hazırlayın. Azot gazını katı, parafilm ile sızdırmaz hale getirin ve kurutuculu bir kapta -20 ° C'de saklayın. | |||||||||
| Biotin-PEG-SVA, MW 5.000 | toz | YOK | -20°C | 111 mg/mL (0,1 M sodyum bikarbonat içinde) | 3.24 mg/mL (0.1 M sodyum bikarbonat içinde) | 6 ay | Her tüpü tam bir toz ağırlığı ile işaretleyerek ~ 3 mg aliquots hazırlayın. Azot gazını katı, parafilm ile sızdırmaz hale getirin ve kurutuculu bir kapta -20 ° C'de saklayın. | |||||||||
Tablo 2: Bu protokolde kullanılan reaktiflerin listesi. Önerilen depolama koşulları ve konsantrasyonları, deney sırasında kullanılan stok çözeltilerinin çalışma konsantrasyonları ve görüntüleme odasındaki son konsantrasyon dahildir. Ek notlar en sağdaki sütunda verilmiştir.
2. Biotin-PEG slaytları hazırlayın
NOT: Görüntüleme odalarını bir deneyin başlangıcına mümkün olduğunca yakın ve en fazla 2 hafta önceden hazırlayın.
- Temiz kapak fişleri
- Sırasıyla 24 x 60 mm ve 18 x 18 mm #1,5 kapak kapaklarını (Şekil 1F) sırasıyla slayt boyama kavanozlarına ve slayt yıkama raflarına eşit sayıda yerleştirin (Şekil 1A,B). 18 x 18 mm kapak kapakları içeren kızaklı yıkama raflarını 100 mL'lik bir beherin içine yerleştirin.
- Tüm kapakları ultra saf suda (18,2 MΩ-cm dirençlilik) 5-6 kez durulayın ve her durulamadan sonra fazla sıvıyı vakum tüpüne bağlı bir pipet ucu ile çıkarın (Şekil 1C).
- Kapakları içeren beherleri ve sürgülü boyama kavanozlarını ultra saf suyla doldurun, parafilmle kapatın ve 10 dakika boyunca sonikat yapın.
- İki adet 150 mL beheri 200 geçirmez etanol ile doldurun. Cımbız kullanarak, her bir örtüyü etanol ile doldurulmuş bir behere, sonra da diğerine batırın.
- Cımbız kullanarak, kapakları sürgülü kurutma rafına aktarın (Şekil 1D), azot gazı akışı altında kurutun ve tamamen kuruyana kadar (~ 15 dakika) 37 ° C'de inkübe edin.
- Kurutulmuş kapak kapaklarını plazma temizleyicinin içine tek bir tabaka halinde yerleştirin. Vakum contası oluşturun ve ardından plazma temizleyicinin Radyo Frekansı (RF) seviyesini ~8 MHz'e ayarlayın.
- Plazma üretildikten sonra, kapakları plazma temizleyicide 5 dakika bekletin. Plazma temizleyiciyi kapatın ve vakumu yavaşça serbest bırakın.
- Vakum contası serbest bırakıldıktan sonra, kapak kapaklarını ters çevirin ve kapak kapaklarının diğer tarafı için plazma temizliğini 5 dakika boyunca tekrarlayın.
- Plazma temizlemeye alternatif: 2.1.2-2.1.3 adımlarının yerine, sonikat örtüler 10 dakika boyunca% 2'lik sıcak bir deterjan çözeltisinde (ultra saf suda) kayar. Daha sonra, kapakları ultra saf suyla iyice yıkayın ve ultra saf suda 2-3 kez (her biri 10 dakika) sonikat yapın. Daha sonra, etanol içinde yıkayın ve 2.1.4-2.1.5 adımlarında olduğu gibi kurutun. 2.1.6-2.1.8 arasındaki adımları atlayın.
- Biotin-PEG tedavisi
- Kullanımdan hemen önce, 400 mL aseton içinde 400 μL 3-Aminopropiltrietoksisilan çözün. Cımbız kullanarak, plazma ile temizlenmiş kapakları slayt yıkama rafına ve slayt boyama kavanozlarına taşıyın. Kapakları 3-Aminopropiltrietoksisilan çözeltisine batırın ve 5 dakika 12,13 için inkübe edin.
- Tüm kapak kapaklarını ultra saf suyla 5-6 kez yıkayın.
- Kapak kapaklarını sürgülü kurutma rafına aktarın, azot gazı akışı altında kurutun ve tamamen kuruyana kadar (~ 20 dakika) 37 ° C'de inkübe edin.
- Kurutulmuş örtüleri hassas görev mendilleri üzerine yerleştirin ve her bir kapak kaymasını bir köşeye etiketleyin, örneğin, her 18 x 18 mm kapak kaymasında 'p' ve her 24 x 60 mm'lik kapak kaymasında 'b' (bkz. Şekil 2).
- Deney gününde, 10 mL ultra saf suda 0.84 mg NaHCO3 çözerek taze bir 0.1 M sodyum bikarbonat çözeltisi hazırlayın.
- Kullanmadan hemen önce mPEG-Süksinimidil Valerate (PEG-SVA) ve Biotin-PEG-SVA alikotlarını oda sıcaklığına getirin. Tablo 2'deki Polietilen Glikol (PEG) alikot preparatı ile ilgili notlara bakınız.
NOT: Hızlı çalışın çünkü Süksinimidil Valerate (SVA) höyüğünün hidroliz yarı ömrü ~ 30 dakikadır. - 102 μL 0,1 M NaHCO3 ila 34 mg PEG-SVA ekleyin, 20 sn boyunca 2.656 x g'de bir tezgah üstü mikrosantrifüjde döndürün ve ardından yukarı ve aşağı pipetleyerek karıştırın. 3 mg Biotin-PEG-SVA'yı 27 μL 0.1 M NaHCO3 içinde yukarı ve aşağı pipetleyerek çözün. Seyreltme hacimlerini, tüplerde belirtilen PEG'nin tam ağırlığına göre ayarlayın (bkz. Tablo 2).
- 20 kapak kapağı için 75 μL PEG-SVA çözeltisi ve 2.25 μL Biotin-PEG-SVA çözeltisini, 30 kapak kapağı için 100 μL ve 3 μL veya 40 kapak kapağı için 125 μL ve 3,75 μL'yi birleştirerek 100:1 w/w PEG:biotin-PEG karışımını hazırlayın.
- Islak kağıt havluları boş bir 10 μL uç kutusunun altındaki uç rafının altına yerleştirerek bir hidrasyon odası oluşturun (Şekil 1E). Bu, PEG çözeltilerinin buharlaşmasını önleyecektir.
- Pipet 6 μL 100:1 PEG-SVA:biotin-PEG karışımı etiketli tarafta 24 x 60 mm'lik bir kapak kaymasının ortasına yerleştirin. İlk kapak kaymasının üzerine 24 x 60 mm'lik başka bir örtü kayması yerleştirin, böylece çift X şekli oluşturur ve kenarlar birbirine bakacak şekilde 'b' etiketlidir. Çifti hidrasyon odasındaki boş bir uç rafına yerleştirin ve kalan 24 x 60 mm'lik kapak kapakları için tekrarlayın.
- Etiketli taraftaki 18 x 18 mm'lik bir kapak kapağının ortasına 6 μL PEG-SVA pipeti. İlk kapak kapağının üzerine, kenarları birbirine bakacak şekilde 'p' etiketli başka bir 18 x 18 mm kapak kayması yerleştirin. Çifti hidrasyon odasındaki boş bir uç rafına yerleştirin ve kalan 18 x 18 mm kapak kapakları için tekrarlayın.
- Hidrasyon odasını kapatın ve 3 saat veya gece boyunca inkübe edin.
- Kapak kapakları çiftlerini ayırın ve ultra saf suda durulayın.
- Kuru kapaklar azot akışıyla kayar ve tamamen kuruması için 37 °C'lik bir inkübatöre yerleştirir.
- Görüntüleme odasını oluşturmak için, 'b' etiketli taraftaki 24 x 60 mm'lik bir kapak kayması üzerine üç şerit çift taraflı bant yapıştırın. Bant şeritlerinin diğer tarafına, tarafı daha büyük kapak kapağına bakan 'p' etiketli 18 x 18 mm'lik bir kapak kayması takın. Bu, mikroskopi deneyleri için, işlenmiş yüzeyler birbirine bakan iki akış odası oluşturur (Şekil 2 ve Şekil 1G).

Şekil 1: (A) 24 x 60 mm kapak kaymaları için sürgülü boyama kavanozları, (B) 18 x 18 mm kapak kaymaları için sürgülü yıkama rafları, (C) vakum kurulumu, (D) sürgü kurutma rafı, (E) hidrasyon odası, (F) kapak kaymaları, (G) görüntüleme odası, (H) slayt tutucu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
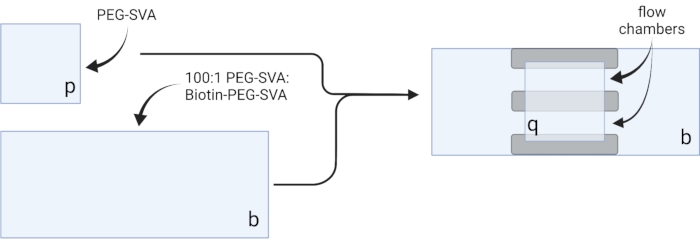
Şekil 2: Çift taraflı bant (gri) ve PEG/Biotin-PEG ile tedavi edilmiş kapaklar kullanılarak görüntüleme odalarının hazırlanması için şematik. BioRender.com ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Mikrotübülleri polimerize edin
- GMPCPP tohumları hazırlayın
NOT: GMPCPP tohumlarını soğuk bir odada hazırlayın, tüm reaktifleri, uçları ve tüpleri 4 ° C'de tutun GMPCPP tohumları önceden hazırlanabilir ve -80 ° C'de 1 yıla kadar saklanabilir. 1 mL santrifüj tüpü içeren sabit açılı ultrasantrifüj rotorunu ultra santrifüje yerleştirin ve sıcaklığı 4 °C'ye ayarlayın.- Liyofilize tübülini (Tablo 2) kullanımdan hemen önce 1X BRB80'de ~ 10 mg / mL'ye kadar tekrarlayın.
- GMPCPP tohumlarının bileşenlerini Tablo 3'te açıklandığı gibi karıştırın.
NOT: Çözünür tübülinin polimerizasyonunu en aza indirmek için tüm tübülin bileşenlerini mümkün olduğunca buz üzerinde tutun. - Sabit açılı ultrasantrifüj rotorda 352.700 x g'de 4 °C'de 5 dakika boyunca karışımı netleştirin.
- Süpernatantı 5 μL alikotlara ayırın, sıvı azotta dondurun ve -80 ° C'de saklayın.
- Deney gününde tohumları polimerize edin
- 1-2 mL BRB80-DTT (Tablo 1) ila 37 °C ısıtın.
- 3.1.4 adımından itibaren 5 μL GMPCPP tohumu (-80 ° C) aliquot'u buz üzerine yerleştirin ve hemen 20 μL ılık BRB80-DTT içinde çözün. Oda sıcaklığında 5 s için 2.000 x g'da döndürün ve karıştırmak için dokunun .
NOT: İlk seyreltme hacmi 13 μL ile 21 μL arasında değişebilir ve her bir tohum grubu için ampirik olarak belirlenir. Tohumlar polimerize olmazsa, ilk seyreltme tamponunu (adım 3.2.2) 0,5 μM GMPCPP ile destekleyerek sorun giderin. - Işıktan koruyun ve 37 ° C'de 30-45 dakika boyunca inkübe edin.
NOT: Mikrotübüllerin uzunluğu inkübasyon süresine bağlıdır. Kısa mikrotübüller için, kuluçka süresi 15 dakika kadar kısa olabilir. Uzun mikrotübüller için, inkübasyon süresi 2 saat kadar uzun olabilir. Biyotinile mikrotübüller, biyotinillenmemiş mikrotübüllerden daha uzun inkübasyon süreleri gerektirme eğilimindedir. - 500 μL santrifüj tüpü içeren sabit açılı ultrasantrifüj rotorunu ultrasantrifüje yerleştirin ve 30 °C'ye kadar ısıtın.
- Kuluçkadan sonra, polimerize GMPCPP tohumlarına 50 μL ılık BRB80-DTT (adım 3.2.1) ekleyin ve karışımı 500 μL'lik bir santrifüj tüpüne aktarın. GMPCPP tohumlarını içeren boş tüpü başka bir 50 μL sıcak BRB80-DTT ile yıkayın, pipet yukarı ve aşağı ve bu tamponu karışımı içeren 500 μL santrifüj tüpüne ekleyin.
- Döndürmeden önce, peletin nerede olacağını belirtmek için santrifüj tüpünün kenarını işaretleyin (pelet görülemeyecek kadar küçük olacaktır). 30 °C12'de 244.900 x g'de 10 dakika boyunca döndürün.
- Süpernatantı dikkatlice pipetle çıkarın ve atın. Peleti 100 μL sıcak BRB80-DTT içinde yeniden askıya alın. Karıştırmak için dokunun.
- 30 °C'de 244.900 x g'de 10 dakika boyunca döndürün, işareti rotorla aynı yerde pelet edecek şekilde hizalayın.
- Süpernatantı çıkarın ve peleti 16 μL sıcak BRB80-DTT içinde yeniden askıya alın. Mikrotübül çözeltisini temiz bir 0,6 mL mikrosantrifüj tüpüne aktarın. Işıktan koruyun ve oda sıcaklığında veya üzerinde tutun.
NOT: Polimerizasyondan sonra, mikrotübülleri oda sıcaklığında veya üzerinde tutun. Üşürlerse, depolimerize olurlar. Daha fazla stabilite için 28 °C'de inkübe edin.
- TIRF mikroskobu ile mikrotübülleri kontrol edin
- Bir mikroskop sürgüsüne 4,5 μL BRB80-DTT ve 1 μL mikrotübül çözeltisi (adım 3.2.9) karışımı pipet yerleştirin. 18 x 18 mm'lik bir kapak kayışı ile örtün ve kenarları şeffaf oje veya oda sıcaklığında katı ve 95 ° C'de sıvı olan 1:1:1 petrolatum, lanolin ve parafin (valap sızdırmazlık maddesi) karışımı ile kapatın.
- TIRF hedefini kapak kaymasının altına yerleştirin (önerilen mikroskop ayarları için adım 4'e bakın) ve yeni polimerize mikrotübülleri, yaklaşan deneylerde mikrotübüllerin hangi seyreltilmesinin kullanılacağını belirlemek için Bright karışımındaki floresan etiketli tübülin için uygun dalga boyunda görselleştirin (Tablo 3).
| Reaktif | Parlak karışım (μL) | Ekleme sırası | Parlak karışım + biyotin (μL) | Ekleme sırası |
| Floresan tübülin, 10 mg/mL | 2 | 6 | 2 | 7 |
| Biotin-tübülin, 10 mg/mL | 0 | YOK | 2 | 6 |
| Etiketsiz tübülin, 10 mg/mL | 20 | 5 | 18 | 5 |
| GMPCPP, 10 mM | 30 | 4 | 30 | 4 |
| DTT, 0.2 M | 0.7 | 3 | 0.7 | 3 |
| 5X BRB80 Serisi | 26.4 | 2 | 26.4 | 2 |
| steril su | 52.9 | 1 | 52.9 | 1 |
| Toplam Hacim (μL) | 132 | 132 |
Tablo 3: GMPCPP tohum karışımı. GMPCPP mikrotübül tohumlarının bileşenleri, hacim ve ekleme sırası dahil. 5 μL alikot hazırlayın ve -80 ° C'de 1 yıla kadar saklayın.
4. Mikroskop ayarları
- Sıcaklık: Dinamik mikrotübülleri görüntülemek için mikroskop sıcaklığını 28 ° C'ye ayarlayın.
- Filtreler: Görüntülenecek floresan kanallara bağlı olarak filtre küpleri ve emisyon filtrelerinin en iyi kombinasyonunu kullanın. Aynı deneyde 488 nm, 560 nm ve 647 nm dalga boylarını görselleştirmek için, belirlenen dalga boyları için emisyon filtreleriyle birlikte 405/488/560/647 nm Lazer Dört Bant Seti kullanın.
- Lazerleri Hizala: Deneyde kullanılan Lazer ışınlarının hizalandığından emin olun. Deney için Lazer yoğunluğunu ampirik olarak belirleyin, böylece tüm floresan proteinleri mümkün olan en yüksek sinyal-gürültü oranıyla görüntülenebilir, ancak deneyin zaman içinde önemli bir fotobeyazlatmaya maruz kalmazlar.
- Amaç: 100x hedefini %70 etanol ile temizlemek için lens kağıdı kullanın. Görüntülemeden önce, hedefe bir damla mikroskop daldırma yağı ekleyin.
- Görüntüleme sırası ayarlama
- 647 nm florofor etiketli biyotinile mikrotübüller, 560 nm florofor etiketli biyotinillenmemiş mikrotübüller ve çözünür tübülin ve GFP etiketli protein ile yapılan bir deney için, 20 dakika boyunca görüntü. Her 10 saniyede bir 560 nm ve 488 nm kanalları ve her 30 saniyede bir 647 nm kanalı görüntüleyin.
- Çözünür tübülin ve MAP'lerin eklenmesinden önce demetlerin referans görüntüsünü yakalamak için, her biri 560 nm ve 647 nm dalga boylarında bir görüntü içeren bir dizi ayarlayın.
5. Yüzey immobilize mikrotübül demetleri oluşturun
NOT: Aşağıdaki adımlar için, bir filtre kağıdını diğer tarafa yerleştirirken tüm çözeltileri bir açık tarafa pipetleyerek bir akış odasına akıtın. Floresan etiketli proteinlerin fotobeyazlatmasını azaltmak için görüntüleme odasını ışıktan koruyun. Hazırlanan görüntüleme odasını bir slayt tutucuya bantlayın (Şekil 1G,H). Protokol steps 5.2-6.4'e karşılık gelen Tablo 4'teki adımları izleyin.
- Çözünür tübülin karışımını Tablo 5'e göre hazırlayın ve buz üzerinde tutun.
NOT: Çözünür tübülin, polimerizasyonu önlemek için her zaman buz üzerine yerleştirilmelidir. Yaklaşık her 2 saatte bir veya mikrotübüller artık polimerize olmadığında taze çözünür bir tübülin karışımı hazırlayın. - Mikrotübülleri bir biyotin-nötravidin-biyotin bağlantısı yoluyla hareketsiz hale getirmek için, ilk önce oda dolana kadar (~ 7.5 μL) Neutravidin (NA) çözeltisinde akar ve 5 dakika boyunca inkübe edin.
- 10 μL MB-soğuk ile yıkayın.
- Bloke edici protein κ-kazeinin (KC) 7.5 μL'sinde akın ve 2 dakika boyunca inkübe edin.
- Odayı mikrotübüllerin sokulmasına hazırlamak için 10 μL MB-ılık ile yıkayın.
- Biyotinile mikrotübüllerin stokunu (adım 3.3.2'deki gözlemlere göre) 1X BRB80-DTT'de seyreltin ve bu seyreltmenin 1 μL'sini 9 μL MB-sıcaklığa ekleyin. Karışımı odaya akıtın ve 10 dakika boyunca inkübe edin. Daha fazla demet için daha yüksek konsantrasyonda mikrotübül kullanın.
- Hareketsiz mikrotübülleri 10 μL MB-ılık ile yıkayın.
- 7.5 μL sıcak KC'yi odaya akıtın ve 2 dakika boyunca inkübe edin.
- Kuluçka sırasında, sıcak KC'de çapraz bağlayıcı protein PRC1'in 2 nM'lik bir çözeltisini hazırlayın. Bu çözeltinin 10 μL'sini akış odasına akıtın ve 5 dakika boyunca inkübe edin.
NOT: Rekombinant PRC1, daha önce tarif edildiği gibi bakteri hücrelerinden eksprese edilir ve saflaştırılır13. - Demetler yapmak için, 10 μL biyotinillenmemiş mikrotübülleri odaya akıtın ve 10 dakika boyunca inkübe edin. PRC1, biyotinillenmemiş ve immobilize edilmiş biyotinile mikrotübülleri çapraz bağlayacaktır15,16 (Şekil 3).
NOT: Kuluçka süresi boyunca tahlil karışımını hazırlamak için adım 6.1'e bakın. - Odayı 10 μL MB-ılık ile iki kez yıkayın. Ekli mikrotübüller bu noktadan itibaren yaklaşık 20 dakika boyunca kararlıdır.
| Adım | Reaktif | Ses seviyesi (μL) | Kuluçka süresi (dakika) |
| 1 | Neutravidin | 7.5 | 5 |
| 2 | MB-soğuk | 10 | - |
| 3 | κ-kazein | 7.5 | 2 |
| 4 | MB-sıcak | 10 | - |
| 5 | Biyotinile mikrotübül (MB-ılık olarak seyreltilmiş) | 10 | 10 |
| 6 | MB-sıcak | 10 | - |
| 7 | Sıcak κ-kazein | 7.5 | 2 |
| 8 | 2 nM PRC1 κ-kazein içinde seyreltilmiş | 10 | 5 |
| 9 | Biyotinillenmemiş Mikrotübül | 10 | 10 |
| 10 | MB-sıcak x 2 | 10 | - |
| 11 | Tahlil karışımı | 10 | - |
| Ekli tohumlar bu noktada yaklaşık 20 dakika bekletilir. | |||
Tablo 4: Tahlil adımları. Görüntüleme odasına eklenen reaktiflerin listesi, yıkama (-) veya kuluçka süresi göstergesi ile.
| Reaktif | Ses seviyesi (μL) |
| Geri dönüştürülmüş tübülin, 10 mg/mL | 10 |
| MB-Soğuk | 10.3 |
| cesaret | 13.7 |
| BRB80-DTT | 3.4 |
| GTP, 10 mM | 6.7 |
| ATP, 10 mM (Kinezin kullanılıyorsa) | 6.7 |
| Floresan etiketli tübülin, 10 mg/mL | 1 (Soğuk BRB80-DTT'de liyofilize etiketli tübülini yeniden askıya alın) |
Tablo 5: Çözünür tübülin karışımı bileşenleri. Deneyin başında karıştırın ve buz üzerinde tutun.
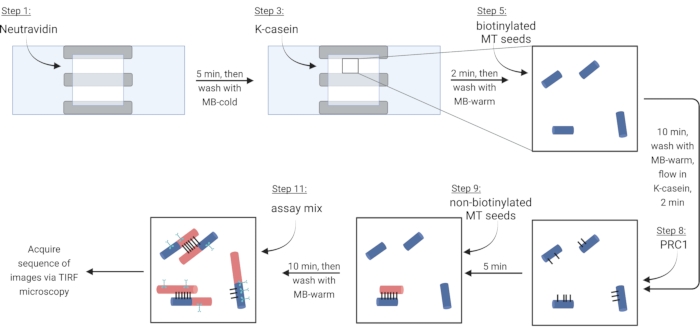
Şekil 3: Floresan olarak etiketlenmiş demetleri ve tek mikrotübülleri yapmak ve görüntülemek için tahlil bileşenlerinin eklenmesinin şeması. Biyotinile tohumlar mavi, biyotinillenmemiş tohumlarda ve kırmızı renkte çözünür tübülin, siyah renkte PRC1 ve camgöbeğinde ilgi çekici protein olarak gösterilir. Şekildeki adım numaraları Tablo 4'tekilere karşılık gelir. Adım 9'a karşılık gelen panel, önceden oluşturulmuş bir demet gösterir (sol altta); adım 11 yeni oluşturulmuş bir demet gösterir (sol üstte). BioRender.com ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Görüntü mikrotübül dinamiği
- Adım 5.10'daki 10 dakikalık inkübasyon süresi boyunca, Tablo 6'ya göre ilgilenilen proteinler, çözünür tübülin, nükleotitler, oksijen temizleyiciler14 ve antioksidanlar içeren 10 μL tahlil karışımı hazırlayın. Karışımı buz üzerinde tutun.
- Slayt tutucuya bantlanmış hazırlanmış görüntüleme odasını 100x TIRF hedefine yükleyin. Tek mikrotübüllerin ve demetlerin optimum sayısını ve yoğunluğunu içeren bir görüş alanı bulmak için 560 nm ve 647 nm kanalları kullanın.
NOT: Hem biyotinile edilmiş hem de biyotinillenmemiş mikrotübüller aynı floroforla etiketlenmişse, floresan yoğunluklarının hat tarama analizleri tek mikrotübüller ve demetler arasında ayrım yapabilir. - Bir görüş alanı tanımlandıktan sonra, bir referans görüntüsü alın.
- Görüntüleme odasını rahatsız etmeden tahlil karışımında dikkatlice akın.
- Odanın açık uçlarını valap sızdırmazlık maddesi ile kapatın.
- Görüntüleme dizisini adım 4.5.1'de açıklandığı gibi başlatın.
| Reaktif | Ses seviyesi (μL) |
| Çözünür tübülin karışımı | 4 |
| OSF | 1 |
| Trolox (kolayca fotobeyazlatıcı florofor ile etiketlenmiş mikrotübüller kullanılıyorsa) | 1 |
| ATP, 10 mM (Kinezin kullanılıyorsa) | 1 |
| PRC1 (veya tercih edilen çapraz bağlayıcı) | 1 |
| İlgilenilen proteinler | X |
| MB-soğuk | 2-X |
Tablo 6: Tahlil karışımı bileşenleri. 30 dakika içinde görüntüleme odasına akış ve görüntü mikrotübül dinamiklerini karıştırın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yukarıda açıklanan deney, 647 nm florofor etiketli biyotinillenmiş mikrotübüller, 560 nm florofor etiketli biyotinillenmemiş mikrotübüller ve 560 nm florofor etiketli çözünür tübülin karışımı kullanılarak gerçekleştirilmiştir. Mikrotübüller, çapraz bağlayıcı protein PRC1 (GFP etiketli) ile çapraz bağlandı. Yüzeysel hareketsiz demetler ve tek mikrotübüller üretildikten sonra (adım 5.11), görüntüleme odası bir TIRF 100X 1.49 NA yağ hedefi üzerine monte edildi ve 560 nm ve 647 nm f...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada açıklanan deney, geleneksel olarak tek mikrotübüller veya bir dizi türü üzerinde gerçekleştirilen geleneksel mikrotübül sulandırma tahlillerinin kapsamını ve karmaşıklığını önemli ölçüde genişletmektedir. Mevcut tahlil, iki popülasyonda, yani tek mikrotübüller ve çapraz bağlı demetler üzerindeki düzenleyici MAP aktivitesini aynı anda ölçmek ve karşılaştırmak için bir yöntem sunmaktadır. Ayrıca, bu tahlil iki tür demetin incelenmesine izin verir: dinamiklerin başlatılm...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu çalışma, NIH'den (no. 1DP2GM126894-01) bir hibe ve Pew Charitable Trusts ve Smith Family Foundation'dan R.S.'ye sağlanan fonlarla desteklendi. Yazarlar, protokollerin geliştirilmesine ve optimizasyonuna yaptığı katkılardan dolayı Dr. Shuo Jiang'a teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma Aldrich | 238813 | |
| 1,4-piperazinediethanesulfonic acid (PIPES) | Sigma Aldrich | P6757 | |
| 18x18 mm #1.5 coverslips | Electron Microscopy Sciences | 63787 | |
| 2-Mercaptoethanol (BME) | Sigma Aldrich | M-6250 | |
| 24x60 mm #1.5 coverslips | Electron Microscopy Sciences | 63793 | |
| 405/488/560/647 nm Laser Quad Band | Chroma | TRF89901-NK | |
| Acetone | Sigma Aldrich | 320110 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sigma Aldrich | A7699-5G | |
| Avidin, NeutrAvidin® Biotin-binding Protein (Molecular Probes®) | Thermo Fischer Scientific | A2666 | |
| Bath sonicator: Branson 2800 Cleaner | Branson | CPX2800H | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 11 x 34 mm | Beckman-Coulter | 343778 | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 8 x 34 mm | Beckman-Coulter | 343776 | |
| Biotin-PEG-SVA, MW 5,000 | Laysan Bio | #Biotin-PEG-SVA-5000 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 2905 | |
| Catalase | Sigma Aldrich | C40 | |
| Corning LSE Mini Microcentrifuge, AC100-240V | Corning | 6670 | |
| Delicate Task Wipes | Kimtech | 34120 | |
| Dithiothreitol (DTT) | GoldBio | DTT10 | |
| Emission filter | Chroma | ET610/75m | |
| Ethanol (200-proof) | Decon Labs | 2705 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma Aldrich | 3777 | |
| Glucose Oxidase | Sigma Aldrich | G2133 | |
| GMPCPP | Jena Bioscience | NU-405 | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma Aldrich | G8877 | |
| Hellmanex III detergent | Sigma Aldrich | Z805939 | |
| Immersion oil, Type A | Fisher Scientific | 77010 | |
| Kappa-casein | Sigma Aldrich | C0406 | |
| Lanolin | Fisher Scientific | S25376 | |
| Lens Cleaning Tissue | ThorLabs | MC-5 | |
| Magnesium Chloride (MgCl2) | Sigma Aldrich | M9272 | |
| Methylcellulose | Sigma Aldrich | M0512 | |
| Microfuge 16 Benchtop Centrifuge | Beckman-Coulter | A46474 | |
| Microscope Slides, Diamond White Glass, 25 x 75mm, 90° Ground Edges, WHITE Frosted | Globe Scientific | 1380-50W | |
| mPEG-Succinimidyl Valerate, MW 5,000 | Laysan Bio | #NH2-PEG-VA-5K | |
| Optima™ Max-XP Tabletop Ultracentrifuge | Beckman-Coulter | 393315 | |
| Paraffin | Fisher Scientific | P31-500 | |
| PELCO Reverse (self-closing), Fine Tweezers | Ted Pella | 5377-NM | |
| Petrolatum, White | Fisher Scientific | 18-605-050 | |
| Plasma Cleaner, 115V | Harrick Plasma | PDC-001 | |
| Potassium Hydroxide (KOH) | Sigma Aldrich | 221473 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Thermal-Lok 1-Position Dry Heat Bath | USA Scientific | 2510-1101 | |
| Thermal-Lok Block for 1.5 and 2.0 mL Tubes | USA Scientific | 2520-0000 | |
| Thermo Scientific™ Pierce™ Bond-Breaker™ TCEP Solution, Neutral pH; 500mM | Thermo Fischer Scientific | PI-77720 | |
| TIRF 100X NA 1.49 Oil Objective | Nikon | CFI Apochromat TIRF 100XC Oil | |
| TIRF microscope | Nikon | Eclipse Ti | |
| TLA 120.1 rotor | Beckman-Coulter | 362224 | |
| TLA 120.2 rotor | Beckman-Coulter | 357656 | |
| Tubulin protein (>99% pure): porcine brain | Cytoskeleton | T240 | |
| Tubulin Protein (Biotin): Porcine Brain | Cytoskeleton | T333P | |
| Tubulin protein (fluorescent HiLyte 647): porcine brain | Cytoskeleton | TL670M | |
| Tubulin protein (X-rhodamine): bovine brain | Cytoskeleton | TL620M | |
| VECTABOND® Reagent, Tissue Section Adhesion | Vector Biolabs | SP-1800-7 | |
| VWR® Personal-Sized Incubator, 120V, 50/60Hz, 0.6A | VWR | 97025-630 |
Referanslar
- Subramanian, R., Kapoor, T. M. Building complexity: insights into self-organized assembly of microtubule-based architectures. Developmental Cell. 23 (5), 874-885 (2012).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Bitan, A., Rosenbaum, I., Abdu, U. Stable and dynamic microtubules coordinately determine and maintain Drosophila bristle shape. Development. 139 (11), 1987-1996 (2012).
- Foe, V. E., von Dassow, G. Stable and dynamic microtubules coordinately shape the myosin activation zone during cytokinetic furrow formation. The Journal of Cell Biology. 183 (3), 457-470 (2008).
- Pous, C., et al. Functional specialization of stable and dynamic microtubules in protein traffic in WIF-B cells. The Journal of Cell Biology. 142 (1), 153-165 (1998).
- Uehara, R., Goshima, G. Functional central spindle assembly requires de novo microtubule generation in the interchromosomal region during anaphase. The Journal of Cell Biology. 191 (2), 259-267 (2010).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bieling, P., et al. Reconstitution of a microtubule plus-end tracking system in vitro. Nature. 450 (7172), 1100-1105 (2007).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Shimamoto, Y., Forth, S., Kapoor, T. M. Measuring pushing and braking forces generated by ensembles of Kinesin-5 crosslinking two microtubules. Developmental Cell. 34 (6), 669-681 (2015).
- Mani, N., Jiang, S., Neary, A. E., Wijeratne, S. S., Subramanian, R. Differential regulation of single microtubules and bundles by a three-protein module. Nature Chemical Biology. 17 (9), 964-974 (2021).
- Hyman, A. A., Salser, S., Drechsel, D., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Subramanian, R., et al. Insights into antiparallel microtubule crosslinking by PRC1, a conserved nonmotor microtubule binding protein. Cell. 142 (3), 433-443 (2010).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Wijeratne, S., Subramanian, R. Geometry of antiparallel microtubule bundles regulates relative sliding and stalling by PRC1 and Kif4A. eLife. 7, 32595(2018).
- Mani, N., Wijeratne, S. S., Subramanian, R. Micron-scale geometrical features of microtubules as regulators of microtubule organization. eLife. 10, 63880(2021).
- Freal, A., et al. Feedback-driven assembly of the axon initial segment. Neuron. 104 (2), 305-321 (2019).
- Ledbetter, M., Porter, K. A "microtubule" in plant cell fine structure. The Journal of Cell Biology. 19 (1), 239-250 (1963).
- Wijeratne, S. S., Marchan, M. F., Tresback, J. S., Subramanian, R. Atomic force microscopy reveals distinct protofilament-scale structural dynamics in depolymerizing microtubule arrays. Proceedings of the National Academy of Sciences of the United States of America. , 119(2022).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır